Адъювантная композиция, содержащая наночастицы поли-гамма-глутаминовой кислоты-хитозан
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к иммунологии, и может быть использована для повышения степени продуцирования антител против антигена у животных. Для этого животному, исключая людей, вводят адъювантную композицию, включающую наночастицы поли-гамма-глутаминовой кислоты-хитозан, имеющие отрицательно заряженную поверхность, полученные смешиванием поли-гамма-глутаминовой кислоты и хитозана в соотношении 1:1-8:1, вместе с антигеном. Группа изобретений включает также вакцинную композицию, включающую наночастицы поли-гамма-глутаминовой кислоты-хитозан, имеющие отрицательно заряженную поверхность. Использование наночастиц, имеющих отрицательно заряженную поверхность и полученных путем увеличения соотношения поли-гамма-глутаминовой кислоты в препарате наночастиц поли-гамма-глутаминовой кислоты-хитозана, оказывает значимо усиленное воздействие на клеточный иммунный ответ и выработку антител. 3 н. и 5 з.п. ф-лы, 12 ил., 2 табл.
Реферат
Область техники
Настоящее изобретение относится к адъювантной композиции, содержащей наночастицы поли-гамма-глутаминовой кислоты-хитозан, и вакцинной композиции, содержащей адъювантную композицию, и в более частном случае, к адъювантной композиции, содержащей наночастицы, полученные за счет ионной связи между поли-гамма-глутаминовой кислотой с гарантированной безопасностью и хитозаном, и вакцинной композиции, содержащей наночастицы поли-гамма-глутаминовой кислоты-хитозан и антиген.
Уровень техники
Адъюванты представляют собой материалы, которые можно использовать или для разработок вакцин с повышенной антигенностью, или для терапевтических и профилактических целей за счет усиления неспецифического иммунного ответа на антигены. Поскольку адъюванты обладают способностью поддерживать сильный и быстрый иммунный ответ организма на антиген в течение длительного времени при низких уровнях антигена, адъюванты используют при получении вакцин. Также адъюванты позволяют использовать специальные антигены или изменять низкие уровни антигенов, причем посредством этого регулируется иммунный ответ на антигены или регулируются типы и подклассы антител против антигенов. Кроме того, адъюванты можно использовать для усиления иммунного ответа, в частности, у иммунологически незрелых или стареющих людей, для того чтобы усилить индукцию защитных свойств слизистых оболочек.
Большинство адъювантов обнаружено во многих природных материалах путем многочисленных испытаний и проб. В первом в мире сообщении об адъювантах в 1925 г. Ramon (Франция) сообщил, что когда маниоковый крахмал (Casaba), который используют в пищевых продуктах, смешивают с дифтерийным и столбнячным токсоидом, антигенная специфичность и продуцирование антител существенно возрастают. Затем было сообщено об иммуннологическом усилении квасцового адъюванта, и был разработан эффективный адъювант типа эмульсии, содержащий в качестве иммуномодулятора инактивированные убитые микобактерии. Он представляет собой полный адъювант Фрейнда (FCA), известный как весьма эффективный иммуномодулятор, но не подходящий для использования людьми из-за его высокой реактогенности. По этой причине был разработан неполный адъювант Фрейнда (FIA), не содержащий микобактерии. Сообщено, что грамотрицательный бактериальный эндотоксин обладает иммунологическим усилением, и в 1974 Ellouz et al. (Ellouz F. et al., Biochem. Biophys. Res. Commun., 59: 1317-25, 1974) подтверждено действие мурамилдипептида (MDP). Затем было сообщено, что лецитин, сапонин и подобные соединения также можно использовать в качестве адъювантов для усиления иммунности.
Идеальный адъювант должен обладать способностью усиливать иммунность и также должен быть нетоксичным, хорошо биоразлагаемым, легко применяться, быть легко доступным и недорогим. До настоящего времени сообщалось о многих типах адъювантов, но только некоторые типы адъювантов действительно могут быть использованы в клинической практике. Это так, поскольку должны быть подтверждены достоверные данные о безопасности, что является наиболее важным при разработке адъювантов для использования в вакцинах.
Вакцины имеют терапевтическое и превентивное действие и, таким образом, могут уменьшить заболеваемость на 99%. Таким образом, вакцины представляют собой лечебные средства, которые имеют высокий эффект относительно стоимости. В настоящее время использование вакцин не ограничивается только инфекционными заболеваниями, но распространяется на трудноизлечимые заболевания, включая рак и аутоиммунные заболевания. Также признано, так как появляются терапевтические вакцины, что разработка вакцин является очень важной. Таким образом, разработка адъювантов как продуктов, связанных с вакцинами, ускоряется вместе с разработкой вакцин. Так как круг заболеваний, связанных с иммунитетом, расширяется, разработка новых адъювантов признается многообещающей областью.
Между тем авторы настоящего изобретения получили патент, относящийся к высокомолекулярной поли-гамма-глутаминовой кислоте и ее применению (регистрация патента Кореи, №399091), и патент, относящийся к способу получения поли-гамма-глутаминовой кислоты с использованием Bacillus subtilis var. chungkookjang - солеустойчивого штамма, продуцирующего высокомолекулярную поли-гамма-глутаминовую кислоту (регистрация патента Кореи, №500796), а также патенты, относящиеся к противораковой композиции, адъюванту, иммунологическому усилителю, ингибированию вирусной инфекции (регистрация патентов Кореи, №№496606, 517114, 475406 и 0873179). Кроме того, авторы настоящего изобретения сообщили об ингибиторе гиалуронидазы, содержащем поли-гамма-глутаминовую кислоту (регистрация патента Кореи, №582120), и обнаружили противораковое действие, основанное на иммунологическом усилении поли-гамма-глутаминовой кислоты [Poo H.R. et al., Journal of Immunology, 178: 775, 2007; Poo H.R. et al., Cancer Immunol. Immunother. (published on-line, 18 March 2009)]. Иными словами, авторы настоящего изобретения выполнили широкие исследования по разработке применения поли-гамма-глутаминовой кислоты, включая применение поли-гамма-глутаминовой кислоты в медицине, причем посредством этого обнаружили различное действие поли-гамма-глутаминовой кислоты.
Между тем полимерным наночастицам, в особенности, наночастицам, полученным из биоразлагаемых полимеров, таких как поликапролактон, уделяют большое внимание из-за их высокой биосовместимости. Однако такие наночастицы имеют такой недостаток, что они не подходят для доставки гидрофильных лекарственных средств или антигенов, поскольку они являются гидрофобными по природе.
Примеры применения поли-гамма-глутаминовой кислоты для доставки in vivo белков или усиления гуморального иммунитета описаны (Akagi Т. et al., J. controlled release, 108: 226, 2005; Uto T. et al., J. Immunol., 178: 2979, 2007). Однако, когда поли-гамма-глутаминовую кислоту используют в качестве адъюванта, ее способность продуцировать антитела недостаточная. Таким образом, способность поли-гамма-глутаминовой кислоты индуцировать антигенспецифический иммунитет нуждается в дополнительном усилении.
Хитозан является катионным полисахаридом, который представляет собой диацетилированную форму хитина, и он является нетоксичным и высоко биосовместимым. Также хитозан известен как материал, который может размыкать плотное соединение между клетками и, таким образом, является высокоэффективным в системах доставки лекарственных средств через слизистые оболочки. Большинство хитозанов имеет молекулярную массу 50-2000 кД и растворяется в растворе уксусной кислоты (рН 4). Однако для того чтобы применять хитозан в качестве лечебных материалов, хитозан необходимо выдерживать в водном растворе при нейтральном рН. Для того чтобы сохранить хитозан в катионной форме в водном растворе при физиологическом рН, необходимо обработать хитозан целлюлазой для уменьшения молекулярной массы.
Комплекс наночастиц поли-гамма-глутаминовой кислоты и хитозана представляет собой комплекс поли-гамма-глутаминовой кислоты и хитозана, связанных ионной связью, и используется как носитель для пероральной доставки инсулина или доставки ДНК, но о его использовании при индукции иммунного ответа не сообщается (Lin Y. et al., Biomacromolecules, 6: 1104, 2005; Lin Y. et al., Nanotechnology, 16: 105102, 2007).
Соответственно, авторы настоящего изобретения приложили значительные усилия для преодоления вышеуказанных недостатков, имеющих место на известном уровне техники, и в результате обнаружили, что когда мышам вводят вместе с различными антигенами адъювант, содержащий наночастицы, полученные за счет ионной связи между поли-гамма-глутаминовой кислотой и хитозаном, продуцирование антител существенно возрастает по сравнению с тем, когда в качестве адъюванта используют одну поли-гамма-глутаминовую кислоту, причем посредством этого осуществлено настоящее изобретение.
Сущность изобретения
Целью настоящего изобретения является адъювантная композиция, содержащая наночастицы поли-гамма-глутаминовой кислоты с превосходной способностью индуцировать антигенспецифический иммунный ответ.
Другой целью настоящего изобретения является вакцинная композиция, содержащая наночастицы поли-гамма-глутаминовой кислоты и антиген.
Еще одной целью настоящего изобретения является способ получения вакцины, содержащей наночастицы поли-гамма-глутаминовой кислоты-хитозан и антиген.
Для достижения указанных выше целей настоящее изобретение предлагает адъювантную композицию, содержащую наночастицы поли-гамма-глутаминовой кислоты-хитозан.
Настоящее изобретение также относится к способу повышения продуцирования антител против антигена путем введения животным, за исключением людей, адъювантной композиции вместе с антигеном.
Настоящее изобретение также относится к вакцинной композиции, содержащей наночастицы поли-гамма-глутаминовой кислоты-хитозан и антиген.
Настоящее изобретение также относится к способу получения вакцины, включающей наночастицы поли-гамма-глутаминовой кислоты-хитозан, связанные ионной связью с антигеном, имеющим отрицательно заряженную поверхность, причем способ включает стадии (а) соединения хитозана ионной связью с антигеном, имеющим отрицательно заряженную поверхность; и (b) добавления поли-гамма-глутаминовой кислоты к антигену, связанному с хитозаном, с образованием ионной связи между хитозаном и поли-гамма-глутаминовой кислотой, причем таким образом получают вакцину, включающую наночастицы поли-гамма-глутаминовой кислоты-хитозан и антиген.
Настоящее изобретение также относится к способу получения вакцины, включающей наночастицы поли-гамма-глутаминовой кислоты-хитозан, связанные ионной связью с антигеном, имеющим положительно заряженную поверхность, причем способ включает стадии (а) соединения ионной связью поли-гамма-глутаминовой кислоты с антигеном, имеющим положительно заряженную поверхность; и (b) добавления хитозана к антигену, связанному с поли-гамма-глутаминовой кислотой, с образованием ионной связи между поли-гамма-глутаминовой кислотой и хитозаном, причем таким образом получают вакцину, включающую наночастицы поли-гамма-глутаминовой кислоты-хитозан и антиген.
Настоящее изобретение также относится к способу повышения продуцирования антител против антигена путем введения животным, за исключением людей, вакцинной композиции.
Другие особенности и воплощения настоящего изобретения станут более очевидными из последующего подробного описания и прилагаемой формулы изобретения.
Краткое описание чертежей
Фиг.1 представляет собой микрофотографию наночастиц поли-гамма-глутаминовой кислоты-хитозан.
Фиг.2 представляет собой конфокальные микрофотографии лазерной флуоресценции наночастиц поли-гамма-глутаминовой кислоты-хитозан, введенных с меченным FITC OVA, для того чтобы проверить степень введения антигена в соответствии с порядком добавления белка.
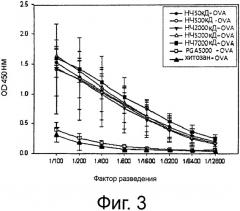
Фиг.3 показывает результаты определения продуцирования OVA-специфических антител путем измерения OVA-специфического сывороточного IgG после смешивания OVA с наночастицами поли-гамма-глутаминовой кислоты (РСА)-хитозан, содержащими PGA различной молекулярной массы, для того чтобы наблюдать действие антигена OVA на гуморальный иммунитет.
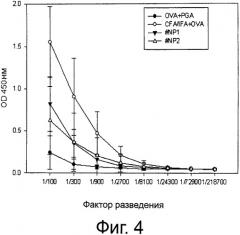
Фиг.4 показывает результаты наблюдения за продуцированием OVA-специфических антител и измерения выработки OVA-специфического сывороточного IgG для сравнения с адъювантом Фрейнда после инъекции мышам смеси OVA с наночастицами поли-гамма-глутаминовой кислоты-хитозан, имеющими различные заряды.
Фиг.5 показывает результаты анализа FACS активации секретирующих IFN-γ Т-клеток CD8+ PGA различной молекулярной массы, проведенного для проверки клеточного иммунного ответа Т-клеток в селезенке мыши на OVA, с помощью наночастиц поли-гамма-глутаминовой кислоты-хитозан.
Фиг.5 показывает результаты анализа FACS активации секретирующих IFN-γ Т-клеток CD8+ наночастицами PGA-хитозан, содержащими PGA различной молекулярной массы, проведенного для проверки клеточного иммунного ответа Т-клеток в селезенке мыши на OVA с помощью наночастиц поли-гамма-глутаминовой кислоты-хитозан.
Фиг.6 показывает результаты анализа FACS распределения секретирующих IFN-γ Т-клеток CD8+, проведенного для проверки активации Т-клеток, в соответствии с соотношением смешивания дендритных клеток с Т-клетками, наночастицами поли-гамма-глутаминовой кислоты-хитозан, полученными при разном порядке смешивания.
Фиг.7 показывает результаты измерения AI-специфического сывороточного IgG после подкожной инъекции мышам смеси белка AI и наночастиц поли-гамма-глутаминовой кислоты-хитозан или введения смеси мышам в носовую полость, для того чтобы проверить продуцирование AI-специфических антител.
Фиг.8 показывает результаты измерения титра антител в мышиной сыворотке с использованием метода испытания на HI (ингибирование гемагглютинации), для того чтобы проверить способность наночастиц поли-гамма-глутаминовой кислоты-хитозан индуцировать нейтрализующие антитела.
Фиг.9 представляет собой график, показывающий изменение числа погибших инфицированных вирусом мышей со временем после подкожной инъекции или назального введения наночастиц поли-гамма-глутаминовой кислоты-хитозан, наблюдаемого для того, чтобы проверить антителопродуцирующую способность наночастиц.
Фиг.10 показывает результаты измерения специфического к антигену вакцины сывороточного IgG после инъекции смеси антигена противогриппозной вакцины с наночастицами поли-гамма-глутаминовой кислоты-хитозан в мышцы мышам, для того чтобы проверить выработку антител, специфических к антигену противогриппозной вакцины.
Фиг.11 представляет собой график, показывающий изменение массы инфицированных вирусом мышей со временем после внутримышечной инъекции смеси антигена противогриппозной вакцины с наночастицами поли-гамма-глутаминовой кислоты-хитозан, наблюдаемого для того, чтобы проверить антителопродуцирующую способность смеси.
Фиг.12 представляет собой график, показывающий изменение числа погибших инфицированных вирусом мышей со временем после подкожной инъекции смеси антигена противогриппозной вакцины с наночастицами поли-гамма-глутаминовой кислоты-хитозан, наблюдаемого для того, чтобы проверить антителопродуцирующую способность смеси.
Раскрытие изобретения
Настоящее изобретение относится к адъювантной композиции, содержащей наночастицы поли-гамма-глутаминовой кислоты-хитозан, и вакцинной композиции, содержащей наночастицы поли-гамма-глутаминовой кислоты-хитозан и антиген.
В настоящем изобретении наночастицы, образованные за счет электростатического взаимодействия между отрицательным зарядом реакционноспособной карбоксильной группы поли-гамма-глутаминовой кислоты и протонированным положительным зарядом реакционноспособной аминогруппы хитозана, используют как наночастицы поли-гамма-глутаминовой кислоты-хитозан.
Поскольку наночастицы поли-гамма-глутаминовой кислоты-хитозан по настоящему изобретению получают за счет простого электростатического взаимодействия без сшивания белков, вредных для человеческого организма, такие наночастицы являются весьма высокобезопасными и эффективными и таким образом подходят для использования в качестве адъюванта.
Поли-гамма-глутаминовая кислота представляет собой вязкую полиаминокислоту, состоящую из D- и L-глутаминовых кислот, соединенных гамма-глутамильными связями, и представляет собой природный аминокислотный материал штаммов вида Bacillus. В одном аспекте настоящего изобретения поли-гамма-глутаминовую кислоту получают ферментацией Bacillus subtilis chungkookjang (КСТС 0697 ВР), и она имеет среднюю молекулярную массу 1-15000 кД.
В настоящем изобретении поли-гамма-глутаминовую кислоту можно расщепить на фрагменты с нужной молекулярной массой подходящим способом или разделить на фрагменты с нужной молекулярной массой подходящим способом.
Адъювант, содержащий наночастицы поли-гамма-глутаминовой кислоты-хитозан, по настоящему изобретению, получают за счет простой ионной связи, а не химической связи между поли-гамма-глутаминовой кислотой, которая представляет собой биополимер, полученный ферментацией Bacillus subtilis chungkookjang, и хитозаном, и таким образом, представляет собой адъювант, имеющий высокую безопасность, биосовместимость и антителопродуцирующую способность.
Молекулярная масса поли-гамма-глутаминовой кислоты, которую используют при получении наночастиц поли-гамма-глутаминовой кислоты-хитозан, по настоящему изобретению, предпочтительно составляет 50-15000 кД. Если молекулярная масса поли-гамма-глутаминовой кислоты меньше 50 кД, ее иммунологическое усиление будет низким, и если молекулярная масса поли-гамма-глутаминовой кислоты больше 15000 кД, могут возникнуть проблемы, связанные с повышенной вязкостью.
В настоящем изобретении молекулярная масса хитозана предпочтительно составляет 500-1000 кД. Если молекулярная масса хитозана меньше 500 кД, будет затруднительно получение наночастиц хитозана, и если молекулярная масса хитозана больше 1000 кД, он будет иметь низкую растворимость в нейтральном водном растворе.
В настоящем изобретении наночастицы с отрицательно заряженной поверхностью можно получить, увеличивая долю поли-гамма-глутаминовой кислоты при получении наночастиц поли-гамма-глутаминовой кислоты-хитозан.
В настоящем изобретении поверхность поли-гамма-глутаминовой кислоты может быть заряжена отрицательно.
Наночастицы поли-гамма-глутаминовой кислоты-хитозан, по настоящему изобретению, не получают химическим способом, а получают простым ионным взаимодействием, и таким образом, они являются менее токсичными и имеют высокую безопасность.
В адъювантной композиции, содержащей наночастицы поли-гамма-глутаминовой кислоты-хитозан, по настоящему изобретению, такие наночастицы могут содержаться в количестве 0,001-5 мас. частей, и предпочтительно, 0,01-3 мас. части, на 100 мас.частей (на сухую массу) вакцинной композиции. Если наночастицы поли-гамма-глутаминовой кислоты-хитозан содержатся в количестве менее 0,001 мас. частей на 100 мас. частей (на сухую массу) вакцинной композиции, композиция не может иметь способность продуцировать антитела, и если они содержатся в количестве больше 5 мас. частей, вязкость композиции будет избыточно возрастать.
В настоящем изобретении антиген, который содержится в вакцинной композиции, может быть выбран из белков, пептидов, нуклеозидов, нуклеотидов, вирусов, противовирусных средств, противоопухолевых средств, антибиотиков и противовоспалительных средств.
В настоящем изобретении вакцинную композицию можно использовать для предупреждения или лечения заболевания, вызванного одним или несколькими вирусами, выбранными из вируса птичьего гриппа, вируса свиного гриппа и нового вируса гриппа. Также ее можно использовать для предупреждения или лечения любого одного или нескольких заболеваний, выбранных из группы, состоящей из цервикального рака, меланомы кожи, рака предстательной железы, рака толстой кишки, рака легких, рака молочной железы, рака яичников, рака головы и шеи, рака вульвы, рака мочевого пузыря, рака головного мозга и глиомы.
В другом аспекте настоящее изобретение относится к способу получения вакцины, включающей наночастицы поли-гамма-глутаминовой кислоты-хитозан, связанные ионной связью с антигеном, имеющим отрицательно заряженную поверхность, причем способ включает стадии (а) образования ионной связи хитозана с антигеном, имеющим отрицательно заряженную поверхность; и (b) добавления поли-гамма-глутаминовой кислоты к антигену, связанному с хитозаном, с образованием ионной связи между хитозаном и поли-гамма-глутаминовой кислотой, причем посредством этого получают вакцину, включающую наночастицы поли-гамма-глутаминовой кислоты-хитозан и антиген.
Если при получении наночастиц поли-гамма-глутаминовой кислоты-хитозан по настоящему изобретению связываемый антиген или вирус имеет положительный заряд, сначала поли-гамма-глутаминовую кислоту связывают с антигеном или вирусом, и затем связывают хитозан, и если антиген или вирус имеет отрицательный заряд, сначала с ним связывают хитозан, и затем добавляют к ним поли-гамма-глутаминовую кислоту, в связи с чем полученные наночастицы поли-гамма-глутаминовой кислоты-хитозан могут эффективнее функционировать как адъювант.
В еще одном аспекте настоящее изобретение относится к способу получения вакцины, включающей наночастицы поли-гамма-глутаминовой кислоты-хитозан, связанные ионной связью с антигеном, имеющим положительно заряженную поверхность, причем способ включает стадии (а) образования ионной связи поли-гамма-глутаминовой кислоты с антигеном, имеющим положительно заряженную поверхность; и (b) добавления хитозана к антигену, связанному с поли-гамма-глутаминовой кислотой, с образованием ионной связи между поли-гамма-глутаминовой кислотой и хитозаном, причем посредством этого получают вакцину, включающую наночастицы поли-гамма-глутаминовой кислоты-хитозан и антиген.
В еще одном аспекте настоящее изобретение относится к способу повышения продуцирования антител против антигена путем введения животным, исключая людей, адъювантной композиции вместе с антигеном или введения вакцинной композиции.
В настоящем изобретении введение осуществляют любым способом, выбранным из группы, состоящей из подкожной инъекции, внутримышечной инъекции, внутрикожной инъекции, интраперитонеальной инъекции, интраназального введения, перорального введения и трансдермального введения.
Примеры носителей, эксципиентов и разбавителей, которые могут содержаться в адъювантной композиции или вакцинной композиции, содержащей наночастицы поли-гамма-глутаминовой кислоты-хитозан, включают лактозу, декстрозу, сахарозу, сорбит, маннит, ксилит, мальтит, крахмал, глицерин, аравейскую камедь, альгинат, желатин, фосфат кальция, силикат кальция, целлюлозу, метилцеллюлозу, микрокристаллическую целлюлозу, поливинилпирролидон, воду, метилглидроксибензоат, пропилгидроксибензоат, тальк, стеарат магния и минеральное масло. Для композиций можно использовать обычно используемые разбавители или эксципиенты, такие как наполнители, придающие объем вещества, связующие вещества, смачивающие вещества, вещества, способствующие рассыпанию, и поверхностно-активные вещества, и т.д. Композиции для парентерального введения включают стерильные водные растворы, неводные растворители, суспензии, эмульсии, лиофилизованные вещества, суппозитории и т.д. Неводные растворители и суспензии можно получить с использованием пропиленгликоля, полиэтиленгликоля, растительных масел, таких как оливковое масло, или эфиров, пригодных для инъекции, таких как этилолеат.
Доза адъюванта, содержащего наночастицы поли-гамма-глутаминовой кислоты-хитозан по настоящему изобретению, может значительно изменяться в зависимости от возраста, пола и массы тела субъекта, способа введения и тяжести заболевания.
Кроме того, наночастицы поли-гамма-глутаминовой кислоты-хитозан по настоящему изобретению можно добавлять к лекарственным композициям, включающим профилактические или лечебные вакцины, которые используют для предупреждения и лечения онкозаболеваний, в частности, меланомы кожи, рака предстательной железы, рака толстой кишки, рака легких, рака молочной железы, рака яичников, рака головы и шеи, рака вульвы, рака мочевого пузыря, рака головного мозга и глиомы, а также неинфекционных хронических заболеваний.
Примеры
Далее настоящее изобретение будет описываться подробнее с обращением к примерам. Для специалиста в данной области техники будет очевидно, что указанные примеры имеют только пояснительную цель и не должны истолковываться как ограничение объема настоящего изобретения.
Пример 1. Получение поли-гамма-глутаминовой кислоты сверхвысокой молекулярной массы
Получают и стерилизуют базальную среду (с добавлением 3% L-глутаминовой кислоты; содержащую 3% глюкозы, 1% (NH4)2SO4, 0,27% КН2РO4, 0,17% Na2HPO4·12H2O, 0,1% NaCl, 0,5% цитрата натрия, 0,02% пептона сои, 0,7% MgSO4·7H2O, 10 мл/л раствора витаминов, рН 6,8) для получения поли-гамма-глутаминовой кислоты. В среду инокулируют питательную жидкость (среда LB) для Bacillus subtilis var chungkookjang (КСТС 0697BP) в 5-л ферментере Jar (рабочий объем 3 л) в концентрации 4%, и проводят ферментацию при скорости перемешивания 500 об/мин, скорости подачи воздуха 1,0 об.об.мин (vvm) и 37°С в течение 48 часов. Затем бактериальные клетки удаляют с использованием небольшого фильтрпресса (1% целита), и оставшийся материал используют в качестве образца раствора, содержащего поли-гамма-глутаминовую кислоту.
Образец раствора, содержащего поли-гамма-глутаминовую кислоту, доводят до рН 2,0 2N раствором серной кислоты и затем оставляют стоять при 10°С или более низкой температуре на 15 минут, причем посредством этого получают осадок поли-гамма-глутаминовой кислоты. Полученный материал промывают достаточным количеством холодной дистиллированной воды (10°С или ниже) с рН 3,5 или выше и затем фильтруют через нутч-фильтр и собирают поли-гамма-глутаминовую кислоту, которую затем сушат вымораживанием, получая посредством этого поли-гамма-глутаминовую кислоту сверхвысокой молекулярной массы.
Пример 2. Получение наночастиц поли-гамма-глутаминовой кислоты/хитозан С использованием поли-гамма-глутаминовой кислоты, полученной в примере 1, и хитозана (Amicogen Co., Корея) получают наночастицы, используемые в качестве адъюванта.
Конкретно, поли-гамма-глутаминовую кислоту и хитозан растворяют в 0,85% растворе NaCl. Раствор поли-гамма-глутаминовой кислоты и раствор хитозана смешивают друг с другом в соотношении 1:1-8:1 (поли-гамма-глутаминовая кислота: хитозан), и получают посредством этого наночастицы поли-гамма-глутаминовой кислоты/хитозан, имеющие отрицательно заряженную поверхность. Размер частиц и поверхностный заряд полученных наночастиц измеряют с использованием DLS (динамического светорассеяния). В результате видно, что полученные наночастицы имеют средний размер 200-300 нм и поверхностный заряд - 20,8 мВ. Кроме того, с помощью электронного микроскопа наблюдают морфологию поверхности полученных наночастиц (см. фиг.1)
| Таблица 1. | ||
| Размер частиц и поверхностный заряд наночастиц поли-гамма-глутаминовой кислоты/хитозан | ||
| Размер частиц (нм) | Поверхностный заряд (мВ) | |
| Наночастицы поли-гамма-глутаминовой кислоты/хитозан (отрицательный заряд) | 263 | -20,8 |
Пример 3. Получение наночастиц поли-гамма-глутаминовой кислоты/хитозан с добавлением различных количеств белка-мишени
Для того чтобы убедиться, функционируют ли наночастицы поли-гамма-глутаминовой кислоты/хитозан, полученные в примере 2, как адъювант для повышения продуцирования антител к соответствующему белку, проверяют величину pi соответствующего белка, и получают наночастицы с использованием различного порядка добавления белка. Сначала OVA-FITC, полученные связыванием флуоресцентного вещества FITC с белком OVA (SIGMA, США), имеющие величину pI 5,2, связывают с наночастицами поли-гамма-глутаминовой кислоты. Конкретно, получают следующие два вида наночастиц: наночастицы, полученные смешиванием поли-гамма-глутаминовой кислоты с OVA-FITC с последующим добавлением к ним хитозана; и наночастицы, полученные смешиванием хитозана с OVA-FITC с последующим добавлением к ним поли-гамма-глутаминовой кислоты. Степень связывания OVA в полученных наночастицах оценивают с помощью флуоресцентного микроскопа.
В результате, как видно на фиг.2, образец наночастиц, полученных смешиванием хитозана с OVA-FITC и последующим добавлением к ним поли-гамма-глутаминовой кислоты, показывает большее свечение флуоресценции на поверхности и внутри образца. Полагают, что это имеет место из-за того, что OVA имеет отрицательный заряд при нейтральном рН, и, таким образом, большее количество OVA внедряется в образец наночастиц, полученных связыванием OVA с положительно заряженным хитозаном и последующим добавлением поли-гамма-глутаминовой кислоты.
Пример 4. Усиление продуцирования OVA-специфических антител с помощью наночастиц поли-гамма-глутаминовой кислоты/хитозан
В данном примере, для того чтобы проверить усиливающее действие наночастиц поли-гамма-глутаминовой кислоты/хитозан по настоящему изобретению на иммунитет, специфический для антигена OVA, проверяют действие наночастиц на опосредуемый В-клетками гуморальный иммунный ответ (связанный с продуцированием антител) среди антителоспецифических иммунных ответов.
Сначала для контроля OVA (100 мкг) смешивают с поли-гамма-глутаминовой кислотой с молекулярной массой 5000 кД и инъецируют мышам С57/В в абдоминальную полость. В тест-группах каждый из образцов поли-гамма-глутаминовой кислоты с молекулярной массой 50 кД, 500 кД, 2000 кД, 5000 кД и 7000 кД смешивают с хитозаном для получения наночастиц, которые затем смешивают с OVA (100 мкг) и инъецируют мышам С57/В в абдоминальную полость.
Также поли-гамма-глутаминовую кислоту с молекулярной массой 7000 кД используют для получения наночастиц с использованием различного порядка добавления белка-мишени. Конкретно, получают следующие наночастицы: наночастицы, полученные смешиванием поли-гамма-глутаминовой кислоты с хитозаном с последующим добавлением к ним OVA; и наночастицы, полученные смешиванием хитозана с OVA с последующим добавлением к ним поли-гамма-глутаминовой кислоты. В качестве контроля OVA инъецируют вместе с поли-гамма-глутаминовой кислотой или CFA.
Каждый из образцов инъецируют мышам в абдоминальную полость дважды раз в неделю, собирают мышиную сыворотку через 3 недели после инъекции, и измеряют титр антител против OVA в сыворотке с помощью ELISA (твердофазный иммуноферментный анализ).
В анализе ELISA планшет, сенсибилизированный OVA (0,5 мкг/мл), блокируют смесью PBS/5% снятого латекса, после чего сыворотки контрольной группы и тест-групп серийно разводят до различных концентраций и культивируют на планшете при 37°С. Затем к ним добавляют мышиные антитела IgG, конъюгированные с пероксидазой из хрена (специфические для Fc). Блокировку планшета и добавление мышиных антител IgG осуществляют в течение 1 часа, и сыворотки инкубируют в течение 2 часов. После каждой из вышеуказанных стадий три раза осуществляют промывку смесью PBS/0,05% твина 20. В качестве субстрата для развития реакции добавляют 100 мкл ТМВ (тетраметилбензидин (BD Biosciences, США), и затем измеряют поглощение при 450 нм с помощью аппарата для прочтения планшетов ELISA.
В результате, как видно на фиг.3, титр антител против OVA у мышей, инъецированных наночастицами поли-гамма-глутаминовой кислоты/хитозан (имеющими различную молекулярную массу) вместе с OVA, существенно выше, чем титр антител против OVA у мышей, инъецированных смесью OVA с поли-гамма-глутаминовой кислотой.
Также, как видно на фиг.4, титр антител у мышей, инъецированных наночастицами, полученными смешиванием хитозана с поли-гамма-глутаминовой кислотой и последующим добавлением OVA, схож с титром антител у мышей, инъецированных наночастицами, полученными смешиванием хитозана с OVA, и последующим добавлением к ним поли-гамма-глутаминовой кислоты.
Пример 5. Усиление клеточноопосредованного иммунного ответа с помощью наночастиц поли-гамма-глутаминовой кислоты/хитозан
Проверяют клеточноопосредованный иммунный ответ Т-клеток на OVA в селезенке мыши с помощью наночастиц поли-гамма-глутаминовой кислоты/хитозан. Из мышей, обработанных в примере 4, отбирают 5 мышей на группу, и у каждой мыши извлекают селезенку. Ткань селезенки переносят в стерилизованную чашку Петри и измельчают с использованием стрейнера для клеток, и клетки извлекают из капсулы с измельченной тканью. Все содержимое чашки Петри переносят в 15-мл пробирку, которую наполняют средой RPMI. Затем содержимое пробирки центрифугируют при 1500 об/мин в течение 5 минут, и удаляют супернатант. К осадкам добавляют 3 мл буфера для лизиса эритроцитов (Sigma Aldrich, Германия), которые затем оставляют стоять в емкости с водой при 37°С в течение 10 минут для лизиса эритроцитов. Клетки в пробирке промывают PBS и затем суспендируют в среде RPMI 1640 для отделения спленоцитов. Отделенные спленоциты высевают на 24-луночный планшет при плотности 1×106 клетки/мл и обрабатывают в течение 12 часов 2 мкл golgi plug и 1 мкг/мл пептида OVA, ограниченного МНС класса I. Затем клетки окрашивают CD-8-специфическими антителами (антимышиные CD-8, конъюгированные с РЕ), которые представляют собой поверхностные молекулы Т-клеток. Затем клетки перфорируют с помощью набора Cytofix/Cytoperm (BD Biosciences, США), и IFN-γ в клетках окрашивают IFN-y-специфическими антителами (антимышиный IFN-γ, конъюгированный с FITC).
В результате, как видно на фиг.5, наночастицы поли-гамма-глутаминовой кислоты/хитозан (содержащие поли-гамма-глутаминовую кислоту различной молекулярной массы) промотируют активацию секретирующих IFN-γ CD-8+ -клеток при сравнении с контрольной группой.
Также, в случае наночастиц, полученных с использованием различного порядка добавления антигена, как видно на фиг.6, наночастицы, полученные смешиванием хитозана с OVA и последующим добавлением к ним поли-гамма-глутаминовой кислоты, имеют более высокую способность индуцировать активацию секретирующих IFN-γ CD-8+Т-клеток, чем наночастицы, полученные смешиванием поли-гамма-глутаминовой кислоты с хитозаном и последующим добавлением к ним OVA (см. фиг.6).
Пример 6. Усиление клеточноопосредованного иммунного ответа на белок AI с помощью наночастиц поли-гамма-глутаминовой кислоты/хитозан
В данном примере, для того чтобы проверить, оказывают ли наночастицы поли-гамма-глутаминовой кислоты/хитозан, по настоящему изобретению, действие усиления иммунитета, специфического для антигена НА (гемагглютинин), характерного для вируса птичьего гриппа (AIV), проверяют действие наночастиц на опосредуемый В-клетками гуморальный иммунный ответ (ассоциированный с продуцированием антител) среди антителоспецифических иммунных ответов.
Белок НА в эксперименте представляет собой НА (гемагглютинин), известный как имеющий главный эпитоп для нейтрализующих антител вируса птичьего гриппа [A/chicken/Korea/IS2/2006 (H5N1))] (Yong-Jeong Lee et al., Emerging Infectious Diseases, 2008, 14: 487-490). Конкретно, его получают синтезом ПЦР гена, соответствующего инвентарному №EU233683, Genbank, встраиванием синтезированного гена в экспрессирующий вектор Е. coli (pRSET), экспрессией рекомбинантного антигена в Е. coli и очисткой антигена (Langzhou Song et al., PLoS ONE, 2008, e2257).
Мышам контрольной группы инъецируют подкожно или вводят назально один белок НА (7,128 мкг). В тест-группе наночастицы, полученные смешиванием поли-гамма-глутаминовой кислоты с молекулярной массой 7000 кД с хитозаном, смешивают с белком НА (7,128 мкг) и инъецируют мышам подкожно или вводят назально.
После первой подкожной инъекции или назального введения у мышей собирают сыворотку с 1-недельными интервалами, и измеряют титр антител против белка НА в сыворотке с помощью ELISA (твердофазный иммуноферментный анализ).
В анализе ELISA планшет, сенсибилизированный белком НА, блокируют смесью PBS/5% сыворотки плода коровы, и затем сыворотки контрольной группы и тест-группы инкубируют при различных коэффициентах разведения. Затем к ним добавляют мышиные антитела IgG, конъюгированные с пероксидазой из хрена (специфические для Fc). Все инкубации выполняют при 37°С в течение 1 часа, и после каждой из вышеуказанных стадий три раза осуществляют промывку смесью PBS/0,05% твина 20. В качестве субстрата для развития реакции добавляют 1 мг/мл ABTS (2,2-азинобис(3-этилбензтиоазолинсульфоновая кислота)), и через 30 минут измеряют поглощение при 450 нм с помощью аппарата для прочтения планшетов ELISA.
В результате, как видно на фиг.7, титр антител против белка НА у мышей, получивших подкожной инъекцией или назальным введением наночастицы поли-гамма-глутаминовой кислоты/хитозан вместе с белком НА, выше, чем титр антител у мышей, получивших подкожной инъекцией или назальным введением один белок НА.
Пример 7. Способность наночастиц поли-гамма-глутаминовой кислоты/хитозан индуцировать нейтрализующие антитела
Измерение титра антител в сыворотке мышей каждой группы осуществляют методом испытания на HI (ингибирование гемагглютинации) следующим образом.
Все сыворотки обрабатывают 3-кратным объемом RDE (нейромеридазы) (например, 30 мкл