Лекарственная форма для комбинации hgh и rhigf-1
Иллюстрации
Показать всеИзобретение относится к фармацевтике. Описана лекарственная форма комбинированных композиций гормона роста (GH) и инсулиноподобного фактора роста (IGF-1). Композиция включает средство, предупреждающее агрегирование, гистидиновый или цитратный буфер, неионное поверхностно-активное вещество, также необязательно содержит консервант, модификатор тоничности или наполнитель. В качестве средства, предупреждающего агрегирование, используется аргинин. В качестве модификатора тоничности - хлорид натрия. Также раскрывается способ получения композиции. Изобретение обеспечивает стабильные прозрачные фармацевтические композиции без образования агрегатов. 3 н. и 15 з.п. ф-лы, 2 ил., 14 табл., 10 пр.
Реферат
Настоящее изобретение относится к фармацевтическим композициям. Более конкретно, настоящее изобретение относится к лекарственным формам комбинированных композиций гормона роста (GH) и инсулиноподобного фактора роста (IGF-1). Эти комбинированные композиции предоставляют стабильные жидкие фармацевтические композиции без образования видимых нерастворимых агрегатов при желаемом рН.
Кроме того, настоящее изобретение предоставляет лекарственную форму для инсулиноподобного фактора роста 1 (IGF-1) и гормона роста (GH), где белки могут быть приготовленными совместно в инъецируемой форме или они могут быть приготовленными раздельно с последующим смешиванием перед введением в единой дозируемой инъецируемой форме.
Инсулиноподобный гормон роста относится к семейству полипептидов, известных как соматомедины; он представляет собой полипептид, естественно присутствующий в жидкостях тела человека. Большинство тканей (особенно печень) продуцируют IGF-1 совместно со специфическими белками, связывающими IGF. IGF-1 стимулирует рост и деление разнообразных типов клеток, в частности, во время индивидуального развития; таким образом, уровень IGF-1 влияет на такие процессы, как рост скелета и репликация клеток. Эти молекулы находятся под контролем гормона роста (GH).
IGF-1 является первичным белковым гормоном, опосредующим эффекты GH, стимулирующие рост костей. IGF-1 продуцируется в ответ на GH и затем он индуцирует последующие клеточные реакции, включая клеточные реакции в кости. IGF-1 состоит из 70 аминокислот в единственной цепи с тремя внутримолекулярными дисульфидными мостиками. IGF-1 имеет молекулярную массу 7649 Да; он продуцируется, прежде всего, в печени в качестве эндокринного гормона, а также в тканях-мишенях паракринным/аутокринным образом. IGF-1 производят рекомбинантно (rhIGF-1) в крупном масштабе, используя как дрожжи, так и E. coli.
Гормон роста, или человеческий ростовой гормон (hGH), представляет собой одноцепочечный полипептид, состоящий из 191 аминокислоты. Дисульфидные связи соединяют положения 53 и 165 и 182 и 189. Человеческий GH является сильным анаболическим средством. К наиболее значительным его эффектам, проявляющимся при его введении субъектам с гипофизарной недостаточностью (дефицитом GH), относится ускоренный линейный рост хряща в зоне роста кости, результатом чего является увеличение общего роста тела.
В международной заявке на патент W09118621 описан благоприятный и синергичный эффект, производимый комбинацией обоих белков. Совместное введение IGF-1 и GH млекопитающему способствует большему росту, чем рост, достигаемый при одиночном применении IGF-1 или GH. Это увеличение равняется сумме роста, наблюдаемого тогда, когда вводят IGF-1, и роста, наблюдаемого тогда, когда вводят GH.
Способы и композиции, предназначенные для повышения скорости роста, раскрыты также в международной заявке на патент WO 2006/130769. Это исследование относилось существенно к способу лечения, а его результаты были сфокусированы на реакции пациента. Описаны фармацевтические композиции - в частности, смесь IGF-1 и GH, составленная с маннитом, глицином и/или фосфатом при рН 7,4. Если смесь необходимо хранить, ее составляют в буфере, таком как цитрат, при рН примерно 6 с поверхностно-активным веществом, повышающим растворимость GH при этом рН, таком как полисорбат 20 или полоксамер 188. Указанная заявка также описывает возможность добавления неорганической соли и стабилизатора. В рецептурах, раскрытых в WO 2006/130769, не применяют никаких средств, предупреждающих агрегирование.
При комбинировании двух белков в растворе часто возникают осложнения, заключающиеся в появлении комплексов, образуемых белок-белковыми взаимодействиями. На образование таких комплексов особенно влияет изменение концентрации, температуры, рН и буфера в растворах, содержащих белки. Белковые комплексы могут затем образовывать нерастворимые агрегаты, результатом чего является утрата действенности и активности белков.
Кроме того, в фармацевтических препаратах важна доза терапевтического белка, которая должна находиться в пределах контролируемых диапазонов в течение длительного периода времени. Для получения и поддержания правильной концентрации белка в растворе и особенно для растворения больших количеств белков, часто требуется применение солюбилизаторов. Патент США № 6767892 раскрыл фармацевтические композиции IGF-1 и его аналогов, содержащие такие солюбилизирующие соединения, как аргинин, N-ацетиларгинин или гидрохлорид гуанидина. Композиции испытаны, предоставлены сравнительные данные с повышенной растворимостью IGF-1 при рН более 5,0 и температурах холодильного шкафа. Однако указанный документ не раскрывает никаких композиций содержащих IGF-1, комбинированный с другими терапевтическими белками.
Целью настоящего изобретения является получение жидких препаратов, содержащих как IGF-1, так и гормон роста (GH), стабильных при 4°C в течение не менее 30 дней без какого бы то ни было значительного агрегирования, свидетельством чего является видимая прозрачность раствора. Дополнительной целью настоящего изобретения является способ получения жидких препаратов, содержащих как IGF-1, так и GH.
Описание фигур:
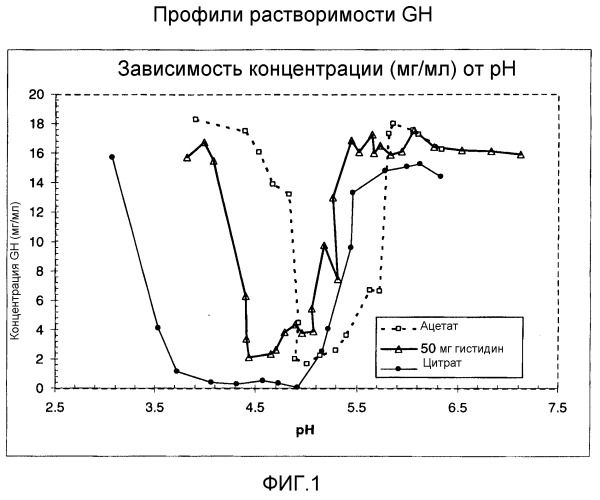
Фигура 1 показывает наложенные друг на друга профили скорости седиментации, полученные при аналитическом ультрацентрифугировании раствора IGF-1, растворов GH и смеси двух растворов (1:1). Первый набор таких профилей (фигура 1), получали с белками, приготовленными в 25 мМ цитратном буфере при рН 6; он свидетельствует о существенной взаимной ассоциации этих белков.
Фигура 2 показывает профили седиментации растворов, включающих в себя ион аргининия (аргинин в концентрации 100 мМ). Эти профили показывают, что присутствие аргинина вызывает изменения, свидетельствующие о том, что в растворах уменьшилось количество агрегатов с высокой молекулярной массой.
Следующие определения даны для того, чтобы проиллюстрировать и определить смысл и объем терминов, используемых для описания настоящего изобретения в данном документе.
Согласно настоящему изобретению, термин «средство, предупреждающее агрегирование», относится к соединениям, которые предотвращают или уменьшают образование нерастворимых белковых агрегатов, когда белки вводят в раствор.
Термин «IGF-1» относится к инсулиноподобному фактору роста 1 из многих видов, включая, но не ограничиваясь ими, бычий, овечий, свиной, птичий и, предпочтительно, человеческий IGF-1 в нативной последовательности или в вариантной форме и из любого природного, синтетического или рекомбинантного источника.
Предпочтительно, IGF-1 производят рекомбинантно, как описано, например, в патенте США № 6331414. Более предпочтительно, IGF-1 представляет собой активный фармацевтический ингредиент в продукте, коммерчески предоставляемом на рынке в виде препарата INCRELEX™.
Термин «rhIGF-1» относится к рекомбинантному человеческому IGF-1.
Термин «GH» относится к гормону роста из любых видов, включая, но не ограничиваясь ими, бычий, овечий, свиной, птичий и, предпочтительно, человеческий GH в нативной последовательности или в вариантной форме и из любого природного, синтетического или рекомбинантного источника.
Термины «гормон роста человека» и «hGH» относятся к гормону роста человека, производимого способами, включающими в себя экстракцию и очистку из природного источника и применение систем рекомбинантных клеточных культур, как описано, например, в научной публикации «Direct expression in Escherichia coli of a DNA sequence coding for human growth hormone» Goeddel & al, Nature Vol. 281, October 1979. Последовательность hGH дана, например, в Hormone Drugs, Gueriguian et al., USP convention, Rockville, MD (1982). Термины также охватывают биологически активные эквиваленты человеческого гормона, например, включающие одну или более отличающихся аминокислот в общей последовательности. Кроме того, термины, используемые в настоящей заявке, должны охватывать замены, делеции и вставки вариантов аминокислот в hGH, т.е. аналоги и/или гомологи hGH или множественные формы hGH с посттрансляционными модификациями. Часто применяют два вида: нативный вид, состоящий из 191 аминокислоты (соматотропин), и вид, содержащий 192-ую аминокислоту (N-концевой метионин); оба вида обычно получают рекомбинантным путем.
Предпочтительно применять метионилированный гормон роста человека (met-hGH), продуцируемый в E. coli, который Genentech Inc. продает под торговым наименованием PROTROPIN® и который идентичен природному полипептиду, за исключением присутствия N-концевого остатка метионина. Также предпочтителен рекомбинантный hGH, доступный у Genentech, Inc. под торговым наименованием NUTROPIN®. Более предпочтительным является жидкий рекомбинантный rhGH для инъекций, доступный у Genentech, Inc. под торговым наименованием NUTROPIN AQ®.
Термин «буфер», используемый в настоящем документе, означает фармацевтически приемлемый буфер, который, предпочтительно, предоставляет рН 5-6,5. Подходящие буферы включают в себя, но не ограничиваются ими, ацетатные буферы, цитратные буферы, фосфатные буферы, сукцинатные буферы и аминокислотные буферы, такие как гистидиновые буферы, и все их соли.
Термин «консервант», используемый в настоящем документе, означает фармацевтически приемлемое вещество, предотвращающее разрушение, обусловленное ростом микроорганизмов, или нежелательным химическим изменением.
Термин «поверхностно-активное вещество», используемый в настоящем документе, означает фармацевтически приемлемое вещество, дающее возможность создавать дисперсию или суспензию, посредством уменьшения поверхностного натяжения растворителя (такого как вода) или межфазного натяжения между двумя несмешивающимися жидкостями. Подходящими поверхностно-активными веществам являются, например, неионные поверхностно-активные вещества, такие как полисорбаты или полоксамеры.
Термин «наполнитель», используемый в настоящем документе, означает фармацевтически приемлемое вещество, применяемое для увеличения количества твердых веществ, которое представляет собой, например, сахарозу, трегалозу и маннит (но не ограничивается перечисленными веществами).
Термин «модификатор тоничности» относится к изотоническому модификатору или осмотическому регулятору или осмолиту, который придает осмоляльность буферному раствору. Термин «осмоляльность» относится к общей осмотической активности, придаваемой ионами и неионными молекулами раствору, содержащему неорганические соли (такие как хлорид натрия и хлорид калия), полиэтиленгликоли (ПЭГи), полипропиленгликоль, глицин, глицерин.
Термин «лиофилизованный», используемый в настоящем документе, относится к препарату, который был подвергнут процессу, известному в данной области техники как сушка из замороженного состояния, включающему в себя замораживание препарата и последующее удаления льда из замороженного содержимого.
Термин «аминокислота», используемый в настоящем документе, означает аминокислоту (свободную аминокислоту, т.е. не аминокислоту в пептиде или в белковой последовательности). Аминокислоты, используемые в настоящем изобретении, включают в себя, но не ограничиваются ими, например, аргинин, глицин, лизин, гистидин, глутаминовую кислоту, аспарагиновую кислоту, изолейцин, лейцин, аланин, фенилаланин, триптофан, серин, метионин и пролин.
Термин «IRF», или «лекарственная форма с немедленным высвобождением», относится к лекарственной композиции или смеси лекарственных композиций, предпочтительно, в жидкой форме, в которой нет никаких носителей, регулирующих биодоступность активного вещества лекарственного средства для тканей в месте введения в организме пациента.
Термин «средство, предупреждающее агрегирование», используемый в настоящем документе, относится к продукту, который предупреждает взаимодействие белков с образованием комплексов и/или агрегатов, когда их смешивают в растворе.
Согласно настоящему изобретению, фармацевтическая композиция содержит rhIGF-1 и rhGH и
- средство, предупреждающее агрегирование;
- буфер;
- поверхностно-активное вещество;
- необязательно, консервант; и
- необязательно, модификатор тоничности или наполнитель,
где средство, предупреждающее агрегирование, присутствует в композиции в концентрации, составляющей не менее 80 мМ.
Характерной особенностью фармацевтической композиции согласно настоящему изобретению является то, что два активных ингредиента (IGF-1 и GH) присутствуют в едином препарате. Термин «единый препарат», используемый в настоящем документе, также относится к «совместному препарату» или к «совместной смеси». Термины «совместный препарат» или «совместная смесь» в настоящем документе используются взаимозаменяемым образом.
Предпочтительно, два активных ингредиента представляют собой человеческие IGF-1 и GH, в настоящем документе также называемые hIGF-1 и hGH. Кроме того, предпочтительно, чтобы оба активных ингредиента производились рекомбинантными средствами.
В предпочтительном варианте осуществления фармацевтическая композиция согласно настоящему изобретению является жидкой композицией. Кроме того, предпочтительно, чтобы она являлась многодозовой композицией. В варианте осуществления многодозовой композиции, предпочтительно, присутствует консервант.
В следующем аспекте настоящее относится к способам получения фармацевтической композиции, содержащей IGF-1 и GH. Один способ согласно настоящему изобретению для получения фармацевтической композиции можно осуществлять следующим образом:
a) Приготовление раствора hGH в буфере при рН 5-6,5, содержащем средство, предупреждающее агрегирование, модификатор тоничности или наполнитель;
b) Приготовление раствора IGF-1 посредством диализа препарата IGF-1 против буфера, используемого на стадии (а), содержащего указанные средство, предупреждающее агрегирование, модификатор тоничности или наполнитель;
c) Добавление поверхностно-активного вещества и, необязательно, консерванта к обоим основным растворам; и
d) Смешивание растворов hGH и IGF-1.
В вариантах осуществления этого способа, на стадии (а) лиофилизованный hGH растворяют в буфере или в жидком препарате hGH (например, в его растворе в бикарбонатном буфере с концентрацией приблизительно 20 мг/мл) буфер заменяют другим буфером (предпочтительно, цитратным, сукцинатным или гистидиновым) с обычным значением рН (предпочтительно, примерно 5-6,5), содержащим средство, предупреждающее агрегирование, концентрация которого составляет 80-200 мМ (предпочтительно, примерно 100-150 мМ), причем, необязательно, по меньшей мере, один раствор, приготовленный на любой из стадий (a), (b), (c) или (d) содержит консервант (предпочтительно, фенол или бензиловый спирт).
Термин «примерно», в контексте с количествами ингредиентов, представленных в настоящем документе, означает, что указанное количество может варьировать не более чем на +20% или не более чем на +15%, или не более чем на +10%, или не более чем на +5%.
На стадии (b) лиофилизованный IGF-1 растворяют в буфере или в жидком препарате IGF-1 (например, в растворе в цитратном буфере с концентрацией IGF-1, составляющей приблизительно 20-35 мг/мл), буфер заменяют другим буфером (предпочтительно, цитратным, сукцинатным или гистидиновым) с обычным значением рН (предпочтительно, примерно 5-6,5), содержащим средство, предупреждающее агрегирование, концентрация которого составляет примерно 80-200 мМ.
Затем смешивают два независимо приготовленных раствора.
Настоящее изобретение охватывает и альтернативный способ получения фармацевтической композиции.
Согласно настоящему изобретению, альтернативный способ получения фармацевтической композиции данного изобретения включает в себя:
a) Приготовление раствора I, посредством смешивания буфера (предпочтительно, гистидинового буфера), средства, предупреждающего агрегирование (предпочтительно, аргинина), предпочтительно, полисорбата 20, необязательно, консерванта (предпочтительно, бензилового спирта), поверхностно-активного вещества и, необязательно, посредством доведения водой до нужного объема, причем раствор I имеет значение рН, равное примерно 5,8, или его доводят до этого значения;
b) Приготовление раствора IGF-1 (раствора II), содержащего буфер и средство, предупреждающее агрегирование, которые применяют на стадии (а);
c) Добавление раствора II к раствору I для получения раствора III;
d) Приготовление раствора IV посредством смешивания буфера (предпочтительно, гистидина), средства, предупреждающего агрегирование (предпочтительно, аргинина), поверхностно-активного вещества (предпочтительно, полисорбата 20), консерванта (предпочтительно, бензилового спирта) и, необязательно, посредством доведения водой до нужного объема, причем раствор IV имеет значение рН, равное примерно 5,8, или его доводят до этого значения;
e) Приготовление раствора GH (раствора V), содержащего буфер и средство, предупреждающее агрегирование, которые применяют на (d), причем GH, необязательно, содержит натрий-бикарбонатный буфер;
f) Добавление раствора V к раствору IV для получения раствора VI;
g) Необязательно, независимое фильтрование растворов III и VI;
h) Смешивание профильтрованных растворов III и VI при отношении массы IGF-1 к массе GH, составляющем от примерно 1:1 до примерно 7:1 мас/масс, предпочтительно, 1,1:1 мас/мас, 3,3:1 мас/мас и 6,6:1 мас/мас для получения раствора VII; и
i) Необязательно, фильтрование раствора VII.
Стадии (b) и (e) можно проводить, например, посредством диафильтрации раствора, содержащего IGF-1 или GH, против подходящего раствора, содержащего буфер и средство, предупреждающее агрегирование, или против любого другого подходящего раствора для получения растворов II и IV.
В варианте осуществления настоящего изобретения раствор I и раствор IV являются идентичными. В этом варианте осуществления настоящего изобретения не применяют стадию (d), т.е. не готовят раствор IV, а раствор V просто смешивают с раствором I для получения раствора VI.
В варианте осуществления настоящего изобретения растворы II и IV могут содержать наполнитель, такой как, например, сахароза или маннит.
В варианте осуществления настоящего изобретения жидкий препарат лекарственного вещества GH (т.е. раствор, содержащий GH, предпочтительно, hGH и, более предпочтительно, rhGH) прямо смешивают с раствором IV, без какой бы то ни было замены буфера или диафильтрации против раствора, содержащего буфер и средство, предупреждающее агрегирование, согласно стадии (е), т.е. без проведения стадии (е), как описано выше.
Таким образом, в этом варианте осуществления настоящего изобретения указанный способ включает в себя следующие стадии:
a) Приготовление раствора I, посредством смешивания буфера, предпочтительно, гистидинового буфера, средства, предупреждающего агрегирование, предпочтительно, аргинина, предпочтительно, полисорбата 20, необязательно, консерванта, предпочтительно, бензилового спирта, поверхностно-активного вещества и, необязательно, посредством доведения водой до нужного объема, причем раствор I имеет значение рН, равное примерно 5,8, или его доводят до этого значения;
b) Приготовление раствора IGF-1 (раствора II), содержащего буфер и средство, предупреждающее агрегирование, которые применяют на стадии (а);
c) Добавление раствора II к раствору I для получения раствора III;
d) Приготовление раствора IV посредством смешивания буфера, предпочтительно, гистидина, средства, предупреждающего агрегирование, предпочтительно, аргинина, поверхностно-активного вещества, предпочтительно, полисорбата 20, консерванта, предпочтительно, бензилового спирта и, необязательно, посредством доведения водой до нужного объема, причем раствор IV имеет значение рН, равное примерно 5,8, или его доводят до этого значения;
e) - вариант: Добавление лекарственного вещества GH, необязательно, содержащего натрий-бикарбонатный буфер, к раствору IV для получения раствора VI;
f) Необязательно, независимое фильтрование растворов III и VI;
g) Смешивание профильтрованных растворов III и VI при отношении массы IGF-1 к массе GH, составляющем от примерно 1:1 до примерно 7:1 мас/масс, предпочтительно, 1,1:1 мас/мас, 3,3:1 мас/мас и 6,6:1 мас/мас для получения раствора VII; и
h) Необязательно, фильтрование раствора VII.
В осуществлении этого варианта указанного способа раствор I и раствор IV являются идентичными. В этом варианте осуществления настоящего изобретения не применяют стадию (d), т.е. не готовят раствор IV, а лекарственное вещество GH просто смешивают с раствором I для получения раствора VI.
Предпочтительно, жидкий препарат лекарственного вещества hGH представляет собой раствор с концентрацией hGH, составляющей приблизительно 20 мг/мл, в бикарбонатном буфере с концентрацией, составляющей примерно 6-10 мМ, предпочтительно, 7,5 мМ, разбавленный без предварительной диафильтрации в буфере, предпочтительно, цитратном, сукцинатном или гистидиновом с обычным значением рН, предпочтительно, примерно 5-6,2 и, необязательно, содержащий средство, предупреждающее агрегирование, в концентрации примерно 80-200 мМ, предпочтительно, примерно 100-150 мМ.
В другом варианте осуществления настоящего изобретения в жидком препарате IGF-1 (например, его растворе в 200 мМ цитратном буфере с концентрацией IGF-1, составляющей приблизительно 20-35 мг/мл) заменяют буфер на другой буфер, предпочтительно, цитратный, сукцинатный или гистидиновый буфер с обычным рН, предпочтительно, примерно 5-6,5, необязательно, содержащий средство, предупреждающее агрегирование, в концентрации примерно 80-200 мМ, предпочтительно, примерно 100-150 мМ. Затем смешивают два независимо приготовленных раствора.
Фильтрование можно осуществлять, применяя любые подходящие средства - например, фильтры на целлюлозной основе или фильтры, изготовленные из PES (полиэфирсульфона). В предпочтительном варианте осуществления настоящего изобретения фильтрование всех растворов (до и после смешивания растворов) можно выполнять, применяя 0,22-микрометровые фильтры с низким сродством к белкам, такие, как например, фильтры, изготовленные из поливинилиденфторида (PVDF). Мембраны указанных фильтров, предпочтительно, имеют пределы по молекулярным массам, составляющие примерно 5 кДа или 3 кДа.
Преимущественно, фармацевтические композиции согласно настоящему изобретению являются стабильными не менее 1 месяца, 3 месяцев, 6 месяцев, 9 месяцев, 1 года или до 2 лет.
В следующем аспекте настоящее изобретение охватывает применение аргинина в качестве средства, предупреждающего агрегирование, в жидкой фармацевтической композиции, содержащей IGF-1 и GH, предпочтительно, hIGF-1 и hGH, более предпочтительно, rhIGF-1 и rhGH, где концентрация аргинина находится в диапазоне от примерно 80 мМ до примерно 200 мМ, т.е. составляет, например, примерно 80, примерно 90 мМ, примерно 100 мМ, примерно 110 мМ, примерно 120 мМ, примерно 130 мМ, примерно 140 мМ, примерно 150 мМ, примерно 160 мМ, примерно 170 мМ, примерно 180 мМ, примерно 190 мМ или 200 мМ.
Было обнаружено, что включение аминокислоты в фармацевтическую композицию дает возможность составлять смеси IGF-1 и GH в прозрачных лекарственных формах в виде растворов, без потери визуальной прозрачности смеси при последующем охлаждении при 2-8°С в течение не менее 30 дней (предпочтительно, в течение не менее 6 месяцев, более предпочтительно, в течение не менее 12 месяцев).
В предпочтительном варианте осуществления настоящего изобретения лекарственная форма является стабильной при хранении при температуре -20°C, или 2-8°C, в течение не менее 18 месяцев.
В одном варианте осуществления настоящее изобретение охватывает стабильную, смешиваемую лекарственную форму, активными ингредиентами которой являются человеческий инсулиноподобный фактор роста 1 (hIGF-1) и человеческий гормон роста (hGH). В предпочтительном варианте осуществления активные ингредиенты производят рекомбинантными средствами и обозначают rhIGF-1 и rhGH.
Лекарственные формы содержат rhIGF-1 и rhGH, средство, предупреждающее агрегирование, и буфер. Лекарственные формы могут содержать поверхностно-активное вещество, предпочтительно, неионное поверхностно-активное вещество, необязательно, консервант и, необязательно, модификатор тоничности и/или наполнитель.
Предпочтительной аминокислотой, дающей возможность составлять смеси IGF-1 и GH в прозрачной лекарственной форме в виде раствора, является аргинин или лизин (более предпочтительно, аргинин - например, в виде иона аргининия).
Предпочтительно, аминокислоту, которая действует в качестве средства, предупреждающего агрегирование, добавляют отдельно в каждый раствор до их смешивания в прозрачной лекарственной форме в виде раствора. Более предпочтительно, конечная концентрация средства, предупреждающего агрегирование, в прозрачном растворе присутствует в концентрационном диапазоне от примерно 80 мМ до примерно 200 мМ или в концентрационном диапазоне от примерно 100 мМ до примерно 180 мМ, или в концентрационном диапазоне от примерно 120 до примерно 160 мМ, или в концентрации, составляющей примерно 150 мМ.
Величину рН доводят до значения в диапазоне от примерно 5 до примерно 7, предпочтительно, от примерно 5,5 до примерно 6,5, более предпочтительно, от примерно 5,8 до 6,2. В контексте со значениями рН термин «примерно» означает, что значение рН может варьировать на ±0,2 или ±0,1. Значение рН некоторого раствора можно регулировать любыми подходящими средствами, такими как, например, добавление необходимого количества кислого раствора, такого как, например, раствор цитрата, или, предпочтительно, HCl.
Значение рН, применяемое согласно настоящему изобретению, может составлять, например, 5,1, 5,2, 5,3, 5,4, 5,5, 5,6, 5,7, 5,8, 5,9, 6,0, 6,1, 6,2, 6,3, 6,4, 6,5 (предпочтительно, 5,8, 6,2 или примерно 6,5).
В дополнительном варианте осуществления настоящего изобретения, осмолитом или модификатором тоничности может быть неорганическая соль. Органическая соль, если она включена, может представлять собой, например, хлорид натрия или хлорид калия - предпочтительно, хлорид натрия, присутствующий в композиции в концентрации от 0 до 150 мМ, предпочтительно, в концентрации от 1 до 50 мМ.
В дополнение к этому можно выбрать необязательный консервант из следующего списка: фенол, бензиловый спирт, м-крезол, хлорбутанол. Предпочтительными консервантами являются фенол или бензиловый спирт. В композиции консервант может присутствовать в концентрации, составляющей примерно 0,1-5% по массе, предпочтительно, примерно 0,2-2% по массе или, еще более предпочтительно, примерно 1%.
Поверхностно-активное вещество, применяемое в композиции, раскрытой в настоящем изобретении, выбирают, например, из следующего списка: полисорбат (Tween) или полоксамер, такой как полисорбат 80, полисорбат 20 или полоксамер 188. Предпочтительно, поверхностно-активное вещество является неионным, более предпочтительно, оно представляет собой полисорбат (Tween), такой как полисорбат 80, полисорбат 20, или полоксамер, такой как полоксамер 188, более предпочтительно, полисорбат 20 или полоксамер 188, в концентрации, составляющей примерно 0,01-3% по массе, предпочтительно, примерно 0,03-0,50% по массе и, более предпочтительно, примерно 0,2% по массе.
В дополнение к этому, буфер можно выбирать из подходящих фармацевтически приемлемых буферов, предоставляющих рН 5-6,5, таких как цитрат натрия или гистидин или они оба; предпочтительны ацетатные буферы, цитратные буферы, фосфатные буферы, аминокислоты, такие как гистидин и их соли, наиболее предпочтительны цитратные или гистидиновые буферы. Предпочтительно, в конечной композиции буфер присутствует в концентрации, составляющей 1-100 мМ, предпочтительно, 1-50 мМ и, более предпочтительно, примерно 10 мМ или примерно 20 мМ.
Согласно настоящему изобретению, количества IGF-1 и GH составляют примерно 2-40 мг/мл и примерно 1-12 мг/мл, соответственно; предпочтительные количества составляют примерно 5-20 мг/мл (IGF-1) и примерно 2-8 мг/мл (hGH). Кроме того, предпочтительными являются количества, составляющие примерно 10 мг/мл (IGF-1) и примерно 3 мг/мл (hGH) или примерно 13,2 мг/мл (IGF-1) и 2 мг/мл (GH).
Отношение массы IGF-1 к массе GH, предпочтительно, находится в диапазоне от 1:1 до 9:1, или, альтернативно, в диапазоне от примерно 1:9 до 1:1. Более предпочтительным является отношение массы IGF-1 к массе GH, выбранное из следующего списка: 9:1, 6:1, 3:1, 2:1, 3:7, 1:1, 1:2, 1:5, 7:3, 9:1.
Более предпочтительные отношения массы IGF-1 к массе GH выбирают из следующих отношений: 1,1:1, 2,2:1, 3,3:1 и 6,6:1. В варианте осуществления настоящего изобретения композиция содержит комбинацию rhIGF-1 и rhGH в концентрациях, составляющих примерно 10-30 мг/мл и примерно 1-12 мг/мл, соответственно, с отношением массы IGF-1 к массе GH в диапазоне от примерно 9:1 до примерно 1:9, примерно 0,01-3% по массе поверхностно-активного вещества, необязательно, примерно 0,1-5% по массе консерванта, примерно 1-150 мМ буфера, предпочтительно, цитратного или гистидинового, соединение, предупреждающее агрегирование, такое как аргинин или лизин в концентрационном диапазоне от 80 до 200 мМ. Необязательно, композиция может также содержать один или два модификатора тоничности, такие как NaCl, KCl в концентрации, составляющей примерно 0-150 мМ и/или наполнители, такие как трегалоза, маннит, сорбит или сахароза, 1-10% по массе маннита, сорбита, трегалозы или сахарозы.
Кроме того, настоящее изобретение относится к способу получения фармацевтической композиции, содержащей комбинацию IGF-1 и GH.
Человеческий гормон роста человека и инсулиноподобный фактор роста, включаемые в фармацевтическую лекарственную форму согласно настоящему изобретению, производят, предпочтительно, рекомбинантными средствами.
В дополнительных вариантах осуществления настоящего изобретения IGF-1 и GH, предпочтительно, в композиции согласно настоящему изобретению можно вводить пациенту, каждый в эффективных количествах или каждый в количествах, которые являются субоптимальными, но эффективными при комбинировании. Предпочтительно, такие количества составляют примерно 25-250 мкг IGF-1 на кг массы тела в день и примерно 0,05-0,5 мг GH на кг массы тела в неделю.
Предпочтительно, фармацевтическую лекарственную форму вводят посредством инъекции; предпочтительно, инъекция является парентеральной, такой как подкожная, внутримышечная, внутривенная инъекция или инфузия; наиболее предпочтительно, фармацевтическую композицию будут применять в виде ежедневной болюсной инъекции и, предпочтительно, в виде лекарственной формы с немедленным высвобождением (IRF).
Пациент, лечение которого осуществляют, предпочтительно, является млекопитающим (в частности, человеком), но он может быть и другим животным.
В дополнительном варианте осуществления настоящее изобретение предоставляет применение композиции при изготовлении лекарственного средства для такого способа лечения заболевания, который характеризуется увеличением или регулированием количества гормона роста в плазме.
Конкретно, настоящее изобретение предоставляет способы и композиции для лечения дефицита гормона роста (GDH); синдрома Тернера, синдрома Прадера-Вилли (PWS); низкорослости у детей, рожденных с очень низкой массой тела (VLBW), GDH у взрослых. А также для лечения эндокринного заболевания, которое включает в себя, например, введение пациенту, страдающему от метаболического расстройства, характеризующегося частичной активностью эндогенного гормона роста, или указывая количество инсулиноподобного фактора роста 1 (IGF-1) и количество гормона роста (GH), которые эффективны при сочетанной терапии для исправления метаболического нарушения у пациента. При котором пациент имеет синдром идиопатической низкорослости во взрослом возрасте (ISS), при котором пациент принимает IGF-1, вводимый один раз в день, и принимает GH, вводимый один раз в день, и при котором пациент принимает IGF-1 и GH, вводимые одновременно.
Настоящее изобретение также предоставляет способы и композиции для детей, страдающих от нарушений роста, характеризующихся частичной активностью эндогенного гормона роста или его признаками. Эти аномалии роста, вызывающие расстройства в детском возрасте, сохраняются и у взрослых, и такой взрослый индивид может страдать от разнообразных метаболических расстройств.
Согласно настоящему изобретению, hGH и hIGF-1 применяют в виде лекарственного средства или в виде фармацевтической композиции.
Ценным преимуществом настоящего изобретения является предоставление композиций, которые можно применять, предварительно наполнив некоторую емкость, такую как шприцы, или в виде лекарственных форм, готовых для применения.
Следующие примеры служат для иллюстрирования настоящего изобретения без его ограничения.
ПРИМЕР 1
Испытания растворимости
Смеси препаратов Increlex® (раствор 10 мг/мл, составленный в 50 мМ ацетатном буфере при рН 5,4) и Nutropin AQ® (раствор 5 мг/мл, составленный в 10 мМ цитратном буфере при рН 6) готовили при объемных отношениях в диапазоне от 9:1 до 1:9. Смеси показывали различные степени наличия видимого осадка непосредственно после смешивания или в пределах нескольких часов после него. Масс-спектроскопический анализ осадков, образованных в смесях препаратов Nutropin AQ® и Increlex®, показал, что в осадках присутствуют оба белка. В таблице 1 собраны наблюдения и результаты, относящиеся к прозрачности совместных смесей, приготовленных из коммерческих продуктов IGF-1 (Increlex®) и GH (Nutropin AQ®)
| Таблица 1 | |||||
| Отношение (об:об) | Increlex (мл) | Nutropin AQ (мл) | Наблюдения | ||
| Начало (20марта08) | 24 часа (21марта08) | 1 неделя (27марта08) | |||
| 9:1 | 3,6 | 0,4 | Очень слабый свободно плавающий осадок pH=5,42 | Очень слабый свободно плавающий осадок | Очень слабый свободно плавающий осадок |
| 5:1 | 3,6 | 0,72 | Слабый свободно плавающий осадок pH=5,51 | Слабый свободно плавающий осадок | Слабый свободно плавающий осадок |
| 2:1 | 3,6 | 1,8 | Свободно плавающий осадок pH=5,57 | Свободно плавающий осадок | Свободно плавающий осадок |
| 1:1 | 2,0 | 2,0 | Свободно плавающий осадок pH=5,64 | Свободно плавающий осадок | Свободно плавающий осадок |
| 1:2 | 1,8 | 3,6 | Мутно, тяжелый осадок pH=5,74 | Прозрачно, с желеобразной пленкой на стекле | Прозрачно, с желеобразной пленкой на стекле |
| 1:5 | 0,72 | 3,6 | Свободно плавающий осадок pH=5,85 | Тяжелый комковой осадок | Прозрачно, с желеобразной пленкой на стекле |
| 1:9 | 0,40 | 3,6 | Свободно плавающий осадок pH=5,94 | Свободно плавающий осадок | Свободно плавающий осадок |
Было подтверждено, что растворимость IGF-1 превышает 20 мг/мл во всем диапазоне рН смесей (5,4-5,9); это свидетельствует о том, что растворимость IGF-1 не является причиной наблюдаемого осадка, который не является IGF-1. Было найдено, что растворимость GH в цитратном, ацетатном или гистидиновом буферах в указанном диапазоне рН зависела от буфера. Результаты демонстрируют резкое снижение растворимости в растворах GH с ацетатным буфером при рН ниже 5,6, что может служить одной из причин наблюдаемого осаждения в растворах, приготовленных из смесей.
Однако сравнительные смеси препарата Nutropin AQ® с плацебо препарата Increlex® (не содержащим IGF-1, но остальной состав которого идентичен препарату Increlex®) или смеси препарата Increlex® с плацебо препарата Nutropin AQ® (не содержащим GH, но остальной состав которого идентичен препарату Nutropin AQ®) остаются прозрачными, указывая на то, что уменьшенная растворимость белков может быть обусловленной взаимодействием между этими двумя белками. Кроме того, препарат Increlex®, разбавленный плацебо препарата Increlex® до конечной концентрации 2,5 мг/мл, можно смешивать с препаратом Nutropin AQ® при отношениях IGF-1:hGH, составляющих 2,2:1 или больших, без какого бы то ни было осаждения, что указывает на то, что взаимодействия между белками являются обратимыми.
ПРИМЕР 2
Сравнение и получение совместно смешанных композиций в цитратном буфере при разных рН
Лиофилизованный hGH растворяли в 10 мМ цитратном буфере при рН 6, содержавшем 150 мМ хлорида натрия и 0,2% полисорбата 20, до конечной концентрации 5 мг/мл. Растворы IGF-1 в буферах разных составов, показанных в первом столбце таблицы 1, получали либо посредством диализа IGF-1 против соответствующего буфера, либо посредством растворения лиофилиз