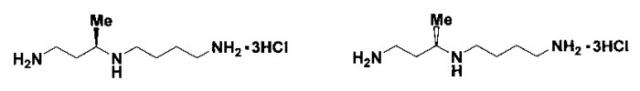(r)- и (s)-изомеры 3-метилспермидина
Иллюстрации
Показать всеИзобретение относится к новым тригидрохлоридам (R)- и (S)-изомеров 1,8-диамино-3-метил-4-азаоктана (3-метилспермидина), соответствующих нижеуказанным структурным формулам, и к способу их получения. Указанные соединения могут быть использованы in vitro и in vivo для изучения индивидуальных клеточных функций легковзаимопревращающихся и частично взаимозаменяемых спермина и спермидина, которые жизненно необходимы опухолевым клеткам и болезнетворным трипаносоматидам. (R)-Изомер тригидрохлорида 3-метилспермидина является первым метаболически устойчивым функционально-активным миметиком спермидина.
Способ получения заключается в алкилировании солей (R)- и (S)-изомеров сульфамида N1-защищенного 1,3-диаминобутана при помощи N-защищенных 1-амино-4-бутилгалогенидов с последующим последовательным удалением защитных групп и обработкой полученного остатка раствором соляной кислоты. В качестве алкилирующего агента можно использовать N-(фталоил)-1-амино-4-бутилгалогениды в апротонных полярных растворителях или N-(4-йодбутил)фталимид в диметилформамиде в присутствии карбоната калия. Удаление фталильной защиты обычно проводят при помощи гидразингидрата в спирте. Удаление бензилоксикарбонильных групп обычно осуществляется каталитическим гидрированием над Pd-чернью при атмосферном давлении в смеси метанол-уксусная кислота. Превращение полученных триацетатов (R)- и (S)-изомеров 1,8-диамино-3-метил-4-азаоктана в тетрагидрохлориды проводят при помощи водного раствора соляной кислоты. 2 н. и 5 з.п. ф-лы, 5 ил., 5 пр.
Реферат
Изобретение относится к области органической химии и биоорганической химии, а именно к новым биологически активным производным полиаминов, конкретно к получению неизвестных ранее (R)- и (S)-изомеров 3-метилспермидина (1,8-диамино-3-метил-4-азаоктан). (R)-изомер 3-метилспермидин представляет собой первый метаболически устойчивый функционально-активный миметик спермидина и может быть использован in vitro и in vivo для изучении индивидуальных клеточных функций легковзаимопревращающихся и частично взаимозаменяемых спермина и спермидина.
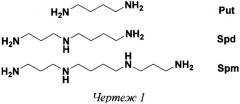
Биогенные полиамины спермин (Spm) и спермидин (Spd) присутствуют в клетках всех типов в мкМ-мМ концентрациях и жизненно необходимы для их нормального роста. Высокое внутриклеточное содержание Spm и Spd (Чертеж 1) определяет множественность и разнообразие их клеточных функций, многие из которых на молекулярном уровне остаются все еще малоизученными, что и обеспечивает поступательное развитие этой области биоорганической химии [Casero R.A., Marton L.J. "Targeting polyamine metabolism and function in cancer and other hyperproliferative diseases". Nat. Rev. Drug Discov., 6, 373-390 (2007)]. Повышенное содержание Spm и Spd в опухолевых клетках [Frydman В., Valasinas A. Polyamine-based chemotherapy of cancer. Exp. Opin. Ther. Patents, 9, 1055-1068 (1999)], жизненная необходимость полиаминов для развития возбудителей малярии, сонной болезни, лейшманиоза и других тропических заболеваний, вызываемых трипаносоматидами [Heby О., Persson L., Rentala М. "Targeting the polyamine biosynthetic enzymes: a promising approach to therapy of African sleeping sickness, Chagas′ disease and leishmaniasis". Amino Acids, 33, 359-366 (2007)], а также наблюдаемые нарушения метаболизма полиаминов у больных панкреатитом и диабетом формируют прикладную составляющую исследований клеточных функций Spm и Spd и поиска новых регуляторов их метаболизма [Wallace Н.М. "Targeting polyamine metabolism: a viable therapeutic/preventative solution for cancer?" Expert. Opin. Pharmacother., 8, 2109-2116 (2007)]. Правомерность подобного подхода подтверждается противоопухолевой активностью ингибиторов биосинтеза полиаминов [Seiler N. "Thirty years of polyamine-related approaches to cancer therapy. Retrospect and prospect. Part 1. Selective enzyme inhibitors". Curr. Drug Targets., 4, 537-564 (2003)] и индукторов ферментов катаболизма Spm и Spd [Casero R.A., Woster P.M. "Recent advances in the development of polyamine analogues as antitumor agents". J. Med. Chem., 52, 4551-4573 (2009)], а также успешным использованием α-дифторметилорнитина (DFMO, Eflornithine), являющегося эффективным ингибитором биосинтеза Spm и Spd, для лечения поздних стадий сонной болезни [Burri С.С., Brun R. "Eflornithine for the treatment of human african trypanosomiassis". Parasitol. Res. 90, 49-52 (2003)].
Изучение клеточных функций полиаминов на молекулярном уровне осложнено частичной взаимозаменяемостью и легкостью взаимопревращений Spm и Spd. Поэтому в этих исследованиях широко используются мутантные микроорганизмы и клетки [Chattopadhyay М.К., Tabor C.W., Tabor Н. "Polyamines are not required for aerobic growth of Escherichia coli: preparation of a strain with deletions in all of the genes for polyamine biosynthesis". J. Bacteriol., 191, 5549-5552 (2009)], a также трансгенные животные [Janne J., Alhonen L., Pietila M., Keinanen T.A. "Genetic approaches to the cellular functions of polyamines in mammals". Eur. J. Biochem., 271, 877-894 (2004)], что позволяет активировать или «выключать» заданные ферменты метаболизма полиаминов и регуляторные механизмы, ответственные за поддержание их гомеостаза. Относительно простым решением, хорошо дополняющим существующие подходы и позволяющим дискриминировать клеточные эффекты Spm и Spd, может быть истощение внутриклеточного пула полиаминов и использование для обращения эффекта функционально активных миметиков Spm и Spd, не способных к взаимопревращениям. Однако соединения с подобным комплексом свойств до настоящего времени не известны.
В литературе описано множество разнообразных аналогов Spd, включая ингибиторы ферментов его биосинтеза и катаболизма, а также соединения, специфически снижающие содержание полиаминов в клетках, что приводит к замедлению их роста и гибели [Seiler N. "Thirty years of polyamine-related approaches to cancer therapy. Retrospect and prospect. Part 2. Structural analogues and derivatives". Curr. Drug Targets., 4, 565-585 (2003); Wallace H.M., Niiranen K. "Polyamine analogues - an update". Amino Acids, 33, 261-265 (2007); Casero R.A., Woster P.M. "Recent advances in the development of polyamine analogues as antitumor agents". J. Med. Chem., 52, 4551-4573 (2009)]. Наиболее близкими аналогами заявляемых соединений являются рацемические С-монометилированные производные Spd [Hyvönen М.Т., Keinänen T.A. Khomutov M., Simonian A., Weisell J., Kochetkov S.N., Vepsäläinen J., Alhonen L., Khomutov A.R. "The use of novel C-methylated spermidine derivatives to investigate the regulation of polyamine metabolism". J. Med. Chem., 54, 4611-4618 (2011)], а также R- и S-изомеры 1-метилспермидина [Grigorenko N.A., Khomutov A.R., Keinänen T.A., Järvinen A., Alhonen L., Jänne J., Vepsäläinen J. "Synthesis of novel optical isomers of α-methylpolyamines". Tetrahedron, 63(10), 2257-2262 (2007)]. Анализ данных по взаимодействию системы рацемических С-монометилированных аналогов Spd с ферментами метаболизма полиаминов и клетками [Hyvönen М.Т., Keinänen T.A. Khomutov M., Simonian A., Weisell J., Kochetkov S.N., Vepsäläinen J., Alhonen L., Khomutov A.R. "The use of novel C-methylated spermidine derivatives to investigate the regulation of polyamine metabolism". J. Med. Chem., 54, 4611-4618 (2011); Хомутов M.A., Хивонен M.T., Симонян A.P., Вепсалайнен Й., Алхонен Л., Кочетков С.Н., Кейнанен Т.А. "Новый метаболически устойчивый функционально-активный миметик спермидина." Биоорган. химия, 37(2), 253-258 (2011); Даидх С., Хомутов М.А., Симонян А.Р., Кочетков С.Н., Мадхубала P. "Leishmania donovani: Структурные аспекты узнавания С-метилированных аналогов спермидина в качестве природного полиамина". Молекулярная биология, 45(4), 673-678 (2011)], а также активности в этих системах (R)- и (S)-изомеров 1-метилспермидина [Keinänen Т.А., Järvinen A., Uimari A., Vepsäläinen J., Khomutov A.R., Grigorenko N.A., Hyvonen M.T., Cerrada-Gimenez M., Alhonen L., Jänne J. "α-Methylated polyamines as potential drugs and experimental tools in enzymology" Mini Rev. Med. Chem., 7(8), 813-820 (2007); Хомутов A.P., Кейнанен T.A., Григоренко H.A., Хивонен М.Т., Умари А., Пиетила М., Серрада-Хименес М., Симонян А.Р., Хомутов М.А., Вепсалайнен Й., Алхонен Л., Янне Ю. "Метилированные аналоги биогенных полиаминов спермина и спремидина как инструмент исследования клеточных функций полиаминов и ферментов их метаболизма". Молекулярная биология, 43(2), 274-285 (2009); Hyvonen М.Т., Howard М.Т., Anderson С.В., Grigorenko N., Khomutov A.R., Vepsalainen J., Alhonen L., Janne J., Keinanen T.A. "Divergent regulation of the key enzymes of polyamine metabolism by chiral alpha-methylated polyamine analogs". Biochem. J., 422(2), 321-328 (2009)], показал, что искомым комплексом практически значимых свойств (метаболическая устойчивость в комбинации со способностью выполнять функции Spd в клетках) может обладать один из оптических 3-метилспермидина. Это предположение основывалось на отсутствии у рацемического 3-метилспермидина субстратных свойств в спермин/спермидин-N1-ацетилтрансферазной реакции [Hyvönen М.Т., Keinänen T.A. Khomutov M., Simonian A., Weisell J., Kochetkov S.N., Vepsäläinen J., Alhonen L., Khomutov A.R. "The use of novel C-methylated spermidine derivatives to investigate the regulation of polyamine metabolism". J. Med. Chem., 54, 4611-4618 (2011)], что обеспечивает катаболическую устойчивость аналога, невозможности биосинтеза 3-метилспермина из 3-метилспермидина в культуре клеток [Хомутов М.А., Хивонен М.Т., Симонян А.Р., Вепсалайнен Й., Алхонен Л., Кочетков С.Н., Кейнанен Т.А. "Новый метаболически устойчивый функционально-активный миметик спермидина." Биоорган. химия, 37(2), 253-258 (2011)], а также способности рацемического 3-метилспермидина подцеживать рост клеток с дефицитом полиаминов, вызванным инкубацией клеток с DFMO (ингибитор биосинтеза Spm и Spd) в течение 3 сут [Хомутов М.А., Хивонен М.Т., Симонян А.Р., Вепсалайнен Й., Алхонен Л., Кочетков С.Н., Кейнанен Т.А. "Новый метаболически устойчивый функционально-активный миметик спермидина." Биоорган. химия, 37(2), 253-258 (2011)]. Однако рацемический 3-метилспермидина, в противоположность рацематам 1- и 2-метилспермидина, не восстанавливал рост клеток, обработанных DFMO в течение 12 сут и более, хотя in vitro все три аналога были субстратами дезоксигипузинсинтазы - фермента, который обеспечивает посттрансляционную модификацию жизненно необходимого фактора инициации трансляции 5А, (eIF5A) и использует Spd в качестве донора аминобутильного фрагмента [Hyvönen М.Т., Keinänen Т.А., Khomutov М., Simonian A., Vepsäläinen J., Park J.H., Khomutov A.R., Alhonen L., Park M.H. "Effects of novel C-methylated spermidine analogs on cell growth via hypusination of eukaryotic translation initiation factor 5A". Amino Acids, 42(2-3), 685-695 (2012)].
Данным изобретением задача создания первого функционально активного метаболически устойчивого миметика Spd решена в результате синтеза неизвестных ранее (R)- и (S)-изомеров 3-метилспермидина (1,8-диамино-3-метил-4-азаоктан) формулы:
Целевые тригидрохлориды (R)- и S-изомеров 3-метилспермидина были получены по схеме, представленной на Чертеже 2.
Исходными соединениями в синтезах неизвестных ранее тригидрохлоридов (R)- и (S)-изомеров 3-метилспермидина служили коммерчески доступные (R)- и (S)-аланинолы, из которых через метансульфонаты N-(трет-бутилоксикарбонил)-2-аминопропанола-1 с высоким выходом были приготовлены нитрилы N-(трет-бутилоксикарбонил)-3-аминомасляной кислоты. Восстановление этих нитрилов LiAlH4 в эфире при 0°C гладко приводило к N3-Вос-1,3-диаминобутанам в соответсвии с ранее описанным в литературе [Grigorenko N.A., Khomutov A.R., Keinänen Т.А., Järvinen A., Alhonen L., Jänne J., Vepsäläinen J. "Synthesis of novel optical isomers of α-methylpolyamines". Tetrahedron, 63(10), 2257-2262 (2007)]. Последующее карбобензоксилирование свободной аминогруппы позволило получить N1-Cbz-N3-Вос-1,3-диаминобутаны (1) и (2), из которых в результате избирательным удалением Вос-группы при помощи HCl/EtOH были синтезированы ключевые интермедиаты - N1-Cbz-1,3-диаминобутаны (3) и (4). Из этих N1-Cbz-диаминов были приготовлены соответствующие нозилаты (5) и (6), алкилирование которых N-(4-йодбутил)-фталимидом в DMF и последующее удаление нозильной защиты, без выделения промежуточного нозилата, с высоким выходом привело к N1-Cbz-N8-фталоил-триаминам (7) и (8), которые очищали хроматографией на SiO2. Последовательным удалением фталильной и Cbz-групп гидразинолизом и каталитическим гидрированием над Pd-чернью и последующим переводом тетраацетатов в тригидрохлориды были получены целевые тригидрохлориды (R)- и (S)-изомеры 3-метилспермидина (11) и (12) с суммарными выходами 30% и 25%, считая на (S)- и (R)-аланинолы.
Исследование основных биохимических свойств (R)- и (S)-изомеров тригидрохлоридов 3-метилспермидина показало, что предпочтительным субстратом дезоксигипузинсинтазы оказался (R)-изомер тригидрохлорида 3-метилспермидина (Чертеж 3). Подобную субстратную специфичность фермента невозможно было предсказать на основании литературных данных, учитывая, что из (R)- и (S)-изомеров тригидрохлорида 1-метилспермидина выраженными субстратными свойствами обладал лишь (S)-изомер [Hyvonen М.Т., Keinanen Т.А., Cerrada-Gimenez M., Sinervirta R., Grigorenko N., Khomutov A.R., Vepsalainen J., Alhonen L., Janne J. "Role of hypusinated eukaryotic translation initiation factor 5A in polyamine depletion-induced cytostasis". J. Biol. Chem., 282(48), 34700-34706 (2007)]. Установлено, что система транспорта полиаминов дискриминирует (R)- и (S)-изомеры тригидрохлоридов 3-метилспермидина, при этом (S)-изомер тригидрохлорида 3-метилспермидина ингибирует проникновение в клетки биологически-активного (R)-изомера (Чертеж 4) - подобная зависимость действия от строения является неожиданной для биоорганической химии полиаминов. Совокупность этих обстоятельств и привела к тому, что рацемический тригидрохлорид 3-метилспермидина не восстанавливал рост клеток, обработанных DFMO в течение 12 сут и более, т.е. в условиях полного истощения внутриклеточного пула полиаминов [Hyvönen М.Т., Keinänen Т.А., Khomutov М., Simonian А., Vepsäläinen J., Park J.H., Khomutov A.R., Alhonen L., Park M.H. "Effects of novel C-methylated spermidine analogs on cell growth via hypusination of eukaryotic translation initiation factor 5A". Amino Acids, 42(2-3), 685-695 (2012)]. Напротив, (R)-изомер тригидрохлорида 3-метилспермидина, в отличие от (S)-изомера тригидрохлорида 3-метилспермидина, достаточно эффективно восстанавливал рост клеток с полностью истощеным внутриклеточным пулом полиаминов (инкубация с DFMO в течение 10 сут) (Чертеж 5), что делает его первым и пока единственным функционально активным метаболически устойчивым миметиком Spd.
Ниже приведены конкретные примеры, раскрывающие сущность изобретения.
Пример 1
Синтез (R)- и (S)-изомеров 3-метилспермидина в виде тригидрохлоридов
(S)-N1-(Бензилоксикарбонил)-N3-(трет-бутилоксикарбонил)-1,3-диаминобутан (1).
К охлажденному до +4°C раствору 2.4 г (12.8 ммоль) (S)-N3-(трет-бутилоксикарбонил)-1,3-диаминобутана и 2.6 г (26 ммоль) Et3N в 35 мл смеси С6Н6/Et2O, 2:1 при перемешивании прибавляют за 30 мин раствор 2.2 г (13 ммоль) CbzCl в 10 мл абс. С6Н6, перемешивают 1 ч при +4°C и 4 ч при 20°C. Осадок отфильтровывают, фильтрат промывают последовательно Н2О (2×5 мл), 10% лимонной кислотой (4×4 мл), Н2О (5 мл), 5 М NaCl (2×5 мл) и высушивают над MgSO4. Растворитель отгоняют в вакууме, остаток очищают колоночной хроматографией на SiO2 (60 г), элюируя смесью CH2Cl2-МеОН, 98:2, что приводит к густому маслу, затвердевающему при высушивании в вакууме (25°C/1 мм Hg). После перекристаллизация из гексана получают 3.31 г (81.3%) соединения (1), т. пл. 82.5-83°C, Rf 0.72 (диоксан-25% NH4OH, 98:2), [α]D 20 +48.9°. Вычислено, %: С 63.33; Н 8.13; N 8.69. C8H24Cl3N3. Найдено, %: С 63.41; Н 8.18; N 8.66. 1Н-ЯМР (CDCl3) δ: 7.39-7.27 (5Н, м, С6Н5), 5.57 (1H, уш. с, NHCbz), 5.12-5.02 (2Н, м, CH2C6H5), 4.34 (1Н, уш. с, CbzNHCH2), 3.74 (1Н, уш. с, CbzNHCH2), 3.46-3.41 (1H, м, NHCH2CH2), 3.05-2.98 (1Н, м, NHCH2CH2), 1.74-1.68 (1Н, м, СН3СН), 1.48-1.42 (10Н, м, NHC(CH3)3), 1.14 (3Н, д, J 6.5, СН3). 13С-ЯМР (CDCl3) δ: 128.52, 128.13, 128.04, 77.41, 77.30, 77.09, 76.77, 66.54, 43.83, 37.98, 37.86, 37.17, 28.43, 21.64.
(R)-N1-(Бензилоксикарбонил)-N3-(трет-бутилоксикарбонил)-1,3-диаминобутан (2). Получают аналогично соединению (1), исходя из 1.84 г (9.79 ммоль) (R)-N3-(трет-бутилоксикарбонил)-1,3-диаминобутана, 2.02 г (20 ммоль) Et3N и 1.7 г (10 ммоль) CbzCl, что приводит к 2.71 г (86%) соединения (2), [α]D 20 - 50.4°. Вычислено, %: С 63.33; Н 8.13; N 8.69. C8H24Cl3N3. Найдено, %: С 63.37; Н 8.11; N 8.68. Остальные физико-химические характеристики идентичны соединению (1).
(S)-N1-(Бензилоксикарбонил)-1,3-диаминобутан (3). К раствору 1.0 г (3.1 ммоль) соединения (1) в 5 мл абс. EtOH прибавляют 2 мл 6.7 М HCl/EtOH и через 3 ч при 20°C реакционную смесь упаривают в вакууме досуха. Остаток растворяют в 10 мл абс. EtOH, выливают в 40 мл абс. Et2O и оставляют на ночь при -20°C. Выделившееся масло отделяют, промывают абс. EtOH (10 мл) декантацией и к остатку прибавляют 4 мл 2 М NaOH и 6 мл CH2Cl2. Органическую фазу отделяют, а водную фазу экстрагируют CH2Cl2 (4×4 мл). Объединенные CH2Cl2-вытяжки промывают Н2О (2 мл), 5 М NaCl (3×5 мл) и высушивают над К2СО3. Растворитель отгоняют в вакууме, остаток высушивают в вакууме над Р2О5 и получают 0.515 г (75%) соединения (3) в виде густого масла, Rf 0.44 (диоксан-25% NH4OH, 9:1), 1Н-ЯМР (CDCl3) δ: 7.35-7.26 (5Н, м, С6Н5), 5.48 (1H, уш. с, NHCbz), 5.09 (2Н, с, СН2С6Н5), 3.4-3.2 (2Н, м, CbzNHCH2), 3.01-2.92 (1Н, м, СН3СН), 1.62-1.55 (1H, м, NHCH2CH2), 1.47-1.38 (1H, м, NHCH2CH2), 1.25-1.22 (2Н, м, NH2), 1.20 (3Н, д, J 6.5, СН3). 13С-ЯМР (CDCl3) δ: 156.55, 136.85, 128.55, 128.09, 77.40, 77.09, 76.77, 66.60, 45.56, 39.18, 29.75, 24.90.
(R)-N1-(Бензилоксикарбонил)-1,3-диаминобутан (4). Получают аналогично соединению (5), исходя из 1.17 г (3.63 ммоль) соединения (2)и 2.5 мл 6.7 М HCl/EtOH в 5 мл абс. EtOH что приводит к 0.6 г (75%) соединения (4) в виде густого масла, физико-химические характеристики которого идентичны соединению (3).
(S)-N1-(Бензилоксикарбонил)-N3-(о-нитрофенилсульфонил)-1,3-диаминобутан (5). К охлажденному до +4°C раствору 0.515 г (2.32 ммоль) соединения (3) и 0.36 мл (8.8 ммоль) Et3N в 4.5 мл абс. CH2Cl2 прибавляют при перемешивании в течение 10 мин раствор 0.525 г (2.37 ммоль) NsCl в 2.5 мл абс. CH2Cl2, перемешивают 1 ч при +4°C и еще 3 ч при 20°C. Осадок отфильтровывают, фильтрат разбавляют 10 мл CH2Cl2 и последовательно промывают Н2О (2×5 мл), 10% лимонной кислотой (4×4 мл), Н2О (5 мл), 5 М NaCl (2×5 мл) и высушивают над MgSO4. Растворитель отгоняют в вакууме, остаток высушивают в вакууме над Р2О5 и получают 0.93 г (98.5%) соединения (5), в виде полузакристаллизовавшегося масла, Rf 0.22 (EtOAc-гексан, 2:3). 1H-ЯМР (CDCl3) δ: 8.22-8.05 (1Н, м, C6H4NO2), 7.84-7.83 (1H, м, C6H4NO2), 7.73-7.69 (2Н, м, C6H4NO2), 7.36-7.31 (5Н, м, С6Н5), 5.09 (2Н, с, CH2C6H5), 3.59-3.52 (1Н, м, NHCbz), 3.44-3.36 (1H, м, NHCH2CH2), 3.26-3.18 (1Н, м, NHCH2CH2), 1.78-1.77 (1Н, уш. с, NHNs), 1.58-1.51 (2Н, м, NHCH2CH2), 1.26-1.24 (1Н, м, СН3СН), 1.04 (3Н, д, J 6.5, СН3). 13С-ЯМР (CDCl3) δ: 156.53, 147.96, 136.71, 133.65, 133.00, 130.78, 128.60, 128.18, 125.52, 77.41, 77.10, 76.77, 66.74, 48.76, 37.64,37.15,21.67.
(R)-1-(Бензилоксикарбонил)-N3-(о-нитрофенилсульфонил)-1,3-диаминобутан (6). Получают аналогично соединению (5), исходя из 0.6 г (2.7 ммоль) соединения (4), 0.41 мл (3.01 ммоль) Et3N и 0.61 г (2.75 ммоль) NsCl, что приводит к 1.07 г (97.4%) соединения (6), в виде густого масла, физико-химические характеристики которого идентичны соединению (5).
(S)-N1-(Бензилоксикарбонил)-N8-(фталоил)-3-метил-1,3-диамино-4-азаоктан (7). К раствору 0.92 г (2.26 ммоль) соединения (5) в 7.5 мл абс. DMF прибавляют 1.09 г (3.31 ммоль) N-(4-йодбутил)фталимида, 1.2 г (7.23 ммоль) безв. K2CO3 и перемешивают 12 ч при 40°C. Затем к реакционной смеси прибавляют 0.6 г (3.6 ммоль) безв. K2CO3, 0.73 мл (7.2 ммоль) PhSH и перемешивают еще 16 ч при 20°C. Осадок отделяют центрифугированием, промывают DMF (2×5 мл), растворитель отгоняют в вакууме, остаток очищают колоночной хроматографией на SiO2 (50 г), элюируя смесью CH2Cl2-МеОН-25% NH4OH, 100:1.8:0.2, что после высушивания в вакууме над P2O5/KOH приводит к 0.78 г (81.2%) соединения (7) в виде густого масла, Rf 0.23 (CH2Cl2-МеОН-25% NH4OH, 100:5.4:0.6). 1Н-ЯМР (CDCl3) δ: 7.9-7.75+7.68-7.65 (4Н, м, С6Н4), 7.34-7.26 (5Н, м, С6Н5), 5.91 (1Н, уш. с, NHCbz), 5.06 (2Н, с, CH2C6H5), 3.68-3.66 (2Н, т, CH2NHCbz), 3.33-3.23 (2Н, м, CHNHCH2), 2.75-2.66 (2Н, м, CH2NPht), 2.58-2.52 (1Н, м, CHNHCH2), 1.76-1.69 (2Н, м, CH2CHNH), 1.63-1.45 (5Н, м, CH2CH2CH2NPht+СН3СН), 1.07 (3Н, д, J 6.5, СН3). 13С-ЯМР (CDCl3) δ: 168.77, 156.79, 137.25, 134.21, 132.48, 128.78, 128.31, 128.26, 123.51, 77.67, 77.36, 77.03, 66.69, 52.39, 46.69, 39.19, 38.06, 36.10, 27.87, 26.69, 20.70.
(R)-N1-(Бензилоксикарбонил)-N8-(фталоил)-3-метил-1,3-диамино-4-азаоктан (8). Получают аналогично соединению (7), исходя из 1.05 г (2.58 ммоль) соединения (6) и 1.26 г (3.83 ммоль) N-(4-йодбутил)фталимида, что после удаления нозильной защиты приводит к 0.963 г (87.8%) соединения (8) в виде густого масла, физико-химические характеристики которого идентичны соединению (7).
(S)-N1-(Бензилоксикарбонил)-3-метил-1,3-диамино-4-азаоктан (9). К раствору 0.78 г (1.84 ммоль) соединения (7) в 10 мл абс. EtOH прибавляют 2.5 мл 1 М N2H4*H2O/EtOH и кипятят при перемешивании 2 ч. Реакционную смесь упаривают в вакууме досуха, к остатку прибавляют 10 мл теплого 25% NH4OH и 5 мл теплого CHCl3, органический слой отделяют, а водный экстрагируют горячим CHCl3 (4×4 мл). Объединенные органические вытяжки промывают 5 М NaCl (7 мл) и высушивают над К2СО3. Растворитель отгоняют в вакууме, остаток растворяют в 5 мл диоксан-25% NH4OH, 97:3 и очищают колоночной хроматографией на SiO2 (22 г), элюируя последовательно смесью диоксан-25% NH4OH, 97:3 и диоксан-25% NH4OH, 95:5, что после высушивания в вакууме над Р2О5/КОН приводит к 0.44 г (81.6%) соединения (9), в виде густого масла Rf 0.23 (диоксан-25% NH4OH, 9:1). 1Н-ЯМР (CDCl3) δ: 7.34-7.25 (5Н, м, С6Н5), 6.06 (1Н, уш. с, NHCbz), 5.07 (2Н, с, CH2C6H5), 3.34-3.22 (2Н, м, CH2NHCbz), 2.81-2.72+2.53-2.47 (1H+1H, м, CbzNHCH2CH2), 2.69-2.65 (СН3СН+CHNHCH2), 1.61-1.50 (5Н, м, NHCH2CH2CH2), 1.29-1.24 (4Н, м, CH2CH2CH2NH2), 1.07 (3Н, д, J 6.5, СН3). 13С-ЯМР (CDCl3) δ: 156.80, 128.80, 128.33, 120.91, 77.67, 77.36, 77.04, 66.74, 52.59, 47.18, 42.42, 39.31,35.94,31.95, 28.11,20.68.
(R)-N1-(Бензилоксикарбонил)-3-метил-1,3-диамино-4-азаоктан (10). Получают аналогично соединению (9), исходя из 0.956 г (2.25 ммоль) соединения (8) и 2.8 мл 1 М раствора N2H4/EtOH, что приводит к 0.606 г (92%) соединения (10) в виде густого масла, физико-химические характеристики которого идентичны соединению (9).
Тригидрохлорид (S)-1,8-диамино-3-метил-4-азаоктана (11). К раствору 0.44 г (1.5 ммоль) соединения (9) в 8 мл смеси АсОН-МеОН, 1:1 прибавляют ~0.2 мл суспензии Pd-черни в МеОН и гидрируют при атмосферном давлении до прекращения выделения СО2. Pd-чернь отфильтровывают, промывают МеОН, объединенные фильтраты упаривают в вакууме досуха. Остаток растворяют в EtOH, прибавляют 2 мл 5.0 М HCl, упаривают в вакууме досуха и остаток перекристаллизовывают из смеси MeOH-EtOH, что после высушивания в вакууме над P2O5/КОН приводит к 0.34 г (84%) соединения (11), т. пл. 231-232°C; [α]D 20 +3.8°; ее>99.5% (Чертеж 4В); Rf 0.24 (n-бутанол-АсОН-пиридин-H2O, 4:2:1:2). 1Н-ЯМР (D2O) δ: 3.48-3.41 (1H, м, СН(СН3)); 3.20-3.03 (6Н, м, H2NCH2(CH2)2CH2NH+NH2CH2); 2.24-2.17 (1H, м, СНСН2); 2.00-1.91 (2Н, м, CHCH2); 1.83-1.74 (4Н, м, С-СН2СН2-С); 1.37 (3Н, д, J 6.7, СН(СН3)). 13С-ЯМР (D2O) δ: 54.88, 47.10, 41.68, 38.75, 33.07, 26.84, 25.83, 17.96. Вычислено, %: С 35.76; Н 9.00; N 15.64. C8H24Cl3N3. Найдено, %: С 35.71; Н 8.95; N 15.64.
Тригидрохлорид (R)-1,8-диамино-3-метил-4-азаоктана (12). Получают аналогично соединению (11), исходя из 0.6 г (2.05 ммоль) соединения (10), что приводит к 0.44 г (79.5%) соединения (12); [α]D 20 -4.1°; ее >99.5% (Чертеж 4Б). Вычислено, %: С 35.76; Н 9.00; N 15.64. C8H24Cl3N3. Найдено, %: С 35.70; Н 8.93; N 15.66. Остальные физико-химические характеристики идентичны соединению (11).
Пример 2
Субстратные свойства (R)- и (S)-изомеров тригидрохлорида 3-метилспермидина в дезоксигипузинсинтазной реакции.
Метод основан на включении аминобутильной группы С-метилированных аналогов спермидина в радиоактивно-меченый путресцин и последующем разделении образовавшихся радиоактивно-меченых гомоспермидина и путресцина при помощи ионообменной хроматографии [Hyvönen М.Т., Keinänen Т.А., Khomutov М., Simonian A., Vepsäläinen J., Park J.H., Khomutov A.R., Alhonen L., Park M.H. "Effects of novel C-methylated spermidine analogs on cell growth via hypusination of eukaryotic translation initiation factor 5A"'. Amino Acids, 42(2-3), 685-695 (2012)]. Субстратная смесь в объеме 0.05 мл содержит 0.2 М натрий-глициновый буфер (pH=9.5), 0.05 мг бычьего сывороточного альбумина; 1 мМ дитиотреитола; 1 микроКи [14С]-путресцина (уд. активность 100 мКи/ммоль), 1 мМ никотинамиддинуклеотида и 10-25 микроМ исследуемого С-метилированного аналога спермидина.
Пример 3
Определение стереоизомерной чистоты тригидрохлоридов (R)- и (S)-3-метилспермидинов.
Для определения стереоизомерной чистоты тригидрохлориды (R)- и (S)-3-метилспермидины превращают в соответствующие трис-дансильные производные согласно описанному в работе [Kabra P.M., Lee Н.К., Lubich W.P., and Marton L.J. "Solid-phase extraction and determination of dansyl derivatives of unconjugated and acetylated polyamines by reversed-phase liquid chromatography: improved separation systems for polyamines in cerebrospinal fluid, urine and tissue". J. Chromatogr., 380, 19-32 (1986)]. Для этого к раствору рацемического тригидрохлорида 3-метилспермидина, или тригидрохлоридам его (R)- и (S)-изомеров, в 0.1 М натрий-биккарбонатном буфере (pH=9.5) прибавляют 5-ти кратный мольный избыток 10% раствора дансилхлорида в ацетоне и инкубируют 30 мин при 37°C, встряхивая реакционную смесь на "Vortex" каждые 5 мин. Затем на мини-колонке С-18 отделяют трис-дансильные производные 3-метилспермидина от натриевой соли дансилсульфокислоты, промывая картридж последовательно 0.1 М NaHCO3 (4×2 мл) и H2O (2 мл). Трис-дансильные производные 3-метилспермидина элюируют МеОН (1 мл) и аликвоту этого раствора используют для анализа стереоизомерного состава образца на хиральной ВЭЖХ колонке Phenomex Lux-2 (150×4.6 мм, размер частиц 5 µm). Элюция МеОН, содержащим 0.1% диэтиламина, со скоростью 0.6 мл/мин, детекция по флуоресценции - возбуждение при 360 нм, эмиссия при 460 нм. Результаты анализов представлены на Чертеж 4А, Чертеж 4Б и Чертеж 4В.
Пример 4
Определение соотношения (R)- и (S)-изомеров 3-метилспермидина в клетках DU145 после их инкубации с рацемическим тригидрохлоридом 3-MeSpd и 5 мМ DFMO в течение 6 сут.
Клетки карциномы простаты DU145 выращивают на модифицированной среде Игла, содержащей 10% эмбриональной телячьей сыворотки и 0.05 мг/мл гентамицина при 37°C в атмосфере, содержащей 10% СО2, в целом, как описано ранее [Hyvonen М.Т., Keinanen Т.А., Cerrada-Gimenez М., Sinervirta R., Grigorenko N., Khomutov A.R., Vepsalainen J., Alhonen L., Janne J. "Role of hypusinated eukaryotic translation initiation factor 5A in polyamine depletion-induced cytostasis". J. Biol. Chem., 282(48), 34700-34706 (2007)]. Для определения соотношения (R)- и (S)-изомеров 3-метилспермидина клетки DU145 выращивают в 10 см чашках Петри до плотности 1×106 клеток/чашку, а затем продолжают выращивание в среде, содержащей 0.1 мМ рацемического тригидрохлорида 3-метилспермидина и 5 мМ α-дифторметилорнитина (DFMO) в течение 6 сут. Через 3 сут, среду заменяют на свежую, содержащую 0.1 мМ рацемического тригидрохлорида 3-метилспермидина и 5 мМ (DFMO). Клетки DU145 разрушают, инкубируя 20 мин при 0°C в лизирующем натрий-фосфатном буфере, содержащем Na2-EDTA, Triton Х-100 и дитиотреитол. К аликвоте прибавляют 50% раствор сульфосалициловой кислоты, содержащий 1,7-диаминогептан (внутренний стандарт) и после инкубации при 0°C в течение 2 ч центрифугируют. В супернатанте определяют количество (R)- и (S)-изомеров 3-метилспермидина как описано в Примере 3. Результаты анализа представлены на Чертеж 4Г.
Пример 5
Восстановление роста клеток с полностью истощенным пулом полиаминов при помощи R-изомера тригидрохлорида 3-метилспермидина
Клетки DU145 выращивают в присутствии 5 мМ DFMO в течение 3, 6, или 10 дней без добавления (R)- и (S)-изомеров тригидрохлорида 3-метилспермидина, или в присутствии 0.1 мМ (R)- и (S)-изомеров тригидрохлорида 3-метилспермидина, аналогично описанному в Примере 4. Рост-восстанавливающую способность оценивают, сравнивая количество клеток в контроле (клетки DU145, выращеннные без добавления DFMO или аналогов спермидина) с количеством клеток, выращенных только в присутствии DFMO, или в присутствии DFMO и изомеров тригидрохлорида 3-метилспермидина. Результаты экспериментов представлены на Чертеж 5.
Краткое описание чертежей
Чертеж 1. Биогенные полиамины путресцин (Put), спермидин (Spd) и спермин (Spm).
Чертеж 2. Схема синтеза (R)- и (S)-изомеров тригидрохлорида 3-метилспермидина и условия проведения реакции.
i - CbzCl/Et3N/THF; ii - HCl/EtOH/H2O; iii - NsCl/CH2Cl2/Et3N; iv - J(CH2)4NPht/DMF/K2CO3; v - PhSH/DMF/K2CO3; vi - N2H4EtOH/Δ; vii - H2/Pd/MeOH/AcOH.
Чертеж 3. Субстратные свойства спермидина (Spd), тригидрохлорида рацемического 3-метилспермидина (rac-3-MeSpd) и его (R)- и (S)-изомеров (R-3-MeSpd и S-3-MeSpd, соответственно) в дезоксигипузинсинтазной реакции.
Чертеж 4. Соотношение (R)- и (S)-изомеров в рацемическом 3-MeSpd (А), в (R)-изомере 3-MeSpd (Б), в (S)-изомере 3-MeSpd (В) и в клетках DU145 после их инкубации в присутствии 0.1 мМ 3-MeSpd и 5 мМ DFMO в течение 6 сут (Г). Цифры над пиками соответствуют временам удерживания, а цифры под фрагментами профиля элюции соответствуют площади пиков (R)-3-MeSpd и (S)-3-MeSpd - по данным ВЭЖХ.
Чертеж 5. Восстановление роста клеток DU145 с истощенным пулом полиаминов (инкубация с 5 мМ DFMO в течение 3, 6 или 10 сут) при помощи 0.1 мМ рацемического тригидрохлогида 3-метилспермидина (rac-3-MeSpd), 0.1 мМ (R)- или 0.1 мМ (S)-изомеров тригидрохлорида 3-метилспермидина (R-3-MeSpd и S-3-MeSpd, соответственно).
1. Тригидрохлориды (R)- и (S)-изомеров 1,8-диамино-3-метил-4-азаоктана (3-метилспермидина):
2. Метод синтеза (R)- и (S)-изомеров тригидрохлорида 1,8-диамино-3-метил-4-азаоктана (3-метилспермидин), заключающийся в алкилировании солей (R)- и (S)-изомеров сульфамида N1-защищенного 1,3-диаминобутана при помощи N-защищенных 1-амино-4-бутилгалогенидов с последующим последовательным удалением защитных групп и последующей обработкой полученного остатка раствором соляной кислоты.
3. Метод синтеза по п. 2, заключающийся в том, что алкилирование солей (R)- и (S)-изомеров сульфамида N1-(бензилоксикарбонил)-1,3-диаминобутана при помощи N-(фталоил)-1-амино-4-бутилгалогенидов проводят в апротонных полярных растворителях.
4. Метод синтеза по п. 2, заключающийся в том, что алкилирование (R)- и (S)-изомеров сульфамида N1-(бензилоксикарбонил)-N1-(о-нитрофенилсульфонил-1,3-диаминобутана при помощи N-(4-йодбутил)фталимида проводят в диметилформамиде в присутствии карбоната калия.
5. Метод синтеза по п. 2, заключающийся в том, что удаление фталильной защиты в (R)- и (S)-изомерах N1-(бензилоксикарбонил)-N8-(фталоил)-3-метил-1,3-диамино-4-азаоктана проводят при помощи гидразингидрата в спирте.
6. Метод синтеза по п. 2, заключающийся в том, что удаление бензилоксикарбонильных групп в (R)- и (S)-изомерах N1-(бензилоксикарбонил)-1,8-диамино-3-метил-4-азаоктана осуществляется каталитическим гидрированием над Pd-чернью при атмосферном давлении в смеси метанол-уксусная кислота.
7. Метод синтеза по п. 2, заключающийся в том, что превращение триацетатов (R)- и (S)-изомеров 1,8-диамино-3-метил-4-азаоктана в тетрагидрохлориды проводят при помощи водного раствора соляной кислоты.