Способ моделирования пролиферативной витреоретинопатии у крыс
Иллюстрации
Показать всеИзобретение относится к медицине, в частности к экспериментальной офтальмологии, и предназначено для получения модели пролиферативной витреоретинопатии. Для этого крысам в полость стекловидного тела глаза вводят 2 мкл раствора диспазы, содержащего фермент в дозе 0,03U. Устанавливают признаки витреоретинопатии через 6 недель после введения фермента. Способ позволяет получить адекватную модель заболевания. 3 ил., 1 пр.
Реферат
Область техники
Изобретение относится к области медицины, в частности к офтальмологии, и может быть использовано при разработке методов профилактики и лечения пролиферативной витреоретинопатии (ПВР).
Уровень техники
ПВР - это глазная патология, которая может возникать вследствие травмы, диабетической ретинопатии и регматогенной отслойки сетчатки. ПВР характеризуется пролиферацией клеток пигментного эпителия, глиальных, макрофагов и фибробластов на поверхности сетчатки, что приводит к образованию мембран. В среднем через 2 недели с момента начала ПВР у клеток, образующих мембраны, появляется сократительная способность, что соответствует следующей фазе процесса - формированию фиксированных складок отслоенной сетчатки с выраженным ее укорочением. ПВР является наиболее распространенной причиной рецидива отслойки сетчатки после хирургического лечения. Гемофтальм способствует разрастанию эпиретинальных мембран.
Профилактика и консервативное лечение этой патологии не разработаны. Весьма перспективным является разработка лечения на экспериментальных моделях.
Известны два типа моделирования ПВР: первый заключается во введении в стекловидное тело различных видов клеток (Sugita G. et al. Intravitreal autotransplantation of fibroblasts. // Am J Ophthalmol. 1980. Vol. 89, №LP. 121-130. Fastenberg D. et al. A comparison of different cellular inocula in an experimental model of massive periretinal proliferation. // Am. J. Ophthalmol. 1982. Vol. 93, №5. P. 559-564. Hui Y.N., Sorgente N., Ryan S. Posterior vitreous separation and retinal detachment induced by macrophages // Graefe′s Arch. Clin. Exp.Ophthalmol. 1987. Vol. 225. P. 279-284. Garcia-Layana A. et al. Porcine model of proliferative vitreoretinopathy with platelets // Curr Eye Res. 1997. Vol.16, №6. P. 556-563), второй требует хирургических манипуляций с глазом (Chinn С.et al. Strain-dependent gene expression in a lens extraction PVR model // Invest Ophthalmol Vis Sci. 2005. Vol. 46. P. E-Abstract 5528. Cleary P., Ryan S.. Experimental posterior penetrating eye injury in the rabbit. II. Histology of wound, vitreous, and retina. // Br J Ophthalmol. 1979. Vol. 63, №5. P. 312-321).
Метод введения в стекловидное тело клеток имеет следующие недостатки:
1. Вводится один тип клеток (фибробласты, тромбоциты, макрофаги или клетки пигментного эпителия), хотя исследования последних лет показали, что образование эпиретинальных мембран является результатом одновременной пролиферации различных типов клеток, в том числе и глиальных. Таким образом, введение одного типа клеток значительно отличает модель ПВР от клинических проявлений.
2. Пролиферация клеток в процессе образования мембран - это следствие, а не первое звено процесса. К пролиферации могут приводить следующие факторы: воспаление внутри глаза, нарушение гематоофтальмического барьера, травма, нарушение целостности сетчатки. Таким образом, введение клеток в стекловидное тело не отражает особенности патогенеза заболевания.
Метод моделирования ПВР с использованием различных хирургических манипуляций (удаление хрусталика и стекловидного тела, криопексия, отслоение сетчатки или ее удаление, проникающая травма глаза) приводит к сильному повреждению глаза и нарушению его строения и целостности. Эти модели могут быть использованы для изучения развития ПВР только при конкретных патологиях глаза.
Из уровня техники известен способ моделирования пролиферативной витреоретиноатии, предложенный Frenzel Е.М. и соавт.(Frenzel Е.М. et al. A new model of proliferative vitreoretinopathy. // Invest. Ophthalmol. Vis. Sci. 1998. Vol. 39, №11. P. 2157-2164). Недостатком способа является то, что в качестве экспериментального животного был выбран кролик. Строение сетчатки у кролика достаточно сильно отличается от сетчатки человека. Часть сетчатки кролика аваскулярна: только ее небольшая часть, в непосредственной близости от диска зрительного нерва, имеет двойной источник кровообращения, вся остальная сетчатка получает питание исключительно из хориоидеи. Также у кролика различные участки слоя клеток пигментного эпителия имеют разную форму и нерегулярное расположение, в отличие от регулярного гексагонального пигментного эпителия сетчатки человека. У кролика, в отличие от человека, отсутствует истинная фовеа, но имеются полосы повышенной остроты зрения с повышенной плотностью фоторецепторов и ганглиозных клеток. Так как в процессе формирования ПВР задействованы пигментный эпителий, слой ганглионарных клеток сетчатки и сосудистое русло глаза, то такие их значительные отличия в строении от человека могут играть выраженную роль в изменении процесса развития мембран. Процесс создания модели также отличается длительностью - 10 недель.
Наиболее близким к заявляемому решению является способ моделирования пролиферативной витреоретинопатии, предложенный Тихонович М.В. и соавт. (Тихонович М.В. и др. Влияние неселективного блокатора циклооксигеназ на развитие эпиретинального фиброза в моделях необратимой ишемии глаза и диспазовызванной пролиферативной витреоретинопатии. Механизмы функционирования висцеральных систем. Санкт-Петербург, 2012, с. 238). В данной публикации представлена информация о влиянии противовоспалительных средств на состояние сетчатки глаза крыс при внутриглазной инъекции диспазы. Однако в опубликованных материалах отсутствуют дозы вводимого фермента и морфологические критерии изменения сетчатки, которые предложены в настоящем изобретении по итогам проведенных исследований. Целью проведенных дополнительных исследований являлась отработка модели, касающейся сроков развития и клинической картины изменения, которые были приближены к таковым у людей. При этом были использованы несколько доз фермента и взяты разные сроки для разработки морфологических критериев оценки. Предлагаемая в заявляемом решении доза вызывает деструкцию сетчатки, а противовоспалительная терапия зрительно улучшает состояние глаза.
Раскрытие изобретения
Задачей изобретения является создание нового способа моделирования пролиферативной витреоретинопатии у крыс, которая будет вызвана эндогенными клетками и факторами, добиться высокой результативности и стабильности получаемого результата, а именно разрастания на поверхности сетчатки мембран в относительно короткие сроки. Это достигается за счет введения в витреальную полость глаза крысы водного раствора протеолитического фермента диспазы, что приводит к развитию воспаления в глазу и нарушению гематоофтальмического барьера.
Техническим результатом изобретения является получение ПВР в глазу крыс, отражающей патогенез процесса, близкий к изменениям у человека, сокращение длительности эксперимента и стабильность получаемого результата.
Технический результат достигается за счет использования протеолитического фермента, способного расщеплять межклеточные контакты и внутреннюю пограничную мембрану сетчатки, что активирует клеточную пролиферацию и нарушает целостность сосудистой стенки.
Согласно настоящему изобретению способ моделирования пролиферативной витреоретинопатии у крыс характеризуется тем, что в полость стекловидного тела глаза крысы вводят 2 мкл раствора протеолитического фермента диспазы в концентрации 0,03U, при этом образование мембран на поверхности сетчатки наблюдается через 6 недель после введения фермента.
Через 6 недель после введения фермента может быть проведена энуклеация глаза для последующего гистологического анализа образовавшихся на поверхности сетчатки мембран.
Диспаза используется для создания микроокружения между сетчаткой и стекловидным телом, в котором формируется мембрана, сокращающаяся и приводящая к отслойке сетчатки, что очень похоже на процесс ПВР у человека. Фермент расщепляет фибронектин, коллаген IV и, в меньшей степени, коллаген I. Диспаза обеспечивает активный пролиферативный процесс на поверхности сетчатки. Разрушение внутренней пограничной мембраны сетчатки и нарушение межклеточных контактов в ее слоях приводят к активации воспалительного процесса и пролиферации глиальных клеток, фибробластов и иммунных клеток. Нарушение гематоофтальмического барьера - это второй ключевой момент, приводящий к развитию ПВР. Кровь является источником различных цитокинов, которые стимулируют миграцию и пролиферацию вышеупомянутых клеток. Запущенные воспалительные процессы приводят к еще большему нарушению гематоофтальмического барьера. Получается замкнутый патологический круг развития ПВР.
Краткое описание чертежей
Изобретение поясняется фигурами 1-3.
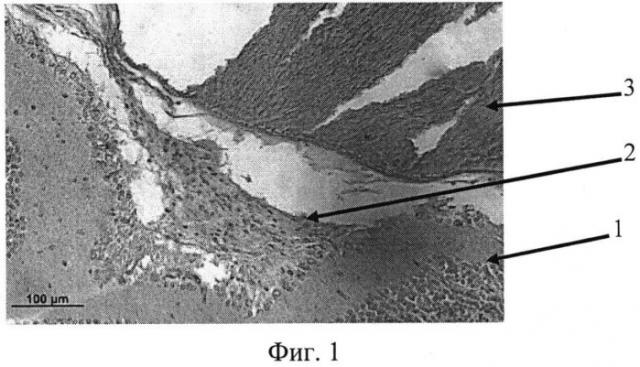
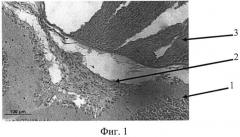
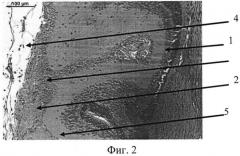
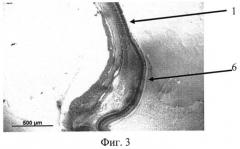
На фиг. 1 изображена эпиретинальная мембрана, образовавшаяся на поверхности сетчатки в ответ на введение диспазы в витреальную полость, на фиг. 2 изображена эпиретинальная мембрана с более выраженной волокнистой структурой, приводящая к образованию складок сетчатки, на фиг. 3 - отслойка сетчатки.
Позицией 1 обозначена сетчатка, позицией 2 - эпиретинальная мембрана, позицией 3 - хрусталик, позицией 4 - стекловидное тело, позицией 5 - складчатость сетчатки, позицией 6 - отслойка сетчатки.
Осуществление изобретения
Способ осуществляется следующим образом:
1. Все манипуляции выполняли на наркотизированных хлоралгидратом крысах популяции Rattus norvegicus (400 мг/кг внутрибрюшинно).
2. В правый глаз крысы закапывали местный анестетик Алкаин 0,5% (Alcon), зрачок расширяли с помощью 1,0% раствора Тропикамида (Ромфарм компани), в качестве антисептика использовали Витабакт 0,05% (Novartis).
3. Диспазу, разведенную в изотоническом растворе, концентрацией 0,03U в объеме 2 мкл вводили в витреальную полость через прокол в плоской части цилиарного тела иглой 30G.
Предложенный способ применен в эксперименте на 15 крысах. У всех экспериментальных животных получен идентичный результат - формирование ПВР, подтвержденное гистологическим исследованием.
После эксперимента клиническое наблюдение проводилось в течение 1, 6 и 8 недель. После производили энуклеацию глаза и декапитацию животного. Глаза фиксировали в растворе Дэвидсона и подвергали гистологическому исследованию. После фиксации глаза обезвоживались в спиртах восходящей концентрации и заливались в парафин. Парафиновые срезы окрашивались гематоксилин-эозином. Клинически после введения диспазы в глаз экспериментальных животных в первые три дня отмечался легкий мидриаз, в стекловидном теле у 70% животных отмечался гемофтальм. Через 6 недель у 100% крыс наблюдалось образование выраженных эпиретинальных мембран, у 60% - отслойка сетчатки, гемофтальм был в 25% глаз, а катаракта к 8 недели эксперимента наблюдалась у 75%.
В качестве контроля мы использовали крыс (N =15), которые получили инравитреальную инъекцию изотонического раствор хлорида натрия (0,9%). У этих крыс на протяжении всего эксперимента не наблюдалось развития ПВР.
Пример
Крыса №12. Под общим обезболиванием в правый глаз инстилировали алкаин 0,5%, тропикамид 1,0% и витабакт 0,05%. Диспазу, разведенную в изотоническом растворе, концентрацией 0,03U в объеме 2 мкл ввели в витреальную полость через прокол в плоской части цилиарного тела иглой 30G. В послеоперационном периоде, в первые дни, наблюдался небольшой мидриаз, в стекловидном теле - плавающие помутнения. Через шесть недель в стекловидном теле формировались тяжи, складчатость сетчатки, ограниченная ее отслойка. Роговица не изменена. Заднекапсулярная катаракта.
Гистологически. В стекловидном теле вблизи внутренней поверхности сетчатки - уплотнение структур кортикальных слоев. В заднем отделе глаза множественные очаги ПВР, под которыми выявлялась зона разрушения внутренней пограничной мембраны, пролиферация клеток ганглионарного слоя, наряду с клеточными элементами в мембранах определялись волокнистые структуры (фиг. 1).
Контрактильные свойства в новообразованной эпиретинальной мембране проявлялись в формировании складок и очагов отслоенной сетчатки (фиг. 2, 3).
Патогистологический диагноз: Пролиферативная витреоретинопатия. Отслойка сетчатки.
Способ моделирования пролиферативной витреоретинопатии (ПВР) у крыс путем введения в полость стекловидного тела глаза крысы раствора протеолитического фермента диспазы, отличающийся тем, что вводят 2 мкл раствора, содержащего диспазу в дозе 0,03U, и устанавливают признаки ПВР через 6 недель после введения фермента.