Новые аналоги глюкагона
Иллюстрации
Показать всеНастоящее изобретение относится к новым соединениям глюкагона, содержащим три или более отрицательно заряженных фрагмента, где один из указанных отрицательно заряженных фрагментов расположен дистально от липофильного фрагмента. Соединения обладают повышенной физической стабильностью в растворе и улучшенной растворимостью при нейтральных значениях рН. Изобретение также относится к способам лечения и к применению этих соединений для изготовления лекарств для лечения гипергликемии, диабета и ожирения, а также различных заболеваний или состояний, ассоциированных с гипергликемией, диабетом и ожирением. 9 н. и 18 з.п. ф-лы, 2 табл., 20 ил., 108 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к новым пептидным аналогам глюкагона с улучшенными физической стабильностью и растворимостью, а также с более длительным профилем действия, к применению указанных пептидов в терапии, к способам лечения, включающим введение указанных пептидов пациентам, и к применению указанных пептидов при изготовлении лекарств.
УРОВЕНЬ ТЕХНИКИ
Человеку, а также другим млекопитающим, жизненно необходима строгая регуляция уровней глюкозы в крови. Точно установлено, что для поддержания правильных уровней глюкозы в крови важны два гормона - инсулин и глюкагон. Тогда как инсулин действует в печени и периферических тканях, снижая уровни глюкозы в крови посредством увеличения поглощения глюкозы периферическими тканями и снижения выработки глюкозы печенью, глюкагон в основном оказывает действие на поджелудочную железу и печень, повышая уровни глюкозы в крови посредством активации глюконеогенеза и гликогенолиза. Также сообщалось, что глюкагон усиливает липолиз, индуцирует избыточное образование кетоновых тел и снижает уровни триглицеридов в плазме [Schade and Eaton, Acta Diabetologica, 1977, 14, 62].
Глюкагон является важной составляющей механизма защиты от гипогликемии, и введение низкой дозы глюкагона может предотвратить индуцированную инсулином гипогликемию или улучшить способность восстанавливаться после гипогликемии. Исследования также показали, что глюкагон действительно снижает потребление пищи и массу тела у крыс и людей [Schulman et al. J. Appl. Physiol. 1957, 11, 419]. Следовательно, глюкагон является приемлемой сигнальной молекулой, которая может быть полезна для ограничения потребления пищи. Кроме того, введение более низкой дозы глюкагона может индуцировать чувство насыщения, не влияя на уровень глюкозы в крови. Большое количество людей, страдающих диабетом, в частности, диабетом 2 типа, имеют избыточную массу тела или ожирение. Ожирение представляет собой фактор высокого риска возникновения серьезных или даже смертельных общих заболеваний, и для большинства больных диабетом в высокой степени желательно, чтобы их лечение не вызывало прибавки массы тела.
Однако глюкагон обладает ограниченным спектром возможных применений в лекарственных препаратах из-за быстрого клиренса из кровообращения, с периодом полувыведения, равным примерно 5 мин. Быстрый клиренс терапевтического агента неудобен в случаях, когда желательно поддерживать его высокий уровень в крови в течение продолжительного периода времени, так как при этом будут необходимы повторные введения. В некоторых случаях можно повлиять на профиль высвобождения пептидов, применяя пригодные фармацевтические композиции, но такой подход обладает различными недостатками и не является общеприменимым.
В настоящее время глюкагон доступен в рекомбинантной форме в виде лиофилизированной готовой лекарственной формы с коротким периодом действия, ограниченным несколькими часами, несмотря на то, что максимальный уровень глюкагона достигает значений, намного превышающих уровни эндогенного глюкагона. Следовательно, имеется потребность в химически модифицированных соединениях глюкагона для их доставки на постоянных уровнях таким образом, чтобы достигался более длительный биологический период полувыведения, т.е., в модифицированных пептидах глюкагона с более длительным профилем действия.
Кроме того, глюкагон не обладает стабильностью в течение очень длительного периода времени при его растворении в водном растворе, так как физическая стабильность глюкагона очень низка, и растворы глюкагона образуют гели и фибриллы в течение нескольких часов или дней (Beaven et al. European J. Biochem. 1969, 11, 37-42), в зависимости от чистоты пептида, концентрации соли, значения рН и температуры. Кроме того, у глюкагона человека очень низкая растворимость при рН 3,5-9,5.
Специалистам известны несколько заявок на патент, раскрывающих различные аналоги на основе глюкагона и GLP-1/коагонистов рецептора глюкагона, такие как, например, патенты WO 2008/086086, WO 2008/101017, WO 2007/056362, WO 2008/152403 и WO 96/29342. Некоторые GLP-1/коагонисты рецептора глюкагона, раскрытые в данных патентах, имеют отношение к специфическим мутациям, отличающим их от нативного глюкагона человека. Другими раскрытыми аналогами глюкагона являются пегилированный (см., например, WO 2007/056362) или ацилированный по специфическим положениям нативный глюкагон человека (см., например, WO 96/29342). Был описан глюкагон для профилактики гипогликемии, например, в заявке на патент US 7314859.
Пептиды по настоящему изобретению относятся к новым модифицированным пептидам глюкагона с более длительным профилем действия и, кроме того, делают возможным получение таких модифицированных пептидов глюкагона в составе стабильных фармацевтических композиций при физиологическом значении рН.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым пептидам глюкагона с улучшенными физической стабильностью и растворимостью при нейтральных значениях рН, к применению указанных пептидов в терапии, к способам лечения, включающим введение указанных пептидов пациентам, и к применению указанных пептидов при изготовлении лекарств для применения при лечении диабета, ожирения и сопутствующих им заболеваний и состояний.
Авторы настоящего изобретения неожиданно обнаружили ряд положений в составе глюкагона человека, присоединение к которым заместителей, содержащих три или более отрицательно заряженных фрагмента, таким образом, что при этом один из указанных отрицательно заряженных фрагментов расположен дистально от липофильного фрагмента, приводит к получению агонистов глюкагона с улучшенными физической стабильностью и растворимостью.
В первом варианте воплощения (в воплощении 1) настоящее изобретение относится к пептиду глюкагона, содержащему SEQ ID 1, до семи аминокислотных замен в указанном пептиде глюкагона и заместитель, включающий три или более отрицательно заряженных фрагмента, при этом один из указанных отрицательно заряженных фрагментов расположен дистально от липофильного фрагмента, и при этом указанный заместитель присоединен в положении эпсилон в составе Lys, в положении дельта в составе Orn или к атому серы в составе Cys, находящихся в одном или нескольких из следующих положений аминокислот в составе указанного пептида глюкагона: Х10, X12, X16, X17, X18, X20, X21, X24, X25, X27, X28, X29 и/или Х30, или к его фармацевтически приемлемой соли, амиду, кислоте или пролекарству.
Настоящее изобретение дополнительно относится к применению соединений по настоящему изобретению в терапии, к фармацевтическим композициям, содержащим соединения по изобретению, и к применению соединений по изобретению при изготовлении лекарств.
ОПИСАНИЕ ФИГУР
На фиг.1 показана зависимость растворимости глюкагона (1, черная линия) и соединения из примера 3 (2, серая линия) от значения рН (тест VIII).
На фиг.2 показано суммарное потребление пищи у крыс после подкожного введения 100 нмоль/кг, 300 нмоль/кг или 1000 нмоль/кг аналога глюкагона из примера 3. Данные = среднее значение±стандартная ошибка среднего, n=5-6.
На фиг.3 показано суммарное потребление пищи у крыс после подкожного введения 300 нмоль/кг аналога глюкагона из примера 4. Данные = среднее значение±стандартная ошибка среднего, n=5-6.
На фиг.4 показано суммарное потребление пищи у крыс после подкожного введения 300 нмоль/кг аналога глюкагона из примера 5. Данные = среднее значение±стандартная ошибка среднего, n=5-6.
На фиг.5 представлена фармакокинетика аналога глюкагона из примера 3 после внутривенного и подкожного введения доз крысам. Период полувыведения (в/в) ~ 8,6±0,5 ч, период полувыведения (п/к) ~ 9,4±0,9 ч (среднее значение±стандартная ошибка среднего).
На фиг.6 показано снижение массы тела при алиментарном ожирении у крыс, которым вводили дозы аналога глюкагона из примера 3 отдельно или в сочетании с аналогом GLP-1 - соединением G3. Пунктирные линии обозначают начало введения доз и снижения доз, соответственно.
На фиг.7 показано изменение массы тела на 14 день при алиментарном ожирении у крыс, которым вводили дозы аналога глюкагона из примера 3 отдельно или в сочетании с аналогом GLP-1 - соединением G3. Отрезками показана значимость различий (однофакторный дисперсионный анализ, поправка Бонферрони).
На фиг.8 показаны профили содержания глюкозы в крови на 11 день введения доз при алиментарном ожирении у крыс, которым вводили аналог глюкагона из примера 3 отдельно или в сочетании с аналогом GLP-1 - соединением G3. Пунктирные линии обозначают введение доз.
На фиг.9 показано потребление пищи при алиментарном ожирении у крыс, которым вводили аналог глюкагона из примера 3 отдельно или в сочетании с аналогом GLP-1 - соединением G3.
На фиг.10 показаны уровни инсулина, измеренные в конце исследования, при алиментарном ожирении у крыс, которым вводили аналог глюкагона из примера 3 отдельно или в сочетании с аналогом GLP-1 - соединением G3. Сравнение групп проводили с помощью однофакторного дисперсионного анализа и апостериорного множественного сравнения Дуннета, сопоставляя группы с группой, получавшей пищу с высоким содержанием жиров, которой вводили носитель.
На фиг.11 показаны уровни холестерина, измеренные в конце исследования, при алиментарном ожирении у крыс, которым вводили аналог глюкагона из примера 3 отдельно или в сочетании с аналогом GLP-1 - соединением G3. Сравнение групп проводили с помощью однофакторного дисперсионного анализа и апостериорного множественного сравнения Дуннета, сопоставляя группы с группой, получавшей пищу с высоким содержанием жиров, которой вводили носитель.
На фиг.12 представлена растворимость аналогов глюкагона в буферном растворе 10 мМ HEPES (рН7,5). Буферный раствор добавляли к аналогам глюкагона до достижения номинальной концентрации 250 мкМ и измеряли концентрацию через один час, после центрифугирования. Концентрации оценивали с применением хемилюминесцентного, специфичного к азоту, детектора для ВЭЖХ.
На фиг.13 показана стабильность аналогов глюкагона. К аналогам глюкагона добавляли буферный раствор до номинальной концентрации 250 мкМ и через один час получали хроматограмму с помощью сверхэффективной жидкостной хроматографии (UPLC). Растворы хранили в течение 6 дней при 30°С, после чего пробы профильтровали и получили новую хроматограмму с помощью UPLC. Значения площадей под кривыми для пиков (214 нМ) использовали в качестве показателя концентрации пептида в растворе.
На фиг.14 показано время запаздывания (по левой оси Y) и степень извлечения (по правой оси Y), определенные при проведении теста на образование фибрилл с применением ThT (тиофлавина Т). Столбец 1: время запаздывания и степень извлечения для готовой лекарственной формы 1. Столбец 2А: время запаздывания и степень извлечения для аналога глюкагона из примера 3 в составе готовой лекарственной формы 2. Столбец 2В: степень извлечения аналога инсулина G5 в составе готовой лекарственной формы 2. Столбец 3А: время запаздывания и степень извлечения для аналога глюкагона из примера 3 в составе готовой лекарственной формы 3. Столбец 3В: степень извлечения аналога GLP-1 - соединения G5 - в составе готовой лекарственной формы 3. Столбец 4: время запаздывания и степень извлечения для аналога глюкагона из примера 3 в составе готовой лекарственной формы 4 (степень извлечения аналога GLP-1 - соединения G5 - не определяли по техническим причинам). Столбец 5: время запаздывания и степень извлечения для аналога инсулина G5 в составе готовой лекарственной формы 5. Столбец 6: время запаздывания и степень извлечения для аналога GLP-1 - соединения G1 - в составе готовой лекарственной формы 6.
На фиг.15 показаны результаты инкубирования GLP-1, глюкагона и аналога глюкагона из примера 3 с DPP-IV (2 мкг/мл) при 37°С в буферном растворе HEPES. Определенные периоды полужизни составляли 11 мин., 32 мин. и 260 мин., соответственно.
На фиг.16 показано потребление пищи у крыс после разового подкожного введения аналогов глюкагона из примеров 53 и 54 (тест V).
На фиг.17 представлен фармакокинетический профиль аналога глюкагона из примера 51 после разового подкожного или внутривенного введения крысам (тест VII).
На фиг.18 показано потребление пищи у крыс после разового подкожного введения аналогов глюкагона из примера 51 (тест V).
На фиг.19 показана зависимость растворимости нативного глюкагона (черная линия) и соединения из примера 51 (серая линия) от значения рН (тест VIII).
На фиг.20 показана динамика образования фибрилл по флуоресценции ThT.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Среди дополнительных вариантов воплощения настоящего изобретения представлены следующие:
2. Пептид глюкагона по воплощению 1, при этом указанный пептид глюкагона не содержит ни одной или содержит одну, две, три, четыре, пять, шесть или семь замен аминокислотных остатков в составе указанного пептида глюкагона.
3. Пептид глюкагона по любому из воплощений 1-2, при этом указанный пептид глюкагона не содержит ни одной замены аминокислотных остатков в составе указанного пептида глюкагона.
4. Пептид глюкагона по любому из воплощений 1-2, при этом указанный пептид глюкагона содержит одну замену аминокислотных остатков в составе указанного пептида глюкагона.
5. Пептид глюкагона по любому из воплощений 1-2, при этом указанный пептид глюкагона содержит две замены аминокислотных остатков в составе указанного пептида глюкагона.
6. Пептид глюкагона по любому из воплощений 1-2, при этом указанный пептид глюкагона содержит три замены аминокислотных остатков в составе указанного пептида глюкагона.
7. Пептид глюкагона по любому из воплощений 1-2, при этом указанный пептид глюкагона содержит четыре замены аминокислотных остатков в составе указанного пептида глюкагона.
8. Пептид глюкагона по любому из воплощений 1-2, при этом указанный пептид глюкагона содержит пять замен аминокислотных остатков в составе указанного пептида глюкагона.
9. Пептид глюкагона по любому из воплощений 1-2, при этом указанный пептид глюкагона содержит шесть замен аминокислотных остатков в составе указанного пептида глюкагона.
10. Пептид глюкагона по любому из воплощений 1-2, при этом указанный пептид глюкагона содержит семь замен аминокислотных остатков в составе указанного пептида глюкагона.
11. Пептид глюкагона по любому из воплощений 1-10, при этом указанные аминокислотные замены расположены в следующих положениях аминокислот в составе указанного пептида глюкагона: Х2, Х4, Х9, Х10, X12, X16, X17, X18, X20, X21, X24, X25, X27, X28, X29 и/или X30.
12. Пептид глюкагона по любому из воплощений 1-11, при этом указанные аминокислотные замены могут быть расположены в следующих положениях в составе указанного пептида глюкагона:
Х2 представляет собой Aib или D-Ser;
Х4 представляет собой D-Phe;
Х9 представляет собой Glu;
Х10 представляет собой Cys, Lys, Orn или (p)Tyr;
X12 представляет собой Cys, Lys, Orn, lie, His, Gln, Tyr, Leu или Arg;
X16 представляет собой Cys, Glu, Lys или Orn;
X17 представляет собой Cys, Gln, Lys, His или Orn;
X18 представляет собой Cys, Gln, Ala, Lys, His или Orn;
X20 представляет собой Cys, Arg, Lys, Glu, His или Orn;
X21 представляет собой Cys, Orn, Glu, Arg, His или Lys;
X24 представляет собой Cys, Lys, Arg, His, Glu, Asp, Gly, Ser или Orn;
X25 представляет собой Cys, Arg, Lys, His, Glu, Asp, Gly, Phe, Ser, Tyr, (p)Tyr или Orn;
X27 представляет собой Met(O), Val, lie, Leu, Arg, His, Cys, Lys, Glu, Gln или Orn;
X28 представляет собой Cys, Lys, His, Arg, Ser, Thr, Glu, Asp, Ala, Gln или Orn;
X29 представляет собой Cys, Glu, Asp, Lys, His, Arg, Pro или Orn и
Х30 отсутствует или представляет собой Cys, Lys, Arg, Glu, Gly, Pro или Orn.
13. Пептид глюкагона по любому из воплощений 1-12, при этом указанные аминокислотные замены могут быть расположены в следующих положениях в составе указанного пептида глюкагона: Х4 представляет собой D-Phe, Х9 представляет собой Glu, X12 представляет собой Arg, X16 представляет собой Lys, X20 представляет собой Lys или Glu, X21 представляет собой Glu, X24 представляет собой Lys или His, X25 представляет собой Arg или Lys, X27 представляет собой Leu, Lys, Glu или Gln, X28 представляет собой Lys или Ser, X29 представляет собой Lys или Pro, Х30 отсутствует или представляет собой Lys или Pro.
14. Пептид глюкагона по любому из воплощений 1-13, где X17 представляет собой Lys, X18 представляет собой Lys, X21 представляет собой Glu, Х24 представляет собой Lys или Оrn и X27 представляет собой Leu.
15. Пептид глюкагона по любому из воплощений 1-14, где Х17 представляет собой Lys, X18 представляет собой Lys, X21 представляет собой Glu и X27 представляет собой Leu.
16. Пептид глюкагона по любому из воплощений 1-15, где X17 представляет собой Lys, X21 представляет собой Glu и Х27 представляет собой Leu.
17. Пептид глюкагона по любому из воплощений 1-16, где X17 представляет собой Lys и X21 представляет собой Glu.
18. Пептид глюкагона по любому из воплощений 1-17, где Х2 представляет собой Aib или D-Ser.
19. Пептид глюкагона по любому из воплощений 1-18, где Х4 представляет собой D-Phe.
20. Пептид глюкагона по любому из воплощений 1-19, где Х9 представляет собой Glu.
21. Пептид глюкагона по любому из воплощений 1-20, где Х10 представляет собой Cys, Lys, Orn или (р)Tyr.
22. Пептид глюкагона по любому из воплощений 1-21, где Х10 представляет собой Cys.
23. Пептид глюкагона по любому из воплощений 1-22, где Х10 представляет собой Lys.
24. Пептид глюкагона по любому из воплощений 1-23, где Х10 представляет собой Orn.
25. Пептид глюкагона по любому из воплощений 1-24, где X12 представляет собой Cys, Lys, Orn, lie, His, Gln, Tyr, Leu или Arg.
26. Пептид глюкагона по любому из воплощений 1-25, где X12 представляет собой Arg.
27. Пептид глюкагона по любому из воплощений 1-26, где X12 представляет собой Cys, Lys или Orn.
28. Пептид глюкагона по любому из воплощений 1-27, где X12 представляет собой Lys или Orn.
29. Пептид глюкагона по любому из воплощений 1-28, где Х12 представляет собой Cys.
30. Пептид глюкагона по любому из воплощений 1-29, где Х12 представляет собой Lys.
31. Пептид глюкагона по любому из воплощений 1-30, где Х12 представляет собой Orn.
32. Пептид глюкагона по любому из воплощений 1-31, где Х16 представляет собой Cys, Lys или Orn.
33. Пептид глюкагона по любому из воплощений 1-32, где Х16 представляет собой Cys, Lys или Orn.
34. Пептид глюкагона по любому из воплощений 1-33, где Х16 представляет собой Lys или Orn.
35. Пептид глюкагона по любому из воплощений 1-34, где X16 представляет собой Lys.
36. Пептид глюкагона по любому из воплощений 1-35, где Х16 представляет собой Cys.
37. Пептид глюкагона по любому из воплощений 1-36, где Х16 представляет собой Orn.
38. Пептид глюкагона по любому из воплощений 1-37, где X17 представляет собой Cys, Gln, Lys, His или Orn.
39. Пептид глюкагона по любому из воплощений 1-38, где X17 представляет собой Lys.
40. Пептид глюкагона по любому из воплощений 1-39, где Х17 представляет собой Cys.
41. Пептид глюкагона по любому из воплощений 1-40, где X17 представляет собой Orn.
42. Пептид глюкагона по любому из воплощений 1-41, где X18 представляет собой Gln, Ala, Lys, His или Orn.
43. Пептид глюкагона по любому из воплощений 1-42, где Х20 представляет собой Cys, Arg, Lys, Glu, His или Orn.
44. Пептид глюкагона по любому из воплощений 1-43, где Х20 представляет собой Lys или Glu.
45. Пептид глюкагона по любому из воплощений 1-44, где X20 представляет собой Lys.
46. Пептид глюкагона по любому из воплощений 1-45, где Х20 представляет собой Glu.
47. Пептид глюкагона по любому из воплощений 1-46, где Х20 представляет собой Cys.
48. Пептид глюкагона по любому из воплощений 1-47, где Х20 представляет собой Orn.
49. Пептид глюкагона по любому из воплощений 1-48, где X21 представляет собой Cys, Orn, Glu, Arg, His или Lys.
50. Пептид глюкагона по любому из воплощений 1-49, где X21 представляет собой Glu или Lys.
51. Пептид глюкагона по любому из воплощений 1-50, где X21 представляет собой Glu.
52. Пептид глюкагона по любому из воплощений 1-51, где X21 представляет собой Lys.
53. Пептид глюкагона по любому из воплощений 1-52, где Х21 представляет собой Cys.
54. Пептид глюкагона по любому из воплощений 1-53, где X21 представляет собой Orn.
55. Пептид глюкагона по любому из воплощений 1-54, где Х24 представляет собой Cys, Lys, Arg, His, Glu, Asp, Gly, Ser или Orn.
56. Пептид глюкагона по любому из воплощений 1-55, где Х24 представляет собой Cys, Lys или Orn.
57. Пептид глюкагона по любому из воплощений 1-56, где Х24 представляет собой Lys или Orn.
58. Пептид глюкагона по любому из воплощений 1-57, где Х24 представляет собой Lys или His.
59. Пептид глюкагона по любому из воплощений 1-58, где Х24 представляет собой Lys.
60. Пептид глюкагона по любому из воплощений 1-59, где Х24 представляет собой His.
61. Пептид глюкагона по любому из воплощений 1-60, где Х24 представляет собой Cys.
62. Пептид глюкагона по любому из воплощений 1-61, где Х24 представляет собой Orn.
63. Пептид глюкагона по любому из воплощений 1-62, где Х25 представляет собой Arg, Lys, His, Glu, Asp, Gly, Phe, Ser, Tyr, (p)Tyr или Orn.
64. Пептид глюкагона по любому из воплощений 1-63, где X25 представляет собой His, Lys, lie, Leu, Ala, Met, Cys, Asn, Val, Ser, Gln, Asp, Glu, Thr или (p)Tyr.
65. Пептид глюкагона по любому из воплощений 1-64, где X25 представляет собой His, Arg, Lys или (p)Tyr.
66. Пептид глюкагона по любому из воплощений 1-65, где Х25 представляет собой Arg или Lys.
67. Пептид глюкагона по любому из воплощений 1-66, где Х25 представляет собой Arg.
68. Пептид глюкагона по любому из воплощений 1-67, где Х25 представляет собой Lys.
69. Пептид глюкагона по любому из воплощений 1-68, где Х25 представляет собой Cys.
70. Пептид глюкагона по любому из воплощений 1-69, где Х25 представляет собой От.
71. Пептид глюкагона по любому из воплощений 1-70, где Х27 представляет собой Cys, Met(O), Val, lie, Leu, Arg, His, Lys, Glu, Gln или Orn
72. Пептид глюкагона по любому из воплощений 1-71, где Х27 представляет собой Leu, Lys, Glu или Gln.
73. Пептид глюкагона по любому из воплощений 1-72, где Х27 представляет собой Leu.
74. Пептид глюкагона по любому из воплощений 1-73, где Х27 представляет собой Lys.
75. Пептид глюкагона по любому из воплощений 1-74, где X27 представляет собой Glu.
76. Пептид глюкагона по любому из воплощений 1-75, где Х27 представляет собой Gln.
77. Пептид глюкагона по любому из воплощений 1-76, где Х27 представляет собой Cys, Lys или Orn.
78. Пептид глюкагона по любому из воплощений 1-77, где Х27 представляет собой Lys или Orn.
79. Пептид глюкагона по любому из воплощений 1-78, где Х27 представляет собой Cys.
80. Пептид глюкагона по любому из воплощений 1-79, где Х27 представляет собой Orn.
81. Пептид глюкагона по любому из воплощений 1-80, где Х28 представляет собой Cys, Lys, His, Arg, Ser, Thr, Glu, Asp, Ala, Gln или Orn.
82. Пептид глюкагона по любому из воплощений 1-81, где Х28 представляет собой Lys или Ser.
83. Пептид глюкагона по любому из воплощений 1-82, где Х28 представляет собой Cys, Lys или Orn.
84. Пептид глюкагона по любому из воплощений 1-83, где X28 представляет собой Lys или Orn.
85. Пептид глюкагона по любому из воплощений 1-84, где Х28 представляет собой Cys.
86. Пептид глюкагона по любому из воплощений 1-85, где Х28 представляет собой Orn.
87. Пептид глюкагона по любому из воплощений 1-86, где Х28 представляет собой Lys.
88. Пептид глюкагона по любому из воплощений 1-87, где Х29 представляет собой Cys, Lys или Orn.
89. Пептид глюкагона по любому из воплощений 1-88, где Х29 представляет собой Lys или Orn.
90. Пептид глюкагона по любому из воплощений 1-89, где Х29 представляет собой Orn.
91. Пептид глюкагона по любому из воплощений 1-90, где Х29 представляет собой Lys или Pro.
92. Пептид глюкагона по любому из воплощений 1-91, где Х29 представляет собой Lys.
93. Пептид глюкагона по любому из воплощений 1-92, где Х30 отсутствует или представляет собой Cys, Lys, Arg, Glu, Gly, Pro или Orn.
94. Пептид глюкагона по любому из воплощений 1-93, где Х30 отсутствует или представляет собой Cys, Lys или Orn.
95. Пептид глюкагона по любому из воплощений 1-94, где Х30 отсутствует или представляет собой Lys или Orn.
96. Пептид глюкагона по любому из воплощений 1-95, где Х30 отсутствует или представляет собой Orn.
97. Пептид глюкагона по любому из воплощений 1-96, где Х30 отсутствует или представляет собой Cys.
98. Пептид глюкагона по любому из воплощений 1-97, где Х30 отсутствует или представляет собой Lys или Pro.
99. Пептид глюкагона по любому из воплощений 1-98, где Х30 отсутствует или представляет собой Lys.
100. Пептид глюкагона по любому из воплощений 1-99, где Х30 отсутствует или представляет собой Pro.
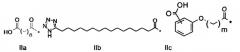
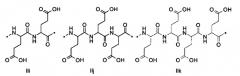
101. Пептид глюкагона по любому из воплощений 1-100, при этом указанный заместитель имеет формулу II:
,
где
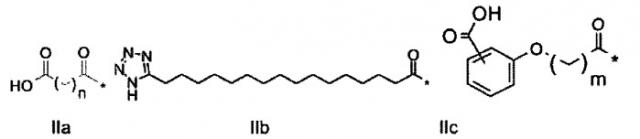
Z1 представляет собой структуру согласно одной из формул IIa, IIb или IIc;
где n в формуле IIa равно 6-20,
m в формуле IIc равно 5-11;
группа СООН в формуле Не может быть присоединена в положении 2, 3 или 4 в составе фенильного кольца, символ * в формулах IIa, IIb и IIc указывает место присоединения к атому азота в Z2; если Z2 отсутствует, Z1 присоединен к атому азота на Z3 в месте, указанном символом *, и если Z2 и Z3 отсутствуют, Z1 присоединен к атому азота на Z4, в месте, указанном символом *;
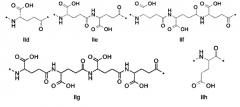
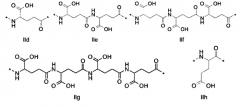
Z2 отсутствует или представляет собой структуру согласно одной из формул IId, IIc, IIf, IIg, IIh, IIi, IIj или IIk:
где каждый аминокислотный фрагмент независимо обладает стереохимией L или D;
где Z2 присоединен через атом углерода, обозначенный *, к атому азота в составе Z3, обозначенному *;
если Z3 отсутствует, Z2 присоединен через атом углерода, обозначенный *, к атому азота в составе Z4 обозначенному *;
и если Z3 и Z4 отсутствуют, Z2, присоединен через атом углерода, обозначенный *, к эпсилон-атому азота в составе лизина или к дельта-атому азота в составе орнитина в пептиде глюкагона.
Z3 отсутствует или представляет собой структуру согласно одной из формул IIm, IIn, IIo или IIp:
Z3 присоединен через атом углерода в составе Z3, обозначенный символом *, к атому азота в составе Z4, обозначенному символом *, если Z4 отсутствует, Z3 присоединен через атом углерода, обозначенный *, к эпсилон-атому азота в составе лизина или к дельта-атому азота в составе орнитина в пептиде глюкагона;
Z4 отсутствует или представляет собой структуру согласно одной из формул IId, IIe, IIf, IIg, IIh, Iii, IIj или IIk, где каждый аминокислотный фрагмент независимо является либо L-, либо D-формой, при этом Z4 присоединен через атом углерода, обозначенный *, к эпсилон-атому азота в составе лизина или к дельта-атому азота в составе орнитина в пептиде глюкагона.
102. Пептид глюкагона по любому из воплощений 1-101, при этом указанный заместитель имеет формулу II:
,
где:
Z1 представляет собой структуру согласно одной из формул IIa, IIb или IIc:
где n в формуле IIа равно 6-20,
Z2 отсутствует или представляет собой структуру согласно одной из формул IId, IIc, IIf, IIg, IIh, IIi, IIj или IIk:
где каждый аминокислотный фрагмент независимо обладает стереохимией L или D.
Z3 отсутствует или представляет собой структуру согласно одной из формул IIm, IIn, IIо или IIp:
Z4 отсутствует или представляет собой структуру согласно одной из формул IId, IIc, IIf, IIg, IIh, Iii, IIj или IIk;
где каждый аминокислотный фрагмент независимо обладает стереохимией L или D.
103. Пептид глюкагона по любому из воплощений 1-102, где структуры, представленные формулами IIa-IIp, обладают стереохимией L.
104. Пептид глюкагона по любому из воплощений 1-103, где структуры, представленные формулами IIa-IIp, обладают стереохимией D.
105. Пептид глюкагона по любому из воплощений 1-104, где Z2 в составе указанного заместителя формулы II отсутствует, если присутствует Z4.
106. Пептид глюкагона по любому из воплощений 1-105, где Z4 в составе указанного заместителя формулы II отсутствует, если присутствует Z2.
107. Пептид глюкагона по любому из воплощений 1-106, где указанный заместитель представляет собой структуру в соответствии с одной из формул IIIa, IIIb, IIIc, IIId, IIIe, IIIf, IIIg, IIIh, IIIi, IIIj, IIIk, IIIl, IIIm, IIIn или IIIo:
или
108. Пептид глюкагона по любому из воплощений 1-107, где Z4 в составе указанного заместителя отсутствует.
109. Пептид глюкагона по любому из воплощений 1-108, где Z3 и Z4 в составе указанного заместителя отсутствуют.
110. Пептид глюкагона по любому из воплощений 1-109, где Z2 и Z4 в составе указанного заместителя независимо представлены отрицательно заряженными фрагментами, такими как γGlu, Glu и/или Asp.
111. Пептид глюкагона по любому из воплощений 1-110, где Z2 и Z4 в составе указанного заместителя независимо представлены указанными фрагментами в количестве до десяти штук.
112. Пептид глюкагона по любому из воплощений 1-111, где Z2 и Z4, в составе указанного заместителя независимо представлены тремя указанными фрагментами.
113. Пептид глюкагона по любому из воплощений 1-112, где Z2 и Z4 в составе указанного заместителя независимо представлены четырьмя указанными фрагментами.
114. Пептид глюкагона по любому из воплощений 1-113, где Z2 и Z4 в составе указанного заместителя независимо представлены пятью указанными фрагментами.
115. Пептид глюкагона по любому из воплощений 1-114, где Z2 и Z4 в составе указанного заместителя независимо представлены фрагментами Glu и/или γGlu.
116. Пептид глюкагона по любому из воплощений 1-115, где Z2 и Z4 в составе указанного заместителя независимо представлены γGlu, γGlu-Glu, γGlu-Glu-Glu, γGlu-Glu-Glu-Glu, γGlu-Glu-Glu-Glu-Glu.
117. Пептид глюкагона по любому из воплощений 1-116, где Z2 и Z4 в составе указанного заместителя независимо представлены фрагментами Glu и/или Asp.
118. Пептид глюкагона по любому из воплощений 1-117, где Z2 и Z4 в составе указанного заместителя независимо представлены фрагментами γGlu и/или Asp.
119. Пептид глюкагона по любому из воплощений 1-118, где Z2 и Z4 в составе указанного заместителя независимо представлены фрагментами Asp.
120. Пептид глюкагона по любому из воплощений 1-119, где Z2 и Z4 в составе указанного заместителя независимо представлены Asp, Asp-Asp, Asp-Asp-Asp или Asp-Asp-Asp-Asp.
121. Пептид глюкагона по любому из воплощений 1-120, где Z2 и Z4 в составе указанного заместителя независимо представлены фрагментами Glu.
122. Пептид глюкагона по любому из воплощений 1-121, где Z2 и Z4 в составе указанного заместителя независимо представлены Glu, Glu-Glu, Glu-Glu-Glu, Glu-Glu-Glu-Glu, Glu-Glu-Glu-Glu-Glu.
123. Пептид глюкагона по любому из воплощений 1-122, где Z2 и Z4 в составе указанного заместителя независимо представлены фрагментами γGlu.
124. Пептид глюкагона по любому из воплощений 1-123, где Z2 и Z4 в составе указанного заместителя независимо представлены γGlu, γGlu-γGlu, γGlu-γGlu-γGlu, γGlu-γGlu-γGlu-γGlu, γGlu-γGlu-γGlu-γGlu-γGlu.
125. Пептид глюкагона по любому из воплощений 1-124, при этом указанный заместитель содержит липофильный остаток.
126. Пептид глюкагона по любому из воплощений 1-125, при этом указанный заместитель содержит алкильную группу с линейной цепочкой или разветвленную алкильную группу.
127. Пептид глюкагона по любому из воплощений 1-126, при этом указанный заместитель нековалентно связывается с альбумином.
128. Пептид глюкагона по любому из воплощений 1-127, при этом указанный заместитель отрицательно заряжен при физиологических значениях рН.
Дополнительные варианты воплощения настоящего изобретения относятся к следующему:
129. Пептид глюкагона по любому из воплощений 1-128, при этом указанный заместитель присоединен в положении эпсилон в составе Lys, в положении дельта в составе Orn или к атому серы в составе Cys.
130. Пептид глюкагона по любому из воплощений 1-129, при этом указанный заместитель присоединен в положении эпсилон в составе Lys или в положении дельта в составе Orn.
131. Пептид глюкагона по любому из воплощений 1-130, при этом указанный заместитель присоединен в положении эпсилон в составе Lys.
132. Пептид глюкагона по любому из воплощений 1-131, при этом указанный заместитель присоединен в положении дельта в составе Orn.
133. Пептид глюкагона по любому из воплощений 1-132, при этом указанный заместитель присоединен к атому серы в составе Cys.
134. Пептид глюкагона по любому из воплощений 1-133, при этом указанный заместитель присоединен к одному или нескольким из следующих положений аминокислот в составе указанного пептида глюкагона: Х10, X12, X16, X17, X18, X20, X21, X24, X25, X27, X28, X29 и/или X30.
135. Пептид глюкагона по любому из воплощений 1-134, при этом указанный заместитель находится в одном или нескольких из следующих положений аминокислот в составе указанного пептида глюкагона: X12, X16, X20, Х24, X25, X28, X29 и/или Х30.
136. Пептид глюкагона по любому из воплощений 1-135, при этом указанный заместитель находится в одном или нескольких из следующих положений аминокислот в составе указанного пептида глюкагона: X16, X24 и/или Х28.
137. Пептид глюкагона по любому из воплощений 1-136, при этом указанный заместитель находится в положении аминокислоты X12 в составе указанного пептида глюкагона.
138. Пептид глюкагона по любому из воплощений 1-137, при этом указанный заместитель находится в положении аминокислоты X16 в составе указанного пептида глюкагона.
139. Пептид глюкагона по любому из воплощений 1-138, при этом указанный заместитель находится в положении аминокислоты X20 в составе указанного пептида глюкагона.
140. Пептид глюкагона по любому из воплощений 1-139, при этом указанный заместитель находится в положении аминокислоты X24 в составе указанного пептида глюкагона.
141. Пептид глюкагона по любому из воплощений 1-140, при этом указанный заместитель находится в положении аминокислоты X28 в составе указанного пептида глюкагона.
142. Пептид глюкагона по любому из воплощений 1-141, при этом указанный заместитель находится в положении аминокислоты Х29 в составе указанного пептида глюкагона.
143. Пептид глюкагона по любому из воплощений 1-142, при этом указанный заместитель находится в положении аминокислоты Х30 в составе указанного пептида глюкагона.
144. Пептид глюкагона по любо