Белки, связывающие простагландин е2, и их применение
Иллюстрации
Показать всеНастоящее изобретение относится к области иммунологии. Предложено антитело и его антиген-связывающий фрагмент, способные связывать простагландин Е2 (PGE2) и охарактеризованные последовательностями CDR. Также рассмотрены: кодирующая антитело или его антиген-связывающий фрагмент выделенная нуклеиновая кислота, вектор экспрессии, клетка-хозяин, способ продуцирования антитела или его антиген-связывающего фрагмента по изобретению, композиции, содержащие антитело или антиген-связывающий фрагмент антитела по изобретению, применение антитела или антиген-связывающего фрагмента по изобретению в производстве лекарственного средства для понижения активности PGE2 у субъекта-человека и для лечения субъекта, а также способ определения присутствия PGE2 или его фрагмента в тестируемом образце посредством иммуноанализа. Данное изобретение может найти дальнейшее применение в терапии и диагностике заболеваний, связанных с повышенной активностью или экспрессией PGE2. 10 н. и 15 з.п. ф-лы, 9 ил., 21 табл., 4 пр.
Реферат
Ссылка на родственные заявки
Настоящая заявка не является предварительной заявкой и имеет заявленный приоритет в соответствии с предварительной заявкой США с серийным номером 61/134264, поданной 8 июля 2008, а также в соответствии с предварительной заявкой США с серийным номером 61/197258, поданной 23 октября 2008, содержание которых полностью включено в настоящее описание в виде ссылок.
Область изобретения
Настоящее изобретение связано со связывающими белками и их композициями, например, антителами и их антиген-связывающими частями, специфичными в отношении метаболитов липидов, таких как простагландин E2 (PGE2), а также со способами их получения, определения их характеристических свойств и применения в профилактике, диагностике и лечении заболеваний.
Предшествующий уровень техники
Биологически активные липиды, такие как простагландин (PG), тромбоксан (TX), лейкотриен (LT) и сфингозин-1-фосфат, играют критическую физиологическую роль в этиологии различных расстройств. (Wymann, MP and Schneiter R, Nat. Rev. Mol. Cell. Biol. 9(2): 162-76 (2008)). В процессе воспаления клеточные фосфолипазы, в особенности фосфолипазы A2 и C, активируются и вызывают деградацию фосфолипидов клеточной мембраны до арахидоновой кислоты (АК). АК метаболизируется двумя основными путями обмена, циклооксигеназным (COX) и липоксигеназным (LO). Путь COX продуцирует простагландины (PGD2, PGE2, PGF2α, простациклин или PGI2, а также тромбоксан A2 или TXA2). Путь LO имеет два ответвления; путь 5-LO продуцирует лейкотриены (например, LTA4, LTB4, LTC4, LTD4, LTE4 и LTF4), а путь 15-LO продуцирует липоксины (например, LXA4, LXB4). Простаноиды, такие как простагландин (PG), тромбоксан (TX) и лейкотриен (LT), имеют различные физиологические активности для установления локального гомеостаза в организме (The Pharmacological Basis of Therapeutics, Gilman, et al., eds., 7th Ed., p. 660, Macmillan Publishing Co., New York (1985)). Продукты путей обмена COX, PG G2/PG H2 превращаются в специфические простагландины под действием тканевых специфических изомераз, с получением PGI2, TXA2, PGD2, PGE2 и PGF2α. Биологические функции простагландинов опосредованы тканеспецифическими родопсиноподобными семиспиральными трансмембранными рецепторами клеточной поверхности, сопряженными с G-белком (GPCR). Точную физиологическую/патологическую роль каждого простагландина определяют в клеточном контексте, по профилю экспрессии рецептора, по аффинности лиганда и по дифференциальному сопряжению с тем или иным путям сигнальной трансдукции (Haluska et al., Annu. Rev. Pharm. Tox. 10: 213 (1989); Prostanoids and their Receptors. In Comprehensive Medicinal Chemistry, p. 643, Pergamon Press, Oxford (1990)). Простагландины играют весьма разнообразные физиологические роли в регуляции изменения двигательности сосудов, в циклах сна/бодрствования, в кишечной секреции, липолизе, клубочковой фильтрации, дегрануляции тучных клеток, нейротрансмиссии, агрегации тромбоцитов, в лютеолизе желтого тела, в сокращении миометрия и родоразрешении, в развитии воспаления и артритов, в незаращении артериального протока, в росте и дифференцировке клеток и в целом в иммунном ответе. В патофизиологическом отношении простагландины причастны ко множеству различных заболеваний, включая проявления боли и воспаления, злокачественные опухоли, неврологические заболевания, сердечно-сосудистые заболевания и гипертонию.
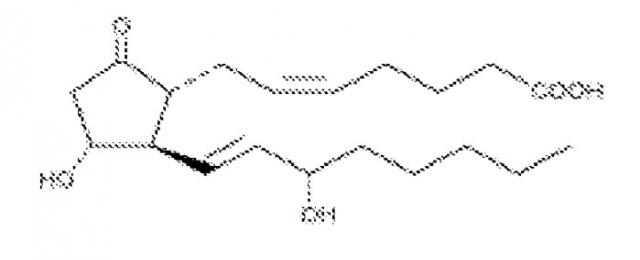
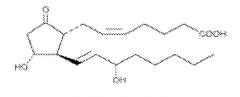
Простагландин E2 (PGE2) является членом семейства простаноидов. PGE2 принимает обширное участие в процессах сокращения и расслабления желудочно-кишечного тракта, секреции желудочного сока, релаксации гладкой мускулатуры и высвобождении нейротрансмиттеров. Было идентифицировано четыре подтипа рецепторов для PGE2, включая EP1, EP2, EP3 и EP4 (Negishi, M. et al., J. Lipid Mediators Cell Signalling, 12: 379-391 (1995)), каждый из которых участвует в различных путях сигнальной трансдукции.
PGE2 является основным продуктом метаболизма АК пути обмена COX. Он является главным простагландином, синтезируемым в суставах и играющим важную роль в процессе воспаления и в патогенезе артрита. Было идентифицировано пять PGE2-синтаз. (Smith WL, Am. J. Physiol. 263 (2 Pt 2): F181-91 (1992)). Из указанных пяти мембранная PGE-синтаза (mPGES)-1 представляется ключевым PGE2-превращающим ферментом, ответственным за продукцию PGE2. MPGES-1 проявляет наиболее высокую каталитическую активность, по сравнению с другими PGE-синтазами, и функцию, в сочетании с COX-1 и/или COX-2, по превращению PGH2 в PGE2. Исследования с использованием мышей KO с mPGES-1 (Kamei, D., et al., J. Biol. Chem., 279(32): 33684-95 (2004); Trebino, C.E., et al., Proc. Natl. Acad. Sci. USA 100(15): 9044-9 (2003) специфической изоформы рецептора PGE2 у мышей KO (McCoy, J.M., et al. J. Clin. Invest., 110(5): 651-8 (2002); Majima, M., et al. Trends Pharmacol. Sci., 24(10): 524-9 (2003); а также Amano, H., et al., J. Exp. Med., 197(2): 221-32 (2003); и специфических антител против PGE2 (Portanova, J.P., et al., J. Exp. Med., 184(3): 883-91 (1996); Zhang, Y., et al., J. Pharmacol. Exp. Ther., 283(3): 1069-75(1997) выявили, что у животных моделей PGE2 играет, по-видимому, основную роль в развитии ревматоидного артрита (RA), боли и воспаления, а также злокачественной опухоли. В отсутствие mPGES-1 уровни COX-1, COX-2 и других PGE2-синтаз остаются относительно неизменными. Мыши mPGES-1 KO являются жизнеспособными, фертильными и нормально развиваются по сравнению с мышами дикого типа. Однако у них возникает резкое снижение как базальных уровней продуцирования PGE2, так и продуцирования PGE2 из макрофагов после сенсибилизации различными воспалительными стимулами. Кроме того, повышается продукция TXA2. У мышей mPGES-1 KO снижена частота встречаемости и степень тяжести развития артрита, к тому же указанные животные в различных моделях проявляли резистентность к боли и воспалению. В нескольких лабораториях независимо были получены различные изоформы рецепторов для EP у мышей KO. Указанные мыши являются жизнеспособными, фертильными и нормально развиваются. Исследование с использованием мышей KO со специфической изоформой EP показало, что различные функции PGE2 опосредованы специфическими изоформами EP. Например, отсутствие у мышей изоформы EP4 четко отражается на тяжести развития артрита, тогда как отсутствие EP3 влияет на развитие и прогрессирование опухолей через модуляцию продуцирования VEGF стромальными клетками и ангиогенез.
В настоящее время считается, что дефекты в биосинтезе и метаболизме простагландинов играют важную роль в этиологии аутоиммунных расстройств и воспаления. Например, синовиальные ткани пациентов, страдающих от ревматоидного артрита, продуцируют в большем количестве PGE2 и простагландин F2α (PGF2α) по сравнению с синовиальными тканями, полученными у субъектов, у которых они не затронуты патологическим процессом (Blotman, F., et al., Rev. Rhum. Mal. Osteoartic, 46(4): 243-7 (1979)). Сходным образом, повышенный синтез PGE2 и PGF2α имеет место у пациентов, у которых проявляются системные и желудочно-кишечные симптомы на фоне нарушения переносимости пиши. Таким образом, головные боли, носящие характер мигрени, проявляющиеся вследствие принятия определенной пищи, могут быть результатом повышенного синтеза простагландинов второго ряда. Множественный склероз также ассоциируется с дисбалансом нормальных уровней простагландинов PGE1 и PGE2. Многие аспекты репродукции, например, фертильность, беременность и роды, могут регулироваться простагландинами. Простагландины играют также ведущую роль в физиологии репродукции. Избыточный синтез простагландинов вызывает дисменорею и родовую деятельность, которые могут быть индуцированы путем внутривенного введения простагландинов или путем установки маточного кольца. (Wang L. et al., Occup. Environ. Med. 61(12): 1021-1026 (2004)). Избыточный синтез PGE2 играет ведущую роль также в расстройствах процессов репродукции, таких как бесплодие, повторные выкидыши, преэклампсия и эклампсия. Следовательно, есть потребность в антителах, специфичных в отношении PGE2, которые блокируют или модулируют его биологические функции, которые могут быть использованы для профилактики и лечения заболеваний, ассоциированных с избыточной продукцией PGE2, а также в диагностических целях.
Имеется сообщение о получении высокоаффинного (с KD, приблизительно составляющим 300 пкМ) моноклонального антитела (mAb) против PGE2, 2B5. (Mnich SJ, et al. J. Immunol. 155(9): 4437-44 (1995)). Эффективность 2B5 по сравнению с индометацином, ингибитором COX-1,2, была определена на животных моделях боли и воспаления у мышей и индуцированного адъювантом артрита у крыс. (Portanova JP et al., J. Exp. Med. 184(3): 883-91 (1996)). Указанные исследования четко показали, что 2B5 было столь же эффективно, сколь и индометацин, в ослаблении боли и воспаления, давая основания предполагать, что PGE2 является ключевым звеном в реализации пути COX-1,2 метаболизма АК у указанных животных моделей.
В течение десятилетий ингибирование пан-PG-продуцирования под действием ингибиторов COX считается хорошо установленной терапевтической стратегией. Известны две изоформы COX, COX-1 и COX-2, каждая из которых кодируется индивидуальным геном. Указанные две изоформы выполняют, по существу, одну и ту же каталитическую реакцию и имеют сходные третичные структуры (Garavito RM, et al., Annu. Rev. Biophys. Biomol. Struct. 32: 183-206 (2003)). COX-1 конститутивно экспрессируется почти во всех тканях и считается в значительной степени ответственным за нормальные функции "домашнего хозяйства", такие как защита клеток и гомеостаз желудка. В отличие от этого, COX-2 конститутивно экспрессируется в особых тканях и является высокоиндуцибельным в местах локализации воспаления и злокачественной опухоли. Таким образом, считается, что COX-2-опосредованная продукция PG играет важную роль в местах локализации воспаления и злокачественной опухоли. Традиционные нестероидные противовоспалительные лекарственные средства (NSAID), например, аспирин, индометацин, ибупрофен) ингибируют обе изоформы COX. Указанные соединения являются наиболее широко применимыми лекарственными средствами в случае боли, ревматоидного артрита (RA), остеоартрита (OA), а также сердечно-сосудистых заболеваний, и в настоящее время они проходят испытания на предмет возможной профилактики злокачественной опухоли толстой кишки и AD. Основными возражениями в связи с традиционными NSAID являются нежелательные явления в популяциях высокого риска, связанные с желудком и почками, и, по-видимому, указанные явления происходят в связи с ингибированием COX-1. Соответственно, второе поколение NSAID, селективные ингибиторы COX-2 (например, целекоксиб, целебрекс; рофекоксиб, виокс; вальдекоксиб, бекстра), имеют, как полагают, улучшенный терапевтический профиль. Это предположение привело к тому, что их стали широко применять против боли, RA и OA. Начиная с момента утверждения первого ингибитора COX-2 в 1999 году, суммарные продажи ингибиторов COX-2 в 2004 году приблизительно составили сумму в 5 биллионов долларов США. Однако к настоящему времени некоторые селективные ингибиторы COX-2 были изъяты с рынка, и они находятся в стадии пересмотра на уровне FDA, в силу их побочных эффектов в отношении сердечно-сосудистых заболеваний в популяции пациентов высокого риска при использовании ими ингибиторов COX-2. Ответственность, ассоциированная с ингибиторами COX, возможно, возрастает в силу того, что они способны ингибировать все простагландины, и, в частности, в силу их способности дифференциально препятствовать продуцированию PGI2 и TXA2, каждый из которых играет важную роль в поддержании сердечно-сосудистого гомеостаза (Martinez-Gonzalez J. et al., Curr. Pharm. Des. 13(22): 2215-2227 (2007)). Ингибирование COX может способствовать тому, что АК становится более доступна для ее метаболизирования липоксигеназным (LO) путем, и, таким образом, увеличивается продукция лейкотриенов и липоксинов, которые могут вносить свой вклад в возникновение побочных эффектов, ассоциированных с ингибированием COX. Современные исследования с использованием мышей, нокаутных в отношении COX-1 и/или COX-2, и специфических ингибиторов COX-1 и COX-2 дают основание допустить, что предположения относительно физиологических ролей двух указанных COX-изоформ могут быть неверными. (Loftin, CD., et al. Prostaglandins Other Lipid Mediat. 68-69: 177-85 (2002)). Указанные исследования свидетельствуют о том, что как COX-1, так и COX-2 играют важную роль в обеспечении простагландинов для поддержания тканевого гомеостаза, и что обе эти изоформы могут участвовать в развитии заболеваний, таких как боль, воспаление и злокачественная опухоль. Следовательно, блокирование пагубного PGE2 ниже путей COX-1 и COX-2 специфическим антителом представляется привлекательным подходом к лечению определенных заболеваний человека.
Другим примером важного биологически активного простагландина является PGD2. PGD2 представляет собой основной циклооксигеназный продукт арахидоновой кислоты, происходящий из тучных клеток при иммунологической сенсибилизации (Lewis, et al., J. Immunol. 129: 1627-1631 (1982)). Активированные тучные клетки, основной источник PGD2, играют одну из ключевых ролей на пути, приводящем к аллергическому ответу при таких состояниях как астма, аллергический ринит, аллергический конъюнктивит, аллергический дерматит и другие заболевания (Brightling, et al., Clin. Exp. Allergy 33: 550-556 (2003)). Современные исследования показывают, что свои эффекты PGD2 оказывает посредством двух различных связанных с G-белком рецепторов (GPCR), D-простаноидным рецептором (DP) и молекулой, гомологичной хемотактическому рецептору и экспрессируемой на Т-хелперных клетках типа 2 (CRTH2, chemoattractant receptor-homologous molecule expressed on T helper type-2), экспрессируемых в различных тканях человека. Системой PGD2/CRTH2 опосредован хемотаксис эозинофилов, базофилов и Th2-клеток, которые участвуют в индукции аллергического воспаления (Ulven T et al., Curr. Top. Med. Chem. 6(13): 1427-1444 (2006)). Многие из воздействий PGD2 опосредованы его действием на рецептор простагландина D-типа ("DP"), G-белок-связанный рецептор, экспрессируемый на клетках эпителия и гладкой мускулатуры. В течение длительного периода считалось, что при астме дыхательный эпителий является ключевым источником воспалительных цитокинов и хемокинов, которые способствуют прогрессированию заболевания (Holgate, et al., Am. J. Respir. Crit. Care Med. 162: 113-117 (2000)). В экспериментальной мышиной модели астмы уровень DP-рецептора на дыхательном эпителии резко увеличивается при сенсибилизации антигеном (Matsuoka, et al., Science 287: 2013-2017 (2000)). DP-рецептор участвует в аллергическом рините у человека, частом аллергическом заболевании, которое характеризуется симптомами чихания, зуда, ринореи и заложенности носа. Было показано, что антагонисты DP эффективны в плане облегчения симптомов аллергического ринита у многих видов, и, более конкретно, было показано, что они ингибируют вызванную антигеном заложенность носа, наиболее ярко выраженный симптом аллергического ринита (Jones, et al., Am. J. Resp. Crit. Care Med. 167: A218 (2003); Arimura, et al., S-5751. J. Pharmacol. Exp. Ther. 298(2): 411-9 (2001)). DP-антагонисты эффективны также в экспериментальных моделях аллергического конъюнктивита и аллергического дерматита (Arimura et al., S-5751. J. Pharmacol. Exp. Ther. 298(2): 411-9 (2001); Torisu, et al., Bioorg. & Med. Chem. 12: 5361-5378 (2004)). Таким образом, есть потребность также и в антителах, специфичных в отношении PGD2, и, следовательно, блокирование или модуляция его биологических функций могут быть использованы для профилактики и лечения заболеваний, которые ассоциированы с избыточной продукцией PGD2.
Сфингозин-1-фосфат (S1P) является другим примером биологически активного липида, который индуцирует многие клеточные эффекты, включая и те, которые приводят к агрегации тромбоцитов, к клеточной пролиферации, а также те, которыми обусловлены клеточная морфология, инвазия опухолевых клеток, хемотаксис эндотелиальных клеток и ангиогенез эндотелиальных клеток in vitro. Следовательно, S1P-рецепторы являются подходящими мишенями для терапевтических воздействий, таких как ранозаживление и ингибирование опухолевого роста. S1P-сигналы передаются клеткам отчасти через группы связанных с G-белком рецепторов, обозначаемых S1P1, S1P2, S1P3, S1P4 и S1P5 (раньше называемых, соответственно, EDG-1, EDG-5, EDG-3, EDG-6 и EDG-8). Указанные рецепторы имеют 50-55% аминокислотную и кластерную идентичность трем остальным рецепторам (LPA1, LPA2 и LPA3 (раньше называемым EDG-2, EDG-4 и EDG-7)) для родственной по структуре лизофосфатидиловой кислоты (LPA). (Ishii, I. et al., Mol. Pharmacol. 58(5): 895-902 (2000)). Когда лиганд связывается с рецептором, в связанном с G-белком рецепторе (GPCR) индуцируется конформационный сдвиг, являющийся причиной того, что ГДФ на α-субъединице ассоциированных G-белков заменяется на ГТФ, с последующим высвобождением G-белков в цитоплазму. Затем α-субъединица и βγ-субъединица диссоциируют, после чего каждая из субъединиц может ассоциировать с эффекторными белками, что активирует вторичные посредники, приводя к реализации клеточного ответа. В конечном итоге ГТФ на G-белках гидролизуется до ГДФ, и происходит реассоциация субъединиц G-белков друг с другом, а затем с рецептором. Амплификация играет основную роль в общем пути метаболизма GPCR. Связывание одного лиганда с одним рецептором приводит к активации многих G-белков, каждый из которых способен к ассоциации со многими эффекторными белками, что приводит к усиленному клеточному ответу. S1P-рецепторы служат хорошими мишенями для лекарственных средств, поскольку индивидуальные рецепторы являются как тканеспецифичными, так и специфичными в отношении конкретного ответа. Тканеспецифичность S1P-рецепторов важна, поскольку создание агониста или антагониста, селективного в отношении одного рецептора, локализует клеточный ответ на тканях, содержащих данный рецептор, ограничивая появление нежелательных побочных эффектов. Специфичность ответа S1P-рецепторов также важна, поскольку дает возможность создания агонистов или антагонистов, которые вызывают инициацию или супрессию определенных клеточных ответов, не воздействуя на другие ответы. Например, специфичность ответа S1P-рецепторов может допустить создание S1P-миметика, который инициирует агрегацию тромбоцитов, не влияя на морфологию клеток.
S1P образуется в качестве метаболита сфингозина и его реакции с сфингозинкиназой, и он в избытке хранится в агрегатах тромбоцитов, когда имеются высокие уровни сфингозинкиназы и отсутствует сфингозинлиаза. S1P высвобождается в процессе агрегации тромбоцитов, накапливается в сыворотке и обнаруживается также в злокачественных асцитах. Биодеградация S1P, наиболее вероятно, происходит путем гидролиза под действием фосфогидролаз, в частности, эктофосфогидролаз сфингозин-1-фосфата. Следовательно, существует потребность в антителах, специфичных в отношении S1P, для модуляции его биологических функций либо путем блокирования его взаимодействия с рецепторами, либо путем стабилизации S1P и усиления его биологических эффектов, для применения в профилактике или лечении аутоиммунных заболеваний, воспалительных заболеваний и злокачественных опухолей.
С учетом роли PGE2 в развитии различных расстройств человеческого организма, созданы терапевтические стратегии для ингибирования или противодействия активности PGE2. В частности, нет никаких публикаций относительно терапевтических антител, подходящих для доставки в организм человека, которые бы связывали и нейтрализовали PGE2. В данной области есть потребность в создании улучшенных антител, способных к связыванию и нейтрализации PGE2.
Краткое описание изобретения
Настоящее изобретение относится к связывающим белкам, специфичным в отношении метаболитов липидов, таких как простагландин E2 (PGE2). Связывающие PGE2 белки согласно изобретению включают в себя, но не ограничиваются перечисленным, антитела, антиген-связывающие фрагменты, а также антиген-связывающие фрагменты с различными каркасными структурами, которые способны к связыванию с PGE2.
Один из аспектов настоящего изобретения относится к связывающим белкам, способным к связыванию PGE2. В одном из аспектов связывающие белки согласно изобретению обладают нейтрализующей, стабилизирующей активностью, активностью антагониста и/или агониста. В другом аспекте связывающие белки способны к модуляции биологической функции PGE2. Например, связывающие белки способны, по меньшей мере, к нейтрализации PGE2.
В одном из аспектов настоящего изобретения связывающие белки способны к связыванию PGE2 и предотвращению связывания PGE2 с одним или несколькими рецепторами PGE2 (например, EP1, EP2, EP3 и EP4). В одном из аспектов настоящего изобретения связывающие белки способны к связыванию PGE2 и предотвращению связывания PGE2 с рецепторами EP1, EP2, EP3 и EP4.
Настоящее изобретение связано со способами получения, определения свойств и применения PGE2-связывающих белков в качестве монотерапии или в качестве комбинированной терапии наряду с другими терапевтическими средствами; а также со способами профилактики и/или лечения заболеваний, опосредованных PGE2, например, аутоиммунных и воспалительных заболеваний, таких, например, как ревматоидный артрит, болезнь Крона, остеоартрит, AMD [возрастная макулярная дистрофия], лимфаденопатии, гемолитические анемии, пурпура, анкилозирующий спондилит, множественный склероз, сахарный диабет, злокачественная опухоль, боль, потеря/восстановление кости, атеросклеротические заболевания, репродуктивные расстройства и другие заболевания. Связывающие белки согласно изобретению могут быть использованы в диагностике таких заболеваний.
В одном из воплощений настоящего изобретения связывающий белок является выделенным белком или его антиген-связывающим фрагментом, которые связываются с PGE2. Такое связывание может быть продемонстрировано путем анализа биотинилированного PGE2 на основе ELISA, с EC50, выбранной из группы, составляющей приблизительно из интервалов от 1×10-6 приблизительно до 1×10-7 M, приблизительно от 1×10-7 приблизительно до 1×10-8 M, приблизительно от 1×10-8 приблизительно до 1×10-9 M, приблизительно от 1×10-9 приблизительно до 1×10-10 M, приблизительно от 1×10-10 приблизительно до 1×10-11 M и приблизительно от 1×10-11 приблизительно до 1×10-12 M. В другом воплощении связывание белков, связывающихся с PGE2, может быть продемонстрировано радиоиммуноанализом на основе 3H-меченного PGE2, с KD, выбранным из группы, состоящей из интервалов приблизительно от 1×10-6 приблизительно до 1×10-7 M, приблизительно от 1×10-7 приблизительно до 1×10-8 M, приблизительно от 1×10-8 приблизительно до 1×10-9 M, приблизительно от 1×10-9 приблизительно до 1×10-10 M, приблизительно от 1×10-10 приблизительно до 1×10-11 M и приблизительно от 1×10-11 приблизительно до 1×10-12 M. В другом воплощении связывание белков, связывающихся с PGE2, может быть продемонстрировано методом FLIPR, где PGE2-индуцированный приток кальция, опосредованный его рецептором EP4, ингибируется путем связывания белков, связывающихся с PGE2, с IC50, выбранной из группы, состоящей из интервалов приблизительно от 1×10-6 приблизительно до 1×10-7 M, приблизительно от 1×10-7 приблизительно до 1×10-8 M, приблизительно от 1×10-8 приблизительно до 1×10-9 M, приблизительно от 1×10-9 приблизительно до 1×10-10 M, приблизительно от 1×10-10 приблизительно до 1×10-11 M и приблизительно от 1×10-11 приблизительно до 1×10-12 M.
В одном из воплощений антитело ингибирует связывание биотинилированного PGE2 с рецептором EP1, EP2, EP3 и/или EP4 на клеточной поверхности на основе FACS-анализа связывания рецептора, или же антитело ингибирует связывание биотинилированного PGE2 с рецептором EP1, EP2, EP3 и/или EP4 на препарате мембран, полученном с помощью рецептор-экспрессирующих клеток, в анализе связывания рецептора на основе ELISA, с IC50, выбранной из группы, состоящей из интервалов приблизительно от 1×10-6 приблизительно до 1×10-7 M, приблизительно от 1×10-7 приблизительно до 1×10-8 M, приблизительно от 1×10-8 приблизительно до 1×10-9 M, приблизительно от 1×10-9 приблизительно до 1×10-10 M, приблизительно от 1×10-10 приблизительно до 1×10-11 M и приблизительно от 1×10-11 приблизительно до 1×10-12 M, или антитело ингибирует связывание 3H-PGE2 с рецептором EP1, EP2, EP3 и/или EP4 на клеточной поверхности или на препарате мембран, в радиоиммуноанализе на основе 3H-меченного PGE2, с IC50, приблизительно составляющей от 1×10-6 приблизительно до 1×10-7 M, приблизительно от 1×10-7 приблизительно до 1×10-8 M, приблизительно от 1×10-8 приблизительно до 1×10-9 M, приблизительно от 1×10-9 приблизительно до 1×10-10 M, приблизительно от 1×10-10 приблизительно до 1×10-11 M и приблизительно от 1×10-11 приблизительно до 1×10-12 M, с IC50, и/или антитело ингибирует PGE2-индуцированный приток кальция в EP4-опосредованном FLIPR-анализе, с IC50, приблизительно составляющей от 1×10-6 приблизительно до 1×10-7 M, приблизительно от 1×10-7 приблизительно до 1×10-8 M, приблизительно от 1×10-8 приблизительно до 1×10-9 M, приблизительно от 1×10-9 приблизительно до 1×10-10 M, приблизительно от 1×10-10 приблизительно до 1×10-11 M и приблизительно от 1×10-11 приблизительно до 1×10-12 M. В одном из воплощений антитело или его антиген-связывающий фрагмент связываются с PGE2 и ингибируют связывание PGE2, по меньшей мере, с одним из его рецепторов в анализе связывания рецептора на основе клеточной поверхности или в анализе связывания рецептора на основе радиоиммуноанализа приблизительно на 70-100% при концентрации 100 нМ.
В одном из воплощений указанным антителом является антитело 19C9, 4F10, 15F10, K1B, K7H, K3A, L11, L21, 2B5-7.0, 2B5-8.0 или 2B5-9.0, или его вариант. В одном из воплощений указанным вариантом является гуманизированный вариант, такой как Hu2B5.P1 или Hu2B5.P2.
В другом аспекте настоящее изобретение связано с выделенным антителом или его антиген-связывающим фрагментом, которые связываются с PGE2 и ингибируют отек лапы приблизительно на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 100% на модели индуцированного каррагинаном отека лапы у грызунов. В особом воплощении указанное антитело ингибирует отек лапы более чем приблизительно на 10% на модели индуцированного каррагинаном отека лапы у грызунов.
В другом аспекте настоящее изобретение связано с выделенным антителом или его антиген-связывающим фрагментом, которые связываются с PGE2 и ингибируют припухлость лапы или артрит среднего масштаба приблизительно на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 100% на модели индуцированного коллагеном артрита у грызунов. В особом воплощении указанное антитело ингибирует припухлость лапы или артрит среднего масштаба приблизительно более чем приблизительно на 10% на модели индуцированного коллагеном артрита у грызунов.
В другом аспекте настоящее изобретение связано с выделенным антителом или с его антиген-связывающим фрагментом, которые связываются с PGE2 и ингибируют отек лапы приблизительно на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 100% на модели индуцированного каррагинаном отека подушечки стопы у грызунов. В особом воплощении указанное антитело ингибирует отек подушечки стопы более чем приблизительно на 10% на модели индуцированного каррагинаном отека подушечки стопы у грызунов.
В другом аспекте настоящее изобретение связано с выделенным антителом или его антиген-связывающим фрагментом, которые связываются с PGE2 и ингибируют припухлость лапы или артрит среднего масштаба приблизительно на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 100% на модели индуцированного коллагеном артрита у грызунов. В особом воплощении указанное антитело ингибирует припухлость лапы или артрит среднего масштаба приблизительно более чем приблизительно на 10% на модели индуцированного коллагеном артрита у грызунов.
В другом воплощении связывающий белок согласно изобретению имеет константу скорости диссоциации (koff) от PGE2, составляющую самое большее приблизительно 10-3 сек-1; самое большее приблизительно 10-4 сек-1; самое большее приблизительно 10-5 сек-1; или самое большее приблизительно 10-6 сек-1, измеряемую методом радиоиммуноанализа. Предпочтительно, чтобы связывающий белок согласно изобретению имел константу скорости диссоциации (koff) от PGE2, приблизительно составляющую от 10-3 сек-1 приблизительно до 10-4 сек-1; приблизительно от 10-4 сек-1 приблизительно до 10-5 сек-1; или приблизительно от 10-5 сек-1 приблизительно до 10-6 сек-1, определяемую методом радиоиммуноанализа.
В другом воплощении связывающий белок согласно изобретению имеет константу диссоциации (KD) от PGE2, определяемую методом радиоиммуноанализа, составляющую самое большее приблизительно 10-6 M; самое большее приблизительно 10-7 M; самое большее приблизительно 10-8 M; самое большее приблизительно 10-9 M; самое большее приблизительно 10-10 M; самое большее приблизительно 10-11 M; самое большее приблизительно 10-12 M; или самое большее приблизительно 10-13 M. Предпочтительно, чтобы связывающий белок согласно изобретению имел константу диссоциации (KD) от PGE2, приблизительно составляющую от 10-7 приблизительно до 10-8 M; приблизительно от 10-8 приблизительно до 10-9 M; приблизительно от 10-9 приблизительно до 10-10 M; приблизительно от 10-10 приблизительно до 10-11 M; приблизительно от 10-11 приблизительно до 10-12 M; или приблизительно от 10-12 приблизительно до 10-13 M. Один из аспектов настоящего изобретения связан, по меньшей мере, с одним анти-PGE2-идиотипическим антителом, по меньшей мере, к одному связывающему PGE2 белку согласно изобретению. Антиидиотипическое антитело включает в себя любой белок или пептид, содержащий молекулу, которая содержит, по меньшей мере, часть молекулы иммуноглобулина, такую, без ограничения, как, по меньшей мере, одну определяющую комплементарность область (CDR) тяжелой или легкой цепи или их лиганд-связывающую область, вариабельную область тяжелой цепи или вариабельную область легкой цепи, константную область тяжелой цепи или легкой цепи, каркасную область; или любую их часть, которая может быть встроена в связывающий белок согласно изобретению.
В другом аспекте настоящее изобретение связано с выделенным антителом или его антиген-связывающим фрагментом, которые связываются с простагландином E2 и ингибируют связывание простагландина E2, по меньшей мере, с одним из рецепторов E1, E2, E3 и E4 в анализе связывания рецептора на основе рецепторов клеточной поверхности, с IC50, выбранной из группы, состоящей приблизительно из интервалов от 1×10-6 до 1×10-7 M, от 1×10-7 до 1×10-8 M, от 1×10-8 до 1×10-9 M, от 1×10-9 до 1×10-10 M, от 1×10-10 приблизительно до 1×10-11 M и от 1×10-11 до 1×10-12 M, или в анализе связывания рецептора на основе метода ELISA, с IC50, выбранной из группы, приблизительно состоящей из интервалов от 1×10-6 до 1×10-7 M, от 1×10-7 до 1×10-8 M, от 1×10-8 до 1×10-9 M, от 1×10-9 до 1×10-10 M, от 1×10-10 до 1×10-11 M и от 1×10-11 до 1×10-12 M.
В другом аспекте антитело или его антиген-связывающий фрагмент связываются с простагландином E2 и ингибируют связывание простагландина E2, по меньшей мере, с одним из рецепторов E1, E2, E3 и E4 в анализе связывания с рецептором клеточной поверхности или в радиоиммуноанализе на основе 3H-PGE2 с использованием экспрессирующих клеток или препаратов клеточных мембран, экспрессирующих, по меньшей мере, один из рецепторов E1, E2, E3 и E4, приблизительно на 70-100%, в концентрации приблизительно в 100 нМ. В одном из воплощений антитело выбрано из группы, состоящей из антител 19C9, 4F10, 15F10, K1B, K7H, K3A, L11, L21, 2B5-7.0, 2B5-8.0 и 2B5-9.0. В другом воплощении антитело или его антиген-связывающий фрагмент способны модулировать биологическую функцию простагландина E2, такую как нейтрализация простагландина E2. Указанное антитело или его антиген-связывающий фрагмент выбраны из группы, состоящей из молекулы иммуноглобулина, моноклонального антитела, химерного антитела, CDR-привитого антитела, гуманизированного антитела, Fab-, Fab'-, F(ab')2-, Fv-, дисульфидным мостиком связанного Fv-, scFv-, антитела, содержащего один домен, диатела, мультиспецифического антитела, антитела с двойной специфичностью и биспецифического антитела. В одном из воплощений указанное антитело или его антиген-связывающий фрагмент представляют собой гуманизированное антитело. В другом воплощении указанное антитело или его антиген-связывающий фрагмент выбраны из группы, состоящей из Hu2B5.P1 и Hu2B5.P2. Данное изобретение связано также с фармацевтической композицией, содержащей указанное антитело или его антиген-связывающий фрагмент и фармацевтически приемлемый носитель. В одном из воплощений указанная фармацевтическая композиция дополнительно содержит, по меньшей мере, одно дополнительное терапевтическое средство для лечения расстройства, при котором активность простагландина E2 является неблагоприятной.
В другом аспекте настоящее изобретение связано со способом получения антитела или его фрагмента, который связывается с простагландином E2, предусматривающим проведение стадий иммунизации животного, отличного от человека, простагландин-E2-тиреоглобулином, сбора из организма жидкости или органа, содержащих антитело против простагландина E2, и выделения антитела против простагландина E2.
В другом аспекте настоящее изобретение связано с гуманизированным антителом, содержащим антиген-связывающий домен, способный связываться с простагландином E2, содержащим, по меньшей мере, одну CDR-область, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 54-59. В другом воплощении настоящее изобретение связано с гуманизированным антителом, содержащим антиген-связывающий домен, содержащий, по меньшей мере, одну CDR-область, содержащую аминокислотную последовательность, по меньшей мере, приблизительно на 60%, по меньшей мере, приблизительно на 65%, по меньшей мере, приблизительно на 70%, по меньшей мере, приблизительно на 75%, по меньшей мере, приблизительно на 80%, по меньшей мере, приблизительно на 85%, по меньшей мере, приблизительно на 90%, по меньшей мере, приблизительно на 95% или, по меньшей мере, приблизительно на 98% гомологичную аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 54-59. В одном из аспектов указанное гуманизированное антитело содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 78, 79, 80 и 81.
В одном из аспектов связывающий белок согласно изобретению способен связываться с PGE2, домен, связывающий указанный антиген, содержит, по меньшей мере, одну область CDR, содержащую аминокислотную последовательность, выбранную из группы, состоящей из CDR-H1: GYTFTKYWLG (SEQ ID NO: 54), CDR-H2: DIYPGYDYTHYNEKFKD (SEQ ID NO: 55), CDR-H3: SDGSSTY (SEQ ID NO: 56), CDR-L1: TSSQNIVHSNGNTYLE (SEQ ID NO: 57), CDR-L2: KVSNRFSG (SEQ ID NO: 58), CDR-L3: FQVSHVPYT (SEQ ID NO: 59).
В другом воплощении настоящее изобретение связано со связывающим белком или его фрагментом, содержащими антиген-связывающий домен, содержащий, по меньшей мере, одну область CDR, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 6, 7, 8, 10, 11, 12, 14, 15, 16, 18, 19, 20, 22, 23, 26, 27, 28, 30, 31, 32, 34, 35, 37, 38 и 39. В другом воплощении связывающий белок или его фрагмент содержит антиген-связывающий домен, содержащий, по меньшей мере, одну VH- область, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 5, 13, 21, 25, 33, 40, 42 и 44. Еще в одном воплощении связывающий белок или его фрагмент содержат антиген-связывающий домен, содержащий, по меньшей мере, одну VL-область, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 9, 17, 24, 29, 36, 41, 43 и 45. Еще в одном воплощении связывающий белок или его фрагмент содержат антиген-связывающий домен, содержащий, по меньшей мере, одну область CDR, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 54-59.
В одном из воплощений связывающий белок содержит, по меньшей мере, 3 области CDR, выбранные, например, из набора VH-CDR, выбранных из группы, состо