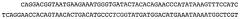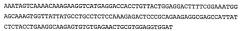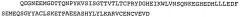Psma×cd3 биспецифическое одноцепочечное антитело с межвидовой специфичностью
Иллюстрации
Показать всеНастоящее изобретение относится к биотехнологии и иммунологии, а именно к модулированию Т-клеточного иммунитета в отношении клеток, экспрессирующих специфический мембранный антиген предстательной железы (PSMA). Предложена молекула биспецифического одноцепочечного антитела, содержащая первый связывающий домен, который представляет собой одноцепочечное антитело, способное связываться с эпитопом CD3ε(эпсилон)-цепи человека, а также приматов Callithrix jacchus (игрунка), Saguinus Oedipus (эдипов тамарин) и Saimiri sciureus (беличья обезьяна), содержащим последовательность Gln-Asp-Gly-Asn-Glu (QDGNE), и второй связывающий домен, способный связываться с PSMA. Также рассмотрены: последовательность нуклеиновой кислоты, кодирующая молекулу биспецифического одноцепочечного антитела по изобретению, экспрессирующий вектор, клетка-хозяин, способ получения молекулы биспецифического одноцепочечного антитела, фармацевтическая композиция, применение молекулы биспецифического одноцепочечного антитела по изобретению для изготовления фармацевтической композиции для предупреждения, лечения или уменьшения симптомов рака, связанного с экспрессией PSMA, и способ предупреждения, лечения или уменьшения симптомов рака, связанного с экспрессией PSMA, у субъекта. Данное изобретение может найти дальнейшее применение в терапии заболеваний, связанных с PSMA. 8 н. и 12 з.п. ф-лы, 57 ил., 9 табл., 26 пр.
Реферат
Настоящее изобретение относится к молекуле биспецифического одноцепочечного антитела, содержащей первый связывающий домен, способный связываться с эпитопом CD3-эпсилон-цепи человека и примата, не являющегося шимпанзе, где указанный эпитоп является частью аминокислотной последовательности, входящей в группу, состоящую из SEQ ID NO:2, 4, 6 и 8, и второй связывающий домен, способный связываться со специфическим мембранным антигеном предстательной железы (PSMA). Согласно изобретению предложены также нуклеиновые кислоты, кодирующие указанную молекулу биспецифического одноцепочечного антитела, а также векторы и клетки-хозяева и способ их получения. Изобретение также относится к фармацевтическим композициям, содержащим указанную молекулу биспецифического одноцепочечного антитела, и к медицинским применениям указанной молекулы биспецифического одноцепочечного антитела.
Т-клеточное распознавание опосредовано клонотипически распределенными альфа-бета и гамма-дельта Т-клеточными рецепторами (TcR), которые взаимодействуют с пептид-нагруженными молекулами пептид-МНС (главный комплекс гистосовместимости) (рМНС) (Davis & Bjorkman, Nature 334 (1988), 395-402). Антиген-специфические цепи TcR не содержат сигнальных доменов, а вместо этого связываются с консервативным мультисубъединичным аппаратом передачи сигнала CD3 (Call, Cell 111 (2002), 967-979; Alarcon, Immunol. Rev. 191 (2003), 38-46; Malissen Immunol. Rev. 191 (2003), 7-27). Механизм, посредством которого TcR-лигирование напрямую связано с аппаратом передачи сигнала, остается фундаментальным вопросом Т-клеточной биологии (Alarcon, см. выше; Davis, Cell 110 (2002), 285-287). Кажется очевидным, что в устойчивые Т-клеточные ответы вовлечены контактирование с корецептором, олигомеризация TcR и организация комплексов TcR-pMHC более высокого порядка в иммунологическом синапсе (Davis & van der Merwe, Curr. Biol. 11 (2001), R289-R291; Davis, Nat. Immunol.4 (2003), 217-224). Однако самая ранняя передача сигнала посредством TcR происходит в отсутствие этих событий и может приводить к лиганд-индуцированному изменению в CD3-эпсилон (Alarcon, см. выше; Davis (2002), см. выше; Gil, J. Biol. Chem. 276 (2001), 11174-11179; Gil, Cell 109 (2002), 901-912). Эпсилон-, гамма-, дельта- и зета-субъединицы сигнального комплекса ассоциируются друг с другом с образованием CD3-эпсилон-гамма гетеродимера, CD3-эпсилон-дельта гетеродимера и CD3-зета-зета гомодимера (Call, см. выше). Различные исследования выявили, что молекулы CD3 важны для надлежащей экспрессии на клеточной поверхности альфа-бета TcR и нормального развития Т-клеток (Berkhout, J. Biol. Chem. 263 (1988), 8528-8536; Wang, J. Exp. Med. 188 (1998), 1375-1380; Kappes, Curr. Opin. Immunol. 7 (1995), 441-447). Исследование структуры фрагментов эктодоменов мышиного CD3-эпсилон-гамма гетеродимера показало, что эпсилон-гамма-субъединицы представляют собой C2-set lg-домены, которые взаимодействуют друг с другом с образованием необычной поперечной (side-to-side) димерной конфигурации (Sun, Cell 105 (2001), 913-923). Хотя богатый цистеиновыми остатками "стебель", по-видимому, играет важную роль в запуске димеризации CD3 (Su, см. выше, Borroto, J. Biol. Chem. 273 (1998), 12807-12816), взаимодействие посредством внеклеточных доменов CD3-эпсилон и CD3-гамма является достаточным для образования комплекса этих белков с TcR-бета (Manolios, Eur. J. Immunol. 24 (1994), 84-92; Manolios & Li, Immunol. Cell Biol. 73 (1995), 532-536). Несмотря на продолжающуюся дискуссию по этому вопросу, преобладающая стехиометрия TcR вероятней всего содержит один альфа-бета TcR, один CD3-эпсилон-гамма гетеродимер, один CD3-эпсилон-дельта гетеродимер и один CD3-зета-зета гомодимер (Call, см. выше). С учетом центральной роли человеческого CD3-эпсилон-гамма гетеродимера в иммунном ответе не так давно была установлена кристаллическая структура этого комплекса, связанного с терапевтическим антителом OKT3 (Kjer-Nielsen, PNAS 101, (2004), 7675-7680).
Многие терапевтические стратегии основаны на модулировании Т-клеточного иммунитета путем направленного воздействия на передачу сигнала посредством TcR, в частности на моноклональные антитела (mAb) против CD3 человека, которые широко используются в клинических схемах введения иммунодепрессантов. CD3-специфическое мышиное mAb OKT3 было первым mAb, разрешенным для применения у людей (Sgro, Toxicology 105 (1995), 23-29), и оно находит широкое клиническое применение в качестве иммунодепрессанта при трансплантации (Chatenoud, Clin. Transplant 7 (1993), 422-430; Chatenoud, Nat. Rev. Immunol. 3 (2003), 123-132; Kumar, Transplant. Proc. 30 (1998), 1351-1352), при диабете типа 1 (Chatenoud (2003), см. выше) и при псориазе (Utset, J. Rheumatol. 29 (2002), 1907-1913). Более того, анти-CD3 mAb могут индуцировать частичную Т-клеточную передачу сигнала и клональную толерантность (Smith, J. Exp. Med. 185 (1997), 1413-1422). OKT3 описано в литературе как мощный Т-клеточный митоген (Van Wauve, J. Immunol. 124 (1980), 2708-18) и как мощный Т-клеточный киллер (Wong, Transplantation 50 (1990), 683-9). OKT3 проявляет эти виды активности время-зависимым образом, и после ранней активации Т-клеток, приводящей к высвобождению цитокинов, последующее введение OKT3 блокирует все известные Т-клеточные функции. Благодаря этому последующему блокированию Т-клеточной функции OKT3 нашло такое широкое применение в качестве иммунодепрессанта в курсах терапии с целью снижения или даже аннулирования отторжения тканевого аллотрансплантата.
OKT3 реверсирует отторжение тканевого аллотрансплантата вероятней всего путем блокирования функции всех Т-клеток, которые играют главную роль в остром отторжении. OKT3 взаимодействует с CD3-комплексом и блокирует функцию CD3-комплекса в мембране Т-клеток человека, который ассоциирован с антиген-распознающей структурой Т-клеток (TCR) и является важным для сигнальной трансдукции. Предметом множества исследований был вопрос о том, с какой субъединицей TCR/CD3 связывается OKT3. Некоторые факты все же свидетельствуют о специфичности OKT3 к эпсилон-субъединице комплекса TCR/CD3 (Tunnacliffe, Int. Immunol. 1 (1989), 546-50; Kjer-Nielsen, PNAS 101, (2004), 7675-7680). Дополнительные данные свидетельствуют о том, что для связывания OKT3 с комплексом TCR/CD3 необходимо присутствие других субъединиц этого комплекса (Salmeron, J. Immunol. 147 (1991), 3047-52).
Другие общеизвестные антитела, обладающие специфичностью к молекуле CD3, перечислены в Tunnacliffe, Int. Immunol. 1 (1989), 546-50. Как указано выше, такие CD3-специфические антитела способны индуцировать различные Т-клеточные ответы, такие как продуцирование лимфокинов (Von Wussow, J. Immunol. 127 (1981), 1197; Palacious, J. Immunol. 128 (1982), 337), пролиферация (Van Wauve, J. Immunol. 124 (1980), 2708-18) и индукция Т-клеточных супрессоров (Kunicka, "Lymphocyte Typing II" 1 (1986), 223). То есть, в зависимости от условий эксперимента CD3-специфическое моноклональное антитело может либо ингибировать. либо индуцировать цитотоксичность (Leewenberg, J. Immunol. 134 (1985), 3770; Phillips. J. Immunol. 136 (1986) 1579; Platsoucas, Proc. Natl. Acad. Sci. USA 78 (1981), 4500; Itoh, Cell. Immunol. 108 (1987), 283-96; Mentzer, J. Immunol. 135 (1985), 34; Landegren, J. Exp. Med. 155 (1982), 1579; Choi (2001), Eur. J. Immunol. 31, 94-106; Xu (2000), Cell Immunol. 200, 16-26; Kimball (1995), Transpl. Immunol. 3, 212-221).
Хотя известно, что многие антитела против CD3, описанные в данной области, распознают CD3-эпсилон-субъединицу CD3-комплекса, большинство из них в действительности связываются с конформационными эпитопами и, следовательно, распознают CD3-эпсилон только в нативном окружении TCR. Конформационные эпитопы характеризуются наличием двух или более отдельных аминокислотных остатков, которые обособлены в первичной последовательности, но объединяются на поверхности молекулы, когда полипептид сворачивается в нативный белок/антиген (Sela, (1969) Science 166, 1365; Laver, (1990) Cell 61, 553-6). Конформационные эпитопы, связывающиеся с антителами против CD3-эпсилон, описанными в данной области, можно разделить на две группы. В основной группе указанные эпитопы представляют собой эпитопы, образованные двумя субъединицами CD3, например CD3-эпсилон-цепью и CD3-гамма- или CD3-дельта-цепью. Например, в результате проведения нескольких исследований было установлено, что наиболее широко используемые моноклональные антитела против CD3-эпсилон, а именно OKT3, WT31, UCHT1, 7D6 и Leu-4, не связываются с клетками, однократно трансфицированными CD3-эпсилон-цепью. Однако эти антитела окрашивали клетки, двукратно трансфицированные комбинацией CD3-эпсилон плюс либо CD3-гамма, либо CD3-дельта (Tunnacliffe, см. выше; Law, Int. Immunol. 14 (2002), 389-400; Salmeron, J. Immunol. 147 (1991), 3047-52; Coulie, Eur. J. Immunol. 21 (1991), 1703-9). Во второй, меньшей группе конформационный эпитоп представляет собой эпитоп, образованный в пределах самой CD3-эпсилон субъединицы. Членом этой группы является, например, mAb АРА 1/1, индуцированное против денатурированной CD3-эпсилон-цепи (Risueno, Blood 106 (2005), 601-8). В совокупности, большинство антител против CD3-эпсилон, описанных в данной области, распознают конформационные эпитопы, расположенные на двух или более субъединицах CD3. Отдельные аминокислотные остатки, образующие трехмерную структуру этих эпитопов, могут быть локализованы при этом либо на самой CD3-эпсилон субъединице, либо на CD3-эпсилон субъединице и других субъединицах CD3, таких как CD3-гамма или CD3-дельта.
Другая проблема, связанная с антителами против CD3, заключается в том, что многие антитела против CD3, как было установлено, являются видоспецифическими. Моноклональные антитела против CD3 функционируют путем высокоспецифического распознавания свих молекул-мишеней что справедливо, как правило, для любых других моноклональных антител. Они распознают только один сайт, или эпитоп, на их целевой молекуле CD3. Например, одним из наиболее широко используемых и лучше всего охарактеризованных моноклональных антител, специфичных к CD3-комплексу, является OKT-3. Это антитело взаимодействует с CD3 шимпанзе, но не с гомологом CD3 других приматов, таких как макаки, или с CD3 собаки (Sandusky et al., J. Med. Primatol. 15 (1986), 441-451). Аналогичным образом, в WO 2005/118635 или WO 2007/033230 описаны человеческие моноклональные антитела против CD3-эпсилон, которые взаимодействуют с CD3-эпсилон человека, но не с CD3-эпсилон мыши, крысы, кролика или примата, не являющегося шимпанзе, такого как макак-резус, яванский макак или павиан. Анти-CD3 моноклональное антитело UCHT-1 также взаимодействует с CD3 шимпанзе, но не с CD3 макака (собственные данные). С другой стороны, есть также примеры моноклональных антител, которые распознают антигены макака, но не их человеческие копии. Одним из примеров этой группы является моноклональное антитело FN-18, направленное на CD3 макака (Uda et al., J. Med. Primatol. 30 (2001), 141-147). Интерес представляет тот факт, что обнаружено, что периферические лимфоциты от примерно 12% яванских макаков не взаимодействуют с моноклональным антителом против CD3 макака-резуса (FN-18) из-за полиморфизма антигена CD3 у макаков. Uda с соавторами описали замену двух аминокислот в последовательности CD3 яванских макаков, которые не взаимодействуют с антителами FN-18, по сравнению с CD3 животных, которые взаимодействуют с антителами FN-18 (Uda et al., J. Med. Primatol. 32 (2003), 105-10; Uda et al., J. Med. Primatol. 33 (2004), 34-7).
Эта различающая способность, т.е. видовая специфичность, свойственная не только моноклональным антителам против CD3 (и их фрагментам), но и моноклональным антителам вообще, существенно затрудняет их разработку в качестве терапевтических агентов для лечения заболеваний человека. Для того чтобы получить разрешение на продажу, любое новое лекарство-кандидат должно пройти строгое тестирование. Это тестирование можно подразделить на доклиническую и клиническую фазы, причем клиническая фаза дополнительно подразделяется на общеизвестные клинические фазы I, II и III, которые проводят на пациентах-людях, а доклиническую фазу проводят на животных. Цель доклинического тестирования состоит в том, чтобы доказать, что лекарственное средство-кандидат обладает желаемой активностью и, что очень важно, является безопасным. Только после установления безопасности и возможной эффективности лекарственного средства-кандидата в доклинических испытаниях на животных это лекарственное средство-кандидат будет одобрено соответствующим регулирующим органом для клинических испытаний на людях. Лекарственные средства-кандидаты могут быть протестированы в отношении безопасности на животных следующими тремя путями: (1) на релевантном виде, т.е. на виде, в организме которого лекарственные средства-кандидаты могут распознавать ортологические антигены, (2) на трансгенном животном, содержащем человеческие антигены, и (3) путем использования имитатора лекарственного средства-кандидата, который может связываться с ортологическими антигенами, присутствующими в организме животного. Ограничения по трансгенным животным заключаются в том, что эта технология обычно ограничивается грызунами. Между грызунами и человеком имеются значительные различия в физиологии, и результаты по безопасности нельзя с легкостью экстраполировать на людей. Ограничениями по имитатору лекарственного средства-кандидата являются другой состав вещества по сравнению с реальным лекарственным средством-кандидатом, и часто используемыми животными являются грызуны с тем ограничением, которое обсуждается выше. Следовательно, доклинические данные, полученные на грызунах, имеют ограниченную прогностическую способность в отношении лекарственного средства-кандидата. Подход к решению проблемы выбора тестирования безопасности заключается в использовании релевантного вида, предпочтительно низшего примата. В настоящее время ограничение, касающееся моноклональных антител, подходящих для терапевтического вмешательства у человека и описанных в данной области, заключается в том, что релевантными видами являются высшие приматы, в частности шимпанзе. Шимпанзе считаются исчезающим видом, и в связи с их человекоподобной природой использование таких животных для тестирования безопасности лекарственного средства запрещено в Европейских странах и в значительной степени ограничено в других странах. CD3 был также успешно использован в качестве мишени для биспецифических одноцепочечных антител с той целью, чтобы перенаправлять цитотоксические Т-клетки к патологическим клеткам и, в результате, выводить больные клеток из соответствующего организма (WO 99/54440; WO 04/106380). Например, Bargou с соавторами (Science 321 (2008):974-7) недавно сообщили о клинической активности конструкции CD19xCD3 биспецифического антитела, названной блинатумомабом, которая обладает потенциалом контактировать со всеми цитотоксическими Т-клетками у пациентов-людей для лизиса раковых клеток. Низкие дозы, такие как 0,005 миллиграммов на квадратный метр в сутки, у пациентов с неходжкинской лимфомой приводили к истощению клеток-мишеней в крови. Частичные и полные регрессии опухолей впервые наблюдались при уровне дозы 0,015 миллиграммов, и у всех семи пациентов, которых лечили дозами 0,06 миллиграммов, наблюдалась регрессия опухоли. Блинатумомаб также приводил к клиренсу опухолевых клеток из костного мозга и печени. Несмотря на то, что это исследование дало клиническое доказательство концепции для терапевтической эффективности формата биспецифического одноцепочечного антитела в лечении рака клеток крови, все еще существует потребность в успешных концепциях для терапий других видов рака.
По оценкам, в Соединенных Штатах Америки в 2008 году у 186320 мужчин будет впервые диагностирован рак предстательной железы, и примерно 28660 мужчин умрут от этой болезни. Согласно большинству предыдущих отчетов по смертности от рака в 2004 году общий уровень смертности от рака предстательной железы среди американских мужчин составлял 25 на 100000. В конце 1980-х годов широкое применение теста на специфический антиген предстательной железы (PSA) сыграло большую роль в улучшении лечения рака предстательной железы. Этот тест позволяет измерять количество PSA-белка в крови, которое часто бывает повышенным у пациентов с раком предстательной железы. В 1986 году Управление по контролю пищевых продуктов и лекарственных средств США (U.S. Food and Drug Administration) одобрило применение теста на PSA для мониторинга пациентов с раком предстательной железы и в 1994 году дополнительно одобрило его применение в качестве скрининг-теста в отношении этого заболевания. Благодаря всеобщему проведению тестирования на PSA в США, в настоящее время приблизительно 90 процентов всех случаев рака предстательной железы диагностируется на ранней стадии, и, следовательно, мужчины живут дольше после установления диагноза. Однако чтобы определить, действительно ли скрининг PSA спасает жизни, потребуются результаты двух проводящихся в настоящее время клинических испытаний, а именно спонсируемого Национальным институтом рака (NCI) Скринингового испытания в отношении предстательной железы, легкого, ободочной и прямой кишки и яичника (PLCO) и Европейского исследования со скринингом в отношении рака предстательной железы (ERSPC). В проводившихся в течение последних 25 лет клинических испытаниях исследовалась эффективность природных и синтетических соединений в предупреждении рака предстательной железы. Например, в Испытании в отношении предупреждения рака предстательной железы (РСРТ), в котором участвовало около 19000 здоровых мужчин, было обнаружено, что финастерид, лекарственное средство, разрешенное для лечения доброкачественной гиперплазии предстательной железы (ВРН), которая представляет собой доброкачественное увеличение предстательной железы, снижает риск развития рака предстательной железы на 25 процентов. Еще одно испытание, Испытание по предупреждению рака с использованием селена и витамина Е (SELECT), в котором участвуют более 35000 мужчин, проводится с целью определения, могут ли ежедневные добавки селена и витамина Е снижать инцидентность рака предстательной железы у здоровых мужчин. В других испытаниях по предотвращению рака предстательной железы, которые проводятся в настоящее время, оценивается защитный потенциал поливитаминов, витаминов С и D, сои, зеленого чая и ликопена, который является природным соединением, обнаруженным в томатах. Одно исследование, о котором сообщалось в 2005 году, показало, что специфические гены были слитыми в 60-80 процентах проанализированных опухолей предстательной железы. Это исследование представляет собой первое наблюдение неслучайных генных перестроек при раке предстательной железы. Это генетическое изменение может быть использовано, в конечном счете, в качестве биомаркера для диагностики и, возможно, для лечения этого заболевания. Другие исследования показали, что генетические вариации в специфической области хромосомы 8 могут увеличивать риск развития рака предстательной железы у человека. Эти генетические вариации объясняют приблизительно 25 процентов случаев рака предстательной железы, которые имеют место у белых мужчин. Они являются первыми достоверными генетическими вариантами, которые увеличивают риск развития рака предстательной железы и могут помочь ученым лучше понять генетические причины этого заболевания. Проводится также исследование, направленное на выяснение, как белки, циркулирующие в крови пациента, могут быть использованы для улучшения диагностики рака предстательной железы и других видов рака. В 2005 году ученые идентифицировали группу специфических белков, продуцируемых иммунной системой пациента в ответ на опухоли предстательной железы. Эти белки, типа аутоантитела, способны обнаруживать присутствие клеток рака предстательной железы в образцах крови с точностью свыше 90 процентов. При использовании в комбинации с PSA эти белки и другие белки крови могут, в конечном счете, быть использованы для сокращения количества ложноположительных результатов, получаемых только тестированием на PSA, и, следовательно, для сокращения многочисленных ненужных биопсий предстательной железы, выполняемых каждый год из-за ложноположительных результатов теста на PSA.
Помимо PSA было идентифицировано несколько других маркеров рака предстательной железы, включая, например, шестидоменный трансмембранный эпителиальный антиген предстательной железы (STEAP) (Hubert et al., PNAS 96 (1999), 14523-14528), антиген стволовых клеток предстательной железы (PSCA) (Reiter et al., Proc. Nat. Acad. Sci. 95:1735-1740, 1998) и специфический мембранный антиген предстательной железы (PSMA; PSM) (Israeli et al., Cancer Res. 53 (1993), 227-230). PSMA первоначально был определен моноклональным антителом (MAb) 7E11, получаемым в результате иммунизации частично очищенным мембранным препаратом из клеточной линии метастазов аденокарциномы предстательной железы в лимфатических узлах (LNCaP) (Horoszewicz et al., Anticancer Res. 7 (1987); 927-35). Фрагмент кДНК из 2,65 п.н. (пар нуклеотидов), кодирующий белок PSMA, клонировали и затем картировали в хромосому 11p11.2 (Israeli et al., смотри выше; O'Keefe et al., Biochem. Biophys. Acta 1443 (1998), 113-127). Первоначальный анализ PSMA продемонстрировал повсеместную экспрессию в клетках секреторного эпителия предстательной железы. Иммуногистохимическое окрашивание продемонстрировало, что в гиперпластических и доброкачественных тканях PSMA отсутствует или умеренно экспрессируется, тогда как злокачественные ткани окрашиваются с наибольшей интенсивностью (Horoszewicz et al., смотри выше). Последующие исследования повторили эти результаты и продемонстрировали экспрессию PSMA как универсальный признак в практическим каждой ткани предстательной железы, исследованной на данный момент. Эти сведения также демонстрируют, что экспрессия PSMA стремительно увеличивается пропорционально агрессивности опухоли (Burger et al., Int. J. Cancer 100 (2002), 228-237; Chang et al., Cancer Res. 59 (1999), 3192-98; Chang et al., Urology 57 (2001), 1179-83), Kawakami and Nakayama, Cancer Res. 57 (1997), 2321-24; Liu et al., Cancer Res. 57 (1997), 3629-34; Lopes et al., Cancer Res. 50 (1990), 6423-29; Silver et al., Clin. Cancer Res. 9 (2003), 6357-62; Sweat et al., Urology 52 (1998), 637-40; Troyer et al., Int. J. Cancer 62 (1995), 552-558; Wright et al., Urology 48 (1996), 326-334). Увеличение уровней PSMA связано с андроген-независимым раком предстательной железы (РСа), что согласуется с корреляцией между экспрессией PSMA и стадией опухоли. Анализ образцов тканей, взятых у пациентов с раком предстательной железы, продемонстрировал повышенные уровни PSMA после физической кастрации или андроген-депривационной терапии. В отличие от экспрессии специфического антигена предстательной железы, которая подавляется после удаления андрогенов, экспрессия PSMA значительно увеличивается в образцах первичных и метастатических опухолей (Kawakami et al., Wright et al., смотри выше). Известно также, что согласующаяся с повышенной экспрессией в андроген-независимых опухолях транскрипция PSMA подвергается понижающей регуляции стероидами, и введение тестостерона опосредует резкое снижение уровней белка PSMA и mRNA (Israeli et al., Cancer Res. 54 (1994), 1807-11; Wright et al., смотри выше). Кроме того, PSMA в значительной степени экспрессируется во вторичных опухолях предстательной железы и при скрытом метастическом заболевании. Иммуногистохимический анализ выявил относительно интенсивную и равномерную экспрессию PSMA в метастатических поражениях, распространившихся в лимфатические узлы, кость, мягкую ткань и легкие, по сравнению с доброкачественными тканями предстательной железы (Chang et al. (2001), смотри выше; Murphy et al., Cancer 78 (1996), 809-818; Sweat et al., смотри выше). Некоторые данные также показали ограниченную экспрессию PSMA в экстрапростатических тканях, включая почечные проксимальные канальцы, некоторые клетки интестинальной мембраны щеточной каемки и редкие клетки в криптах ободочной и толстой кишки (Chang et al. (1999), Horoszewicz et al., Israeli et al. (1994), Lopes et al., Troyer et al., смотри выше). Однако уровни PSMA в этих тканях обычно на два-три порядка меньше, чем уровни, наблюдаемые в предстательной железе (Sokoloff et al., Prostate 43 (2000), 150-157). PSMA также экспрессируется в ассоциированных с опухолями новообразованных сосудах большинства исследованных солидных раковых опухолей, однако отсутствует в нормальном сосудистом эндотелии (Chang et al. (1999), Liu et al., Silver et al., смотри выше). Хотя значение экспрессии PSMA в сосудистой сети неизвестно, специфичность к опухоль-ассоциированному эндотелию делает PSMA потенциальной мишенью для лечения многих форм злокачественности.
Несмотря на то, что было приложено много усилий для идентификации новых мишеней для терапевтических подходов к лечению рака, рак все еще является одним из наиболее часто диагностируемых заболеваний. В этой связи, все еще существует потребность в эффективных способах лечения рака.
Согласно настоящему изобретению предложена молекула биспецифического одноцепочечного антитела, содержащая первый связывающий домен, способный связываться с эпитопом CD3ε(эпсилон)-цепи человека и примата, не являющегося шимпанзе, где указанный эпитоп является частью аминокислотной последовательности, входящей в группу, состоящую из SEQ ID NO:2, 4, 6 и 8, и второй связывающий домен, способный связываться со специфическим мембранным антигеном предстательной железы (PSMA).
Хотя контактирующие с Т-клетками биспецифические одноцепочечные антитела, описанные в данной области, имеют большой терапевтический потенциал для лечения злокачественных заболеваний, большинство этих биспецифических молекул ограничены тем, что они являются видоспецифическими и распознают только антиген человека и, вследствие генетического сходства, по всей вероятности шимпанзе. Преимущество настоящего изобретения заключается в создании биспецифического одноцепочечного антитела, содержащего связывающий домен, проявляющий межвидовую специфичность к CD3-эпсилон-цепи человека и примата, не являющегося шимпанзе.
В настоящем изобретении неожиданно был идентифицирован N-концевой, содержащий аминокислотные остатки 1-27 полипептидный фрагмент внеклеточного домена CD3-эпсилон, который, в отличие от всех остальных известных эпитопов CD3-эпсилон, описанных в данной области, сохраняет свою трехмерную структурную целостность при удалении из его нативного окружения в CD3-комплексе (и возможно слиянии с гетерологичной аминокислотной последовательностью, такой как ЕрСАМ или Fc-область иммуноглобулина). Таким образом, согласно настоящему изобретению предложена молекула биспецифического одноцепочечного антитела, содержащая первый связывающий домен, способный связываться с эпитопом N-концевого, содержащего аминокислотные остатки 1-27 полипептидного фрагмента внеклеточного домена CD3-эпсилон-цепи (причем CD3-эпсилон-цепь, например, удалена из ее нативного окружения и/или содержится (презентирована на поверхности) в Т-клетке) человека и по меньшей мере одного примата, не являющегося шимпанзе, где указанный эпитоп является частью аминокислотной последовательности, входящей в группу, состоящую из SEQ ID NO:2, 4, 6 и 8; и второй связывающий домен, способный связываться со специфическим мембранным антигеном предстательной железы (PSMA). Предпочтительные приматы, не являющиеся шимпанзе, упомянуты в данном описании в другом месте. По меньшей мере один (или их выборка или все) примат(ы), выбранный(е) из Callithrix jacchus (игрунка), Saguinus Oedipus (эдипов тамарин), Saimiri sciureus (беличья обезьяна) и Масаса fascicularis (яванский макак) (SEQ ID NO: либо 1047, либо 1048, либо обе), особенно предпочтительны. Масаса mulatta, также известный как макак-резус, также рассматривается как еще один предпочтительный примат. Поэтому предусматривается, что антитела по изобретению связываются с (способны связываться с) независимым от окружения эпитопом N-концевого, содержащего аминокислотные остатки 1-27 полипептидного фрагмента внеклеточного домена CD3-эпсилон человека и Callithrix jacchus, Saguinus oedipus, Saimiri sdureus и Macaca fascicularis (SEQ ID NO: либо 1047, либо 1048, либо обе), и возможно также Macaca mulatta. Молекула биспецифического одноцепочечного антитела, содержащая первый связывающий домен, как он определен в данном описании, может быть получена (доступна) или может быть изготовлена в соответствии с протоколом, изложенным в приведенных ниже примерах (в частности в Примере 2). Для этого предусматривается (а) иммунизация мышей N-концевым, содержащим аминокислотные остатки 1-27 полипептидным фрагментом внеклеточного домена CD3-эпсилон человека и/или Saimiri sciureus; (б) создание иммунной библиотеки scFv мышиных антител; (в) идентификация CD3-эпсилон-специфических связывающих фрагментов путем тестирования способности связываться с по меньшей мере SEQ ID NO:2, 4, 6 и 8.
Независимость от окружения эпитопа CD3, предложенного в этом изобретении, соответствует первым 27 N-концевым аминокислотам CD3-эпсилон или функциональным фрагментам этого участка из 27 аминокислот. Фраза "независимый от окружения", используемая в данном описании в отношении эпитопа CD3, означает, что связывание описанных здесь связывающих молекул/молекул антител по изобретению не приводит к изменению или модификации конформации, последовательности или структуры, окружающей антигенную детерминанту или эпитоп. Напротив, эпитоп CD3, распознаваемый традиционной CD3-связывающей молекулой (например, молекулой, описанной в WO 99/54440 или WO 04/106380), локализован на CD3-эпсилон-цепи в С-концевой области по отношению к N-концевым аминокислотам 1-27 независимого от окружения эпитопа, причем он принимает надлежащую конформацию, только если он встроен в остальную часть эпсилон-цепи и удерживается в правильном стерическом положении за счет гетеродимеризации эпсилон-цепи либо с гамма-, либо с дельта-цепью CD3.
Анти-CD3-связывающие молекулы/домены как часть молекулы биспецифического одноцепочечного антитела, которая представлена в данном описании и создана (и направлена) против независимого от окружения эпитопа CD3, обеспечивают неожиданное клиническое улучшение в отношении перераспределения Т-клеток и, следовательно, более благоприятный профиль безопасности. Без какой-либо связи с теорией, поскольку эпитоп CD3 не зависит от окружения, образуя автономный самодостаточный субдомен без большого влияния на остальную часть CD3-комплекса, CD3-связывающие молекулы/домены, представленные в данном описании, индуцируют меньшие аллостерические изменения в конформации CD3, чем традиционные CD3-связывающие молекулы, которые распознают зависимые от окружения эпитопы CD3 (например, как описано в WO 99/54440 или WO 04/106380).
Независимость от окружения эпитопа CD3, который распознается CD3-связывающим доменом PSMAxCD3 биспецифического одноцепочечного антитела по изобретению, связана с меньшим или с отсутствующим перераспределением Т-клеток (перераспределение Т-клеток отождествляется с начальным эпизодом уменьшения и последующим восстановлением абсолютного количества Т-клеток) в ходе начальной фазы лечения PSMAxCD3 биспецифическим одноцепочечным антителом по изобретению. В результате обеспечивается лучший профиль безопасности PSMAxCD3 биспецифического одноцепочечного антитела по изобретению по сравнению с традиционными CD3-связывающими молекулами, известными в данной области, которые распознают зависимые от окружения эпитопы CD3. В частности, поскольку перераспределение Т-клеток в ходе начальной фазы лечения CD3-связывающими молекулами является основным фактором риска неблагоприятных явлений, таких как неблагоприятные явления со стороны ЦНС (центральная нервная система), PSMAxCD3 биспецифическое одноцепочечное антитело по изобретению имеет значительное преимущество с точки зрения безопасности по сравнению с CD3-связывающими молекулами, известными в данной области, за счет распознавания скорее независимого от окружения, чем зависимого от окружения эпитопа CD3. Пациенты с такими неблагоприятными явлениями со стороны ЦНС, связанными с перераспределением Т-клеток в ходе начальной фазы лечения традиционными CD3-связывающими молекулами, обычно страдают от спутанности сознания и дезориентации и в некоторых случаях от недержания мочи. Спутанность сознания представляет собой изменение психического состояния, при котором пациент не способен думать с его или ее обычным уровнем ясности. Пациенту обычно трудно сконцентрироваться, и процесс мышления становится не только затуманенным и неясным, но часто в значительной степени замедленным. Пациенты с неблагоприятными явлениями со стороны ЦНС, связанными с перераспределением Т-клеток в ходе начальной фазы лечения традиционными CD3-связывающими молекулами, могут также страдать потерей памяти. Часто спутанность сознания приводит к потере способности узнавать людей, места, определять время или даты. Чувство дезориентации является обычным явлением при спутанности сознания, и способность принимать решения нарушается. Неблагоприятные явления со стороны ЦНС, связанные с перераспределением Т-клеток в ходе начальной фазы лечения традиционными CD3-связывающими молекулами, могут дополнительно включать неясную речь и/или трудности с подбором слов. Это расстройство может ухудшать как выразительность, так и восприятие речи, а также способность читать и писать. Помимо недержания мочи у некоторых пациентов неблагоприятные явления со стороны ЦНС, связанные с перераспределением Т-клеток в ходе начальной фазы лечения традиционными CD3-связывающими молекулами, могут также сопровождаться вертиго и головокружением.
Сохранение трехмерной структуры в пределах упомянутого 27-аминокислотного N-концевого полипептидного фрагмента CD3-эпсилон может быть использовано для создания связывающих доменов, предпочтительно человеческих, которые способны связываться с N-концевым полипептидным фрагментом CD3-эпсилон in vitro и с нативным CD3-комплексом (CD3-эпсилон-субъединицей CD3-комплекса) на Т-клетках in vivo с одинаковой аффинностью связывания. Эти данные строго указывают на то, что N-концевой фрагмент, как он описан здесь, образует третичную конформацию, которая сходна с его структурой, в норме существующей in vivo. Был проведен очень чувствительный тест, демонстрирующий важность структурной целостности аминокислот 1-27 N-концевого полипептидного фрагмента CD3-эпсилон. Индивидуальные аминокислоты из аминокислот 1-27 N-концевого полипептидного фрагмента CD3-эпсилон были заменены на аланин (аланиновое сканирование), чтобы протестировать чувствительность аминокислот 1-27 N-концевого полипептидного фрагмента CD3-эпсилон к минорным нарушениям. CD3-связывающие домены как часть биспецифических одноцепочечных антител по изобретению были использованы для тестирования на связывание с аланиновыми мутантами аминокислот 1-27 N-концевого полипептидного фрагмента CD3-эпсилон (смотри приведенный ниже Пример 5). Индивидуальные замены первых пяти аминокислотных остатков в самом конце N-концевого фрагмента и двух аминокислот в положениях 23 и 25 аминокислот 1-27 N-концевого полипептидного фрагмента CD3-эпсилон были критическими для связывания молекул антител. Замена аминокислотных остатков в области положений 1-5, содержащей остатки Q (глутамин в положении 1), D (аспарагиновая кислота в положении 2), G (глицин в положении 3), N (аспарагин в положении 4) и Е (глутаминовая кислота в положении 5), на аланин аннулировала связывание PSMAxCD3 биспецифического одноцепочечного антитела по изобретению, предпочтительно человеческого, с указанным фрагментом. В то же время, по меньшей мере для некоторых биспецифических одноцепочечных антител по изобретению, предпочтительно человеческих, два аминокислотных остатка на С-конце упомянутого фрагмента Т (треонин в положении 23) и I (изолейцин в положении 25) снижали энергию связывания с биспецифическими одноцепочечными антителами по изобретению, предпочтительно человеческими.
Неожиданно было обнаружено, что выделенное таким образом биспецифическое одноцепочечное антитело по изобретению, предпочтительно человеческое, не только распознает N-концевой фрагмент CD3-эпсилон человека, но и соответствующие гомологичные фрагменты CD3-эпсилон различных приматов, включая цепкохвостых обезьян (игрунка, Callithrix jacchus; эдипов тамарин, Saguinus oedipus; беличья обезьяна, Saimiri sciureus) и низших узконосых обезьян (Масаса fascicularis, также известный как яванский макак или макак-крабоед; или Масаса mulatta, также известный как макак-резус). Таким образом, было обнаружено специфическое в отношении многих приматов PSMAxCD3 биспецифическое одноцепочечное антитело по изобретению. Приведенные ниже анализы последовательностей подтвердили, что человек и приматы имеют общий участок с высокогомологичным участком последовательности на N-конце внеклеточного домена CD3-эпсилон-цепи.
Аминокислотная последовательность вышеупомянутых N-концевых фрагментов CD3-эпсилон представлена в SEQ ID NO:2 (человек), SEQ ID NO:4 (Callithnx jacchus); SEQ ID NO:6 (Saguinus oedipus); SEQ ID NO:8 (Saimiri sciureus); SEQ ID NO:1047 QDGNEEMGSITQTPYQVSISGTTILTC или SEQ ID NO:1048 QDGNEEMGSITQTPYQVSISGTTVILT (Масаса fascicularis, также известный как яванский макак) и SEQ ID NO:1049 QDGNEEMGSITQTPYHVSISGTTVILT (Macaca mulatta, также известный как макак-резус).
Второй связывающий домен PSMAxCD3 биспецифического одноцепочечного антитела по изобретению связывается со специфическим мембранным антигеном предстательной железы (PSMA). Предпочтительно, второй связывающий домен PSMAxCD3 биспецифического одноцепочечного антитела связывается с PSMA человека или PSMA примата, не являющегося шимпанзе; более предпочтительно, он связывается с PSMA человека и PSMA примата, не являющегося шимпанзе, и, следовательно, обладает межвидовой специфичностью; еще более предпочтительно, он связывается с PSMA человека и PSMA макака (и, следовательно, также обладает межвидовой специф