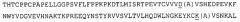Антагонисты рецептора и лигандов alk1 и их применение
Иллюстрации
Показать всеНастоящее изобретение относится к области биотехнологии. Предложен способ лечения опухоли у млекопитающего, предусматривающий введение эффективного количества слитого белка ALK1-Fc, где слитый белок ALK1-Fc содержит внеклеточный домен (ECD) подобной рецептору активина киназы I (ALK1 или ACVRL1), слитый на C-конце с Fc-областью иммуноглобулина. Слитый белок ALK1-Fc по настоящему изобретению способен связывать GDF5, GDF7 и BMP9, обеспечивая ингибирование развития кровеносных сосудов. 15 з.п. ф-лы, 10 ил., 8 пр.
Реферат
РОДСТВЕННАЯ ЗАЯВКА
Эта заявка притязает на приоритет по дате подачи предварительной заявки на патент США № 60/856592, поданной 2 ноября 2006 и озаглавленной «ALK1 Receptor and Ligand Antagonist and Uses Thereof». Взятые в целом учения упомянутой предварительной заявки специально включены сюда посредством ссылки.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Развитие кровеносных сосудов, процесс образования новых кровеносных сосудов, является критическим во многих нормальных и патологических физиологических состояниях. В нормальных физиологических состояниях у людей и животных развитие кровеносных сосудов наблюдается в специфических и ограниченных ситуациях. Например, развитие кровеносных сосудов в нормальном состоянии наблюдается при заживлении ран, зародышевом и эмбриональном развитии и образовании желтого тела, эндометрия и плаценты.
Нежелательное или не соответствующим образом регулируемое развитие кровеносных сосудов встречается при многих нарушениях, при которых аномальный рост эндотелия может вызвать патологический процесс или принимать участие в этом процессе. Например, развитие кровеносных сосудов принимает участие в росте многих опухолей. Нерегулируемое развитие кровеносных сосудов подразумевалось в таких патологических процессах как ревматоидный артрит, ретинопатии, гемангиомы и псориаз. Разнообразные патологические болезненные состояния, при которых присутствует нерегулируемое развитие кровеносных сосудов, были классифицированы как связанные с развитием кровеносных сосудов заболевания.
Полагают, что и контролируемое, и не контролируемое развитие кровеносных сосудов протекает схожим образом. Капиллярные кровеносные сосуды состоят главным образом из эндотелиальных клеток и перицитов, окруженных базальной мембранной. Развитие кровеносных сосудов начинается с эрозии базальной мембраны под действием ферментов, высвобождаемых эндотелиальными клетками и лейкоцитами. Эндотелиальные клетки, которые выстилают просвет кровеносных сосудов, затем выступают наружу через базальную мембрану. Факторы развития кровеносных сосудов индуцируют миграцию эндотелиальных клеток через подвергнутую эрозии базальную мембрану. Мигрирующие клетки образуют «отросток», выступающий из исходного кровеносного сосуда, в котором эндотелиальные клетки подвергаются митозу и пролиферируют. Эндотелиальные отростки объединяются друг с другом, с образованием капиллярных петель, создавая новые кровеносные сосуды.
Было установлено, что агенты, ингибирующие развитие кровеносных сосудов, являются эффективными для лечения множества нарушений. Было установлено, что AvastinTM (бевацизумаб), моноклональное антитело, которое связывается с фактором роста эндотелия сосудов (VEGF), является эффективным для лечения множества раков. Было установлено, что MacugenTM, аптамер, который связывается с VEGF, является эффективным для лечения неоваскулярной (мокнущей) возрастной дегенерации желтого пятна. Антагонисты пути передачи сигнала, опосредуемой SDF/CXCR4, ингибируют неоваскуляризацию опухолей и эффективны против рака в моделях на мышах (Guleng et al. Cancer Res. 2005 Jul 1; 65(13): 5864-71). Завершено клиническое испытание фазы I изокумарина 2-(8-гидрокси-6-метокси-1-оксо-1Н-2-бензопиран-3-ил)пропионовой кислоты (NM-3) в качестве перорально биодоступного ингибитора развития кровеносных сосудов. NM-3 непосредственно уничтожает как эндотелиальные, так и опухолевые клетки in vitro и эффективен для лечения ксенотрансплантатов разнообразных опухолей человека в мышах (Agata et al. Cancer Chemother Pharmacol. 2005 Dec; 56(6): 610-4). Талидомид и родственные соединения продемонстрировали благоприятные эффекты при лечении рака, и хотя молекулярный механизм действия не ясен, ингибирование развития кровеносных сосудов, по-видимому, является важным компонентом противоопухолевого эффекта (см., например, Dredge et al. Microvasc. Res. 2005 Jan; 69(1-2): 56-63). Успех антагонистов TNF-альфа при лечении ревматоидного артрита отчасти объясняется антиангиогенными эффектами на воспаленную ткань сустава (Feldmann et al. Annu. Rev. Immunol. 2001; 19: 163-96). Очень вероятно, что антиангиогенные терапии будут иметь благоприятные эффекты на другие воспалительные заболевания, в частности, псориаз. Несмотря на то, что многие антиангиогенные агенты оказывают эффект на развитие кровеносных сосудов независимо от пораженной ткани, другие антиангиогенные агенты могут иметь тенденцию к оказанию избирательного в отношении ткани эффекта.
Желательно иметь дополнительные композиции и способы для ингибирования развития кровеносных сосудов. Они включают способы и композиции, которые могут ингибировать нежелательный рост кровеносных сосудов, или вообще, или в определенных тканях и/или при определенных болезненных состояниях.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Отчасти настоящее описание представляет характеристику опосредуемой подобной рецептору активина киназой I (ALK1) регуляторной системы и роли этой системы в развитии кровеносных сосудов in vivo. В некоторых аспектах настоящим описанием предоставляются антагонисты лигандов ALK1 и применение таких антагонистов в качестве антиангиогенных агентов. Кроме того, настоящим описанием предоставляются антагонисты самой ALK1 и применение таких антагонистов в качестве антиангиогенных агентов. Описываемая здесь ALK1 представляет собой рецептор для группы лигандов GDF5, которая включает GDF6 и GDF7, а также для группы лигандов BMP9, которая включает ВМР10. В этом описании демонстрируется, что передача сигнала, опосредуемая ALK1 и описываемыми здесь лигандами, вовлечена в развитие кровеносных сосудов in vivo, и что ингибирование этой регуляторной системы оказывает сильный антиангиогенный эффект. Таким образом, в некоторых аспектах настоящим описанием предоставляются антагонисты опосредуемой ALK1 регуляторной системы, включающие антагонисты рецептора и одного или нескольких лигандов, для применения для ингибирования развития кровеносных сосудов. В некоторых аспектах настоящим описанием предоставляются антагонисты лигандов ALK1 для лечения раков, в частности, множественной миеломы, ревматоидного артрита, и нарушений, связанных с патологическим развитием кровеносных сосудов внутри глаза.
В некоторых аспектах настоящим описанием предоставляются полипептиды, включающие лигандсвязывающую часть внеклеточного домена ALK1 («содержащие ECD ALK1 полипептиды») для применения для ингибирования развития кровеносных сосудов. Несмотря на нежелание быть связанными с каким-либо конкретным механизмом действия, предполагают, что такие полипептиды действуют путем связывания с лигандами ALK1 и ингибирования способности этих лигандов взаимодействовать с ALK1, а также другими рецепторами. В некоторых вариантах осуществления содержащие ECD ALK1 полипептиды включают аминокислотную последовательность, которая по меньшей мере на 70%, 80%, 90%, 95%, 97%, 99% или 100% идентична последовательности аминокислот 22-118 последовательности ALK1 человека SEQ ID NO: 1. Содержащие ECD ALK1 полипептиды могут использоваться в виде небольшого мономерного белка или в подвергнутой димеризации форме (например, представленной в виде слитого белка), в частности, для местного введения в ткани, такие как глаз. Содержащие ECD ALK1 полипептиды могут быть также слиты со второй полипептидной частью для обеспечения улучшенных свойств, таких как увеличенный полупериод существования или большая легкость продукции или очистки. Слияния с Fc-областью иммуноглобулина или соединение с полиоксиэтиленовой составляющей (например, полиэтиленгликолем) могут быть особенно полезными для увеличения полупериода существования в сыворотке содержащего ECD ALK1 полипептида при системном введении (например, внутривенном, внутриартериальном и внутрибрюшинном введении). Как здесь продемонстрировано, системное введение полипептида ALK1-Fc оказывает сильный антиангиогенный эффект внутри глаза, а также обеспечивает положительные эффекты в моделях ревматоидного артрита и множественной миеломы на мышах. В некоторых вариантах осуществления слитый белок ALK1-Fc включает в себя полипептид, имеющий аминокислотную последовательность, которая по меньшей мере на 70%, 80%, 90%, 95%, 97%, 99% или 100% идентична последовательности аминокислот 22-118 SEQ ID NO: 1, и слитый, или с использованием промежуточного линкера, или без него, с Fc-областью иммуноглобулина, причем слитый белок ALK1-Fc связывается с GDF5, GDF7 и BMP9 с KD, составляющей менее 1×10-7 М, и связывается с TGFβ-1 с KD, превышающей 1×10-6 М. Fc-область можно выбрать, чтобы она была подходящей для организма. Необязательно, Fc-областью является Fc-область IgG1 человека. В предпочтительном варианте осуществления слитый белок ALK1-Fc включает аминокислоты 22-118 SEQ ID NO: 1. Необязательно слитый белок ALK1-Fc включает аминокислотную последовательность SEQ ID NO: 3. Необязательно слитый белок ALK1-Fc является белком, продуцируемым при экспрессии нуклеиновой кислоты SEQ ID NO: 4 в линии клеток млекопитающего, в частности, в линии клеток яичника китайского хомячка (СНО). Содержащие ECD ALK1 полипептиды можно приготовить в виде фармацевтической композиции, которая по существу не содержит пирогенов. Фармацевтическую композицию можно приготовить для системной доставки (например, внутривенной, внутриартериальной или подкожной доставки) или для местной доставки (например, в глаз).
В некоторых аспектах настоящим описанием предоставляются способы ингибирования развития кровеносных сосудов у млекопитающего путем введения любого из содержащих ECD ALK1 полипептидов, описанных здесь в общем или в частности. В одном варианте осуществления способ включает введение млекопитающему эффективного количества слитого белка ALK1-Fc, причем слитый белок ALK1-Fc содержит полипептид, имеющий аминокислотную последовательность, которая по меньшей мере на 90% идентична последовательности аминокислот 22-118 SEQ ID NO: 1, и слитый с Fc-областью иммуноглобулина, причем слитый белок ALK1-Fc связывается с TGFβ-1 с KD, превышающей 1×10-6 М. Необязательно слитый белок ALK1-Fc связывается с одним или несколькими лигандами ALK1, выбранными из группы, состоящей из GDF5, GDF6, GDF7, BMP9 и ВМР10. Необязательно слитый белок ALK1-Fc имеет последовательность SEQ ID NO: 3. Содержащий ECD ALK1 полипептид может доставляться местно (например, в глаз) или системно (например, внутривенно, внутриартериально или подкожно). В конкретном варианте осуществления настоящим описанием предоставляется способ ингибирования развития кровеносных сосудов внутри глаза млекопитающего путем введения белка ALK1-Fc млекопитающему в месте, удаленном от глаза, например, с помощью системного введения.
В некоторых аспектах настоящим описанием предоставляются антитела, которые связываются с ALK1, в частности, с эпитопом, расположенным во внеклеточном домене, аминокислоты 22-118 SEQ ID NO: 1, и ингибируют связывание ALK1 с по меньшей мере одним лигандом ALK1, выбранным из группы, состоящей из GDF5, GDF6, GDF7, BMP9 и ВМР10. На основании аффинностей этих лигандов в отношении ALK1 антитело может связываться с KD, составляющей менее 1×10-8 М и необязательно находящейся между 5×10-8 и 1×10-10. Можно было бы ожидать, что антитело с аффинностью в пределах этого диапазона ингибирует передачу сигнала, опосредуемую одним или более из GDF5, 6 и 7, несмотря на то, что оно оказывает меньший эффект на передачу сигнала, опосредуемую BMP9 и ВМР10. Такое антитело предпочтительно ингибирует развитие кровеносных сосудов, стимулируемое по меньшей мере одним лигандом ALK1, выбранным из группы, состоящей из GDF5, GDF6 и GDF7. Несмотря на нежелание быть связанными с каким-либо конкретным механизмом, предполагают, что такие антитела будут действовать путем ингибирования непосредственно активности ALK1, которая должна быть противоположностью активности слитого белка ALK1-Fc, который, как предполагают, ингибирует активность лигандов ALK1. Не предполагают, что антитело против ALK1 будет создавать помехи способности GDF5, GDF6, GDF7, ВМР9 или ВМР10 передавать сигнал через альтернативные рецепторные системы, такие как комплексы BMPR1a, BMPR1b или BMPRII. Однако, предполагают, что антитело против ALK1 будет создавать помехи способности лигандов с низкой аффинностью в отношении ALK1 (например, TGF-β, который, как обычно признается, инициирует существенные события передачи сигналов через ALK1, даже несмотря на то, что связывание является относительно слабым) передавать сигнал через ALK1, даже несмотря на то, что ECD ALK1 может не связываться с такими лигандами с низкой аффинностью или не ингибировать такие лиганды. Антитело может связываться с полипептидом ALK1 с KD, составляющей менее 1×10-10 М. Можно было бы ожидать, что антитело с аффинностью в пределах этого диапазона будет ингибировать передачу сигнала, опосредуемую ВМР9 или 10. Такое антитело предпочтительно ингибирует связывание ВМР9 и ВМР10 с ALK1. Примечательно, на основе раскрытых здесь данных, что антитело, которое относительно плохо связывается с ALK1, может ингибировать связывание TGF-β с ALK1, несмотря на то, что оно не ингибирует сильнее связывающиеся лиганды, такие как GDF5 или ВМР9. Описываемые здесь антитела являются предпочтительно рекомбинантными антителами, означающими антитела, экспрессируемые с нуклеиновой кислоты, которая была сконструированы с использованием методов молекулярной биологии, такими как гуманизированные антитела или полностью человеческие антитела, разработанные на основе одноцепочечного антитела. В термин «рекомбинантное антитело» также включены Fv, Fab и одноцепочечные антитела. Антитела могут также быть поликлональными или нерекомбинантными моноклональными антителами (включающими человеческие или мышиные формы, а также антитела человека, получаемые из трансгенных мышей). Антитела и содержащие ECD ALK1 полипептиды можно приготовить в виде фармацевтической композиции, которая по существу не содержит пирогенов. Фармацевтическую композицию можно приготовить для системной доставки (например, внутривенной, внутриартериальной или подкожной доставки) или для местной доставки (например, в глаз).
В некоторых аспектах настоящим описанием предоставляются способы ингибирования развития кровеносных сосудов у млекопитающего путем введения млекопитающему эффективного количества антитела, которое связывается с полипептидом ALK1, описанного здесь в общем или в частности. Применимое для этой цели антитело может связываться с внеклеточным доменом ALK1 (например, связываться с полипептидом, состоящим из аминокислот 22-118 SEQ ID NO: 1) или другой частью ALK1. Антитело может связываться с полипептидом, состоящим из аминокислот 22-118 SEQ ID NO: 1, и ингибирует связывание по меньшей мере одного лиганда ALK1, выбранного из группы, состоящей из GDF5, GDF6, GDF7, BMP9 и ВМР10. Антитело может связываться с полипептидом ALK1 с KD, составляющей менее 5×10-8 М и необязательно находящейся между 5×10-8 и 1×10-10. Антитело может ингибировать развитие кровеносных сосудов, стимулируемое по меньшей мере одним лигандом ALK1, выбранным из группы, состоящей из GDF5, GDF6 и GDF7. Антитело, которое избирательно ингибирует передачу сигнала, опосредуемую GDF5, 6 и 7, относительно передачи сигнала, опосредуемой ВМР9 или 10, может использоваться в качестве избирательного ингибитора развития кровеносных сосудов, которое происходит в тканях, в которых обнаруживаются GDF5, 6 или 7, главным образом, в кости или суставах. Антитело может связываться с полипептидом ALK1 с KD, составляющей менее 1×10-10 М. Антитело может ингибировать связывание ALK1 с лигандом ALK1, причем лиганд ALK1 выбран из группы, состоящей из ВМР9 и ВМР10. Антитело против ALK1 может доставляться местно (например, в глаз) или системно (например, внутривенно, внутриартериально или подкожно). В конкретном варианте осуществления настоящим описанием предоставляется способ ингибирования развития кровеносных сосудов внутри глаза млекопитающего путем введения антитела против ALK1. В другом конкретном варианте осуществления настоящим описанием предоставляется способ лечения пациентов с множественной миеломой. В конкретном варианте осуществления настоящим описанием предоставляется способ ингибирования развития кровеносных сосудов при нарушениях, которые связаны с патологическим развитием кровеносных сосудов в качестве результата действия множества проангиогенных факторов, таких как VEGF, PDGF и/или FGF.
В некоторых аспектах настоящим описанием предоставляются антитела, которые связываются с описанным здесь лигандом ALK1 и ингибируют связывание лиганда ALK1 с ALK1. Несмотря на нежелание быть связанными с каким-либо конкретным механизмом, предполагают, что антитела, которые связываются с лигандами ALK1, будут оказывать эффекты, которые схожи по природе с эффектами содержащих ECD ALK1 полипептидов, поскольку оба типа агентов связываются с лигандами, а не с самим рецептором. В некоторых вариантах осуществления антитело связывается с лигандом, выбранным из группы, состоящей из GDF5, GDF6 и GDF7. Антитело может связываться с лигандом ALK1 с KD, составляющей менее 5×10-8 М. Антитело может быть выбрано для ингибирования развития кровеносных сосудов, стимулируемого лигандом ALK1. Анализ с использованием САМ является подходящей для отбора желаемых антител системой анализа. Такие антитела являются предпочтительно рекомбинантными антителами и могут быть приготовлены в виде фармацевтической композиции, которая по существу не содержит пирогенов. Фармацевтическую композицию можно приготовить для системной доставки (например, внутривенной, внутриартериальной или подкожной доставки) или для местной доставки (например, в глаз).
В некоторых аспектах настоящим описанием предоставляются антитела, которые связываются с лигандом ALK1 и ингибируют связывание лиганда ALK1 с ALK1, причем лиганд ALK1 выбран из группы, состоящей из ВМР9 и ВМР10. Антитело может связываться с лигандом ALK1 с KD, составляющей менее 1×10-10 М. Такие антитела являются предпочтительно рекомбинантными антителами и могут быть приготовлены в виде фармацевтической композиции, которая по существу не содержит пирогенов. Фармацевтическую композицию можно приготовить для системной доставки (например, внутривенной, внутриартериальной или подкожной доставки) или для местной доставки (например, в глаз).
В некоторых аспектах настоящим описанием предоставляются способы ингибирования развития кровеносных сосудов у млекопитающего, включающие введения млекопитающему эффективного количества антитела, которое связывается с лигандом ALK1 и ингибирует связывание лиганда ALK1 с ALK1, причем лиганд ALK1 выбран из группы, состоящей из GDF5, GDF6, GDF7, ВМР9 и ВМР10. Антитело может ингибировать развитие кровеносных сосудов, стимулируемое по меньшей мере одним лигандом ALK1, выбранным из группы, состоящей из GDF5, GDF6 и GDF7.
Члены семейства BMP/GDF, включающие ВМР9, ВМР10, GDF5, GDF6 и GDF7, связываются с рецептором типа I и типа II для того, чтобы образовать функциональный передающий сигнал комплекс. Сайты связывания для этих рецепторов различны. Соответственно, в некоторых вариантах осуществления антитело, которое связывается с лигандом ALK1 и ингибирует связывание лиганда с ALK1, является антителом, которое связывается в сайте связывания с рецептором лиганда типа I или вблизи этого сайта.
В некоторых аспектах настоящим описанием предоставляются способы ингибирования развития кровеносных сосудов у млекопитающего путем введения других ингибиторов описываемой здесь системы передачи сигнала, опосредуемой ALK1. Такие ингибиторы могут включать нуклеиновые кислоты (например, конструкции антисмысловых НК или интерферирующих РНК), которые уменьшают продукцию ALK1, GDF5, GDF6, GDF7, ВМР9 или ВМР10. Можно также использовать множество реагентов для аффинного связывания, таких как аптамеры, произвольные пептиды, каркасные структуры белков, которые можно модифицировать для того, чтобы сделать возможным связывание с выбранными мишенями (примеры таких каркасных структур включают антикалины и домены FNIII), в каждом случае реагенты для аффинного связывания можно было бы выбирать по способности нарушать опосредуемую ALK1 регуляторную систему, описанную здесь, или путем нарушения взаимодействия ALK1-лиганд, или путем ингибирования передачи сигнала, которая происходит после связывания.
В дополнительном варианте осуществления в настоящем описании очерчена роль DAN в качестве регулятора опосредуемой ALK1 регуляторной системы. Как здесь показано, DAN связывается с группой лигандов GDF5, но не связывается с группой лигандов ВМР9. Таким образом, предполагают, что DAN ингибирует развитие кровеносных сосудов, опосредуемое GDF5, GDF6 или GDF7, но не развитие кровеносных сосудов, опосредуемое ВМР9 или ВМР10. Следовательно, DAN можно использовать в качестве избирательного агента для ингибирования развития кровеносных сосудов в кости или суставах, в которых главным образом экспрессируется группа белков GDF5. Таким образом, в некоторых вариантах осуществления настоящим описанием предоставляются белки DAN для применения в качестве антиангиогенных агентов в контексте развития кровеносных сосудов в кости или суставах, в том числе ревматоидного артрита и раков, при которых поражены болезнью кость или суставы (например, множественной миеломы или метастазирования в кость). Белок DAN будет, как правило, связываться с одним или несколькими лигандами ALK1, выбранными из группы, состоящей из GDF5, GDF6 и GDF7, несмотря на то, что он относительно плохо связывается с ВМР9 или ВМР10. Белок DAN может включать аминокислотную последовательность, которая по меньшей мере на 70%, 80%, 90%, 95%, 97%, 99% или 100% идентична последовательности аминокислот, соответствующих аминокислотам 17-180 SEQ ID NO: 10 (зрелого DAN человека) или аминокислотам 21-125 SEQ ID NO: 10 (домена DAN с группой консервативных цистеинов). Белок DAN может также кодироваться нуклеиновой кислотой, включающей последовательность, комплемент которой гибридизуется в жестких условиях гибридизации с нуклеотидами 153-467 SEQ ID NO: 11 и вариантом нуклеотидов 153-467 SEQ ID NO: 11, который имеет такую же кодирующую последовательность («молчащим» вариантом, таким как вариант, содержащий одно или несколько изменений в неоднозначном положении в коде - триплете), или с нуклеотидами 93-635 SEQ ID NO: 11 или его молчащим вариантом. В некоторых аспектах белок DAN является слитым белком, таким как слитый с Fc белок. Несмотря на то, что DAN, как предполагается, особенно полезен для ингибирования развития кровеносных сосудов в кости и суставах (в том числе опухолях, находящихся в кости или суставах, таких как множественная миелома и метастазирование в кость), он может также быть полезен в других контекстах, например, для опухоли, находящейся в другом месте, или для глаза.
В некоторых аспектах настоящим описанием предоставляются способы лечения ревматоидного артрита у млекопитающего, включающие введения млекопитающему, страдающему ревматоидным артритом, эффективного количества агента, выбранного из группы, состоящей из содержащего ECD ALK1 белка; антитела, которое связывается с лигандом ALK1 и ингибирует связывание лиганда ALK1 с ALK1, причем лиганд ALK1 выбран из группы, состоящей из GDF5, GDF6, GDF7, ВМР9 и ВМР10; антитела, которое связывается с полипептидом ALK1, состоящим из аминокислот 22-118 SEQ ID NO: 1, и ингибирует связывание по меньшей мере одного лиганда ALK1, выбранного из группы, состоящей из GDF5, GDF6, GDF7, ВМР9 и ВМР10; и полипептида DAN.
В некоторых аспектах настоящим описанием предоставляются способы лечения опухоли у млекопитающего. Такой способ может включать введения млекопитающему, имеющему опухоль, эффективного количества агента, выбранного из группы, состоящей из содержащего ECD ALK1 белка; антитела, которое связывается с лигандом ALK1 и ингибирует связывание лиганда ALK1 с ALK1, причем лиганд ALK1 выбран из группы, состоящей из GDF5, GDF6, GDF7, ВМР9 и ВМР10; антитела, которое связывается с полипептидом ALK1, состоящим из аминокислот 22-118 SEQ ID NO: 1, и ингибирует связывание по меньшей мере одного лиганда ALK1, выбранного из группы, состоящей из GDF5, GDF6, GDF7, ВМР9 и ВМР10; и полипептида DAN. Способ может, кроме того, включать введение второго агента, ингибирующего развитие кровеносных сосудов. Опухолью может быть опухоль, которая связана с костью, такой как лейкоз, опухоль костного мозга, множественная миелома или метастазы в кость, такие как метастазы, обычно сопровождающие рак молочной железы или предстательной железы. Опухолью может также быть опухоль, которая использует множество проангиогенных факторов, такая как опухоль, которая устойчива к анти-VEGF-терапии.
В некоторых аспектах настоящим описанием предоставляются композиции для глаз. Такие композиции могут включать агент, выбранный из группы, состоящей из содержащего ECD ALK1 белка; антитела, которое связывается с лигандом ALK1 и ингибирует связывание лиганда ALK1 с ALK1, причем лиганд ALK1 выбран из группы, состоящей из GDF5, GDF6, GDF7, ВМР9 и ВМР10; антитела, которое связывается с полипептидом ALK1, состоящим из аминокислот 22-118 SEQ ID NO: 1, и ингибирует связывание по меньшей мере одного лиганда ALK1, выбранного из группы, состоящей из GDF5, GDF6, GDF7, ВМР9 и ВМР10; и полипептида DAN.
В некоторых аспектах настоящим описанием предоставляются способы лечения заболевания глаз, связанного с развитием кровеносных сосудов. Такие способы могут включать введения системно или в указанный глаз фармацевтической композиции, содержащей эффективное количество агента, выбранного из группы, состоящей из содержащего ECD ALK1 белка; антитела, которое связывается с лигандом ALK1 и ингибирует связывание лиганда ALK1 с ALK1, причем лиганд ALK1 выбран из группы, состоящей из GDF5, GDF6, GDF7, ВМР9 и ВМР10; антитела, которое связывается с полипептидом ALK1, состоящим из аминокислот 22-118 SEQ ID NO: 1, и ингибирует связывание по меньшей мере одного лиганда ALK1, выбранного из группы, состоящей из GDF5, GDF6, GDF7, ВМР9 и ВМР10; и полипептида DAN.
В каждом случае описываемый здесь агент может вводиться в соединении со вторым агентом, ингибирующим развитие кровеносных сосудов. Если желательно ингибировать развитие кровеносных сосудов в опухоли, агент может вводиться в соединении со вторым агентом, который оказывает противораковый эффект, таким как химиотерапевтический агент или биологический противораковый агент.
Настоящим описанием также предоставляется фармацевтическая композиция для глаз, содержащая слитый белок ALK1-Fc, содержащий полипептид, имеющий аминокислотную последовательность, которая идентична последовательности аминокислот 22-118 SEQ ID NO: 1 по меньшей мере на 97%, и слитый с Fc-областью иммуноглобулина, причем слитый белок ALK1-Fc связывается с GDF5, GDF7 и BMP9 с KD, составляющей менее 1×10-7 М, и связывается с TGFβ-1 с KD, превышающей 1×10-6 М. В одном варианте осуществления слитый белок имеет последовательность SEQ ID NO: 3. В одном варианте осуществления Fc-область происходит из IgG1 человека. В одном варианте осуществления слитый белок продуцируется при экспрессии нуклеиновой кислоты SEQ ID NO: 4 в линии клеток млекопитающего. В одном варианте осуществления линией клеток является линия клеток яичника китайского хомячка. Композиция может, кроме того, включать одно или несколько следующих лекарственных средств: пегаптаниб, ранибизумаб или глюкокортикоид. В одном варианте осуществления композиция по существу не содержит пирогенов.
Настоящей заявкой также предоставляется фармацевтическая композиция для глаз, содержащая антитело, которое связывается с полипептидом ALK1, состоящим из аминокислот 22-118 SEQ ID NO: 1, и ингибирует связывание по меньшей мере одного лиганда ALK1, выбранного из группы, состоящей из GDF5, GDF6, GDF7, ВМР9 и ВМР10. В одном варианте осуществления антитело ингибирует развитие кровеносных сосудов, стимулируемое по меньшей мере одним лигандом ALK1, выбранным из группы, состоящей из GDF5, GDF6 и GDF7. В одном варианте осуществления антитело связывается с полипептидом ALK1 с KD, составляющей менее 5×10-8 М. В другом варианте осуществления антитело связывается с полипептидом ALK1 с KD, составляющей менее 1×10-10 М. В одном варианте осуществления антитело ингибирует развитие кровеносных сосудов, стимулируемое GDF5, GDF6, GDF7, ВМР9 или ВМР10. Композиция может, кроме того, включать одно или несколько следующих лекарственных средств: пегаптаниб, ранибизумаб или глюкокортикоид. В одном варианте осуществления композиция по существу не содержит пирогенов.
В некоторых аспектах настоящим описанием предоставляется фармацевтическая композиция для глаз, содержащая антитело, которое связывается с лигандом ALK1, описанным здесь, и ингибирует связывание лиганда ALK1 с ALK1. В некоторых вариантах осуществления антитело связывается с лигандом, выбранным из группы, состоящей из GDF5, GDF6 и GDF7. Антитело может связываться с лигандом ALK1 с KD, составляющей менее 5×10-8 М. Антитело может быть выбрано для ингибирования развития кровеносных сосудов, стимулируемого лигандом ALK1. Анализ с использованием САМ является подходящей для отбора желаемых антител системой анализа. Такие антитела являются предпочтительно рекомбинантными антителами. Композиция может, кроме того, включать одно или несколько следующих лекарственных средств: пегаптаниб, ранибизумаб или глюкокортикоид. В одном варианте осуществления композиция по существу не содержит пирогенов.
Настоящей заявкой также предоставляется способы лечения заболевания глаз, связанного с развитием кровеносных сосудов, включающие введение в указанный глаз фармацевтической композиции для глаз, содержащей слитый белок ALK1-Fc, включающий в себя полипептид, имеющий аминокислотную последовательность, которая по меньшей мере на 97% идентична последовательности аминокислот 22-118 SEQ ID NO: 1, и слитый с Fc-областью иммуноглобулина, причем слитый белок ALK1-Fc связывается с GDF5, GDF7 и BMP9 с KD, составляющей менее 1×10-7 М, и связывается с TGFβ-1 с KD, превышающей 1×10-6 М. В одном варианте осуществления слитый белок имеет последовательность SEQ ID NO: 3. В одном варианте осуществления Fc-область происходит из IgG1 человека. В одном варианте осуществления слитый белок продуцируется при экспрессии нуклеиновой кислоты SEQ ID NO: 4 в линии клеток млекопитающего. В одном варианте осуществления линией клеток является линия клеток яичника китайского хомячка. Композиция может, кроме того, включать одно или несколько следующих лекарственных средств: пегаптаниб, ранибизумаб или глюкокортикоид. В одном варианте осуществления композиция по существу не содержит пирогенов.
Настоящей заявкой также предоставляются способы лечения заболевания глаз, связанного с развитием кровеносных сосудов, включающие введение в указанный глаз фармацевтической композиции для глаз, содержащей антитело, которое связывается с полипептидом ALK1, состоящим из аминокислот 22-118 SEQ ID NO: 1, и ингибирует связывание по меньшей мере одного лиганда ALK1, выбранного из группы, состоящей из GDF5, GDF6, GDF7, ВМР9 и ВМР10. В одном варианте осуществления антитело ингибирует развитие кровеносных сосудов, стимулируемое по меньшей мере одним лигандом ALK1, выбранным из группы, состоящей из GDF5, GDF6 и GDF7. В одном варианте осуществления антитело связывается с полипептидом ALK1 с KD, составляющей менее 5×10-8 М. В другом варианте осуществления антитело связывается с полипептидом ALK1 с KD, составляющей менее 1×10-10 М. В одном варианте осуществления антитело ингибирует развитие кровеносных сосудов, стимулируемое GDF5, GDF6, GDF7, ВМР9 или ВМР10. Композиция может, кроме того, включать одно или несколько следующих лекарственных средств: пегаптаниб, ранибизумаб или глюкокортикоид. В одном варианте осуществления композиция по существу не содержит пирогенов.
В одном варианте осуществления раскрытых способов заболевание глаз, связанное с развитием кровеносных сосудов, выбран из группы, состоящей из опухоли, устойчивой к анти-VEGF-терапии опухоли, опухоли в виде множественной миеломы, опухоли, которая метастазировала в кость, воспаления сустава или кости, ревматоидного артрита, диабетической ретинопатии, синдрома Терри, дегенерации желтого пятна, отторжения трансплантированной ткани роговицы, неоваскулярной глаукомы и ретролентальных фиброплазий.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг. 1 приведена аминокислотная последовательность подобной рецептору активина киназы I (ALK1) человека (SEQ ID NO: 1). Однократное подчеркивание показывает предсказываемый внеклеточный домен. Двойное подчеркивание показывает внутриклеточный домен. Сигнальный пептид и трансмембранный домен не подчеркнуты.
На фиг. 2 приведена последовательность нуклеиновой кислоты ALK1 человека кДНК (SEQ ID NO: 2). Кодирующая последовательность подчеркнута. Часть, кодирующая внеклеточный домен, подчеркнута дважды.
На фиг. 3 приведен пример слияния внеклеточного домена ALK1 человека с Fc-областью (SEQ ID NO: 3). Белок hALK1-Fc включает аминокислоты 22-120 ALK1 человека, слитые на С-конце с линкером (не подчеркнут) и Fc-областью IgG1.
На фиг. 4 приведена последовательность нуклеиновой кислоты для экспрессии полипептида hALK1-Fc SEQ ID NO: 3. Также показана кодируемая аминокислотная последовательность. Лидерная последовательность отщепляется таким образом, что Asp22 является N-концевой аминокислотой секретируемого белка.
На фиг. 5 показан антиангиогенный эффект mALK1-Fc («RAP») и hALK1-Fc («ACE») при анализе образования трубок из эндотелиальных клеток. Все концентрации RAP и ACE снижали уровень образования трубок в ответ на вспомогательное средство для роста эндотелиальных клеток (ECGS) в большей степени, чем положительный контроль, эндостатин.
На фиг. 6 показан ангиогенный эффект GDF7 в анализе с использованием хориоаллантоисной оболочки цыпленка (САМ). Эффект GDF7 сравним с эффектом VEGF.
На фиг. 7 продемонстрирован антиангиогенный эффект слитого белка hALK1-Fc в анализе с использованием САМ. hALK1-Fc ингибирует развитие кровеносных сосудов, стимулируемое VEGF, FGF и GDF7.
На фиг. 8 продемонстрированы сравнительные антиангиогенные эффекты mALK1-Fc, hALK1-Fc имеющегося в продаже моноклонального антитела против ALK1 (мАт против ALK1) и имеющегося в продаже нейтрализующего моноклонального антитела против VEGF. Антиангиогенный эффект конструкций ALK1-Fc сравним с эффектами антитела против VEGF.
На фиг. 9 продемонстрированы антиангиогенные эффекты hALK1-Fc и антитела против VEGF in vivo. hALK1-Fc и антитела против VEGF оказывали сравнимые эффекты на развитие кровеносных сосудов внутри глаза, определяемое с помощью анализа с использованием микрокармана в роговице мыши.
На фиг. 10 продемонстрированы эффекты mALK1-Fc в модели ревматоидного артрита в виде индуцируемого коллагеном артрита на мышах. Диаграмма показывает средние групповые показатели артрита, определяемые в течение 42-дневного периода наблюдения у самцов мышей с индуцированным коллагеном артритом DBA/1. RAP-041 представляет собой mALK1-Fc. AvastinTM представляет собой антитело против VEGF бевацизумаб.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
1. Обзор
ALK1 является рецептором клеточной поверхности типа I для надсемейства лигандов TGF-β и также известен как ACVRL1 или ACVRLK1. Под ALK1 подразумевали рецептор для TGF-β1, TGF-β3 и ВМР9 (Marchuk et al., Hum. Mol. Genet. 2003; Brown et al., J. Biol. Chem. 2005 Jul. 1; 280(26): 25111-8).
У мышей мутации в ALK1, приводящие к утрате его функции, приводят к множеству патологий в развивающейся сосудистой сети (Oh et al., Proc. Natl. Acad. Sci. USA 2000, 97, 2626-2631; Urness et al., Nat. Genet. 2000, 26, 328-331).
У людей мутации в ALK1, приводящие к утрате его функции, сопровождаются наследственной геморрагической телеангиэктазией (ННТ или болезнью Ослера-Рендю-Вебера), при которой у пациентов развиваются артериовенозные мальформации, которые создают прямой поток (связь) из артерии в вену (артериовенозный шунт) без промежуточного капиллярного русла. Типичные симптомы пациентов с ННТ включают повторяющееся носовое кровотечение, желудочно-кишечное кровотечение, кожные и слизисто-кожные телеангиэктазии и артериовенозные мальформации (AVM) в легочной, мозговой или печеночной сосудистой сети.
В недавних публикациях David et al. (Blood. 2007 Mar 1; 109(5): 1953-61) и Scharpfenecker et al. (J. Cell Sci. 2007 Mar. 15l 120(Pt 6); 964-72) делается вывод, что ВМР9 и ВМР10 активируют ALK1 в эндотелиальных клетках, и что результатом такой активации является ингибирование пролиферации и миграции эндотелиальных клеток. Эти эффекты прямо противоположны эффектам проангиогенных факторов, таких как VEGF. Таким образом, в этих публикациях делается вывод, что ВМР9 и ВМР10 являются сами антиангиогенными факторами, и, кроме того, что активация ALK1 оказывает антиангиогенный эффект. Напротив, в настоящем описании демонстрируется, что антагонисты, а не агонисты, ВМР9 и ВМР10 оказывают антиангиогенный эффект.
На