Способ определения фертильности сперматозоидов и экспресс-анализ для определения фертильности сперматозоидов
Иллюстрации
Показать всеГруппа изобретений относится к медицине и может быть использована для определения фертильности млекопитающих и людей. Исследование осуществляют на индикаторной полоске, содержащей подложку (101) и слой (103) нанесения, причем на указанном слое (103) нанесения имеется зона V для осуществления предварительного анализа на сперматозоиды для определения концентрации сперматозоидов, зона Р1 для определения концентрации протамина-1 и зона Р2 для определения концентрации протамина-2. При этом в исследуемой пробе, полученной от обследуемого индивидуума, определяют in vitro концентрацию протамина-1 и протамина-2 и соотношение между протамином-1 и протамином-2, причем концентрацию протамина-1 и протамина-2 и соотношение между протамином-1 и протамином-2 определяют путем применения экспресс-анализа на указанной индикаторной полоске. В ходе экспресс-анализа на индикаторной полоске проводят указанный предварительный анализ на сперматозоиды для определения концентрации сперматозоидов в исследуемом образце и экспресс-анализ на протамин. И при соотношение между протамином-1 и протамином-2 в сперматозоидах или сперматидах исследуемой пробы составляет 0,8-1,2 протамина-1 к 0,8-1,2 протамина-2, то это означает, что фертильность сперматозоидов нормальная, и их могут применить для последующего оплодотворения in vitro или интрацитоплазматической инъекции сперматозоида. Также предложена индикаторная полоска и применение индикаторной полоски для определения фертильности сперматозоидов млекопитающего. Группа изобретений обеспечивает возможность быстрого и легкого проведения экспресс-анализа функции сперматозоидов любым человеком. 3 н. и 12 з.п. ф-лы, 14 ил.
Реферат
Изобретение относится к способу и экспресс-анализу для определения фертильности сперматозоидов млекопитающих, преимущественно сперматозоидов человека. Фертильность сперматозоидов определяют путем обнаружения протеинов протамина-1 и протамина-2 и представления соотношения между протамином-1 и протамином-2 (соотношения протамин/протеин). Соотношение протамин/протеин коррелирует с фертильностью сперматозоидов.
Указанный способ и экспресс-анализ применяют для прогнозирования успешности искусственного оплодотворения яйцеклетки.
Аббревиатуры и определения
ДНК (DNA) - дезоксирибонуклеиновая кислота.
ИФА (ELISA (Enzyme-linked Immunosorbent Assay) - иммуноферментный анализ.
Испытуемая проба. Испытуемая проба - это биологический материал обследуемого индивидуума мужского пола, подходящий для определения фертильности сперматозоидов. В частности испытуемая проба представляет собой эякулят, ткань яичка или придатка яичка, содержащие сперматозоиды или сперматиды. Для определения фертильности осуществляют обнаружение в исследуемой пробе протеинов протамин-1 и протамин-2 и представление соотношения между протамином-1 и протамином-2 (соотношения протамин/протеин), которое коррелирует с фертильностью сперматозоидов.
Гистоны - протеины в клеточном ядре эукариотов, которые в качестве составной части хроматина играют значительную роль при упаковке ДНК.
ИКСИ (ICSI: Intracytoplasmatic Sperm Injection) - интрацитоплазматическая инъекция сперматозоида (способ искусственного оплодотворения яйцеклетки).
ME (IU) - международная единица.
ЭКО (IVF) - экстракорпоральное оплодотворение (способ искусственного оплодотворения яйцеклетки).
Мл - миллилитр.
Ммоль - миллимоль.
иРНК (Messenger RNA) - информационная РНК (транскрипция РНК относящегося к гену участка нити ДНК).
Последовательность нуклеотидов - последовательность нуклеотидов любой нуклеиновой кислоты, например ДНК или РНК.
Р-1 - протеин протамин-1.
Р-2 - протеин протамин-2.
ПЦР (PCR) - полимеразная цепная реакция (способ размножения последовательностей нуклеотидов in vitro).
Протамины - протеины, богатые аргинином, в ядре клетки сперматозоидов млекопитающих (включая человека), которые замещают гистоны в поздней гаплоидной фазе сперматогенеза.
Соотношение протамин/иРНК - отношение количества иРНК протамина-1 к количеству иРНК протамина-2 в исследуемой пробе.
Соотношение протамин/протеин - отношение количества протамина-1 к количеству протамина-2 в исследуемой пробе. Соотношение протамин/протеин 1:1 является указанием на позитивную фертильность сперматозоидов или сперматид в исследуемой пробе. В соответствии с изобретением значения соотношения протамин/протеин, находящиеся в диапазоне от 0,8 до 1,2 также указывают на позитивную фертильность сперматозоидов или сперматид в исследуемой пробе.
РНК (RNA) - рибонуклеиновая кислота. Об/мин - оборотов в минуту.
Сперматогенез - размножение и дифференциация мужских половых клеток в яичках, приводящее к возникновению сперматозоидов.
Сперматиды - клетки-предшественники сперматозоидов.
ТЭС (TESE) - тестикулярная экстракция сперматозоидов (извлечение ткани из яичка для получения сперматидов или сперматозоидов).
Описание области изобретения
Для оплодотворения яйцеклетки необходимы фертильные сперматозоиды. Поскольку невозможность реализовать желание иметь детей может быть связана с недостаточной фертильностью сперматозоидов, большое внимание в медицине и ветеринарии уделяется диагностике фертильности сперматозоидов. При применении способа искусственного оплодотворения яйцеклетки, необходимым условием является предвариательное определение фертильности используемых сперматозоидов.
В ходе сперматогенеза ДНК-связывающие гистоны заменяются протаминами. Человек имеет два разных протамина, которые обозначают как протамин-1 (Р-1) и протамин-2 (Р-2). Определение протаминов могут осуществить в пробах ткани яичка или эякулята.
Качественное определение протаминов в пробах ткани яичка указывает на наличие сперматозоидов и служит в качестве прогностического фактора при тестикулярной экстракции сперматозоидов (ТЭС).
Количественное определение протаминов в пробах ткани яичка или эякулята дает информацию о вероятности фертильности имеющихся сперматозоидов. Как ни удивительно, надежным прогностическим признаком успеха последующего оплодотворения in vitro или интрацитоплазматической инъекции сперматозоида является, прежде всего, величина отношения протамина-1 к протамину-2 (например, определенная косвенным образом как соотношение протамин/иРНК). Определение протаминов для оценки фертильности сперматозоидов специфично, так как протамины встречаются только в мужских гаплоидных половых клетках (и, следовательно, в том числе в сперматозоидах). В настоящее время известны различные способы для определения фертильности сперматозоидов, прежде всего сперматозоидов человека.
Уровень техники
Известным методом определения фертильности сперматозоидов прежде всего является анализ эякулята, например, в соответствии с критериями ВОЗ. В ходе указанной процедуры, помимо прочего, оценивают абсолютное количество сперматозоидов в единице объема, а также морфологию и подвижность сперматозоидов. Недостаток этого способа заключается в том, что такой анализа эякулята не позволяет получить прогностические факторы успеха искусственного оплодотворения яйцеклетки. Кроме того, для осуществления этого способа требуется специальное лабораторное оборудование, и проводить исследования этим способом могут только подготовленные специалисты.
Еще одним подобным способом является гистологическое исследование пробы ткани яичка, при котором оценивают наличие и морфологию сперматозоидов в ткани яичка. Недостатком подобного способа явлется то, что на основании такого гистологического исследования невозможно сделать заключение о нормальном функционировании имеющихся сперматозоидов, которые часто функционируют ненормально, несмотря на то, что морфология свидетельствует об обратном. Этот способ не позволяет дать надежную оценку потенциальной фертильности имеющихся сперматозоидов или прогнозировать успех искусственного оплодотворения яйцеклетки. К тому же оценка морфологии сперматозоидов сильно зависит от опыта исследователя, что не позволяет ее стандартизировать. Осуществление этого способа требует специального лабораторного оборудования и привлечения квалифицированного персонала, вследствие чего способ не может быть осуществлен любым человеком в любом месте.
Другой подход к определению фертильности сперматозоидов был описан авторами настоящего изобретения (Штегер и др. "Репродукция человека" (Steger et al., 2007, Human Reproduction)). Этот способ основан на определении иРНК, в частности на определении иРНК протамина-1 и определении иРНК протамина-2, которые сравнивают, рассматривая так называемое соотношение протамин/иРНК. Величина соотношения протамин/иРНК позволяет получить инфрмацию о фертильности сперматозоидов, однако этому способу также присущи существенные недостатки, поскольку он представляет собой специальный лабораторный способ, который из-за чувствительности РНК и ее быстрой деградации требует особой чистоты при изоляции и обработке и может быть осуществлен с возможностью воспроизведения только хорошо подготовленным персоналом с применением специальных приборов для ПЦР-анализа. При реализации этого способа часто возникают ошибки, кроме того он требует сравнительно больших затрат времени, является дорогостоящим и, в общем, не является простым способом, который может быть осуществлен любым человеком и в любом месте.
Задача изобретения
В связи с вышеизложенным задача настоящего изобретения заключается в том, чтобы предложить быстро осуществимый, стандартизируемый и недорогой способ надежного определения фертильности сперматозоидов, который может быть выполнен любым человеком в любом месте и, таким образом, не требует наличия специальных знаний или специального лабораторного оборудования. Задача изобретения заключается также в том, чтобы предложить устройство для экспресс-анализа, позволяющее осуществить предлагаемый способ.
Сущность изобртения
В соответствии с изобретением указаная задача решена путем использования иммунологического метода, посредством которого определяют соотношение протамин/протеин, а также посредством устройства для экспресс-анализа, позволяющего осуществить указанный способ.
Было установлено и подтверждено медицинскими методами, что в пробах, содержащих сперматозоиды или сперматиды здоровых мужчин, значение соотношения протамин/протеин, то есть количественная взаимосвязь между протамином-1 и протамином-2, равное 1:1, свидетельствует о нормальной фертильности сперматозоидов.
Это также действительно в случае некоторого допуска: если в пробах, содержащих сперматозоиды или сперматиды, соотношение протамин/протеин составляет не 1:1, а 0,8-1,2 протамина-1 к 0,8-1,2 протамина-2. Напротив, если в пробах, содержащих сперматозоиды или сперматиды, наблюдается другое соотношение протамин/протеин, то это указывает на пониженную фертильность, вплоть до инфертильности сперматозоидов или сперматид в исследуемой пробе. В таком случае эти сперматозоиды для последующего оплодотворения in vitro или интрацитоплазматической инъекции сперматозоида не применяют.
Многочисленные экспериментальные исследования, проведенные авторами изобретения с разными исследуемыми пробами человека, свидетельствуют о том, что соотношение протамин/протеин, т.е. количественное отношение протамина-1 к протамину-2, является надежным прогностическим признаком успеха последующего оплодотворения in vitro или интрацитоплазматической инъекции сперматозоида. В соответствии с изобретением определение соотношения протамин/протеин в сперматозоидах или сперматидах осуществляют специфическим способом и с использованием метода ИФА или экспресс-анализа.
Для этого исследуемую пробу подходящим способом обрабатывают так, что из сперматозоидов или сперматид выделяют протеины, в частности протамин-1 и протамин-2, так чтобы они были свободно доступными, и их могли обнаруживать по-отдельности иммунологическим методом. Затем следует качественное и количественное определение протамина-1 и протамина-2 и определение соотношения протамин/протеин, в частности при помощи метода ИФА или посредством экспресс-анализа. Для осуществления метода ИФА один образец подготовленной пробы вводят в контакт с антителом, специфически направленным против протамина-1 (антителом анти-протамин-1), а другой образец подготовленной пробы вводят в контакт с антителом, специфически направленным против протамина-2 (антителом анти-протамин-2). Если в исследуемой пробе имеется протамин-1 и/или протамин-2, то происходит соединение между протамином-1 и соответствующим антителом анти-протамин-1 и/или между протамином-2 и соответствующим антителом анти-протамин-2. Такое соединение могут визуализировать и количественно определить посредством цветной реакции, возникающей при контакте со вторичным антителом, эпитоп которого специфически соединяется с антителом анти-протамин-1 и антителом анти-протамин-2.
Визуализацию соединения при помощи вторичного антитела осуществляют посредством ферментативной или физической цветной реакции.
Определяют и сравнивают интенсивность цветной реакции в образцах протамина-1 и протамина-2, в результате получают соотношение протамин/протеин (отношение количества протамина-1 к количеству протамина-2). Это соотношение протамин/протеин является надежным прогностическим признаком успеха последующего оплодотворения in vitro или интрацитоплазматической инъекции сперматозоида. Если соотношение протамин/протеин в сперматозоидах или сперматидах исследуемой пробы составляет 0,8-1,2 протамина-1 к 0,8-1,2 протамина-2, предпочтительно 1:1, то это означает, что фертильность сперматозоидов нормальная, и их могут применить для последующего оплодотворения in vitro или интрацитоплазматической инъекции сперматозоида. Напротив, если наблюдается другое соотношение, то это указывает на пониженную фертильность, вплоть до инфертильности сперматозоидов или сперматид в исследуемой пробе. Эти сперматозоиды для последующего оплодотворения in vitro или интрацитоплазматической инъекции сперматозоида не применяют.
Предложенный способ является первым способом, обеспечивающим возможность быстрого, надежного, стандартизируемого и недорогого определения фертильности сперматозоидов и, таким образом, представляет собой существенное усовершенствование в области определения фертильности сперматозоидов и сперматид в исследуемой пробе.
Приготовление исследуемой пробы предусматривает следующие шаги:
- получение сперматозоидов из исследуемой пробы и повышение их концентрации;
-деконденсацию плотных соединений ДНК, гистонов и протаминов в сперматозоидах с целью выделения протеинов, в частности протамина-1 и/или протамина-2;
- лизис клеток.
В частности получение и увеличение концентрации сперматозоидов из исследуемой пробы, например, из эякулята, ткани придатка яичка или ткани яичка, осуществляют, например, посредством седиментации или центрифугированием.
Деконденсацию плотных соединений ДНК, гистонов и протаминов в сперматозоидах исследуемой пробы осуществляют, например, посредством инкубации с подходящим буфером, который, например, содержит детергенты или ферменты, с выделением протеинов, в частности протамина-1 и/или протамина-2.
Альтернативно в пробе определяют общее содержание протеинов в деконденсированных сперматозоидах, с тем, чтобы установить определенную концентрацию протеинов, например, одним из известных специалисту методов, к примеру, методом Бредфорд, методом Лоури или биуретовым методом.
Нижеприведенные примеры включают особенно предпочтительные примеры осуществления предложенного изобретения, не ограничивающие его объем.
Примеры осуществления изобретения
1. Приготовление исследуемой пробы
Получение сперматозоидов из исследуемой пробы, например, из пробы эякулята, осуществляют, например, посредством центрифугирования всего объема эякулята (для человека этот объем варьирует от 0,5 до 6 мл) в подходящем сосуде при 2000-5000 об/мин, в результате чего получают концентрированный осадок в виде сперматозоидов.
Деконденсацию плотных соединений ДНК, гистонов и протаминов в сперматозоидах осуществляют, например, посредством ресуспендирования осадка сперматозоидов, оставшегося после центрифугирования, с применением буфера для деконденсации, например, 25 ммоль DTT (1,4-дитиотреитол; компании Roche), 0,2% TritonX-100 (компании Sigma), 200 ME гепарина на один мл (гепарин натрий 5000 единиц компании Ratiopharm) в фосфатно-солевом буферном растворе (PBS), например, с 2 мл буферного раствора. Причем инкубацию осуществляют до тех пор, пока ядро сперматозоида будет оставаться целым, несмотря на сильное разбухание головок сперматозоидов, что могут определить, например, посредством наблюдения через микроскоп. Предпочтительно время инкубации составляет от 5 до 30 минут (в зависимости от пробы эякулята). Затем эту суспензию с деконденсированными сперматозоидами промывают, например, с добавлением промывочного буфера (например, фосфатно-солевого буферного раствора с ингибитором протеазы), при этом, промывку осуществляют, предпочтительно, до двух раз. Для этого предпочтительно применяют от 100 до 1000 мкл промывочного буфера, каждый раз производя центрифугирование до осаждения сперматозоидов, например, в течение от 5 до 15 минут при скорости 500-4000 об/мин. Осадок, содержащий сперматозоиды, ресуспендируют при помощи промывочного буфера объемом от 100 до 1000 мкл.
Затем осуществляют лизис клеток, например, посредством циклов замораживания и оттаивания. После этого суспензию с деконденсированными сперматозоидами обрабатывают, например, в течение 5-20 минут в ультразвуковой ванне, а затем в течение 15-60 секунд на льду в ультразвуковом дезинтеграторе при мощности от 20 до 60%.
Определение общего содержания протеинов в суспензии, содержащей деконденсированные сперматозоиды, осуществляют, например, одним из известных специалисту методов, например, методом Бредфорд, методом Лоури или биуретовым методом.
Затем суспензию, содержащую деконденсированные сперматозоиды, при помощи буфера для разбавления (например, фосфатно-солевого буферного раствора с ингибитором протеазы) доводят до соответствующей концентрации протеинов, например, 0,1 мкг/мл, 0,25 мкг/мл, 0,5 мкг/мл, 1,0 мкг/мл, 2,5 мкг/мл, 5,0 мкг/мл, 10,0 мкг/мл и/или 20 мкг/мл.
Для осуществления экспресс-анализа, приготавливают исследуемую пробу, для чего эякулят разжижают, инкубируя его при комнатной температуре в течение 15-60 минут, смешивают с буфером для деконденсации и инкубируют в течение 5-30 минут, получая суспензию, содержащую деконденсированные сперматозоиды. Лизис клеток осуществляют посредством добавления буфера для лизиса, например, 20 ммоль Трис-HCl (рН 7,5, 150 ммоль NaCl, 1 ммоль Na2 EDTA (динатриевая соль этилендиаминтетрауксусной кислоты), 1 ммоль этиленгликольтетрауксусной кислоты, 1% тринитротолуола, 2,5 ммоль пирофосфата натрия, 1 ммоль бета-глицерофосфата, 1 ммоль Na3VO4,1 мкг/мл лейпептина).
Альтернативно применяют необработанную исследуемую пробу, например, эякулят.
Верхнее предельное значение концентрации протаминов при использовании экспресс-анализа рассчитано таким образом, чтобы обеспечить возможность измерения даже таких проб эякулята, которые содержат 200 млн. сперматозоидов на один мл. Нижнее предельное значение концентрации протаминов, установленное путем иммуноферментного анализа (ИФА) на протамин, составляет 0,2 млн. сперматозоидов на один мл.
2. Определение концентрации протамина-1 и протамина-2 в исследуемой пробе
2.1 Способ ИФА (косвенный "сендвич-метод")
Исходный материал представляет собой приготовленную исследуемую пробу согласно примеру 1 осуществления изобретения, то есть суспензию, содержащую деконденсированные сперматозоиды и имеющую концентрацию протеинов, например, 0,1 мкг/мл, 0,25 мкг/мл, 0,5 мкг/мл, 1,0 мкг/мл, 2,5 мкг/мл, 5,0 мкг/мл, 10,0 мкг/мл и/или 20 мкг/мл.
Косвенный "сендвич-метод" представляет собой стандартный метод иммуноферментного анализа. При осуществлении этого метода протеины протамин-1 и протамин-2 из исследуемой пробы, приготовленной согласно примеру 1, иммобилизируют на твердой фазе, например, на 96-ячеечном планшете для микротитрования так, чтобы они были распределены как можно более равномерно. К ним добавляют специфические для протамина антитела (антитела анти-протамин-1 или антитела анти-протамин-2). В первой фазе инкубации эти антитела присоединяются к протеинам протамин-1 и протамин-2. При этом работают с двумя отдельными образцами, причем к первому образцу исследуемой пробы добавляют антитело анти-протамин-1, которое связывает протамин-1, а ко второму образцу той же исследуемой пробы добавляют антитело анти-протамин-2, которое связывает протамин-2.
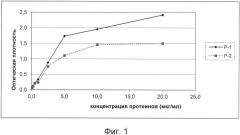
Затем ячейки промывают и в промытые пустые ячейки добавляют конъюгированное с ферментом вторичное антитело, эпитоп которого специфически связывается с антителом анти-протамин-1 и с антителом анти-протамин-2, так что во время второго шага инкубации вторичное антитело специфически присоединяется к фиксированным антителам. Несвязанные молекулы, протеины и антитела удаляют из ячеек в процессе следующего шага промывки. Затем в ячейки добавляют субстрат.В частности добавляют субстрат, который может преобразовываться в цветную реакцию ферментом конъюгированного с ферментом вторичного антитела, например, хромогенный ТМБ (тетраметилбензидиновый) субстрат. Сам по себе бесцветный субстрат благодаря связанному в ячеках конъюгату фермента переходит в цвет, например, в синий цвет. Цветную реакцию останавливают посредством добавления стоп-реагента так, что синий цвет переходит, например, в желтый цвет.Интенсивность желтой цветной реакции измеряют спектрофотометрическим методом, например, при длине волны 450 нм, причем интенсивность цвета пропорциональна концентрации связанных в ячейках антител анти-протамин-1 и антител анти-протамин-2.
Предпочтительно приготовленную пробу пипетируют в планшет для микротитрования в объеме 100 мкл на ячейку и инкубируют так, что протеины протамин-1 и протамин-2 связываются с поверхностью. Остаток жидкости удаляют из планшета для микротитрования путем выколачивания, после чего смешивают с блокирующим раствором (например, используют имеющийся на рынке блокирующий раствор с казеином) и также инкубируют.Блокирующий раствор предназначен для насыщения свободных мест связывания на связанной с протамином поверхности планшета для микротитрования. Таким образом, предотвращают образование на поверхности неспецифических соединений, уменьшают фон и повышают чувствительность способа. Планшет для микротитрования промывают промывочным раствором (например, применяют имеющийся на рынке промывочный раствор на основе трис-гидроксиметиламинометана, содержащий эмульгатор Tween и 350 ммоль NaCl, 10-кратный концентрат). В результате операций промывки удаляют несвязанные и избыточные компоненты, которые могли бы помешать осуществлению процедуры ИФА. Моноклональные антитела анти-протамин-IgG (например, предлагаемые компанией SHAL Technologies) при помощи буфера (например, Sample Buffer, компании Candor) доводят до концентрации 1 мг/мл (1:2100). В ячейки планшета для микротитрования пипетируют по 100 мкл этого раствора и инкубируют, например, в течение 90 минут при температуре 37°C.
Затем планшет для микротитрования промывают промывочным буфером (например, применяя имеющийся на рынке буфер), например, три раза по 200 мкл промывочного буфера на каждую ячейку, каждый раз в течение 10 секунд.
Вторичные антитела, сопряженные с пероксидазой хрена (HRP) (антимышиные антитела IgG компании KPL) при помощи буфера (LowCross компании Candor) доводят до концентрации 1 мг/мл (1:1000). В ячейки планшета для микротитрования пипетируют по 100 мкл этого раствора и инкубируют, например, в течение 60 минут при температуре 37°C. Затем планшет для микротитрования промывают, например, три раза, используя по 200 мкл промывочного буфера (промывочный буфер Tris компании Candor) на каждую ячейку, каждый раз в течение 5 минут.
В ячейки добавляют по 100 мкл тетраметилбензидинового субстрата и инкубируют в темноте в течение 5 минут. Затем в качестве стоп-реагента в ячейки добавляют по 100 мкл H2SO4 и измеряют экстинкцию (оптическую плотность) проб при длине волны 450 нм.
На фиг.1 показана оценка значений оптической плотности при концентрации протеинов протамин-1 и протамин-2 0,1 мкг/мл, 0,25 мкг/мл, 0,5 мкг/мл, 1,0 мкг/мл, 2,5 мкг/мл, 5,0 мкг/мл, 10,0 мкг/мл и/или 20 мкг/мл.
2.2 Способ ИФА (конкурентный метод)
Альтернативно, способ ИФА могут осуществить с применением конкурентного метода.
Исходный материал представляет собой приготовленную исследуемую пробу согласно примеру 1, то есть суспензию, содержащую деконденсированные сперматозоиды и имеющую стандартизированную концентрацию протеинов, например, 0,1 мкг/мл, 0,25 мкг/мл, 0,5 мкг/мл, 1,0 мкг/мл, 2,5 мкг/мл, 5,0 мкг/мл, 10,0 мкг/мл и/или 20 мкг/мл.
Для этого протеины протамин-1 и протамин-2, например, в виде рекомбинантных протеинов с определенной концентрацией, например, 0,1 мкг/мл, 0,25 мкг/мл, 0,5 мкг/мл, 1,0 мкг/мл, 2,5 мкг/мл, 5,0 мкг/мл, 10,0 мкг/мл и/или 20 мкг/мл отдельно друг от друга связывают с поверхностью планшета для микротитрования и инкубируют.
Из планшета для микротитрования путем выколачивания удаляют остаточную жидкость и блокируют неспецифические соединения, например, посредством инкубации в течение 30 минут при температуре 37°C, применяя в каждой ячейке по 300 мкл блокирующего раствора (компании Candor). Затем планшет для микротитрования промывают, например, применяя по 200 мкл промывочного буфера (промывочного буфера Tris фирмы Candor) на каждую ячейку, каждый раз в течение 10 секунд.
Экстракт пробы смешивают с соответствующим количеством моноклональных антител анти-протамин-lgG и инкубируют, например, при температуре +4°C, причем для протеинов протамин-1 и протамин-2 предусмотрены два отдельных образца.
Кроме того, параллельно может быть получена стандартная кривая с использованием определенных концентрацией протамина-1 и протамина-2. Для этого оба рекомбинантных протеина (Р-1 и Р-2) доводят до по меньшей мере трех разных концентраций и смешивают с соответствующими антителами анти-протамин, то есть образец протамина-1 смешивают с антителом анти-протамин-1, а образец протамина-2 смешивают с антителом анти-протамин-2.
В каждую ячейку пипетируют по 100 мкл этого раствора экстракта пробы и антител и инкубируют, например, в течение 90 минут при температуре 37°C. Затем планшет для микротитрования промывают, например, три раза, используя каждый раз по 200 мкл промывочного буфера (промывочный буфер Tris компании Candor) на каждую ячейку, каждый раз в течение 10 секунд.
Вторичные антитела, сопряженные с пероксидазой хрена (антимышиные антитела IgG фирмы KPL) при помощи буфера (LowCross компании Candor) доводят до определенной концентрации (например, 1 мг/мл). В ячейки пипетируют по 100 мкл и инкубируют в течение 60 минут при температуре 37°C. Затем планшет для микротитрования промывают; например, три раза по 5 минут, используя каждый раз по 200 мкл промывочного буфера (промывочный буфер Tris компании Candor) на каждую ячейку.
В ячейки пипетируют по 100 мкл тетраметилбензидинового субстрата и инкубируют в темноте. Затем при помощи пипетки в каждую ячейку добавляют 100 мкл стоп-реагента H2SO4, и экстракт пробы измеряют на планшете для микротитрования при длине волны 450 нм.
При таком конкурентном методе ИФА интенсивность сигнала обратно пропорциональна количеству антигенов (протамина-1 или протамина-2) в пробе. Это означает, что, чем больше свободного протамина содержит экстракт пробы, тем меньше антител связываются со связанным на планшете для микротитрования рекомбинантным протамином. При помощи соответствующих стандартных кривых протамина-1 и протамина-2 для каждой исследуемой пробы рассчитывают точную концентрацию протамина-1 и протамина-2. Затем на основе полученных данных подсчитывают соотношение протамин/протеин, после чего могут судить о потенциальной мужской фертильности и успехе оплодотворения in vitro.
2.3 Экспресс-анализ
Альтернативно предлагаемый способ определения фертильности сперматозоидов, преимущественно сперматозоидов человека, осуществляют, применяя экспресс-анализ на индикаторной полоске. Экспресс-анализ может быть выполнен в любом месте любым человеком, не обладающий специальными знаниями, и не требует дорогого лабораторного оборудования. Результат, говорящий о наличии или отсутствии фертильности, могут оценить быстро и без затруднений.
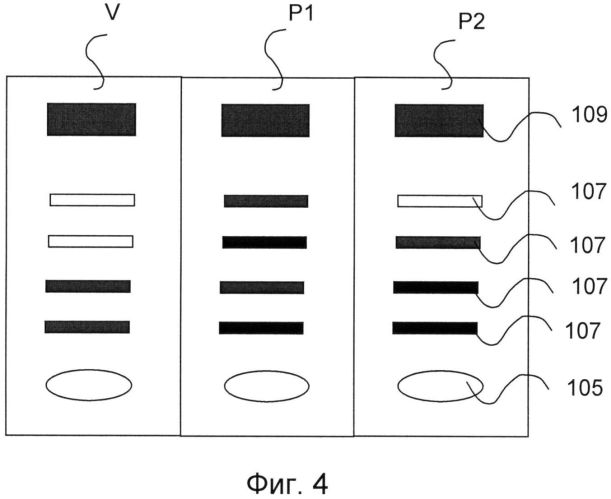
При помощи такого экспресс-анализа обнаруживаемые протеины протамин-1 и протамин-2 впервые в каждом случае оценивают отдельно как качественно, так и количественно. Эта оценка включает простое визуальное отображение количественного соотношения между протеинами протамин-1 и протамин-2, например, в цветных реакциях в полях 107, которые видны невооруженным глазом, обеспечивая, таким образом, возможность непосредственно сделать вывод о потенциальной мужской фертильности.
В соответствии с предложенным изобретением, индикаторная полоска, предпочтительно, имеет подложку 101 из подходящего материала, например, из нейлона. Подложка 101 имеет квадратную или округлую форму, предпочтительно прямоугольную форму.
Предпочтительно предлагаемая индикаторная плоска имеет длину по меньшей мере 4 см и ширину от 3 до 5 мм на одну зону, предпочтительно 4 мм.
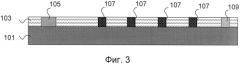
Подложка 101 покрыта подходящим материалом, например, ацетилцеллюлозой или нитроцеллюлозой, так что получается слой 103 нанесения, имеющий толщину несколько мкм, образующий плоскую наружную поверхность (как показано на фиг.3). Индикаторная полоска содержит несколько зон, в частности зону V для предварительного анализа на сперматозоиды, при котором определяют подходящую для экспресс-анализа концентрацию. Кроме того, она содержит зоны Р1 и Р2 для экспресс-анализа на протамины. Зона Р1 предназначена для специфического определения антигена протамина-1, зона Р2 - для специфического определения антигена протамина-2.
Слой 103 нанесения представляет собой непрерывный слой, проходящий через зоны V, Р1 и Р2.
Каждая зона V, Р1 и Р2 имеет поля, расположенные на слое 103 нанесения, а именно в каждом случае поле 105 для нанесения исследуемой пробы, по меньшей мере одно поле 107 и поле 10, представляющее собой контрольное поле.
В соответствии с предпочтительным вариантом изобретения, индикаторная полоска, кроме того, имеет поле 104, состоящее из впитывающего материала, например, силикагеля, благодаря чему поддерживается и ускоряется диффузия материала исследуемой пробы вдоль полей. Поглощающее поле 104 находится на краю индикаторной полоски, за полем 109, так что поддерживается и ускоряется диффузия исследуемой пробы из поля 105 через по меньшей мере одно поле 107 к полю 109.
Поле 104 проходит непрерывно по зонам V, Р1 и Р2 (как показано на фиг.7). Альтернативно, для каждой зоны V, Р1 и Р2 выполнены отдельные поля 104 (как показано на фиг.12, 13 и 14).
2.3.1. Предварительный анализ на сперматозоиды Устройство
Предварительный анализ на сперматозоиды осуществляют в зоне V индикаторной полоски. Данный анализ представляет собой полуколичественный предварительный анализ для определения концентрации сперматозоидов в исследуемой пробе, например, в лизате образца эякулята.
На основании результатов предварительного анализа на сперматозоиды исследуемую пробу либо применяют без изменений для экспресс-анализа на протамин, либо при помощи буфера для разбавления соответствующего объема доводят до определенной концентрации сперматозоидов, а затем применяют для экспресс-анализа на протамин.
Предварительный анализ на сперматозоиды содержит в поле 105 антитела, направленные против поверхностных антигенов сперматозоидов. Предпочтительно поле 105 содержит смесь, состоящую из маркированных коллоидным золотом антител против поверхностных антигенов сперматозоидов и немаркированных антител против поверхностных антигенов сперматозоидов.
После нанесения исследуемой пробы в поле 105, содержащиеся в ней сперматозоиды связываются антителами, направленными против поверхностных антигенов сперматозоидов с формированием комплексов, состоящих из поверхностных антигенов сперматозоидов и направленных против них антител. Благодаря маркировке коллоидным золотом такой комплекс виден для человеческого глаза, как цветная реакция, например, как красное окрашивание.
Между полем 105 и контрольным полем 109 на индикаторной полоске имеется по меньшей мере одно поле 107, предпочтительно несколько расположенных друг за другом полей, например, от двух до десяти, особенно предпочтительно четыре поля 107 (как показано на фиг.2). На фиг.13 проиллюстрирован альтернативный вариант осуществления изобретения, в соответствии с которым имеются три поля 107. На фиг.14 проиллюстрирован еще один альтернативный вариант осуществления изобретения, в соответствии с которым имеются пять полей 107.
Поля 107 расположены на одинаковом расстоянии друг от друга. В соответствии с альтернативным вариантом расстояния между полями могут отличаться друг от друга. Поля 107 содержат немаркированные антитела против комплексов, состоящих из поверхностных антигенов сперматозоидов и направленных против них антител.
Альтернативно, поля 107 содержат различные количества антител против комплексов, состоящих из поверхностных антигенов сперматозоидов и направленных против них антител, в результате чего имеет место разная чувствительность определения.
Предпочтительно, поле 107, ближе всего расположенное к контрольному полю 109, имеет наибольшую концентрацию антител против комплексов, состоящих из поверхностных антигенов сперматозоидов и направленных против них антител.
Количество антител, направленных против комплексов, состоящих из поверхностных антигенов сперматозоидов, связанных с антителами, направленными против указанных антигенов, имеющимися в полях 107, уменьшается в направлении поля 107, наиболее удаленного от контрольного поля 109.
Контрольное поле 109 в зоне V содержит немаркированные антитела против маркированных коллоидом поверхностных антигенов сперматозоидов, оно предназначено для контроля достоверности теста.
Процедура в зоне V
Исследуемую пробу, приготовленную в соответствии с примером 1, например, пробу эякулята в соответствующем объеме, например, не менее 50 мкл, наносят на поле 105 зоны V. Альтернативно, индикаторную полоску погружают в исследуемую пробу так, что полностью исследуемой пробой смачивают только поле 105 зоны V.
Предпочтительно исследуемую пробу, например, эякулят, предварительно инкубируют до разжижения, предпочтительно в течение 30 минут при комнатной температуре.
Если в исследуемой пробе имеются сперматозоиды, сперматозоиды соединяются с маркированным коллоидным золотом и немаркированным антителами против поверхностных антигенов сперматозоидов, уже имеющихся в поле 105, с формированием маркированных и немаркированных комплексов, состоящих из поверхностных антигенов сперматозоидов и направленных против них антител. Маркированные коллоидным золотом комплексы вызывают на поле 105 видимую для человеческого глаза цветную реакцию, в частности красное окрашивание.
Исследуемая проба с образованными в ней маркированными коллоидным золотом и немаркированными комплексами, состоящими из поверхностных антигенов сперматозоидов связанных с направленными против них антителами, мигрирует посредством диффузии вдоль индикаторной полоски в зоне V и достигает одного за другим полей 107 и контрольного поля 109.
В полях 107 образованные маркированные коллоидным золотом и немаркированные комплексы, состоящие из поверхностных антигенов сперматозоидов и направленных против них антител, входят в контакт с уже имеющимися немаркированными антителами против указанных образованных комплексов и в контакт с антителами против поверхностных антигенов сперматозоидов. В зависимости от концентрации сперматозоидов в пробе, в полях 107 соединение этого антитела с образованными комплексами становится видимым как цветная реакция либо в нескольких, либо во всех полях 107 (как показано на фиг.4-7), либо ни в одном поле, так что по количеству полей 107 с цветной реакцией могут судить о концентрации сперматозоидов в пробе.
Наличие цветных реакций в разном количестве полей 107 индикаторной полоски в зоне V указывает на концентрацию сперматозоидов в исследуемой пробе.
Если в зоне V положительная цветная реакция имеет место в по меньшей мере одном, но не во всех полях 107, это означает, что концентрация сперматозоидов в исследуемой пробе оптимальна и составляет от 0,2 до 200 млн. сперматозоидов на мл. Таким образом, эту исследуемую пробу могут без дальнейших изменений применить в экспресс-анализе на протамин в зонах Р1 и Р2.
Если ни в одном из полей 107 зоны V не присутствует положительная цветная реакция, это означает, что концентрация сперматозоидов в исследуемой пробе слишком низка, и исследуемая проба в таком виде не подходит для осуществления анализа, и необходимо предварительно повысить ее концентрацию.
Если в зоне V положительная цветная реакция имеет место во всех полях 107, это означает, что концентрация сперматозоидов в исследуемой пробе слишком высока, и рекомендуется разбавление исследуемой пробы, чтобы достигалась оптимальная концентрация сперматозоидов от 0,2 до 200 млн. сперматозоидов на мл. Предпочтительно разбавление осуществляют при помощи буфера для разбавления.
Предпочтительно определение концентрации сперматозоидов в исследуемой пробе в зоне V завершают спустя 10 минут.
Альтернативно концентрацию сперматозоидов в исследуемой пробе, например, в пробе эякулята, определяют фотометрическим методом, а затем при необходимости доводят до оптимальной концентрации сперматозоидов от 0,2 до 200 млн. сперматозоидов на мл.
Оценка предварительного анализа на сперматозоиды
При оценке предварительного анализа на спермато