Замещенный бисдипептид с нейропротективным и антидепрессивным эффектом
Иллюстрации
Показать всеИзобретение относится к области биологически активных соединений и относится к новому дипептиду формулы, (CH3CO-L-Ser-L-Lys-NH-(CH2)3-)2, обладающему нейропротективной и антидепрессивной активностями, его способу получения, фармацевтическим композициям и методу лечения депрессии и нейродегенеративных заболеваний. 5 н. и 1 з.п. ф-лы, 2 табл., 1 ил., 2 пр.
Реферат
Область изобретения
Изобретение относится к новому биологически активному дипептиду формулы:
(CH3CO-L-Ser-L-Lys-NH-(CH2)3-)2
Новое соединение представляет собой димерный дипептидный миметик мозгового нейротрофического фактора (BDNF) и обладает нейропротективной и антидепрессивной активностями.
Уровень техники
Мозговой нейротрофический фактор (Brain derived neurotrophic factor, BDNF) относится к семейству нейротрофинов, которое включает также фактор роста нервов, нейротрофин-3, нейротрофин-4/5. Основными мишенями BDNF являются дофаминергические нейроны черной субстанции, холинергические нейроны переднего мозга, серотонинергические нейроны коры, ГАМК-ергические нейроны стриатума. BDNF регулирует развитие и выживаемость нейронов, синаптическую пластичность и другие важные функции центральной нервной системы. Дезрегуляция BDNF вовлечена в патогенез многих нейродегенеративных заболеваний, включая болезни Паркинсона, Альцгеймера, Хантингтона, бокового амиотрофического склероза, а также психических заболеваний, таких как биполярные расстройства, шизофрения и депрессия [Zuccato С., Cattaneo E. Nature reviews. Neurology, Vol. 5, p. 311-322, 2009; Castren E., Rantamaki T. Dev Neurobiol, Vol. 70, №5, p. 289-297, 2010].
Биологическая активность BDNF и других нейротрофинов осуществляется через два типа трансмембранных рецепторов [Dechant G., Rodríguez-Tébar A., Barde Y.A., Prog Neurobiol., Vol. 142, №2, p.347-352, 1994]: высокоаффинный Trk семейства тирозинкиназных рецепторов и низкоаффинный р75 семейства рецептора фактора некроза опухолей. BDNF связывается со специфичным TrkB рецептором, вызывая его димеризацию, аутофосфорилирование и запуск нескольких путей передачи биологического ответа, включая те, которые приводят к нейрональной выживаемости. Напротив, гликопротеин р75 выступает как общий низкоаффинный рецептор для всех нейротрофинов. Полагают, что он вовлечен в регуляцию апоптоза и модуляцию сигнального каскада, связанного с Trk-рецептором.
Благодаря своей способности увеличивать выживаемость нейронов, нейротрофины рассматриваются как перспективные антинейродегенеративные средства. Однако их фармакологическое использование затруднительно. Так, несмотря на многообещающие доклинические данные, клинические испытания BDNF для лечения амиотрофичесокого латерального склероза не увенчались успехом [A controlled trial of recombinant methionyl human BDNF in ALS: The BDNF Study Group (Phase III), Neurology, Vol. 52, p. 1427-1433, 1999]. Отсутствие ожидаемого эффекта объясняется главным образом фармакокинетическими ограничениями, такими как быстрая деградация (период полураспада BDNF в кровотоке у крыс меньше 1 мин), низкая способность проникать через гематоэнцефалический барьер и наличием нежелательных побочных эффектов вследствие полифункциональности.
Поэтому для разработки нейропротекторных лекарственных средств представляется актуальным создание низкомолекулярных функциональных миметиков BDNF, способных активировать сигнальные пути TrkB и лишенных недостатков полноразмерного белка BDNF. В связи с этим ряд исследовательских групп занимаются созданием таких соединений.
Группой американских исследователей под руководством Лонго (Longo F.M.) на основе участка 2-й петли BDNF-Ser-Lys-Gly-Gln-Leu- была сформулировала фармакофорная гипотеза и проведен виртуальный скрининг 35 миллионов описанных соединений, который выявил 1785 соединений - кандидатов. Далее, используя такие критерии, как небольшая молекулярная масса и доступность фармакофорной части для взаимодействия с рецептором, число кандидатов было уменьшено до 7 соединений. После тестирования in vitro на клеточных моделях было отобрано одно соединение на основе 1,3,5-бензолтрикарбоновой кислоты (LM22A-4):
Для этого миметика в тесте in vivo при интраназальном введении была показана способность восстанавливать пространственную память у крыс, нарушенную травмой мозга [Massa S.M., Yang Т., Xie Y., Shi J., Bilgen M., Joyce J.N., Nehama D., Rajadas J., Longo F.M. J. Clin. Investigation, Vol. 120, №5, p. 1774-1785, 2010].
Группой австралийских ученых [Hughes R.A. et al., 2000, PCT WO 00/75176] сконструированы миметики на основе петель BDNF, представляющие собой мономерные моноциклические пептиды с антагонистической активностью in vitro на основе 1-й, 2-й и 4-й петель нейротрофина [Fletcher J.M., Hughes R.A. J. Pept. Sci., Vol. 12, p. 515-521, 2006].
На основе данных о гомодимерной структуре BDNF группой Хьюза (Hughes R.A.) созданы димерные бициклические и трициклические пептиды с агонистической активностью на основе 2-й петли [O′Leary P.D., Huges R.A. J. Biol. Chem., Vol. 278, p. 25738-25744, 2003].
Интересно заметить, что трициклический пептид с более строгим конформационным ограничением показывает in vitro лучший результат - выживаемости сенсорных нейронов цыплят линии Е8-Е10 около 35%. В дальнейшей работе [Fletcher J.M., Morton C.M., Zwar R.A., Murray S.S., O′Leary P.D., Huges R.A. J. Biol. Chem., Vol.283, p.33375-33383, 2008] описывается циклопентапептид - лиганд для р75 рецептора на основе трипептидного фрагмента -Lys-Lys-Arg- 4-й петли BDNF: Cyclo(D-Pro-Ala-Lys-Lys-Arg-). В концентрации 10-6 М миметик усиливал выживаемость сенсорных нейронов (эффект около 38%).
В работе датских ученых [Fobian К., Owczarek S., Budtz С., Bock E., Berezin V., Pedersen M.V. Journal of Neuroscience Research, Vol. 88, p. 1170-1181, 2010] описываются пептидные миметики, сконструированные на основе 3-й и 4-й петель BDNF, которые стимулируют рост нейритов и повышают выживаемость нейронов: Betrofin 3 (RGIDKRHWNSQ) and Betrofin 4 (SYVRALTMDSKKRIGWR). Эти миметики проявляют нейропротективную активность in vitro в концентрациях 10-5-10-6 М.
Группой американских ученых [Cardenas-Aguayo MdC, Kazim S.F., Grundke-Iqbal I., Iqbal K. PLoS ONE, Vol. 8, №1, е53596, 2013] созданы тетрапептидные миметики BDNF, которые обладают нейропротективной активностью in vitro в интервале концентраций 10-6-10-7 М в условиях окислительного стресса, вызванного перекисью водорода.
В патенте РФ №2410392 описан миметик, сконструированный на основе бета-изгиба 4-й петли нейротрофина BDNF, представляющий собой гексаметилендиамид бис-(N-моносукцинил-серил-лизина), (ГСБ-106), обладающий нейропротективной активностью in vitro в интервале концентраций 10-5-10-8 М и антидепрессивной активностью in vivo в дозах 0.1 и 1 мг/кг внутрибрюшинно у крыс.
Как видно из представленного выше обзора миметики BDNF это соединения большей частью пептидной природы, которые могут быть получены методами классического пептидного синтеза в гомогенной фазе. Конденсация в гомогенной фазе может быть выполнена следующим образом:
а) конденсация аминокислоты, имеющей свободную карбоксильную группу и защищенную другую реакционноспособную группу, с аминокислотой, которая имеет свободную аминогруппу и защищенные другие реакционоспособные группы, в присутствии конденсирующего агента такого как карбодиимид;
б) конденсация аминокислоты, имеющей активированную карбоксильную группу и защищенную другую реакционноспособную группу, с аминокислотой, которая имеет свободную аминогруппу и защищенные другие реакционноспособные группы;
в) конденсация аминокислоты, имеющей свободную карбоксильную группу и защищенную другую реакционноспособную группу, с аминокислотой, имеющей активированную аминогруппу и защищенные другие реакционносособные группы.
Карбоксильная группа может быть активирована превращением ее в хлорагидридную, азидную, ангидридную группы или активированный эфир, такой как N-оксисукцинимидный, N-оксибензотриазольный, пентахлорфениловый или паранитрофениловый эфиры. Аминогруппа может быть активирована превращением ее в фосфитамид или «фосфоразным» методом.
Наиболее общими для рассмотренных выше реакций конденсации являются: карбодиимидный метод; азидный метод; метод смешанных ангидридов; метод активированных эфиров. Эти методы описаны в "The Peptides". Vol. 1. 1965 (Academic Press), E. Schroeder, K. Lubke, или в "The Peptides", Vol. 1, 1979 (Academic Press) E. Cross, L. Meinhofen.
Сущность изобретения
Целью нашей работы было получение нового миметика нейротрофина BDNF с нейропротективной и антидепрессивной активностями. Мы нашли, что эта цель может быть достигнута с помощью соединения формулы:
(CH3CO-L-Ser-L-Lys-NH-(CH2)3-)2
гексаметилендиамид бис-(N-ацетил-L-серил-L-лизина), шифр ГТ-106Ас.
Описание изобретения
Получение миметика BDNF ГТ-106Ас.
Были разработаны два способа синтеза заявляемого соединения с использованием Boc/Z- и Z/Boc - стратегий защитных групп.
Способ 1. Boc/Z- стратегия защитных групп.
На первой стадии получают активированные N-оксисукцинимидные эфиры Na-Boc-защищенных серина и лизина, защищенных по боковым функциям бензильной и карбобензокси-группами, соответственно. В качестве конденсирующего агента используют дициклогексилкарбодиимид. Реакции проводят при комнатной температуре в тетрагидрофуране в течение 1-3 часов, продукты получают с выходами 85-90%. На второй стадии конденсируют активированный эфир защищенного лизина с гексаметилендиамином в диметилформамиде в течение 1-2 часов, при этом получают соответствующий продукт с выходом 85-93%. Полученное соединение деблокируют раствором хлористого водорода в диоксане, и получают хлоргидрат гексаметилендиамида Nε-Z-лизина с выходом близким к количественному. На четвертой стадии конденсируют активированный эфир защищенного серина и гексаметилендиамид Nε-Z-лизина в виде свободного амина, полученный с помощью диизопропилэтиламина. Реакцию проводят в диметилформамиде при комнатной температуре в течение 1-3 часов, выход продукта 75-85%. Полученный Вос-защищенный бисдипептид деблокируют раствором газообразного HCl в диоксане, получая кристаллический продукт с выходом 75-80%. На шестой стадии бисдипептид в виде свободного амина вводят во взаимодействие с активированным N-оксисукцинимидным эфиром уксусной кислоты. Реакцию ведут при комнатной температуре в диметилформамиде в течение 4-48 часов. Выход продукта 85-97%. На заключительной стадии удаляют бензильную и карбобензокси-защитные группы гидрогенолизом в токе водорода в метаноле в присутствии 10%-ного палладия на угле в качестве катализатора. Целевой пептид ГТ-106Ас получают с общим выходом около 45%.
Способ 2. Z/Boc - стратегия защитных групп. На первой стадии получают активированные N-оксисукцинимидные эфиры Z/Boc-защищенного лизина, уксусной кислоты и пентафторфениловый эфир Z-серина. В качестве конденсирующего агента используют дициклогексилкарбодиимид. Реакции проводят при охлаждении до +10°С для N-оксисукцинимидных и до 0 - +5°С для пентафторфениловых эфиров. Выход продуктов 90-95%. На второй стадии конденсируют активированный эфир защищенного лизина с гексаметилендиамином в диметилформамиде в течение 5-17 часов, при этом получают соответствующий гексаметилендиамид с выходом 92%. Который деблокируют каталитическим гидрогенолизом с добавкой 10% палладия на угле в метаноле, получая продукт с выходом 96%. На четвертой стадии конденсируют пентафторфениловый эфир Z-серина и гексаметилендиамид Nε-Вос-лизина. Реакцию проводят в диметилформамиде при комнатной температуре в течение 12 часов, выход продукта 96%. Полученный Z-защищенный бисдипептид подвергают каталитическому гидрогенолизу с добавкой 10% палладия на угле в метаноле, получая свободный по альфа-аминогруппе бисдипептид с выходом 98%. На шестой стадии полученное соединение конденсируют с N-оксисукцинимидным эфиром уксусной кислоты. Реакцию ведут при комнатной температуре в диметилформамиде. Выход продукта 77%. На заключительной стадии удаляют трет-бутилоксикарбонильные защитные группы безводной трифторуксусной кислотой в дихлорметане. Общий выход конечного продукта ГТ-106Ас - 57%.
Биологическая активность миметика BDNF ГТ-106Ас.
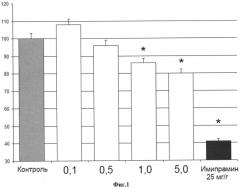
Нейропротективная активность заявляемого соединения была выявлена в тесте in vitro в условиях окислительного стресса в интервале концентраций 10-5-10-8 М. Эффект по выраженности был сопоставим с активность самого нейротрофина BDNF. Антидепрессивная активность была выявлена в in vivo тесте «выученная беспомощность» по Порсолту. В дозах 1-5 мг/кг при внутрибрюшинном введении у мышей наблюдалось достоверное снижение времени иммобильности по сравнению с животными из контрольной группы. Выраженность эффекта ГТ-106Ас (1 мг/кг) составляла около 30% от эффекта трициклического антидепрессанта имипрамина в дозе 25 мг/кг.
Таким образом, дипептид ГТ-106Ас обладает выраженной нейропротективной активностью in vitro и антидепрессивной активностью in vivo.
Примеры
В примерах используются следующие сокращения:
Boc - трет-бутилоксикарбонил
DIEA - диизопропилэтиламин
DCC - дициклогексилкарбодиимид
DCU - дициклогексилмочевина
DMF - диметилформамид
DMAPA - диметиламинопропилендиамин
DMSO - диметилсульфоксид
OSu - оксисукцинил
TFA - трифторуксусная кислота
THF - тетрагидрофуран
Pd/C - наночастицы палладия на поверхности активированного угля
Z - бензилоксикарбонил
(Z(Cl)) - 2-хлорбензилоксикарбонил
ДЦГА - дициклогексиламин
ТСХ - тонкослойная хроматография
ЯМР - ядерный магнитный резонанс
Для определения физико-химических характеристик полученных веществ была использована следующая аппаратура:
температуры плавления определяли на приборе Optimelt MPA100 (Stanford Research Systems, Англия) в открытых капиллярах без корректировки;
удельное оптическое вращение регистрировали на автоматическом поляриметре ADP 440 Polarimeter (Bellingham+Stanley Ltd., Англия);
1Н-ЯМР-спектры регистрировали в шкале 5, м.д., на спектрометре Bruker AC-250 (Германия) в растворах DMSO-d6, используя в качестве внутреннего стандарта тетраметилсилан. Константа спин-спинового взаимодействия J, Гц.
Для обозначения резонансных сигналов использовали следующие сокращения: с -синглет, д - дублет, т - триплет, к - квадруплет, м - мультиплет.
Тонкослойную хроматографию (ТСХ) выполняли на силикагелевых пластинах DC Kieselgel 60 G/F254 (Merck, Германия) в системах растворителей:
хлороформ-метанол, 9:1 (А); диоксан-вода, 9:1 (Б); хлороформ-метанол-вода-уксусная кислота, 15:10:2:3 (В); пиридин-вода-уксусная кислота-этилацетат, 20:11:6:120 (Г); гексан-этилацетат, 4:1 (Д); н-бутанол-уксусная кислота-вода, 4:1:1 (Е); хлороформ-метанол-уксусная кислота, 80:10:1 (Ж); хлороформ-метанол-вода-уксусная кислота, 9:7:2:1 (З); бензол-метанол, 1:4 (И).
Аминосодержащие соединения обнаруживали нингидрином, соединения с амидными группами - в парах йода, соединения с открытой карбоксильной группой - бромкрезоловым зеленым, содержащие ароматические группы - в УФ-лучах.
Очистка растворителей:
Диметилформамид (DMF) - Перегоняют смесь 250 мл диметилформамида, 30 мл бензола и 6 мл воды. Сначала отгоняются бензол, вода, амины, аммиак, затем в вакууме над нингидрином - диметилформамид. Чистый диметилформамид имеет нейтральную реакцию и не обладает запахом. Для более тщательной очистки нагревают диметилформамид 3-4 ч с приблизительно 0,5 г гидрида кальция в атмосфере инертного газа (чистого азота или аргона) в колбе с обратным холодильником. После перегонки в вакууме диметилформамид хранят в атмосфере инертного газа в темноте над молекулярными ситами 4 А. Непрореагировавший гидрид кальция разлагают 70%-ным этанолом (оставляют на несколько часов, затем добавляют несколько капель воды и убеждаются, что при этом не происходит выделение газа).
Диэтиловый эфир, диоксан и THF использовали без дополнительной очистки, однако хранили над твердым NaOH.
Этилацетат, дихлорметан, хлороформ, бензол, ацетон, гексан, метанол и этанол (все х.ч.) использовали без дополнительной очистки.
ПРИМЕР 1. Получение гексаметилендиамида бис-(N-ацетил-L-серил-L-лизина) (ГТ-106Ас) с использованием Boc/Z- стратегии пептидного синтеза
а) Получение N-оксисукцинимидного эфира Nα-трет-бутилоксикарбонил-Nε-2-хлорбензилоксикарбонил-L-лизина, Boc-Lys(Z(Cl))-OSu
К раствору 7.60 г (17.00 ммоль) Boc-Lys(Z(Cl))-OH в 150 мл THF добавляли 2.08 г (18.00 ммоль) N-гидроксисукцинимида, раствор охлаждали до -5°С и в течение 30 мин прикалывали раствор 3.50 г (17.00 ммоль) DCC в 20 мл THF, следя за тем, чтобы температура не превышала 0°С. Затем реакционную массу перемешивали 30 мин при -5°С и 4 ч при комнатной температуре. Выпавший белый осадок DCU отфильтровывали, фильтрат упаривали. Полученное вязкое масло растворяли в 30 мл дихлорметана. Раствор выдерживали 24 ч при 0°С, образовавшийся осадок DCU отфильтровывали, фильтрат упаривали в вакууме. Получали 6.80 г (84%) маслообразного хроматографически гомогенного продукта, Rf 0.40 (А).
б) Получение гексаметилендиамида бис(Nα-трет-бутилоксикарбонил-Nε-2-хлорбензилоксикарбонил-L-лизина), (Boc-Lys(Z(Cl))-NH)2(CH2)6
К раствору 3.50 г (6.80 ммоль) Boc-Lys(Z(Cl))-OSu в 40 мл этилацетата добавляли раствор 0.38 г (3.30 ммоль) гексаметилендиамина в 5 мл этилацетата. Реакционную массу перемешивали в течение 1 ч, затем упаривали, остаток растворяли в 100 мл этилацетата и последовательно промывали 1 н. H2SO4 (50 мл), 3% K2CO3 (50 мл) и водой (2×50 мл), фильтрат сушили Na2SO4, упаривали. Полученный твердый кристаллический осадок сушили в вакууме (15 мм.рт.ст.) над CaCl2. Получали 2.40 г (85%) продукта, Rf 0.45 (А), т.пл. 101-103°С, [ α ] D 20 − 7.3 ° (с 0.5; DMF). Спектр 1Н-ЯМР: 1.29 (8Н, м, 2 СγН2 Lys, -NH(CH2)2CH2CH2(CH2)2NH-), 1.42 (18Н, с, 2-ОС(СН3)3), 1.55 (8Н, м, 2 СδH2 Lys, -NHCH2CH2(СН2)2CH2CH2NH-), 1.79 (4Н, м, 2 СβH2 Lys), 2.96 (4Н, м, 2 CεH2 Lys), 3.20 (4 Н, м, -NHCH2(CH2)4CH2NH-), 4.53 (2Н, м, 2 CαH Lys), 5.34 (4Н, с, 2 CH2C6H4Cl), 7.10 (2Н, д, J 7.8 Гц, 2NH Lys), 7.39 (2Н, т, J 5.7 Гц, 2 NεH Lys), 8.01 (2Н, т, J 4.7 Гц, NH(CH2)6NH).
в) Получение дигидрохлорида гексаметилендиамида бис(Nε-2-хлорбензилоксикарбонил-L-лизина), 2HCl·(Н-Lys(Z(Cl))-NH-)2(СН2)6
К раствору 1.42 г (1.71 ммоль) (Boc-Lys(Z(Cl))-NH)2(CH2)6 в 10 мл диоксана прибавляли 10 мл 4 М HCl в диоксане. По окончании реакции (ТСХ контроль) раствор упаривали досуха и сушили в вакууме над КОН. Полученную пену (затвердевшее масло) не обрабатывая, запускали в следующую стадию. Спектр 1H-ЯМР: 0.95-1.75 (20Н, м, 2 CβγδH2 Lys, -NHCH2(CH2)4CH2NH-), 2.98 (4H, м, -NHCH2(CH2)4CH2NH-), 3.09 (4Н, м, 2 СεH2 Lys), 3.70 (2H, м, 2 CαH Lys), 5.07 (4Н, с, 2-OCH2C6H4Cl), 7.37 (2Н, т, J 4.9, -NH(CH2)6NH-), 7.20-7.45 (8H, м, 2-OCH2C6H4Cl), 8.23 (6H, м, 2 N+H3 Lys), 8.59 (2Н, т, J 6.0, 2 NεH Lys).
г) Получение гексаметилендиамида бис(N-трет-бутилоксикарбонил-О-бензил-L-серил-Nε-хлорбензилоксикарбонил-L-лизина), (Boc-Ser(Bzl)-Lys(Z(Cl))-NH-)2(CH2)6
К раствору 1.13 г (1.44 ммоль) 2 HCl·(H-Lys(Z(Cl))-NH-)2(CH2)6 в 25 мл DMF сначала прибавляли 0.46 мл (2.64 ммоль) DIEA, а затем 2.48 г (2.60 ммоль) Boc-Ser(Bzl)-OSu. Реакционную смесь перемешивали 1 ч, добавляли 0.50 мл DMAPA, перемешивали 15 мин. Реакционную массу разбавляли 150 мл этилацетата, последовательно промывали водой (40 мл), 3% H2SO4 (40 мл), 2% K2CO3 (40 мл) и снова водой (30 мл), сушили Na2SO4 и упаривали. Полученный остаток перекристаллизовывали из МеОН. Получали 1.54 г (85%) продукта в виде белого порошка, Rf 0.40 (A), Rf 0.60 (Б), т.пл. 143-151°С, [ α ] D 20 − 2.5 ° (с 0.4; DMF). Спектр 1Н-ЯМР: 0.93-1.83 (38Н, м, 2 -ОС(СН3)3, 2 CβγδH2 Lys, -NHCH2(CH2)4CH2NH-), 2.93 (8Н, м, 2 CεH2 Lys, -NHCH2(CH2)4CH2NH-), 3.59 (4Н, м, 2 СβH2 Ser), 4.20 (4Н, м, 2 CαH Lys, 2 CαH Ser), 4.47 (4Н, с, 2-ОСН2С6Н5), 5.07 (4Н, с, 2-OCH2C6H4Cl), 7.00 (2Н, д, J 8.1, 2 NH Ser), 7.19-7.50 (20H, м, 2-CH2C6H5, 2-OCH2C6H4Cl, -NH(CH2)6NH-), 7.77 (2Н, т, J 5.8, 2 NεH Lys), 7.91 (2H, J 7.8, 2 NH Lys).
д) Получение дигидрохлорида гексаметилендиамида бис(О-бензил-L-серил-Nε-2-хлорбензилоксикарбонил-L-лизина), 2 HCl·(H-Ser(Bzl)-Lys(Z(Cl))-NH-)2(CH2)6
Растворяли 1.30 г (1.03 ммоль) (Boc-Ser(Bzl)-Lys(Z(Cl))-NH-)2(CH2)6 в 10 мл 4 М HCl в диоксане, перемешивали 40 мин, затем упаривали с диэтиловым эфиром (2×15 мл). Полученное масло затирали под эфиром, кристаллы отфильтровывали и сушили в вакууме (15 мм.рт.ст.) над КОН. Получали 0.89 г (76%) бежевого порошка; т.пл. 146-149°С, Rf 0.33 (A), Rf 0.50 (В), Rf 0.67 (Е). Спектр 1Н-ЯМР: 1.15-1.75 (20Н, м, 2 СβγδН2 Lys, -NHCH2(CH2)4CH2NH-), 3.00 (8Н, м, 2 СεH2 Lys, -NHCH2(CH2)4CH2NH-), 3.90 (4Н, м, 2 СβH2 Ser), 4.25 (4Н, м, 2 CαH Lys, 2 CαH Ser), 4.46 (4Н, с, 2 -ОСН2С6Н5), 5.10 (4Н, с, 2-OCH2C6H4Cl), 7.04 (6Н, с, 2 N+H3 Ser), 7.20-7.50 (20H, м, 2-ОСН2С6Н5, 2-OCH2C6H4Cl, -NH(CH2)6NH-), 7.74 (2Н, т, J 5.6, 2 NεH Lys), 7.88 (2H, д, J 7.6, 2 NH Lys).
е) Получение гексаметилендиамида бис(N-ацетил-O-бензил-L-серил-Nε-2-хлорбензилоксикарбонил-L-лизина), (CH3CO-Ser(Bzl)-Lys(Z(Cl))-NH-)2(CH2)6
К раствору 0.80 г (0.70 ммоль) 2 HCl-(H-Ser(Bzl)-Lys(Z(Cl))-NH-)2(CH2)6 в 5 мл DMF добавляли 0.25 мл (1.48 ммоль) DIEA, перемешивали 30 мин, затем добавляли 0.24 г (1.52 ммоль) Ас-OSu. Реакционную смесь перемешивали 48 ч. По исчезновению исходного соединения (ТСХ контроль) реакционную массу выливали в емкость с 20 мл холодной воды, через 2 ч, выпавший осадок отфильтровывали, промывали водой, сушили в вакууме (15 мм.рт.ст.) над CaCl2. Выход 0.72 г (97%), т.пл. 153-155°С (этилацетат), [ α ] D 20 − 11.3 ° (с 0.4; DMF), Rf 0.12 (A), Rf 0.95 (В), Rf 0.40 (Г). Спектр 1Н-ЯМР: 1.00-1.75 (20Н, м, 2 СβγδН2 Lys, -NHCH2(CH2)4CH2NH-), 1.87 (6Н, с, 2 СН3СО-), 2.74 (4Н, м, 2 СεH2 Lys), 2.94 (4Н, м, -NHCH2(CH2)4CH2NH-), 3.59 (4Н, м, 2 CβH2 Ser), 4.15 (2Н, м, 2 CαH Lys), 4.55 (2Н, м, 2 CαH Ser), 7.20-7.50 (18Н, м, 2-ОСН2С6Н5, 2-OCH2C6H4Cl), 7.52 (2Н, т, J 4.9, -NH(CH2)6NH-), 7.64 (2Н, т, J 5.6, 2 NεH Lys), 8.01 (2Н, д, J 7.8, 2 NH Lys), 8.15 (2Н, д, J 8.1, 2 NH Ser).
е) Получение гексаметилендиамида бис(N-ацетил-L-серил-L-лизина), (СН3СО-Ser-Lys-NH-)2(CH2)6 (ГТ-106Ас)
К раствору 0.60 г (0.56 ммоль) (CH3CO-Ser(Bzl)-Lys(Z(Cl))-NH-)2(CH2)6 в 30 мл МеОН присыпали 0.50 г 10% Pd/C и перемешивали в атмосфере водорода 6 ч. По окончании гидрирования (ТСХ-контроль), катализатор отфильтровывали, фильтрат упаривали, твердый остаток растворяли в МеОН и высаживали диэтиловым эфиром. Получали 0.32 г (91%) (общий выход 44%) продукта в виде белого порошка, т.пл. 182-186°С, [ α ] D 20 − 42.9 ° (с 1; DMF), Rf 0,10 (Е), Rf 0.40 (В), Rf 0,25 (З), τ=11.8 мин (градиент конц. ацетонитрила в 0.5% TFA (0-15%, 15 мин). C32H58N8O12. Спектр 1Н-ЯМР: 1.00-1.75 (20Н, м, 2 СβγδH2 Lys, -NHCH2(CH2)4CH2NH-), 1.90 (6Н, с, 2 СН3СО-), 2.75 (4Н, м, 2 СεH2 Lys), 2.95 (4Н, м, -NHCH2(CH2)4CH2NH-), 3.70 (4Н, м, 2 СβH2 Ser), 4.21 (2Н, м, 2 CαH Lys), 4.55 (2Н, м, 2 СαН Ser), 7.52 (2Н, т, J 4.9, -NH(СН2)6NH-), 8.01 (2Н, д, J 7.8, 2 NH Lys), 8.15 (2Н, д, J 8.1, 2 NH Ser).
ПРИМЕР 2. Получение гексаметилендиамида бис-(N-ацетил-L-серил-L-лизина) (ГТ-106Ас) с использованием Z/Boc - стратегии пептидного синтеза
а) Получение N-оксисукцинимидного эфира Nα-бензилоксикарбонил-Nε-трет-бутилоксикарбонил-L-лизина, Z-Lys(Boc)-OSu
1-я часть
К суспензии 30.00 г (53.40 ммоль) 99% соли Z-Lys(Boc)-OH · ДЦГА в 180 мл этилацетата при перемешивании на магнитной мешалке и комнатной температуре приливали 105 мл (62.00 ммоль) ~5.6% водного раствора H2SO4 (ρ=1,0375). Через 30 мин осадок весь растворялся. Органический слой отделяли, а водный раствор экстрагировали 50 мл этилацетата. Органические растворы объединяли и промывали 3×60 мл воды и 1×50 мл насыщенного раствора NaCl. Этилацетатный раствор сушили над Na2SO4, упаривали (при температуре не выше 50-55°С). После отгонки растворителя получали остаток в виде масла слегка желтоватого цвета, массой 22.28 г Z-Lys(Boc)-OH. Спектр 1H-ЯМР: 1.17-1.30 (4Н, м, СγδН2 Lys) 1.36 (9Н, с, -ОС(СН3)3), 1.53-1.63 (2Н, м, СβH2 Lys), 2.85 (2Н, м, СεH2 Lys), 3.61 (1Н, м, СαН Lys), 4.99 (2Н, с, -ОСН2-С6Н5), 6.55 (1Н, д, J 6.8, NH Lys), 6.73 (1Н, т, J 5.5, NεH Lys), 7.34 (5Н, м, -С6Н5). -СООН обменивается с HDO. C19H28N2O6.
2-я часть
В колбу, снабженную механической мешалкой, обратным холодильником с хлоркальциевой трубкой и термометром, заливали раствор 22.28 г Z-Lys(Boc)-OH в 50 мл этилацетата и приливали 130 мл этилацетата. При перемешивании добавляли одномоментно 7.34 г 98% (7.19 г, 62.48 ммоль (17% изб.)) N-гидроксисукцинимида и 50 мл этилацетата. Реакционную смесь охлаждали до +8°С - +10°С, и приливали раствор 13.24 г 99% (13.11 г, 63.54 ммоль (19% изб.)) DCC в 40 мл этилацетата с такой скоростью, чтобы температура в смеси не поднималась выше +10°С. Перемешивали при этой температуре в течение 1 ч, затем охлаждение убирали и перемешивали реакционную массу при комнатной температуре 20 ч. Выпавший осадок DCU отфильтровывали, промывали на фильтре 30 мл этилацетата. Фильтрат упаривали до объема 100 мл и оставляли на ночь при +4°С. Выпавший осадок DCU отфильтровывали, раствор упаривали, остаток в виде желтоватого масла промывали 3×20 мл гексана, каждый раз декантируя гексан. Остатки растворителей упаривали при температуре 50°С. Полученное масло затирали под диэтиловым эфиром, выдерживали ночь при +4°С, осадок отфильтровывали, сушили в вакууме (15 мм.рт.ст.) над CaCl2. Получали 24.16 г (95%) Z-Lys(Boc)-OSu. Rf 0.90 (A), Rf 0.83 (Б), т.пл. 95-99°С, [ α ] D 25 − 20.66 (с 0.41; EtOH). Спектр 1Н-ЯМР: 1.37 (9Н, с, ОС(СН3)3), 1.41 (2Н, м, CδH2 Lys), 1.76 (2Н, м, СγH2 Lys), 1.85 (2Н, м, СβH2 Lys), 2.81 (4Н, с, -СН2-СН2-, OSu), 2.90 (2Н, м, СεH2 Lys), 4.40 (1Н, м, СαН Lys), 5.07 (2Н, с, ОСН2-С6Н5), 6.78 (1Н, т, NεH Lys), 7.34 (5Н, м, C6H5), 8.05 (1Н, д, NH Lys). C23H31N3O8.
б) Получение гексаметилендиамида бис(Nα-бензилоксикарбонил-Nε-трет-бутилоксикарбонил-L-лизина), (Z-Lys(Вос)-NH-)2(СН2)6
Раствор 20.70 г (43.30 ммоль) Z-Lys(Boc)-OSu в 97 мл свежеперегнанного DMF, перемешивали при комнатной температуре в течение 5-10 мин до полного растворения сукцинимидного эфира и затем одномоментно приливали раствор 2.40 г (20.65 ммоль) гексаметилендиамина в 20 DMF. Реакционную смесь перемешивали в течение 4 ч при комнатной температуре, далее оставляли на ночь без перемешивания. Затем к реакционной смеси при перемешивании медленно приливали 450 мл дистиллированной воды, предварительно нагретой до 43-45°С, при этом выпадал белый творожистый осадок. Перемешивание вели до температуры 20-22°С самоохлаждением, после чего оставляли раствор с осадком на 12 ч при температуре 12-17°С. Хорошо сформированный осадок отфильтровывали, промывали водой до нейтральной реакции, затем 40 мл гексана, удаляя остатки воды. Осадок сушили на воздухе, получали 16.70 г (92%) (Z-Lys(Boc)-NH-)2(CH2)6 в виде белого порошка. Rf 0.90 (В), Rf 0.93 (Г), т.пл. 150-154°С, [ α ] D 25 − 9.31 ° (с 0.29; EtOH). Спектр 1Н-ЯМР: 1.07-1.51 (20Н, м, 2 СβγδH2 Lys, -NHCH2(CH2)4CH2NH-), 1.36 (18 Н, с, 2-ОС(СН3)3), 2.88 (4Н, м, 2 CεH2 Lys), 3.02 (4Н, м, -NH-CH2-(CH2)4-CH2-NH-), 3.88 (2Н, м, 2 СαН Lys), 4.99 (4Н, с, OCH2-С6Н5), 6.74 (2Н, т, NεH Lys), 7.27 (2Н, д, NH Lys), 7.32 (10Н, м, 2-C6H5, 7.81 (2Н, т, 2-NH(CH2)6NH-). C44H68N6O10.
в) Получение N-бензилоксикарбонил-L-серина, Z-Ser-OH
В колбу емкостью 2 л, снабженную механической мешалкой, термометром и обратным холодильником последовательно загружали 30.30 г 99% (30.00, 0.2855 моль) Н-Ser-OH, 300 мл дистиллированной воды, 300 мл ацетона, 23.98 г NaHCO3, 100 мл дистиллированной воды, 100 мл ацетона. К полученному раствору при перемешивании и температуре 20-22°С присыпали 71.86 г 99%-ного (71.14 г, 0.2855 моль) Z-OSu. Реакционную массу перемешивали 5 часов, затем оставляли на ночь без перемешивания. Ацетон удаляли под вакуумом, водный раствор после промывки 2×170 мл CH2Cl2 подкисляли конц. HCl до рН=2.5 и экстрагировали 3×285 мл этилацетатом. Этилацетатный раствор промывали 250 мл воды и 170 мл насыщенного раствора NaCl. Растворитель упаривают на роторном испарителе, приливают 50 мл гексана и упаривают досуха при температуре 50°С. Белый пластинчатый осадок сушили в вакууме (15 мм.рт.ст.) над CaCl2. Получали 61.54 г (90%) Z-Ser-OH. Rf 0.90 (A), Rf 0.83 (Б), т.пл. 95-99°С, [ α ] D 25 + 6.57 (с, 7; уксусная кислота). Спектр 1Н-ЯМР: 3.66 (2Н, д, J 5.4, СβH2 Ser), 4.05 (1Н, д т, J 8.1, J 5.4, CαH Ser), 5.03 (2Н, с, -OCH2-С6Н5), 7.3-7.4 (5Н, м, -С6Н5), 7.34 (1Н, д, J 8.1). -ОН и -СООН обмениваются с HDO. C11H13NO5.
г) Получение пентафторфенилового эфира N-бензилоксикарбонил-L-серина, Z-Ser-OPfp
В колбу емкостью 2 л, снабженную термометром, обратным холодильником и механической мешалкой загружали 55.56 г (0.2323 моль) Z-Ser-OH и приливали 600 мл этилацетата и добавляли 47.50 г 99% (47.025 г, 0.2554 моль (10% изб)) Pfp-OH. Реакционную массу, в виде суспензии, охлаждали до 0°С - -3°С и при перемешивании прибавляли раствор 53.23 г 99%-ного (52.69 г, 0.2545 моль (10% изб.)) DCC в 250 мл этилацетата с такой скоростью, чтобы температура в смеси не поднималась выше 0°С. Выдерживали в течение 1 ч, затем охлаждение убирали и перемешивали при комнатной температуре 20 ч, DCU отфильтровывали. Растворитель упаривали при температуре не выше 50°С, к остатку приливали 200 мл петролейного эфира и оставляли на 30 минут, после чего осадок отфильтровывали, промывали 50 мл петролейного эфира, сушили в вакууме (15 мм.рт.ст.) над CaCl2 и парафином. Получали 85.88 г (91%) Z-Ser-OPfp. Rf 0.90 (А), Rf 0.83 (Б), т.пл. 150-154°С (петролейный эфир), [ α ] D 25 − 20.66 (с, 0.41; EtOH). Спектр 1Н-ЯМР: 3.85 (2Н, два дд, J 8.6, J 5.8, СβH Ser), 4.56 (1Н, д т, J 8.6, J 5.4 CαH Ser), 5.08 (2Н, с, -ОСН2-C6H5), 5.23 (1Н, т, J 5.8, OH-Ser), 7.36 (5Н, м, -С6Н5), 7.97 (1Н, д, J 7.6, NH Ser). C17H12NO5F5.
д) Получение гексаметилендиамида бис(Nε-трет-бутилоксикарбонил-L-лизина), (Н-Lys(Boc)-NH-)2(CH2)6
К раствору 10.00 г (11.89 ммоль) (Z-Lys(Boc)-NH-)2(CH2)6 в 195 мл МеОН присыпали 0.76 г 10% Pd/C 50%-ной влажности и перемешивали в атмосфере водорода. По окончании гидрирования (ТСХ-контроль), катализатор отфильтровывали, фильтрат упаривали, к твердому остатку приливали смесь эфиров (петролейный : диэтиловый, 1:3) и оставляли до выпадения осадка (ночь). Смесь эфиров декантировали, а осадок сушили в вакууме (15 мм.рт.ст.). Получали 6.54 г (96%) (H-Lys(Boc)-NH-)2(CH2)6. Rf 0.48 (Г), Rf 0.68 (Д), Rf 0.39 (E); т.пл. 81.2-83.6°С, [ α ] D 25 + 8.3 (с, 1; EtOH). Спектр 1Н-ЯМР: 1.11-1.65 (20Н, м, 2 СβγδН2 Lys, -NHCH2(CH2)4CH2NH-), 1.35 (18Н, с, 2-ОС(СН3)3), 2.86 (4Н, м, 2 CεH2 Lys), 3.04 (4Н, м, -NH-CH2-(CH2)4-CH2-NH-), 3.40 (2H, м, 2 CαH Lys), 6.73 (2Н, т, NεH Lys), 7.78 (2Н, т, -NH(CH2)6NH-). NH2 обменивается с HDO растворителя. C28H56N6O6.
е) Получение гексаметилендиамида бис(N-бензилоксикарбонил-L-серил-Nε-трет-бутилоксикарбонил-L-лизина), Z-Ser-Lys(Boc)-NH-)2(CH2)6
К раствору 5.00 г (8.74 ммоль) (H-Lys(Boc)-NH-)2(CH2)6 в 20 мл свежеперегнанного DMF, одномоментно присыпали 7.44 г (18.35 ммоль (5%-ный изб.)) Z-Ser-OPfp и приливали 10 мл DMF. Реакционную смесь перемешивали в течение 12 ч при комнатной температуре. Затем приливали 0.11 мл DMAPA, выдерживали 50 мин при перемешивании, после чего реакционную массу выливали в дистиллированную воду (150 мл) и оставляли на 12 ч при комнатной температуре. Хорошо сформированный осадок отфильтровывали, промывали 200 мл воды, 50 мл гексана и 50 мл диэтилового эфира. Осадок сушили в вакууме (15 мм.рт.ст.) над CaCl2 и получали 8.48 г (96%) светло-кремового порошка. Rf 0.66 (Ж), Rf 0.93 (И), т.пл. 140-143°С, [ α ] D 25 − 12.82 ° (с, 1; МеОН). Спектр 1Н-ЯМР: 1.1-1.6 (20Н, м, 2 СβγδH2 Lys, -NHCH2(CH2)4CH2NH-), 1.35 (18Н, с, 2-ОС(СН3)3), 2.86 (4Н, м, 2 СεH2 Lys), 2.99 (4Н, м, -NH-CH2-(CH2)4-CH2-NH-), 3.53 (4Н, м, 2 СβH2 Ser), 4.08 (2Н, м, 2 CαH Ser), 4.14 (2Н, м, 2 СαН Lys), 5.04 (4H, с, -ОСН2-С6Н5), 5.08 (2Н, т, ОН-СβH2), 6.72 (2Н, т, NεH Lys), 7.28 (2Н, д, NH Ser), 7.34 (10Н, м, -C6H5), 7.79 (2Н, т, -NH(CH2)6NH-), 7,96 (2Н, д, NH Lys). C50H78N8O14
ж) Получение гексаметилеидиамида бис(L-серил-Nε-трет-бутилоксикарбонил-L-лизина), (Н-Ser-Lys(Вос)-NH-)2(СН2)6
К раствору 5.00 г (4.93 ммоль) (Z-Ser-Lys(Boc)-NH-)2(CH2)6 в 220 мл МеОН присыпали 0.76 г 10% Pd/C 50%-ной влажности и перемешивали в атмосфере водорода. По окончании гидрирования (ТСХ-контроль), катализатор отфильтровывали, фильтрат упаривали, упаривали с 15 мл бензола, к пенообразному остатку приливали 20 мл петролейного эфира и оставляли на 2 ч, эфир декантировали, а осадок сушили в вакууме (15 мм.рт.ст.) над CaCl2. Получали 3.77 г (98%) белого порошка. Rf 0.48 (И), т.пл. 87-89°С, [ α ] D 25 − 9,76 (с, 1; EtOH).
Спектр 1Н-ЯМР: 1.1-1.72 (20Н, м, 2 СβγδH2 Lys, -NHCH2(CH2)4CH2NH-), 1.35 (18Н, с, 2-ОС(СН3)3), 2.83 (4Н, м, 2 СεH2 Lys), 3.00 (4Н, м, -NH-CH2-(CH2)4-CH2-NH-), 3.41 (2Н, м, 2 СαН Ser), 3.52 (4Н, м, J 5.1, 2 CβH2 Ser), 4.17 (2Н, м, 2 CαH Lys), 6.73 (2 Н, т, NεH Lys), 7.93 (2Н, т, -NH(CH2)6NH-), 8,17 (2Н, д, J 8.1 NH Lys). -NH2 обменивается с HDO растворителя. C34H66N8O10
з) Получение N-оксисукцинимидного эфира уксусной кислоты, СН3СО-OSu
К раствору 1.43 мл (25.00 ммоль) уксусной кислоты и 2.87 г (25.00 ммоль) N-гидроксисукцинимида в 50 мл диоксана при +5°С прибавляли 5.15 г (25.00 ммоль) DCC. Реакционную смесь перемешивали 20 ч при комнатной температуре. Выпавшый осадок отфильтровывали и промывали безводным диоксаном, фильтраты объединяли и упаривали. Получали 3.65 г (93%) продукта в виде белых кристаллов, Rf 0.41 (A), Rf 0.75 (Б), т.пл. 103-105°С. Спектр 1Н-ЯМР: 2.34 (3Н, с, СН3СО-), 2.80 (4Н, м, -СН2СН2-, -OSu).
и) Получение гексаметилендиамида бис(N-ацетил-L-серил-Nε-трет-бутилоксикарбонил-L-лизина), (Ас-Ser-Lys(Вос)-NH-)2(СН2)6
К раствору 4.00 г (5.40 ммоль) (H-Ser-Lys(Boc)-NH-)2(CH2)6 в 30 мл DMF при перемешивании и температуре +5°С приливали раствор 2.02 г (13.00 ммоль) Ac-OSu в 10 мл DMF и выдерживали в течение 1 ч, затем охлаждение убирали и перемешивают при комнатной температуре 20 ч. Растворитель упаривали при температуре не выше 50°С, к остатку приливали 40 мл диэтилового эфира и оставляли при температуре +10°С на 12 ч. Осадок отфильтровывали, промывали 20 мл диэтилового эфира. Полученный продукт кипятили на водяной бане в 40 мл ацетона и сразу отфильтровывали, промывали дополнительно 5 мл горячего ацетона, сушили в вакууме (15 мм.рт.ст.) над CaCl2, получали 3.41 г (77%) продукта в виде кристаллов слегка кремового цвета. Rf 0.90 (А), Rf 0.83 (Б), т.пл. 150-154°С (ацетон), [ α ] D 29 − 21.39 ° (с, 1; МеОН). Спектр 1Н-ЯМР: 1.10-1.65 (20Н, м, 2 СβγδН2 Lys, -NHCH2(CH2)4CH2NH-), 1.35 (18Н, с, 2-ОС(СН3)3), 1.85 (6Н, с, 2 СН3СО), 2.85 (4Н, м, 2 СεH2 Lys), 2.98 (4Н, м, -NH-CH2-(CH2)4-CH2-NH-), 3.47-3.55 (4Н, м, J 5.1, 2 CβH2 Ser), 4.11 (2Н, м, 2 CαH Ser), 4.17 (2Н, м, 2 CαH Lys), 5.15 (2Н, т, 2 ОН Ser), 6.77 (2Н, т, NεН Lys), 7.77 (2Н, т, -NH(CH2)