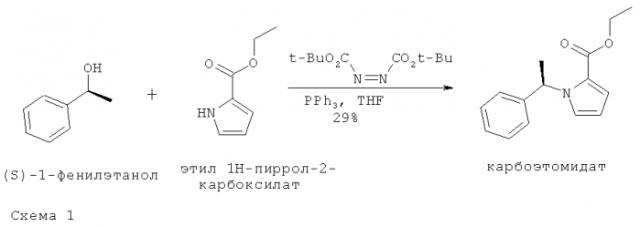
Аналоги этомидата, которые не ингибируют синтез адренокортикостероидов
Иллюстрации
Показать всеИзобретение относится к соединениям формулы (I), где R1 представляет собой L1C(O)OT; R2 представляет собой C1-С10алкил; n равно 0; R4 и R5 независимо представляют собой Н; L1 представляет собой связь; Т представляет собой этил, пропил, изобутил, н-бутил; и его фармацевтически приемлемым солям, стереоизомерным смесям и энантиомерам. Соединения обеспечивают анестезирующее действие у млекопитающих. 4 н. и 4 з.п. ф-лы, 8 ил., 7 пр.
Реферат
ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет по предварительной заявке США №61/224751, поданной 10 июля 2009, содержание которой включено в настоящую заявку посредством ссылки в полном объеме.
ПОДДЕРЖКА ГОСУДАРСТВА
Настоящее изобретение было выполнено при поддержке государства в соответствии с грантом №Р01-58448 выданного Национальными институтами здоровья. Государство имеет определенные права на это изобретение.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к аналогам этомидата, которые имеют улучшенные фармакокинетические и фармакодинамические свойства, и к их применению в качестве анестетиков.
УРОВЕНЬ ТЕХНИКИ
Заболеваемость сепсисом приблизительно составляет 750000 в год в США со смертностью от 30 до 50% и ежегодной стоимостью 17 миллиардов долларов (Hotchkiss, R.S. and I.E. Karl, The pathophysiology and treatment of sepsis. N Engl J Med, 2003. 348 (2): p.138-50). Тяжелый сепсис зачастую ассоциируется с глубокой гипотензией, массивной вазодилятацией, шоком и полиорганной недостаточностью. Пациенты с сепсисом обычно нуждаются в общей анестезии для проведения важных терапевтических вмешательств, таких как интубация и хирургическое вмешательство. К сожалению, вся общая процедура анестезии дает тяжелые и потенциально опасные для жизни побочные эффекты, в частности у больных сепсисом в критическом состоянии. Особую важность представляет собой угнетение сердечно-сосудистой деятельности, которое вызывают почти все анестетики.
Этомидат является высокоэффективным внутривенным анестетиком, который отличается от других общих анестетиков своей способностью поддерживать стабильность сердечно-сосудистой функции. Он индуцирует утрату выпрямительного рефлекса у головастиков (Husain, S.S., et al., 2-(3-Methyl-3H-diaziren-3-yl)ethyl 1-(1-phenylethyl)-1H-imidazole-5-carboxylate: a derivative of the stereoselective general anesthetic etomidate for photolabeling ligand-gated ion channels. J Med Chem, 2003. 46(7): p.1257-65) и утрату ответных реакций у людей (Arden, J.R., F.O. Holley, and D.R. Stanski, Increased sensitivity to etomidate in the elderly: initial distribution versus altered brain response. Anesthesiology, 1986. 65 (1): p.19-27) в концентрации ~2 мкМ. На молекулярном уровне существует убедительное доказательство, что этомидат вызывает анестезию путем модуляции функции рецепторов GABAA (Jurd et al., Faseb J (2003) 17 (2): 250-2 и Rusch et al., J Biol Chem (2004) 279 (20): 20982-92). Этомидат усиливает опосредованные рецепторами GABAA потоки, индуцированные низкими концентрациями GABA, но оказывает небольшое действие на потоки, индуцированные высокими концентрациями GABA. Это сдвигает влево кривую зависимости величины ответа от концентрации GABA, снижая ЕС50 GABA. Также считается, что этот рецепторный механизм также обусловливает анестезирующее действие пропофола.
Существует растущее понимание того, где этомидат действует на рецептор GABAA для осуществления анестезирующего действия. Исследования с использованием фотоаффинного мечения идентифицировали две аминокислоты в рецепторах GABAA, которые вносят свой вклад в сайт связывания с этомидатом.: Met-236 на (субъединице и Met-286 на β субъединице (Li et al., J Neurosci (2006) 26 (45): 11599-605). Моделирование структурной гомологии рецептора GABAA основанное на структуре ацетилхолинового рецептора электрического ската убедительно указывает на то, что эти две аминокислоты вносят свой вклад в связывающий карман анестезирующего средства, расположенный между α и β субъединицами. Этот вывод поддерживается изучениями мутагенеза, показывающими, что замена этих аминокислот на триптофан ослабляет чувствительность рецепторов к этомидату (Stewart et al., Mol Pharmacol (2008) 74 (6): 1687-95).
Ингибирование синтеза стероидов является потенциально смертельным побочным эффектом введения этомидата, особенно у пациентов в критическом состоянии, например у пациентов с сепсисом, которые могли бы в других случаях получить наибольшую пользу от его использования. Это ингибирование является чрезвычайно мощным, происходящим в дозах этомидата, которые ниже тех, которые дают общую анестезию. Это также является чрезвычайно опасным, поскольку значительно увеличивает смертность пациентов в критическом состоянии, которые получили непрерывные инфузии этомидата. Например, Watt, I. и I.M. Ledingham, Anaesthesia (1984) 39 (10): 973-81, ретроспективно обнаружили, что пациентам с травмами в критическом состоянии чаще требуются факторы, повышающие кровяное давление (р<0,0001), и смертность этих пациентов была почти в 3 раза выше (77% vs. 28%; р<0,0005) при анестизии этомидатом по сравнению с бензодиазепинами даже после приведения в соответствие с возрастом, полом и шкалой тяжести травмы. Вследствие его действия на синтез стероидов, этомидат не может эффективно применяться у пациентов в критическом состоянии, в виде длительной непрерывной инфузии и введение даже однократной внутривенной болюсной дозы для индукции анестезии у пациентов с сепсисом в последнее время вызвало опасения. Предположили, что такая заболеваемость и смертность могли быть снижены путем эмпирического введения экзогенных стероидов (Ray, D.C. and D.W. McKeown, Crit Care (2007) 11 (3): R 56); однако этот подход является недостаточным, поскольку дозирование, хронометраж и длительность стероидной терапии у любого заданного пациента были бы ориентировочными. Боле того, введение экзогенных стероидов само может вызывать значительные осложнения (особенно при установлении сепсиса) в том числе измененный гомеостаз глюкозы, ухудшение заживления ран и иммуносупрессию. Предположили, что эти осложнения объясняют, по меньшей мере частично, результаты исследования CORTICUS, указывая на то, что хотя экзогенные стероиды уменьшают необходимость в факторах, повышающих кровяное давление, они не увеличивают выживаемость даже у пациентов в критическом состоянии, у которых предполагается наличие адренокортикальной недостаточности (Sprung et al., N Engl J Med (2008) 358 (2): 111-24).
Этомидат подавляет синтез адренокортикостероидов прежде всего путем связывания и ингибирования 11βгидроксилазы (т.е. CYP11B1), цитохрома Р 450 - фермента, который необходим для биосинтеза кортизола, кортикостерона и альдостерона (de Jong et al., J Clin Endocrinol Metab (1984) 59 (6): 1143-7). Полумаксимальная ингибирующая концентрация этомидата (IC50) находится в нижнем наномолярном диапазоне (Lamberts et al., J Pharmacol Exp Ther (1987) 240 (1): 259-64 и Roumen et al., J Comput Aided Mol Des (2007) 21 (8): 455-71), диапазоне концентрации, который на порядок величины ниже, чем его снотворная/анестезирующая концентрация. Более ранние кристаллографические исследования лекарственных средств, содержащих имидазол (например, кетоконазола) в отношении различных ферментов цитохром Р 450 показали, что высокая аффинность связывания требует сильного взаимного притяжения ("координации") между основным азотом в имидазольном кольце лекарственного средства и железом гемма в каталитическом сайте фермента (Zhao et al., J Biol Chem (2006) 281 (9): 5973-81; Podust et al., Proc Natl Acad Sci USA (2001) 98 (6): 3068-73; и Verras et al., Protein Eng Des Sel (2006) 19 (11): 491-6); ферменты цитохром P 450 (в том числе 11β-гидроксилаза) содержит простетические группы гема в их каталитических сайтах. Хотя 11β-гидроксилаза еще не была ни кристаллизована, ни определено ее взаимодействие с этомидатом, исследования, моделирующие гомологию, дают возможность предположить, что высокая аффинность связывания этомидата с 11β-гидроксилазой также требует координации между основным азотом в имидазольном кольце этомидата и железом гема фермента. Это приводит к предположению, что высокая аффинность связывания с 11β-гидроксилазой (и, следовательно, адренолитической активности) могла быть "исключена" у этомидата (без разрушения сильных анестезирующих и GABAA рецепторных действий) путем замены этого основного азота другими химическими группами, которые не могли координироваться с железом гема. Это было бы крайне желательным, поскольку это позволяет осуществлять сильные анестезирующие и GABAA рецептор модулирующие действия, не подавляя адренокортикальную функцию в клинически релевантных дозах.
Существует большая потребность в более безопасных анестезирующих средствах для применения у пациентов в критическом состоянии, в частности у пациентов с сепсисом. (R) - этомидат обладает многими свойствами, которые сделали бы его идеальным анестезирующим средством (например, высокая анестезирующая активность, меньшее воздействие на сердечно-сосудистую деятельность более высокий терапевтический индекс, чем другие средства), если бы он не был таким мощным ингибитором адренокортикальной функции. Таким образом, в уровне техники существует необходимость разработать аналоги (R)-этомидата, которые сохраняют его многие благоприятные свойства (например, быстрое появление действия, небольшое воздействие на кровяное давление, высокий терапевтический индекс), но не вызывают потенциально опасного ингибирования адренокортикальной функции. Такие аналоги позволят применяемой анестезии быть более безопасной для пациентов, которые находятся в критическом состоянии. Настоящее изобретение отвечает этим потребностям.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к соединениям в соответствии с формулой (I):
,
где
R1 представляет собой L1C(O)OT или L1C(O)OL2C(O)OT;
R2 представляет собой замещенный или незамещенный C1-C10алкил, С2-С10алкенил, или С2-С10алкинил, или R1;
n равно целому числу от 0 до 5;
каждый R3 независимо представляет собой галоген или R2;
R4 и R5 независимо представляют собой водород, галоген, CN или CF3;
L1 и L2 каждый независимо представляет собой связь, замещенный или незамещенный C1-С10алкилен, С2-С10алкенилен или С2-С10алкинилен, где скелет алкилена может содержать один или более гетероатомов; и
Т представляет собой Н, замещенный или незамещенный C1-С10алкил, С2-С10алкенилен, С2-С10алкинилен, нитрофенол или циклопропил, где скелет алкила может содержать один или более гетероатомов. Соединения формулы (I) включают фармацевтически приемлемые соли, их стереоизомерные смеси и энантиомеры.
Соединения формулы (I) обладают улучшенными фармакокинетическими и фармакодинамическими свойствами по сравнению с (R)-этомидатом, которые дают возможность получить эквивалентные или улучшенные анестезирующие свойства наряду с уменьшением нежелательных побочных эффектов. Соединения формулы (I) представляют собой аналоги этомидата, которые сохраняют благоприятные анестезирующие свойства (R)-этомидата, но не вызывают клинически значимого подавления адренокортикальной функции. Другой аспект настоящего изобретения относится к фармацевтической анестезирующей композиции, содержащей эффективное количество соединения в соответствии с формулой (I) и фармацевтически приемлемый носитель.
Еще один аспект настоящего изобретения относится к способу обеспечения анестезии у млекопитающего или способу, включающему введение млекопитающему эффективного анестезирующего соединения формулы (I) или фармацевтической композиции.
Другим аспектом настоящего изобретения является применение соединений формулы (I) по существу как описано в настоящей заявке, в виде композиции или для производства композиции для обеспечения анестезии у пациента, нуждающегося в этом.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
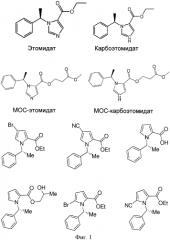
На Фигуре 1 показаны структуры этомидата (этил 3-(1-фенилэтил)имидазол-4-карбоксилат), карбоэтомидата (этил 3-(1-фенилэтил)пиррол-2-карбоксилат), МОС-этомидата, МОС-карбоэтомидата и аналогов карбоэтомидата.
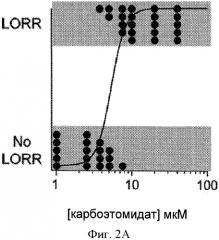
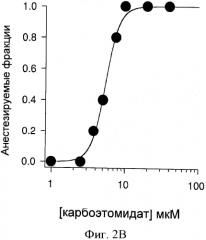
На Фигурах 2А и 2В показана кривая зависимости ответа от концентрации карбоэтомидата в отношении утраты выпрямительного рефлекса (LORR) у головастиков. На Фигуре 2А, каждая экспериментальная точка представляет результаты, полученные от одного головастика. На Фигуре 2В, каждая экспериментальная точка представляет среднее значение, полученное от пяти головастиков. Эта кривая является аппроксимацией набора данных с использованием способа по Waud DR, J Pharmacol Exp Ther, (1972) 183(3): 577-607. Всего 40 головастиков было использовано для построения этой кривой концентрация - ответ. На Фигуре 3 показаны электрофизиологические осциллограммы, демонстрирующие усиление тока, опосредованного рецепторами α1β2γ2L GABAA человека (Фиг.3А) и нечувствительными к этомидату мутантными α1β2M286Wγ2L GABAA (Фиг.3В), экспрессируемыми в ооцитах Xenopus под действием 10 мкМ карбоэтомидата. Эти результаты указывают на то, что карбоэтомидат связывается с тем же сайтом на рецепторе GABAA, как этомидат. Первая и последняя осциллограмма являются контрольными (т.е. без анестезирующего средства). Средняя осциллограмма показывает усиливающее действие карбоэтомидата. Все токи на Фиг.3А были вызваны в одной и той же клетке; аналогично все токи на Фиг.3В также были вызваны в одной и той же клетке.
На Фигуре 4 показан дополнительный пример модуляции карбоэтомидатом функции рецептора человека γ-аминомасляной кислоты (GABA) типа А. На Фигуре 4А представлены осциллограммы, показывающие обратимое усиление под действием 10 мкМ карбоэтомидата токов, опосредованных рецепторами дикого типа, вызванных ЕС5-10 γ-аминомасляной кислотой. На Фигурах 4В представлены осциллограммы, показывающие усиление под действием 10 мкМ карбоэтомидата токов, опосредованных мутантными рецепторами, нечувствительными к карбоэтомидату, вызванных действием ЕС5-10 γ- аминомасляной кислоты.
На Фигуре 5 представлен график, показывающий кривые зависимости ответа от анестезирующей концентрации для ингибирования синтеза кортизола адренокортикальными клетками H295R. Следует отметить, что карбоэтомидат по меньшей мере на три порядка величины является менее эффективным ингибитором продукции кортизола, чем этомидат.
На Фигуре 6А представлен график, показывающий кривые зависимости ответа от анестезирующих доз для LORR у крыс после внутривенного болюсного введения. Каждая экспериментальная точка получена от одной крысы.
На Фигуре 6B представлен график, показывающий отношение между анестезирующей дозой и временем, которое требуется крысе для самостоятельного выпрямления после введения анестезирующего действия. Каждая экспериментальная точка получена от одной крысы.
На Фигуре 7А показан график зависимости среднего кровяного давления от времени у крыс после введения эквивалентных анестезирующих доз пропофола, этомидата и карбоэтомидата и показано, что карбоэтомидат снижает кровяное давление значительно меньше, чем пропофол или этомидат. Каждая точка представляет среднее значение на протяжении 30 секундного периода. Планки погрешностей представляют собой стандартные отклонения. Все анестезирующие средства вводили в дозах, которые являются двойными ED50 для LORR. В группах пропофола и этомидата n=3 крысам. В группе карбоэтомидата n=4 крысам.
На Фигуре 7В показаны действия 14 мг/кг карбоэтомидата (n=7), 2 мг/кг этомидата (n=6) и одного только носителя диметилсульфоксида (DMSO) (n=4) на среднее кровяное давление у крыс. Гипнотические средства вводили в дозах, эквивалентных двойным дозам относительно ED50 для утраты выпрямительного рефлекса в носителе DMSO. Всем крысам вводили одинаковое количество носителя DMSO (350 мкл/кг). Гипнотическое средство в носителе DMSO или в одном только носителе DMSO вводили в момент времени 0. Каждая экспериментальная точка представляет среденее (±SD) изменение среднего кровяного давления в течение каждого 30 секундного периода. *Р<0,05 по сравнению с одним только носителем DMSO. На Фигуре 8 показана концентрация кортикостерона в сыворотке (адренокортикостероида) была относительно неизменной по сравнению с носителем (контролем) в течение 15 минут после введения карбоэтомидата, тогда как она была значительно снижена под действием эквивалентной анестезирующей дозы этомидата. У этих крыс продукцию кортикостерона стимулировали действием АСТН1-24 через 15 минут после введения анестезирующего средства или носителя, а затем измеряли концентрации кортикостерона в сыворотке 15 минут спустя. Дозы этомидата и карбоэтомидата составляли 2х соответствующих им доз ED50 для LORR. В каждой группе использовали четыре крысы. Планки погрешностей представляют собой стандартные отклонения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к более безопасным аналогам (R)-этомидата, которые сохраняют его благоприятные характеристики (например, эффективное анестезирующее действие, быстрое появление анестезирующего действия, небольшое воздействие на кровяное давление), но у которых по существу снижено воздействие на синтез адренокортикостероидов.
Соединения по настоящему изобретению могут рассматриваться как аналоги этомидата (либо R-, либо S-энантиомер), в которых основной азот был заменен СН группой. Не желая связываться теорией, замена основного азота СН группой снижала аффинность связывания этих соединений с 11β-гидроксилазой. Соединения по настоящему изобретению дополнительно могут быть дополнены одной или несколькими дополнительными метаболически лабильными сложноэфирными функциональными группами, присоединенными в различных положениях ядра молекулы напрямую или через линкерные группы (например, -СН2СН2-). Дистально относительно сложноэфирных функциональных групп может находиться «хвостовая» группа (например, -СН3). Различные варианты осуществления настоящего изобретения рассмотрены ниже.
Настоящее изобретение относится к соединениям, соответствующим формуле (I):
.
R1 представляет собой L1C(O)OT или L1C(O)OL2C(O)OT. В предпочтительном варианте осуществления, R1 представляет собой L1C(O)OT.
R2 представляет собой замещенный или незамещенный C1-С10алкил, С2-С10алкенил, или С2-С10алкинил, или R1. Предпочтительно, R2 представляет собой алкил, такой как СН3 или сложный эфир радикала Rb, такой как СН2СН2С(O)ОСН3. В наиболее предпочтительном варианте осуществления, R2 представляет собой СН3 или СН2СН3. R3 каждый независимо представляет собой галоген, радиоизотоп галогена или R2. Предпочтительные галогены включают фтор и хлор. Переменная величина n равна целому числу от 0 до 5. В предпочтительном варианте осуществления, n находится в интервале от 0 до 3 и наиболее предпочтительно равно 0.
R4 и R5 независимо представляют собой Н, галоген, CN или CF3. Предпочтительно, ни один или по меньшей мере один из R4 и R5 представляет собой галоген, CN или CF3. Более предпочтительно, по меньшей мере один из R4 и R5 представляет собой Вr или CN.
Линкеры L1 и L2 каждый независимо представляет собой связь, замещенный или незамещенный C1-С10алкилен, С2-С10алкенилен или С2-С10алкиниленовую группу. Скелет алкилена может содержать один или более гетероатомов, таких как О, N или S. Предпочтительно, L1 и L2 каждый независимо представляет собой связь или линейную С1-С4алкиленовую группу. Наиболее предпочтительно, L1 представляет собой связь или СН2СН2, L2 представляет собой СН2СН2, CH2(CH2)4CH2 или СН2СН2O(СН2)3. В наиболее предпочтительном варианте осуществления, L2 представляет собой СН2СН2.
Хвостовая группа Т может представлять собой Н, замещенный или незамещенный C1-С10алкил, С2-С10алкенил или С2-С10алкинил. Скелет алкила может содержать один или более гетероатомов, таких как О, N или S. Хвостовая группа также может представлять собой циклопропил, нитрофенол или любую другую подходящую электроноакцепторную группу. Предпочтительно, Т представляет собой С1-С4алкильную группу. Наиболее предпочтительно Т представляет собой СН3, СН2СН3, СН2СН2СН2СН3, СН2СН(ОН)СН3 или СН2СН2ОСН3. В наиболее предпочтительном варианте осуществления, Т представляет собой СН3. В другом наиболее предпочтительном варианте осуществления, Т представляет собой нитрофенол. Еще в одном предпочтительном варианте осуществления, Т представляет собой Н. Еще в одном предпочтительном варианте осуществления, Т представляет собой СН2СН(ОН)СН3.
Соединения формулы (I) включают фармацевтически приемлемые соли, их стереоизомерные смеси и энантиомеры. Соединения по настоящему изобретению также включают физиологически приемлемые соли соединений формулы (I). Предпочтительными физиологически приемлемыми солями являются кислотно-аддитивные соли, известные специалистам в данной области. Обычные физиологически приемлемые кислотно-аддитивные соли включают, но не только, соли соляной кислоты, оксалатные соли и тартратные соли.
В некоторых вариантах осуществления настоящего соединения, R1 представляет собой L1C(O)OT, R2 представляет собой СН3, n равно 0, L1 представляет собой связь и Т представляет собой СН2СН3.
В других вариантах осуществления соединения, R1 представляет собой L1C(O)OT, R2 представляет собой СН3, n равно 0, L1 представляет собой связь и Т представляет собой СН3.
В других вариантах осуществления соединения, R1 представляет собой L1C(O)OT, R2 представляет собой СН3, n равно 0, L1 представляет собой связь и Т представляет собой Н.
В предпочтительном варианте осуществления соединения R1 представляет собой L1C(O)OT, R2 представляет собой СН3, n равно 0, L1 представляет собой связь, R4 представляет собой Н, R5 представляет собой Н и Т представляет собой СН2СН3. В другом предпочтительном варианте осуществления соединения, R1 представляет собой L1C(O)OT, R2 представляет собой СН3, n равно 0, L1 представляет собой связь, R4 представляет собой Н, R5 представляет собой Вr или CN и Т представляет собой СН2СН3.
Еще в одном предпочтительном варианте осуществления соединения, R1 представляет собой L1C(O)OT, R2 представляет собой СН3, n равно 0, L1 представляет собой связь, R4 представляет собой Вr или CN, R5 представляет собой Н и Т представляет собой СН2СН3.
В другом предпочтительном варианте осуществления соединения R1 представляет собой L1C(O)OT, R2 представляет собой СН3, n равно 0, L1 представляет собой связь, Rt представляет собой Н, R5 представляет собой Н и Т представляет собой СН2СН(ОН)СН3.
В другом предпочтительном варианте осуществления соединения R1 представляет собой L1C(O)OT, R2 представляет собой СН3, n равно 0, L1 представляет собой связь, R4 представляет собой Н, R5 представляет собой Н и Т представляет собой Н.
В других вариантах осуществления соединения, R1 представляет собой L1C(O)OT, R2 представляет собой СН2СН3, n равно 0, L1 представляет собой связь и Т представляет собой СН3.
В других вариантах осуществления соединения, R1 представляет собой L1C(O)OT, R2 представляет собой СН2СН3, n равно 0, L1 представляет собой связь и Т представляет собой СН2СН3.
В некоторых вариантах осуществления настоящего соединения, R1 представляет собой L1C(O)OT, R2 представляет собой СН3, n равно 1-5, каждый R3 независимо представляет собой галоген, L1 представляет собой связь и Т представляет собой СН2СН3.
В других вариантах осуществления соединения, R1 представляет собой L1C(O)OT, R2 представляет собой СН3, n равно 1-5, каждый R3 представляет собой фтор, L1 представляет собой связь и Т представляет собой СН2СН3.
В других вариантах осуществления соединения, R1 представляет собой L1C(O)OT, R2 представляет собой СН2СН3, n равно 1, R3 представляет собой фтор, L1 представляет собой связь и Т представляет собой СН2СН3.
В другом предпочтительном варианте осуществления соединения, R1 представляет
собой L1C(O)OL2C(O)OT, R2 представляет собой СН3, n равно 0, L1 представляет
собой связь, L2 представляет собой СН2СН2 и Т представляет собой СН3.
В некоторых вариантах осуществления настоящего соединения, R1 представляет
собой L1C(O)OL2C(O)OT, R2 представляет собой СН3, n равно 0, L1 представляет
собой связь, L2 представляет собой СН2(СН2)4СН2 и Т представляет собой СН2СН2СН2СН3.
В других вариантах осуществления соединения, R1 представляет собой L1C(O)OL2C(O)OT, R2 представляет собой СН3, n равно 0, L1 представляет собой связь, L2 представляет собой СН2СН2O(СН2)3 и Т представляет собой СН2СН2ОСН3.
В некоторых вариантах осуществления настоящего соединения, R1 представляет собой L1C(O)OL2C(O)OT, R2 представляет собой СН3, каждый R3 независимо представляет собой галоген, n равно 1-5, L1 представляет собой связь, L2 представляет собой СН2СН2 и Т представляет собой СН3.
В других вариантах осуществления соединения, R1 представляет собой L1C(O)OL2C(O)OT, R2 представляет собой СН3, каждый R3 независимо представляет собой галоген, n равно 1-5, L1 представляет собой связь, L2 представляет собой СН2(СН2)4СН2 и Т представляет собой СН2СН2СН2СН3.
В других вариантах осуществления соединения, R1 представляет собой L1C(O)OL2C(O)OT, R2 представляет собой СН3, каждый R3 независимо представляет собой галоген, n равно 1-5, L1 представляет собой связь, L2 представляет собой СН2СН20(СН2)3 и Т представляет собой СН2СН2ОСН3.
В дополнительных вариантах осуществления соединения, R1 представляет собой L1C(O)OT, R2 представляет собой СН3, по меньшей мере один R3 представляет собой СН2СН2С(O)ОСН3, L1 представляет собой связь и Т представляет собой СН2СН3. В дополнительных вариантах осуществления соединения, R1 представляет собой L1C(O)OL2C(O)OT, R2 представляет собой СН3, по меньшей мере один R3 представляет собой СН2СН2С(O)ОСН3, L1 представляет собой связь, L2 представляет собой СН2СН2 и Т представляет собой СН3.
В предпочтительном варианте осуществления соединения, R1 представляет собой L1C(O)OT, R2 представляет собой СН2СН2С(O)ОСН3, n равно 0, L1 представляет собой связь и Т представляет собой СН2СН3.
В другом предпочтительном варианте осуществления соединения, R1 представляет собой L1C(O)OT, R2 представляет собой СН3, n равно 0, L1 представляет собой СН2СН2 и Т представляет собой СН2СН3.
В некоторых вариантах осуществления соединения формулы (I) выбрано из группы, состоящей из
, , ,
, , , , и фармацевтически приемлемых солей, их стереоизомерных смесей и энантиомеров.
Атом углерода, соединяющий мостиковой связью 6-членное кольцо и 5-членное кольцо, является хиральным центром. Следовательно, соединение может быть в форме чистого энантиомера. В предпочтительном варианте осуществления энантиомер представляет собой R энантиомер. В другом варианте осуществления энантиомер представляет собой S энантиомер.
Соединения формулы (I) предпочтительно имеют такую же стереохимию, как (R)-этомидат. R2, R3, L1, L2 и Т могут быть разветвленными углеводородными цепями, однако не до такой степени, что стерическое несоответствие или конъюгирование мешает желаемой активности.
В некоторых вариантах осуществления соединение включает две или более сложноэфирных группы. Подходящие группы, содержащие сложный эфир (например, линкер - сложный эфир - хвост или сложный эфир - хвост), могут быть добавлены к мостиковому углероду или в различных положениях фенильного кольца или ядра молекулы.
Быстро метаболизируемые аналоги этомидата со сложноэфирными функциональными группами на карбоэтомидате, которые являются стерически незатрудненными и/или электронно-изолированными от pi электронных систем в имидазоле и фенильных кольцах также являются предпочтительными. Такие сложноэфирные функциональные группы, наподобие групп в других лекарственных средствах ультракороткого действия, как ремифентанил и эсолол, считаются в высокой степени подверженными гидролизу под действием эстераз. Смотри патент США №3354173; патент США №5466700; патент США №5019583; и публикацию патента США №US 2003/0055023.
Заместители R2, Т, L1 и L2 каждый независимо могут быть замещены одной или более электроноакцепторными группами. В некоторых вариантах осуществления электроноакцепторная группа представляет собой галоген, нитрофенол или циклопропил. Другие электроноакцепторные группы, такие как гидроксигруппы, аминогруппы, нитрогруппы, нитрильные группы, сульфонатные группы, карбоксилатные группы, галидные группы, группы меркаптана и ненасыщенные алкильные группы, также могут быть использованы. Присутствие электроноакцепторных групп служит для повышения частичного положительного заряда на сложноэфирном карбонильном атоме, тем самым повышая подверженность нуклеофильной атаке эстеразами и дополнительно усиливая быстрый гидролиз под действием эстераз.
Соединения по настоящему изобретению продемонстрировали анестезирующую и повышенную GABAA рецепторную активность. Соединения по настоящему изобретению одинаково демонстрировали мощные in vitro и in vivo анестезирующие и повышенные GABAA рецепторные эффекты. Эти результаты указывают на то, что соединения по настоящему изобретению являются высокоактивными средствами, с мощными in vitro и in vivo действиями. Важным является то, что эти соединения имеют сниженную ингибирующую активность в отношении in vitro и in vivo синтеза адренокортикостероидов и/или короткую продолжительность анестезирующего действия.
Соединения, описанные выше, можно вводить либо отдельно в форме смесей друг с другом, либо в сочетании с фармацевтически приемлемыми носителями. Настоящее изобретение, следовательно, также относится к фармацевтическим композициям, которые содержат эффективное количество по меньшей мере одного соединения по настоящему изобретению с фармацевтически или физиологически приемлемым носителем или без него. При необходимости, это соединение можно вводить в форме физиологически приемлемой соли, например кислотно-аддитивной соли. Настоящее изобретение также охватывает способ лечения животных или людей. Этот способ включает введение животному или человеку эффективного количества по меньшей мере одного из соединений по настоящему изобретению, или его фармацевтически приемлемой соли, с фармацевтически приемлемым носителем, или без него. Предпочтительным введением является внутривенное введение. Смотри патент США №4289783, который таким образом включено посредством ссылки в полном объеме.
Настоящее изобретение представляет собой мощное седативное снотворное средство, которое значительно не подавляет адренокортикальную функцию и может быть использовано для получения и/или поддержания анестезирующего, седативного действия или другого действия, снижающего возбудимость центральной нервной системы. Оно проявляет одно или более из следующих благоприятных свойств по сравнению с альтернативными средствами: более высокая эффективность, более короткая продолжительность терапевтического действия, более короткая продолжительность побочных эффектов, сниженная адренокортикальная супрессия, более высокий терапевтический индекс, меньшая токсичность, сниженное угнетение сердечно-сосудистой деятельности и большая легкость титрования до желаемого эффекта. Соединение по настоящему изобретению можно вводить в виде однократного внутривенного болюса или непрерывной внутривенной инфузии. Другой путь доставки может включать пероральный, ректальный путь, через слизистые оболочки, подкожный или ингаляционный.
Фармацевтические композиции
Для введения пациенту соединения, описанные в настоящем изобретении, могут быть представлены в фармацевтически приемлемых композициях. В соответствии с этим, другой аспект настоящего изобретения относится к фармацевтической композиции, содержащей соединение в соответствии с формулой (I) и фармацевтически приемлемый носитель. Эти фармацевтически приемлемые композиции содержат эффективное количество одного или более соединений, описанных в настоящем изобретении, составленных в композицию вместе с одним или более фармацевтически приемлемыми носителями (аддитивами) и/или разбавителями. Как подробно описано ниже, фармацевтические композиции по настоящему изобретению могут быть специально составлены в композицию для введения в твердой или жидкой форме, включая те, которые адаптированы для следующего: (1) перорального введения, например пропитки (водные или неводные растворы или суспензии), леденцы, драже, капсулы, пилюли, таблетки (например, направленные для защечной, подъязычной и системной абсорбции), болюсы, порошки, гранулы, пасты для нанесения на язык; (2) парентерального введения, например путем подкожной, внутримышечной, внутривенной (например, болюс или инфузия) или эпидуральной инъекции, как, например, стерильный раствор или суспензия, или состав замедленного высвобождения; (3) местного применения, например, в виде крема, мази или пластыря с контролируемым высвобождением, или спрея, наносимого на кожу; (4) внутривлагалищного или интраректального введения, например, в виде вагинального суппозитория, крема или пены; (5) подъязычного введения; (6) глазного введения; (7) чрескожного введения; (8) для введения через слизистые оболочки; или (9) назального введения.
В некоторых вариантах осуществления, соединения по настоящему изобретению могут быть использованы в форме фармацевтически приемлемой соли. Подходящие кислоты, которые обладают способностью формировать соли с соединениями по настоящему изобретению, включают неорганические кислоты, такие как соляная кислота, бромистоводородная кислота, перхлорная кислота, азотная кислота, тиоциановая кислота, серная кислота, фосфорная кислота и подобные; и органические кислоты, такие как муравьиная кислота, уксусная кислота, пропионовая кислота, гликолевая кислота, молочная кислота, пировиноградная кислота, щавелевая кислота, малоновая кислота, янтарная кислота, яблочная кислота, фумаровая кислота, антраниловая кислота, циннамовая кислота, нафталинсульфоновая кислота, сульфаниловая кислота, трифторуксусная кислота, метансульфоновая кислота, бензолсульфоновая кислота, n-толуолсульфоновая кислота и подобные. Подходящие основания, обладающие способностью формировать соли с соединениями по настоящему изобретению включают неорганические основания, такие как гидрохлорид натрия, гидрохлорид аммония, гидрохлорид калия и подобные; и органические основания, такие как моно-, ди- и триалкил и ариламины (например, триэтиламин, диизопропиламин, метиламин, диметиламин, пиридин, пиколин, дициклогексиламин, N,N'дибезоилэтилендиамин и подобное) и необязательно замещенные этанол-амины (например, этаноламин, диэтаноламин, триэтаноламин и подобные).
Используемый в настоящем изобретении термин «фармацевтически приемлемый» или «фармакологически приемлемый» относится к тем соединениям, веществам, композициям и/или лекарственным формам, которые, в объеме результатов тщательной медицинской оценки, подходят для применени