Способ получения терагерцовых изображений раковых опухолей и патологий кожи
Иллюстрации
Показать всеИзобретение относится к медицине, области нанотехнологий, в частности к усилению контраста и глубины зондирования при получении терагерцовых изображений раковых опухолей и патологий кожи с использованием наночастиц и лазерного нагрева. Способ включает введение плазмонно-резонансных композитных наночастиц в зондируемую биоткань и облучение зондируемой биоткани лазерным пучком с длиной волны 700-900 нм, совпадающей с максимумом поглощения наночастиц. Проводят облучение зондируемой биоткани последовательностью импульсов электромагнитных волн терагерцового диапазона, измерение коэффициента отражения электромагнитных волн терагерцового диапазона при пространственном сканировании зондируемой биоткани. При этом перед облучением проводят местную аппликацию путем наложения биологически совместимого агента в жидкой форме, обладающего гиперосмотическими свойствами: глицерина, или полиэтиленгликоля, или пропиленгликоля, или раствора глюкозы или фруктозы в спирте. Облучение лазерным пучком осуществляют в режиме последовательности фемтосекундных импульсов с периодом следования не более 10 нс, синхронизованных с последовательностью импульсов электромагнитных волн терагерцового диапазона так, чтобы в зондируемую область оба импульса приходили одновременно. Часть лазерного пучка для облучения зондируемой биоткани может быть использована для создания последовательности импульсов электромагнитных волн терагерцового диапазона. Способ обеспечивает повышение контрастности и глубины зондирования биообъектов, с пространственным разрешением не менее 100 мкм. 1 з.п. ф-лы, 3 ил.
Реферат
Изобретение относится к области нанотехнологий, в частности к усилению контраста и глубины зондирования при получении терагерцовых изображений раковых опухолей и патологий кожи с использованием наночастиц и лазерного нагрева.
Известно устройство и способ получения терагерцового изображения образца (GB2347835 (A), МПК: A61B5/00, G01N21/35; ARNONE DONALD DOMINIC [GB]; CIESLA CRAIG MICHAEL [GB], 2000-09-13). Способ заключается в облучении образца импульсами электромагнитного излучения со множеством частот в диапазоне от 50 ГГц до 84 ТГц. Площадь образца подразделяется на две двумерные решетки пикселей, и облучение от каждого пикселя детектируется по множеству частот, а изображение строится по величинам радиации для каждой из частот, или по выбору частот из множества частот в импульсном электромагнитном излучении.
Однако из-за использования электромагнитного излучения со множеством частот не удается получить достаточно хорошее терагерцовое изображение и большой глубины зондирование образца, что связано со значительным коэффициентом поглощения гига и терагерцового излучения водой и малой контрастностью отраженного излучения в этих диапазонах.
Известен способ и устройство изображения образца в терагерцовом, инфракрасном или миллиметровом диапазонах (GB2359716 (A), МПК: G01B 11/06, G01N 21/17; CIESLA CRAIG MICHAEL [GB]; 2001-08-29). Источник облучает образец пучком непрерывной широкополосной электромагнитной радиации, имеющей частоту в диапазоне 25 ГГц - 100 ТГц. Устройство включает в себя средство для подразделения площади образца, который должен быть изображен на два двумерных набора пикселей, и средство для детектирования радиации от каждого пикселя. Детектор устроен так, чтобы детектировать фазозависимую величину детектируемой радиации, которой облучается образец. Фаза излучения, проходящего через образец, сравнивается с фазой опорного луча от того же источника, который проходит, минуя образец.
Однако сдвиг фаз для биообразцов малоконтрастен, вследствие широкополосности излучения.
Наиболее близкий способ получения терагерцовых изображений раковых опухолей и патологий кожи с использованием наночастиц и лазерного нагрева, характеризующийся усилением контраста и глубины зондирования, описывается в работе (Seung Jae Oh, Jinyoung Kang, Inhee Maeng, Jin-Suck SuhYong-Min Huh, Seungjoo Haam, and Joo -Hiuk Son. (2009) Nanoparticle-enabled terahertz imaging for cancer diagnosis. OPTICS EXPRESS, V. 17, N. 5, 3469-3475). При синхронном облучении образца, допированного наночастицами, терагерцовыми импульсами и ИК лазерным непрерывным излучением, происходит нагрев наночастиц, вследствие чего изменяется показатель преломления среды и увеличивается глубина зондирования терагерцовым излучением и улучшения контрастности получаемого при этом изображения.
Однако, как известно при использовании непрерывного лазерного облучения при нагреве наночастиц, температура частицы будет соизмерима с температурой окружающей среды, тем самым разница контраста биотканей будет минимальна.
Задачей изобретения является повышение контрастности и глубины зондирования биообъектов, с пространственным разрешением не менее 100 мкм при синхронном пространственно-временном облучении последовательностью фемтосекундных лазерных и терагерцовых импульсов при введении в зондируемую биосреду плазмонно-резонансных композитных наночастиц, повышение глубины зондирования патологических участков ткани за счет обратимой дегидратации кожи при местной аппликации гиперосмотических композиций.
Технический результат заключается в повышении контрастности и глубины зондирования биообъектов, с пространственным разрешением не менее 100 мкм при синхронном пространственно-временном облучении последовательностью фемтосекундных лазерных и терагерцовых импульсов при введении в зондируемую биосреду плазмонно-резонансных композитных наночастиц и местной аппликации гиперосмотических композиций.
Указанный технический результат достигается тем, что в способе получения терагерцовых изображений раковых опухолей и патологий кожи, включающем введение плазмонно-резонансных композитных наночастиц в зондируемую биоткань и облучение зондируемой биоткани лазерным пучком с длиной волны 700-900 нм, совпадающей с максимумом поглощения наночастиц, облучение зондируемой биоткани последовательностью импульсов электромагнитных волн терагерцового диапазона, измерение коэффициента отражения электромагнитных волн терагерцового диапазона при пространственном сканировании зондируемой биоткани, согласно решению облучение лазерным пучком осуществляют последовательностью фемтосекундных импульсов с периодом следования не более 10 нс, синхронизованных с последовательностью импульсов электромагнитных волн терагерцового диапазона так, чтобы в зондируемую область оба импульса приходили одновременно. Часть лазерного пучка используют для создания последовательности импульсов электромагнитных волн терагерцового диапазона. Для обеспечения дополнительной глубины зондирования на поверхность биоткани накладывают биологически совместимый агент в жидкой форме, обладающий гиперосмотическими свойствами. В качестве агента применяется такая композиция, как глицерин, или полиэтиленгликоль, или пропиленгликоль, или раствор глюкозы или фруктозы в спирте.
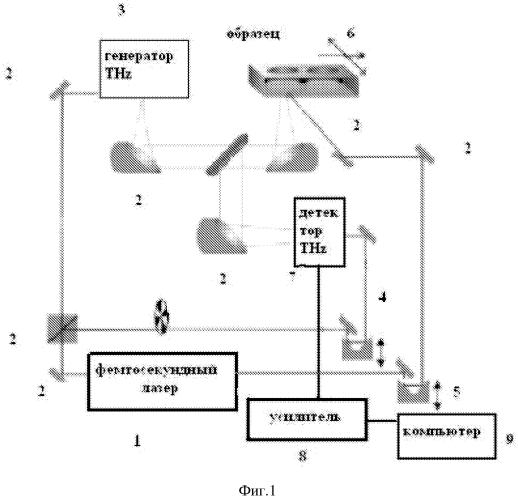
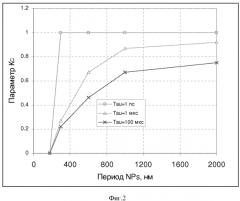
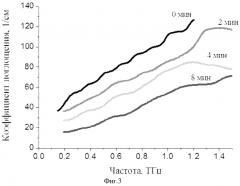
Изобретение поясняется чертежами, где на фиг.1 приведена блок-схема установки для визуализации неоднородности в биоткани, зондируемой терагерцовыми импульсами и лазерным нагревом плазмонно-резонансных композитных наночастиц, введенных в визуализируемую биоткань. На фиг.2 представлена зависимость параметра температурного контраста КС от расстояния между соседними наночастицами для различных длительностей лазерного импульса. На фиг. 3 приведены зависимости коэффициента поглощения глицерина во времени в зависимости от частоты терагерцовых импульсов. Позициями на чертежах обозначены:
1 - фемтосекундный лазер длиной волны в ближнем ИК диапазоне, генерирующий последовательность лазерных импульсов длительностью 10-100 фс с временным расстоянием между импульсами не более 10 нс;
2 - система зеркал и линз;
3 - генератор терагерцовых импульсов на основе полупроводниковых структур;
4 - оптическая линия задержки фемтосекундных лазерных импульсов для детектирования терагерцовых электромагнитных импульсов;
5 - оптическая линия задержки фемтосекундных лазерных импульсов для создания системы временной синхронизации лазерных и терагерцовых импульсов в биоткани;
6 - зондируемая биоткань (раковая опухоль или патология кожи), с введенными плазмонно-резонансными композитными наночастицами;
7 - детектор терагерцовых импульсов на основе полупроводниковых структур;
8 - синхронный усилитель;
9 - персональный компьютер.
Способ осуществляется следующим образом: фемтосекундный лазер 1 с длиной волны в ближнем ИК диапазоне генерирует последовательность лазерных импульсов с длительностью 10-100 фс и временным расстоянием между импульсами не более 10-20 нс, лазерный пучок при помощи систем зеркал 2 делится на три оптических пучка. Один оптический пучок через систему зеркал 2 возбуждает в полупроводниковый структуре терагерцовые импульсы 3 с частотой следования лазерных импульсов, другой пучок через линию оптической задержки 4 воздействует на полупроводниковый детектор терагерцовых импульсов 7, и третий идет через соответствующую оптическую линию задержки 5 для синхронного пространственно-временного облучения фемтосекундными лазерными и терагерцовыми импульсами зондируемой биоткани 6, которая сканируется в плоскости по поперечным координатам Х-У и подвергается местной аппликации гиперосмотическими композициями. Далее, отраженные от биоткани терагерцовые импульсы при помощи системы линз и зеркал попадают на детектор терагерцовых импульсов 7, сигнал от которого через синхронный усилитель 8 анализируется с помощью персонального компьютера 9.
Известен эффект высокой термочувствительности коэффициента отражения терагерцового излучения от температуры воды в биоткани (Seung Jae Oh, Inhee Maeng, Hee Jun Shin, Jaewon Lee Nanoparticle contrast agents for Terahertz medical imaging //33rd International Conference on Infrared, Millimeter and Terahertz Waves, 2008. IRMMW-THz 2008. Pasadena. 2008. P. 1-2. DOI: 10.1109/ICIMW.2008.4665813, Seung Jae Oh, Jinyoung Kang, Inhee Maeng, Jin-Suck Suh Yong-Min Huh, Seungjoo Haam, and Joo -Hiuk Son Nanoparticle-enabled terahertz imaging for cancer diagnosis //Optics express. 2009. Vol.17. No. 5. P. 3469-3475.), что делает перспективным применение его для повышения контраста отображения не только наружных, но и внутренних нагретых включений. Как установлено в прототипе, внедрение поглощающих плазмонно-резонансных наночастиц позволяет существенно улучшить качество терагерцовых изображений при диагностике раковых опухолей.
Как показали нестационарные численные расчеты динамики лазерного резонансного 3D нагрева плазмонно-резонансной композитной наночастицы (Avetisyan Yu.A., Yakunin A.N., Tuchin V.V. Novel thermal effect at nanoshell heating by pulsed laser irradiation: hoop-shaped hot zone //Journal of Biophotonics. 2012. V. 5. No. 10. P. 734-744. DOI: 10.1002/jbio.201100074), при облучении последовательностью фемтосекундных лазерных импульсов достигается большая разница температур вблизи наночастицы на расстоянии нескольких характерных размеров от нее. Результаты детального расчета нестационарного поля нагрева коллоидного раствора наночастиц с учетом окружающей среды (вода, физраствор) показали возможность выбора оптимального режима для повышения температурной контрастности 3D теплового поля при воздействии импульсного лазерного излучения и представлены на фиг.2. Температурная микронеоднородность, возникающая при таком резонансном импульсном лазерном облучении биоткани с наночастицами, приводит к изменению показателя преломления биоткани и соответственно этот эффект отражается на пространственной неоднородности отраженного пучка зондирующих терагерцовых импульсов, вследствие чего происходит усиление контрастности изображения и глубины зондирования при получении терагерцовых изображений.
Контраст изображения зондируемой биоткани определяется соотношением
| KC=(ТNP-Тmed)/(TNP-Tinitial), | (1) |
где ТNP - температура поверхности наночастицы; Тmed - температура в точке на половине расстояния между соседними наночастицами; Tinitial - начальная температура исследуемой среды.
Для обеспечения дополнительной глубины зондирования на поверхность биоткани накладывают биологически совместимый агент в жидкой форме, обладающий гиперосмотическими свойствами. В качестве такого агента может быть использован глицерин, или полиэтиленгликоль, или пропиленгликоль, или раствор глюкозы или фруктозы в спирте.
Как показали эксперименты с терагерцовым зондированием на модели мышечной ткани (см. фиг.3.), однозначно доказана возможность уменьшения поглощения ТГц излучения в диапазоне 0.25-2.5 ТГц при его распространении в биологической ткани во время аппликации гиперосмотических агентов. В зависимости от частоты излучения уменьшение коэффициента поглощения составляет 3-5 раз, необходимое время аппликации порядка 8-10 мин.
1. Способ получения терагерцовых изображений раковых опухолей и патологий кожи, включающий введение плазмонно-резонансных композитных наночастиц в зондируемую биоткань и облучение зондируемой биоткани лазерным пучком с длиной волны 700-900 нм, совпадающей с максимумом поглощения наночастиц, облучение зондируемой биоткани последовательностью импульсов электромагнитных волн терагерцового диапазона, измерение коэффициента отражения электромагнитных волн терагерцового диапазона при пространственном сканировании зондируемой биоткани, отличающийся тем, что перед облучением проводят местную аппликацию путем наложения биологически совместимого агента в жидкой форме, обладающего гиперосмотическими свойствами, а именно глицерина, или полиэтиленгликоля, или пропиленгликоля, или раствора глюкозы или фруктозы в спирте, облучение лазерным пучком осуществляют в режиме последовательности фемтосекундных импульсов с периодом следования не более 10 нc, синхронизованных с последовательностью импульсов электромагнитных волн терагерцового диапазона так, чтобы в зондируемую область оба импульса приходили одновременно.
2. Способ по п. 1, отличающийся тем, что часть лазерного пучка для облучения зондируемой биоткани используют для создания последовательности импульсов электромагнитных волн терагерцового диапазона.