Синтетические глюкопиранозиллипидные адъюванты
Иллюстрации
Показать всеИзобретение относится к иммуностимулирующим соединениям формулы:
(I),
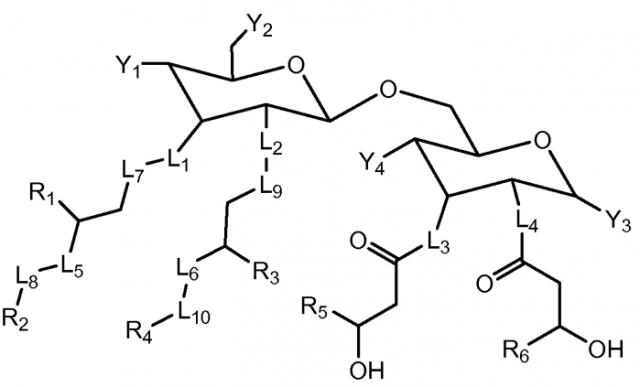
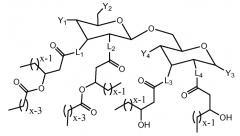
где L1, L2, L3, L4, L5 и L6 независимо представляют собой -O- или -NH-; L7, L8, L9 и L10 независимо отсутствуют или представляют собой -С(=O)-; Y1 представляет собой
-OP(O)(OH)2; Y2, Y3 и Y4 каждый представляет -ОН; R1, R3, R5 и R6 независимо представляют собой C8-13алкил; и R2 и R4 независимо представляют собой C6-11алкил. Предложны новые соединения, фармацевтические и вакцинные композиции на их основе, пригодные для стимуляции иммунной системы. 7 н. и 14 з.п. ф-лы, 45 пр., 12 ил.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
По настоящей заявке испрашивается приоритет в соответствии с § 119(e) 35 U.S.C. на основании предварительной заявки на выдачу патента США № 61/184703, поданной 5 июня 2009 года, причем содержание указанной предварительной заявки включено во всей своей полноте в настоящий документ посредством ссылки.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Область техники, к которой относится изобретение
Настоящее изобретение относится к области фармацевтических и вакцинных композиций. Более конкретно, варианты осуществления, описанные в настоящем документе, относятся к фармацевтическим и вакцинным композициям, а также связанным с ними профилактическим и терапевтическим способам, причем композиции содержат описанный в настоящем документе глюкопиранозиллипидный адъювант (GLA).
Описание предшествующего уровня техники
Иммунная система высших организмов была охарактеризована как различающая чужеродные агенты (или «чужих»), агенты от близких или «своих» компонентов таким образом, что чужеродные агенты индуцируют иммунные ответы, тогда как «свои» компоненты игнорируются или допускаются. Иммунные ответы традиционно характеризуют либо как гуморальные ответы, при которых специфичные в отношении антигенов антитела продуцируются дифференцированными B-лимфоцитами, известными как плазмоциты, либо как опосредованные клетками ответы, при которых различные типы Т-лимфоцитов элиминируют антигены посредством ряда механизмов. Например, CD4+ хелперные T-клетки, которые способны распознавать специфические антигены, могут отвечать высвобождением растворимых медиаторов, таких как цитокины, с вовлечением дополнительных клеток иммунной системы для участия в иммунном ответе. Кроме того, CD8+ цитотоксические T-клетки, которые также способны к распознаванию специфических антигенов, могут отвечать путем связывания и уничтожения или повреждения несущей антиген клетки или частицы. Как известно, в области иммунологии разработаны некоторые вакцины в соответствии с рядом составов, обычно для индукции желаемого иммунного ответа у хозяина.
Некоторые стратегии индукции специфических иммунных ответов путем введения вакцины хозяину включают иммунизацию убитыми нагреванием или живыми аттенуированными инфекционными патогенами, такими как вирусы, бактерии или некоторые эукариотические патогены; иммунизацию невирулентным инфекционным агентом, способным управлять экспрессией генного материала, кодирующего антиген(ы), к которому желательно индуцировать иммунный ответ; и иммунизацию субъединичными вакцинами, которые содержат выделенные иммуногены (такие как белки) конкретного патогена для индукции иммунитета к патогену (см., например, Liu, 1998 Nature Medicine 4(5 suppl.):515). Для некоторых антигенов могут быть желательными один или несколько типов иммунитета, для которых ни один из этих подходов не является особенно эффективным, включая разработку вакцин, которые являются эффективными для иммунной защиты хозяина против вирусов иммунодефицита человека или других инфекционных патогенов, злокачественной опухоли, аутоиммунного заболевания или других клинических состояний.
Давно известно, что энтеробактериальный липополисахарид (LPS) является мощным стимулятором иммунной системы, хотя его применение в качестве адъювантов сократилось из-за его токсических эффектов. Нетоксическое производное LPS, монофосфориллипид A (MPL), полученное удалением основной углеводной группы и фосфата из глюкозамина с восстанавливающим концом, было описано Ribi et al. (1986, Immunology and Immunopharmacology of Bacterial Endotoxins, Plenum Publ. Corp., NY, p. 407-419).
Следующая детоксифицированная версия MPL получается путем удаления ацильной цепи из 3-положения дисахаридного скелета и называется 3-O-дезацилированным монофосфориллипидом A (3D-MPL). Он может быть очищен и получен способами, изложенными в патенте Великобритании №2122204B, ссылка в котором также раскрывает получение дифосфориллипида A и его 3-O-дезацилированных вариантов. Например, 3D-MPL был получен в форме эмульсии с малым размером частиц менее 0,2 мкм в диаметре, а способ его изготовления раскрыт в WO 94/21292. Водные составы, включающие монофосфориллипид A и поверхностно-активное вещество, были описаны в WO 9843670A2.
Полученные из бактериального липополисахарида адъюванты, подлежащие включению в состав адъювантных комбинаций, могут быть выделены и произведены из бактериальных источников, или альтернативно они могут быть синтетическими. Например, очищенный монофосфориллипид A описан в Ribi et al. 1986 (выше), а 3-O-дезацилированный монофосфорил- или дифосфориллипид A, полученный из Salmonella sp., описан в патенте Великобритании №2220211 и патенте США №4912094. Были описаны 3D-MPL и β(1-6)-глюкозаминовые дисахариды, а также другие очищенные и синтетические липополисахариды (WO 98/01139; патент США №6005099 и европейский патент №0729473B1, Hilgers et al., 1986 Int. Arch. Allergy Immunol., 79(4):392-6; Hilgers et al., 1987, Immunology, 60(1); 141-6; и европейский патент №0549074B1). Комбинации 3D-MPL и сапониновых адъювантов, полученных из коры Quillaja saponaria Molina, были описаны в европейском патенте №0761231B. В WO 95/17210 раскрыта адъювантная эмульсионная система на основе сквалена, α-токоферола и полиоксиэтиленсорбитанмоноолеата (TWEEN™-80), составленная с иммуностимулятором QS21 и необязательно включающая 3D-MPL. Несмотря на доступность таких комбинаций, применение адъювантов, полученных из природных продуктов, сопровождается высокими производственными затратами, несовпадением характеристик от партии к партии, трудностями, связанными с серийным производством, и неопределенностью в отношении присутствия примесей в композиционном составе какого-либо данного препарата.
Следовательно, существует потребность в улучшенных вакцинах и, в особенности, в вакцинах, которые фактически содержат высокоочищенные химически определенные адъювантные компоненты, которые характеризуются совпадением характеристик от партии к партии, и которые могут быть эффективно произведены в промышленном масштабе без введения нежелательных или структурно неопределенных загрязнений. Настоящее изобретение относится к композициям и способам на основе таких вакцин и обеспечивает другие связанные с ними преимущества.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение в некоторых своих аспектах относится к соединениям, композициям и способам, в которых в качестве иммуномодуляторов или адъювантов преимущественно использованы определенные синтетические глюкопиранозиллипидные адъюванты (GLA). Таким образом, один аспект настоящего изобретения, описанный в настоящем документе, относится к GLA соединениям, имеющим структуру в соответствии со следующей формулой (I):
(I),
или их фармацевтически приемлемой соли, где значения L1, L2, L3, L4, L5, L6, L7, L8, L9, L10, Y1, Y2, Y3, Y4, R1, R2, R3, R4, R5, R6 определены в настоящем документе.
GLA соединения по настоящему изобретению применимы в широком диапазоне терапевтических применений, при которых желательна индукция специфических или неспецифических иммунных ответов. Например, определенные аспекты настоящего изобретения относятся к вакцинным композициям, содержащим одно или несколько GLA соединений, изложенных в настоящем документе, в сочетании с антигеном. Такие вакцинные композиции могут быть эффективно использованы в соответствии со способами стимулирования антиген-специфических иммунных ответов у нуждающихся в этом субъектов. Другие аспекты настоящего изобретения относятся к фармацевтическим композициям, содержащим одно или несколько GLA соединений, изложенных в настоящем документе, причем композиции по существу не содержат антиген. Такие фармацевтические композиции могут быть эффективно использованы в способах стимулирования неспецифических иммунных ответов у нуждающихся в этом субъектов, например, при лечении инфекции, сезонного ринита и т.п.
Эти и другие аспекты настоящего изобретения станут очевидны при рассмотрении последующего подробного описания и приложенных графических материалов. Кроме того, в настоящем документе приведены различные ссылки, которые более подробно описывают определенные аспекты настоящего изобретения и, следовательно, включены во всей их полноте в настоящий документ посредством ссылки.
КРАТКОЕ ПОЯСНЕНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На фигуре 1 продемонстрирована продукция цитокина IFN-γ, индуцированная in vivo после вакцинации мышей композициями по настоящему изобретению, содержащими антиген и GLA.
На фигурах 2A-2F продемонстрирован гуморальный иммунный ответ, индуцированный in vivo после вакцинации мышей композициями по настоящему изобретению, содержащими антиген и GLA.
На фигуре 3 представлена активация NF-kB, наблюдаемая при различных концентрациях типичного GLA соединения по настоящему изобретению (соединение IX).
На фигурах 4A-4D представлена индукция иммуностимулирующих цитокинов (MIP-1b и TNFα) при различных концентрациях типичного GLA соединения по настоящему изобретению (соединение IX).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Известно, что монофосфориллипид A (MPL) и другие родственные адъюванты опосредуют свои эффекты, по меньшей мере частично, действуя как агонисты Toll-подобных рецепторов (TLR). Глюкопиранозиллипидные адъювантные (GLA) соединения по настоящему изобретению были рационально разработаны на основе пространственных структурных принципов стимуляции TLR рецепторов. Более конкретно, в соответствии с настоящим изобретением путем селективного определения длин ацильных цепей GLA соединений по настоящему изобретению так, что они достигают «плоской» нижней части в трехмерной структуре соединений, в участке связывания TLR рецептора может быть достигнуто улучшенное соответствие, что тем самым приводит к усиленной стимуляции TLR и улучшенным иммуностимулирующим свойствам. Кроме того, растворимость GLA соединений по настоящему изобретению (например, в водных растворах) эффективно повышается из-за уменьшенной длины ацильных цепей, что тем самым облегчает действенность и эффективное включение соединений в составы. Более того, поскольку значения длины ацильных цепей приспособлены для того, чтобы делать трехмерную молекулу «плоской» по нижней части молекулы, соединения могут быть более эффективно включены в везикулы, например, липосомных составов.
Кроме того, соединения по настоящему изобретению характеризуются благоприятными профилями активности по отношению к токсичности. Например, соединения по настоящему изобретению могут быть использованы в широком и относительно высоком диапазоне дозировок для достижения желаемого уровня активности (например, адъювантной активности), оставаясь в то же время по существу нетоксичными для человеческих клеток и для пациентов-людей, что проанализировано, например, по содержанию фактора некроза опухоли, продуцируемого человеческими клетками, в диапазоне концентраций, которое быстро повышается и выравнивается, в отличие от других более токсичных агонистов TLR4, таких как липополисахарид. Такой клеточный анализ может прогнозировать меньшее содержание маркеров воспаления, подобных C-реактивному белку, вовлеченному в нежелательные фармакологические явления. Благоприятная активность относительно профиля токсичности соединений по настоящему изобретению может быть особенно важна, например, при введении детям, у которых толерантность к цитокинам может быть более низкой, или когда соединения используются в составах, предназначенных для большой популяции, где более выровненные ответы будут обуславливать более сопоставимые клинические результаты у людей с разнообразной отвечаемостью на агонизм TLR. Подобным образом, получение разрешения контролирующего органа будет упрощено, поскольку целевое дозирование будет более щадящим, а также будет упрощено производство, если диапазон содержаний активного фармацевтического ингредиента не нужно жестко контролировать как предельно допустимое содержание.
Таким образом, настоящее изобретение во многих своих вариантах осуществления относится к соединениям, вакцинным композициям, адъювантным композициям, фармацевтическим композициям и связанным с ними составам и способам, которые включают синтетические GLA соединения, как описано в настоящем документе. GLA соединения представляют собой синтетические иммуномодуляторы, которые преимущественно по отношению к адъювантам известного уровня техники и, в частности, по отношению к адъювантам из природных продуктов могут быть получены главным образом в гомогенной форме. Более того, GLA соединения по настоящему изобретению могут быть получены эффективно и экономично путем крупномасштабного синтетического химического производства в отличие от получаемых из природных продуктов адъювантов. Поскольку синтетический адъювант, то есть химически синтезированный из определенных исходных материалов с получением химически определенного продукта, проявляет от партии к партии качественное и количественное постоянство, GLA соединения по настоящему изобретению имеют преимущества, включая улучшенный контроль качества продукции.
Как описано в настоящем документе, GLA соединения, композиции и способы их применения включают в некоторых вариантах осуществления применение GLA самого по себе с фармацевтически приемлемым носителем или наполнителем для иммунологической адъювантной активности (например, неспецифической иммуностимулирующей активности), включая «адъювантирование», при котором введение GLA субъекту может быть совершенно независимым и/или разнесенным во времени и/или пространстве относительно введения субъекту одного или нескольких антигенов, к которым желательно индуцировать или усилить иммунный ответ (например, антиген-специфический ответ) у субъекта. Другие варианты осуществления относятся к применению GLA в составе вакцинной композиции, которая также включает один или множество антигенов, к которым желательно индуцировать или усилить иммунный ответ с помощью такой вакцины.
Как описано в настоящем документе, такие вакцинные композиции в определенных связанных вариантах осуществления также могут включать один или несколько агонистов Toll-подобного рецептора (TLR) и/или один или множество из одного или нескольких коадъювантов, имидазохинолиновый модификатор иммунного ответа и иммуномодификатор с двойной структурой «стебель-петля» (dSLIM). В других связанных вариантах осуществления вакцинная композиция, как представлено в настоящем документе, может включать GLA и один или несколько рекомбинантных экспрессирующих конструктов, каждый из которых включает промотор, функционально связанный с последовательностью нуклеиновой кислоты, кодирующей антиген, к которому желательно индуцировать или усилить иммунный ответ (например, антиген-специфический ответ) у субъекта.
GLA
Как отмечено выше, поскольку GLA является химически синтезированным адъювантом, он может быть получен по существу в гомогенной форме, что относится к GLA препарату, который характеризуется чистотой по меньшей мере 80%, предпочтительно по меньшей мере 85%, более предпочтительно по меньшей мере 90%, более предпочтительно по меньшей мере 95% и еще более предпочтительно по меньшей мере 96%, 97%, 98% или 99% по молекуле GLA.
GLA соединения по настоящему изобретению имеют следующую формулу (I):
(I),
или их фармацевтически приемлемая соль, где
L1, L2, L3, L4, L5 и L6 являются одинаковыми или различными и независимо представляют собой -O-, -NH- или -(CH2)-;
L7, L8, L9 и L10 являются одинаковыми или различными и независимо отсутствуют или представляют собой -С(=O)-;
Y1 представляет собой кислотную функциональную группу;
Y2 и Y3 являются одинаковыми или различными и независимо представляют собой -OH, -SH или кислотную функциональную группу;
Y4 представляет собой -OH или -SH;
R1, R3, R5 и R6 являются одинаковыми или различными и независимо представляют собой C8-13алкил; и
R2 и R4 являются одинаковыми или различными и независимо представляют собой C6-11алкил.
Используемые в настоящем документе вышеупомянутые термины имеют следующие значения.
«Алкил» означает с неразветвленной или разветвленной цепью, нециклический или циклический, ненасыщенный или насыщенный алифатический углеводород, содержащий от 1 до 20 атомов углерода, а в определенных предпочтительных вариантах осуществления содержащий от 11 до 20 атомов углерода. Типичные насыщенные алкилы с неразветвленной цепью включают метил, этил, н-пропил, н-бутил, н-пентил, н-гексил и т.п., включая ундецил, додецил, тридецил, тетрадецил, пентадецил, гексадецил, гептадецил, октадецил и т.д.; тогда как насыщенные разветвленные алкилы включают изопропил, втор-бутил, изобутил, трет-бутил, изопентил и т.п. Типичные насыщенные циклические алкилы включают циклопропил, циклобутил, циклопентил, циклогексил и т.п.; тогда как ненасыщенные циклические алкилы включают циклопентенил, циклогексенил и т.п. Циклические алкилы также упоминаются в настоящем документе как «гомоциклы» или «гомоциклические кольца». Ненасыщенные алкилы содержат по меньшей мере одну двойную или тройную связь между соседними атомами углерода (упоминаются как «алкенил» или «алкинил», соответственно). Типичные алкенилы с неразветвленной и разветвленной цепью включают этиленил, пропиленил, 1-бутенил, 2-бутенил, изобутиленил, 1-пентенил, 2-пентенил, 3-метил-1-бутенил, 2-метил-2-бутенил, 2,3-диметил-2-бутенил и т.п.; тогда как типичные алкинилы с неразветвленной и разветвленной цепью включают ацетиленил, пропинил, 1-бутинил, 2-бутинил, 1-пентинил, 2-пентинил, 3-метил-1-бутинил и т.п.
«C8-13алкил» и «C6-11алкил» означают алкил, определенный выше, содержащий 8-13 или 6-11 атомов углерода, соответственно.
«Кислотная функциональная группа» означает функциональную группу, способную донировать протон в водной среде (а именно кислоту Бренстеда-Лоури). После донирования протона кислотная функциональная группа становится отрицательно заряженной частицей (а именно сопряженным основанием кислотной функциональной группы). Примеры кислотных функциональных групп включают без ограничения -OP(=O)(OH)2 (фосфат), -OS(=O)(OH)2 (сульфат), -OS(OH)2 (сульфит), -C(=O)OH (карбоксилат), -OC(=O)CH(NH2)CH2C(=O)OH (аспартат), -OC(=O)CH2CH2C(=O)OH (сукцинат) и -OC(=O)CH2OP(=O)(OH)2 (карбоксиметилфосфат).
В более конкретных вариантах осуществления настоящее изобретение относится к GLA соединениям формулы (I), где L5 и L6 оба представляют собой -O-, а каждый из L7, L8, L9 и L10 представляет собой -C(=O)-, и GLA соединения имеют следующую формулу (II):
(II).
В более конкретных вариантах осуществления настоящее изобретение относится к GLA соединениям формулы (II), где каждый из R1, R3, R5 и R6 представляет собой Cxалкил, где x является постоянной и выбирают из целых чисел от 8 до 13, а R2 и R4 оба представляют собой Cx-2алкил, и GLA соединения имеют следующую формулу (III):
(III).
В других более конкретных вариантах осуществления настоящее изобретение относится к GLA соединениям формулы (III), где x выбирают из целых чисел от 10 до 12.
В других более конкретных вариантах осуществления настоящее изобретение относится к GLA соединениям формулы (III), где x равен 11, и GLA соединения имеют следующую структуру (IV):
(IV).
В следующих конкретных вариантах осуществления настоящее изобретение относится к GLA соединениям формулы (II), где Y1 представляет собой -OP(=O)(OH)2, а каждый из Y2, Y3 и Y4 представляет собой -OH, и GLA соединения имеют следующую формулу (V):
(V).
В других конкретных вариантах осуществления настоящее изобретение относится к GLA соединениям формулы (II), где L1 и L3 оба представляют собой -O-, а L2 и L4 оба представляют собой -NH-, и GLA соединения имеют следующую формулу (VI):
(VI).
В еще более конкретных вариантах осуществления настоящее изобретение относится к GLA соединениям формулы (II), где Y1 представляет собой -OP(O)(OH)2, каждый из Y2, Y3 и Y4 представляет собой -OH, L1 и L3 оба представляют собой -O-, и L2 и L4 оба представляют собой -NH-, и GLA соединения имеют следующую формулу (VII):
(VII).
В следующих конкретных вариантах осуществления настоящее изобретение относится к GLA соединениям формулы (II), где Y1 представляет собой -OP(O)(OH)2, каждый из Y2, Y3 и Y4 представляет собой -OH, L1 и L3 оба представляют собой -O-, L2 и L4 оба представляют собой -NH-, каждый из R1, R3, R5 и R6 представляет собой Cxалкил, где x является постоянной и выбирают из целых чисел от 8 до 13, и R2 и R4 оба представляют собой Cx-2алкил, и GLA соединения имеют следующую формулу (VIII):
(VIII).
В более конкретных вариантах осуществления формулы (VIII) x равен 11, и настоящее изобретение относится к GLA соединению, имеющему следующую структуру (IX):
(IX).
GLA соединения
Как упоминалось выше, настоящее изобретение относится к GLA соединениям. GLA соединения по настоящему изобретению могут быть получены известными методиками органического синтеза, включая способы, описанные более подробно в примерах. В общем, GLA соединения структуры (I) могут быть получены в соответствии со следующими схемами реакций, в которых все заместители определены выше, если иное не указано особо.
Схема реакций 1
Углеводный скелет типичных GLA соединений, как правило, может быть получен согласно схеме реакций 1, где G1, G2, G3, G4, G5, G6, G7, G8, G9 и G10 являются либо одинаковыми, либо различными и независимо замещенными соответствующей защитной группой или водородом. Соответствующий сахар, такой как (i), может быть приобретен или получен в соответствии со способами, известными специалисту в данной области. Функциональные группы сахара (i) затем могут быть полностью защищены с использованием способов, известных специалисту в данной области, с получением (ii). В этом отношении специалисту в данной области будет понятно, какая соответствующая стратегия использования ортогональных защитных групп, которая обеспечивает селективное снятие защиты сахарных функциональных групп, может быть использована. Подходящие защитные группы включают без ограничения силиловые эфиры, бензиловые эфиры, аллилоксикарбонил, ацетали, Fmoc, азид и т.п. Снятие защиты с G1 в результате дает свободный спирт (iii), который затем может быть соединен с защищенным сахаром (iv) с использованием соответствующих условий соединения, например, CCl3CN/NaH, с получением желаемого скелета сахара (v).
Схема реакций 2
Типичные концевые части GLA соединения, в которых оба L5 и L6 представляют собой -O-, а каждый из L7, L8, L9 и L10 представляет собой -C(=O)-, обычно могут быть получены в соответствии со схемой реакций 2, на которой G11 представляет соответствующую защитную группу. Кислотные соединения структуры (vi) могут быть приобретены или получены в соответствии со способами, известными специалисту в данной области. Реакция (vi) с соответствующим реагентом, таким как монометиловый эфир малоновой кислоты, позволяет получить кетоэфир (vii). Восстановление (vii) позволяет получить спирт (viii). Специалисту в данной области будет понятно, что при соответствующих условиях кетогруппа (vii) может быть восстановлена стереоспецифически, как представлено в примерах. Сапонификация (viii) позволяет получить кислоту (ix), которая может быть впоследствии защищена с выходом (x). Обработка (x) хлорангидридом (xi) позволяет получить (xii), которое при снятии защиты позволяет получить (xiii). Оба соединения (ix) и (xiii) могут быть превращены в соответственно защищенное производное хлорангидрида способами, известным специалисту в данной области, и присоединены к углеводному скелету GLA соединения, как показано ниже в схеме реакций 3. Хотя на схеме реакций 2 изображен синтез концевой части GLA соединения, включающей R1 и R2, следует понимать, что аналогичным способом также могут быть получены другие концевые части, включающие другие алкильные группы (например, R3, R4, R5 и R6). Также аналогичным способом могут быть получены другие концевые части с различными группами L5, L6, L7, L8, L9 и L10.
Схема реакций 3
Обычно типичные GLA соединения могут быть получены согласно схеме реакций 3, в которой G12 и G13 являются одинаковыми или различными и независимо представляют соответствующую защитную группу. Удаление защитной группы G5 (v) с последующей реакцией с хлорангидридом (xiv) позволяет получить (xv). Подобным образом, удаление защитной группы G8 с (xv) с последующей реакцией с хлорангидридом (xvi) позволяет получить в результате (xvii). Снятие защиты (xvii) и реакция с хлорангидридом (xviii) позволяет получить (xix). Удаление G9 и реакция с (xx) затем позволяет получить защищенное GLA соединение (xxi). Полное снятие защиты (xxi) позволяет получить в результате соединение структуры (II). Хотя схема реакций 3 изображает синтез соединения структуры (II), специалисту в данной области будет понятно, что для получения какого-либо соединения структуры (I) могут быть использованы аналогичные способы. Кроме того, специалисту в данной области также будет понятно, что при выборе соответствующих защитных групп окончательное снятие защиты позволяет получить в результате желаемое соединение.
Соединения по настоящему изобретению, как правило, могут быть использованы как свободное основание или свободная кислота. Альтернативно, соединения по настоящему изобретению могут быть использованы в форме кислотно- или основно-аддитивных солей. Кислотно-аддитивные соли свободных аминосоединений по настоящему изобретению могут быть получены способами, хорошо известными в данной области, и могут быть образованы из органических и неорганических кислот. Подходящие органические кислоты включают малеиновую, фумаровую, бензойную, аскорбиновую, янтарную, метансульфоновую, уксусную, щавелевую, пропионовую, винную, салициловую, лимонную, глюконовую, молочную, миндальную, коричную, аспарагиновую, стеариновую, пальмитиновую, гликолевую, глутаминовую и бензолсульфоновую кислоты. Подходящие неорганические кислоты включают хлористоводородную, бромистоводородную, серную, фосфорную и азотную кислоты.
Подобным образом, основно-аддитивные соли кислотных соединений по настоящему изобретению могут быть получены способами, хорошо известными в данной области, и могут быть образованы из органических и неорганических оснований. Подходящие органические основания включают без ограничения триэтиламин и пиридин. Подходящие неорганические основания включают без ограничения гидроксид натрия, гидроксид калия, карбонат натрия, карбонат калия и аммиак. Таким образом, термин «фармацевтически приемлемая соль» структуры (I) предназначен охватывать любые и все приемлемые формы солей.
Кроме того, пролекарства также включены в контекст настоящего изобретения. Пролекарства представляют собой любые ковалентно связанные носители, которые высвобождают соединение структуры (I) in vivo при введении такого пролекарства пациенту. Как правило, пролекарства получаются путем модификации функциональных групп таким образом, что при отщеплении модификации или в результате стандартной манипуляции или in vivo получается исходное соединение. Пролекарства включают, например, соединения по настоящему изобретению, в которых гидрокси, аминная или сульфгидрильная группы связаны с любой группой, которая при введении пациенту отщепляется с образованием гидрокси, аминной или сульфгидрильной групп. Таким образом, типичные примеры пролекарств включают (без ограничения) ацетатные, формиатные и бензоатные производные спиртовой и аминной функциональных групп соединений структуры (I). Более того, в случае карбоновой кислоты (COOH), могут быть использованы сложные эфиры, такие как сложные метиловые эфиры, сложные этиловые эфиры и т.п.
Что касается стереоизомеров, то соединения структуры (I) могут иметь хиральные центры и могут встречаться как рацематы, рацемические смеси и как отдельные энантиомеры или диастереомеры. Все эти изомерные формы включены в настоящее изобретение, включая их смеси. Более того, некоторые из кристаллических форм соединений структуры (I) могут существовать как полиморфы, которые включены в настоящее изобретение. Кроме того, некоторые из соединений структуры (I) также могут формировать сольваты с водой или другими органическими растворителями. Такие сольваты аналогично включены в объем настоящего изобретения.
Антиген
Антиген для применения в определенных вариантах осуществления описанных в настоящем документе вакцинных композиций и способов, использующих GLA, может быть любым целевым эпитопом, молекулой (включая биомолекулу), молекулярным комплексом (включая молекулярные комплексы, которые содержат биомолекулы), субклеточным ансамблем, клеткой или тканью, к которым желательно индуцировать или усилить иммунореактивность у субъекта. Часто термин «антиген» будет относиться к интересующему полипептидному антигену. Однако термин «антиген», используемый в настоящем документе, также может относиться к рекомбинантному конструкту, который кодирует интересующий полипептидный антиген, например, к экспрессирующему конструкту. В определенных предпочтительных вариантах осуществления антиген может представлять собой или может быть получен из или может быть иммунологически перекрестно реагирующим с инфекционным патогеном и/или эпитопом, биомолекулой, клеткой или тканью, которые связаны с инфекцией, злокачественной опухолью, аутоиммунным заболеванием, аллергией, бронхиальной астмой или каким-либо другим состоянием, при котором стимуляция антиген-специфического иммунного ответа была бы желательна или полезна.
Предпочтительно и в определенных вариантах осуществления вакцинные составы по настоящему изобретению содержат антиген или антигенную композицию, способную индуцировать иммунный ответ к патогену человека или другого млекопитающего, причем антиген или антигенная композиция может включать композицию, полученную из вируса, такого как ВИЧ-1 (например, tat, nef, gp120 или gp160), вирусов герпеса человека, например, gD или его производные, или предраннего белка, такого как ICP27 из HSV1 или HSV2, цитомегаловируса ((особенно человека) (например, gB или его производные), ротавируса (включая живые аттенуированные вирусы), вируса Эпштейна-Барра (например, gp350 или его производные), вируса ветряной оспы (например, gpI, II и IE63) или из вируса гепатита, такого как вирус гепатита В (например, поверхностный антиген вируса гепатита В или его производное), вирус гепатита А, вирус гепатита С и вирус гепатита Е, или из других вирусных патогенов, таких как парамиксовирусы: респираторный синцитиальный вирус (например, F и G белки или их производные), вирус парагриппа, вирус кори, вирус эпидемического паротита, вирусы папилломы человека (например, HPV6, 11, 16, 18 и т.д.), флавивирусы (например, вирус желтой лихорадки, вирус лихорадки Денге, вирус клещевого энцефалита, вирус японского энцефалита) или вирус гриппа (цельный живой или инактивированный вирус, расщепленный вирус гриппа, выращенный на яйцах или MDCK клетках, или цельные виросомы вируса гриппа (как описано в Gluck, Vaccine, 1992, 10, 915-920) или их очищенные или рекомбинантные белки, такие как HA, NP, NA или M белки, или их комбинации).
В некоторых других предпочтительных вариантах осуществления вакцинные составы по настоящему изобретению содержат антиген или антигенную композицию, способную индуцировать иммунный ответ к патогену человека или другого млекопитающего, причем антиген или антигенная композиция может включать композицию, полученную из одного или нескольких бактериальных патогенов, таких как Neisseria spp., включая N. gonorrhea и N. meningitidis (например, их капсулярные полисахариды и конъюгаты, связывающие трансферрин белки, связывающие лактоферрин белки, PilC, адгезины); S. pyogenes (например, M белки или их фрагменты, C5A-протеаза, липотейхоевые кислоты), S. agalactiae, S. mutans; H. ducreyi; Moraxella spp., включая M. catarrhalis, также известную как Branhamella catarrhalis (например, высоко- и низкомолекулярные адгезины и инвазины); Bordetella spp., включая B. pertussis (например, пертактин, коклюшевый токсин или его производные, филаментный гемагглютинин, аденилатциклаза, фимбрия), B. parapertussis и B. bronchiseptica; Mycobacterium spp., включая M. tuberculosis (например, ESAT6, антиген 85A, -B или -C), M. bovis, M. leprae, M. avium, M. paratuberculosis, M. smegmatis; Legionella spp., включая L. pneumophila; Escherichia spp., включая энтеротоксическую E. coli (например, факторы колонизации, термолабильный токсин или его производные, термостойкий токсин или его производные), энтерогеморрагическую E. coli, энтеропатогенную E. coli (например, токсин, подобный токсину Шига или его производные); Vibrio spp., включая V. cholera (например, холерный токсин или его производные); Shigella spp., включая S. sonnei, S. dysenteriae, S. flexnerii; Yersinia spp., включая Y. enterocolitica (например, Yop белок), Y. pestis, Y. pseudotuberculosis; Campylobacter spp., включая C. jejuni (например, токсины, адгезины и инвазины) и C. coli; Salmonella spp., включая S. typhi, S. paratyphi, S. choleraesuis, S. enteritidis; Listeria spp., включая L. monocytogenes; Helicobacter spp., включая H. pylori (например, уреаза, каталаза, вакуолизирующий токсин); Pseudomonas spp., включая P. aeruginosa; Staphylococcus spp., включая S. aureus, S. epidermidis; Enterococcus spp., включая E. faecalis, E. faecium; Clostridium spp., включая C. tetani (например, столбнячный токсин и его производное), C. botulinum (например, ботулинический токсин и его производное), C. difficile (например, клостридиумные токсины A или B и их производные); Bacillus spp., включая B. anthracis (например, ботулинический токсин и его производные); Corynebacterium spp., включая C. diphtheriae (например, дифтерийный токсин и его производные); Borrelia spp., включая B. burgdorferi (например, OspA, OspC, DbpA, DbpB), B. garinii (например, OspA, OspC, DbpA, DbpB), B. afzelii (например, OspA, OspC, DbpA, DbpB), B. andersonii (например, OspA, OspC, DbpA, DbpB), B. hermsii; Ehrlichia spp., включая E. equi и возбудитель гранулоцитарного эрлихиоза человека; Rickettsia spp., включая R. rickettsii; Chlamydia spp., включая C. trachomatis (например, MOMP, связывающие гепарин белки), C. pneumoniae (например, MOMP, связывающие гепарин белки), C. psittaci; Leptospira spp., включая L. interrogans; Treponema spp., включая T. pallidum (например, редкие белки наружной мембраны), T. denticola, T. hyodysenteriae или другие бактериальные патогены.
В некоторых других предпочтительных вариантах осуществления вакцинные составы по настоящему изобретению содержат антиген или антигенную композицию, способную индуцировать иммунный ответ к патогену человека или другого млекопитающего, причем антиген или антигенная композиция может включать композицию, полученную из одного или нескольких паразитов (см., например, John, D.T. and Petri, W.A., Markell and Voge's Medical Parasitology-9th Ed., 2006, WB Saunders, Philadelphia; Bowman, D.D., Georgis' Parasitology for Veterinarians-8th Ed., 2002, WB Saunders, Philadelphia), таких как Plasmodium spp., включая P. falciparum; Toxoplasma spp., включая T. gondii (например, SAG2, SAG3, Tg34); Entamoeba spp., включая E. histolytica; Babesia spp., включая B. microti; Trypanosoma spp., включая T. cruzi; Giardia spp., включая G. lamblia; Leishmania spp., включая L. major; Pneumocystis spp., включая P. carinii; Trichomonas spp., включая T. vaginalis; или из гельминта, способного инфицировать млекопитающего, например, (i) нематодные инфекции (включая без ограничения Enterobius vermicularis, Ascaris lumbricoid