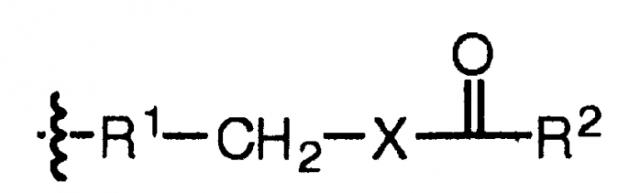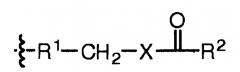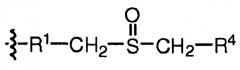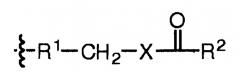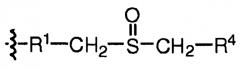Аналоги глюкагона, обладающие повышенной растворимостью и стабильностью в буферах с физиологическими значениями ph
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к получению модифицированных пептидов глюкагона, и может быть использовано в медицине. Получают пептид глюкагона с активностью агониста глюкагона, характеризующийся аминокислотной последовательностью SEQ ID NO: 1, содержащей вплоть до 7 аминокислотных замещений по отношению к SEQ ID NO: 1, где одно из замещений аминокислот представляет собой замещение глютамина в положении 3 последовательности SEQ ID NO: 1 на аминокислоту, содержащую боковую цепь структуры I, и где аминокислота в положении 16 пептида глюкагона представляет собой аминоизомасляную кислоту (AIB). Изобретение позволяет получить агонисты глюкагона, обладающие повышенной растворимостью и стабильностью. 8 н. и 4 з.п. ф-лы, 17 ил., 12 табл., 28 пр.
Реферат
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка утверждает приоритет относительно следующих заявок: предварительная заявка на патент США No. 61/073193, зарегистрированная 17 июня 2008 года, предварительная заявка на патент США No. 61/078165, зарегистрированная 3 июля 2008 года, и предварительная заявка на патент США No. 61/090415, зарегистрированная 20 августа 2008 года. Описание каждого из указанных документов включено в настоящую заявку полностью в качестве ссылок.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Проглюкагон представляет собой предшественник полипептидной природы, состоящий из 158 аминокислот, который процессируется в разных тканях с образованием множества разнообразных получаемых из проглюкагона пептидов, включающих глюкагон, глюкагон-подобный пептид-1 (GLP-1), глюкагон-подобный пептид-2 (GLP-2) и оксинтомодулин (OXM), которые вовлекаются в большое множество физиологических функций, включающих поддержание гомеостаза глюкозы, секрецию инулина, опорожнение желудка и рост клеток кишечника, а также регуляцию приема пищи. Глюкагон представляет собой пептид из 29 аминокислот, которые соответствуют участку преглюкагона от 33 до 61 аминокислоты, а GLP-1 образуется в виде пептида из 37 аминокислот, что соответствует в преглюкагоне участку от 72 до 108 аминокислоты.
Гипогликемия возникает в том случае, когда уровни глюкозы в крови падают настолько сильно, что создается проблема в обеспечении организма достаточным уровнем энергии для осуществления его активности. У взрослых или детей старше 10 лет гипогликемия встречается достаточно редко, если не рассматривать случаи побочного эффекта лечения диабета, хотя она может быть результатом других методов лечения или определенных заболеваний, а также развиваться из-за недостаточности гормонов или ферментов или определяться развитием опухоли. В том случае, когда уровень глюкозы в крови начинает падать, глюкагон, будучи гормоном, продуцируемым поджелудочной железой, подает печени сигнал о необходимости расщепления гликогена и высвобождения глюкозы, что будет вызывать повышение уровней глюкозы в крови до нормального значения. Таким образом, по имеющимся данным, наиболее значимой ролью глюкагона в регуляции глюкозы является противодействие активности инсулина и поддержание нормальных уровней глюкозы в крови. Однако в случае диабета такой ответ глюкагона на гипогликемию может быть изменен, что затрудняет процесс нормализации уровней глюкозы.
Гипогликемия представляет собой опасное для жизни состояние, требующее немедленного медицинского вмешательства. Введение глюкагона представляет собой установленный способ лечения острой гликемии, поскольку он позволяет восстановить нормальный уровень глюкозы в течение нескольких минут после введения. В том случае, когда глюкагон используют в рамках острого медицинского лечения гипогликемии, кристаллическую форму глюкагона солюбилизируют разбавленным кислотным буфером и полученный раствор инъецируют внутримышечно. Несмотря на эффективность такого лечения, данная методика является сложной и опасной, если пациент находится в полубессознательном состоянии. Соответственно, имеется потребность в аналоге глюкагона, который бы сохранял биологические характеристики исходной молекулы и был достаточно растворимым и стабильным в релевантных физиологических условиях, так чтобы его можно было вводить в состав предварительных композиций в виде раствора, готового для инъекции.
Кроме того, диабетикам рекомендуется поддерживать примерно нормальный уровень глюкозы в крови, с тем, чтобы задерживать или предупреждать развитие осложнений микрососудистого характера. Обычно, для достижения этой цели требуется интенсивная инсулиновая терапия. В этой связи, лечащим врачам приходится значительно увеличивать частоту введения, что, соответственно, повышает выраженность гипогликемии у диабетических пациентов. Соответственно, есть потребность в улучшенных фармацевтических препаратах и способах лечения диабета, которые бы в меньшей мере индуцировали развитие гипогликемии, чем проводимая в настоящее время инсулиновая терапия.
В настоящей заявке описываются агонисты глюкагона с высокой эффективностью, которые обладают повышенной биофизической стабильностью и водорастворимостью в диапазоне физиологических значений pH в составе фармацевтических композиций, подходящих для коммерческого использования. Нативный глюкагон не является ни растворимым, ни стабильным в диапазоне физиологических значений pH и, в этой связи, его необходимо изготавливать в виде сухого продукта, который требуется восстанавливать и затем уже использовать. Приведенные в настоящем описании аналоги глюкагона обладают улучшенными физическими свойствами, что делает их более подходящими для использования в условиях медицинских учреждений, где в настоящее время используют нативный гормон. Указанные соединения могут использоваться для получения растворов предварительных композиций, готовых для инъекций при лечении гипогликемии. Альтернативно, агонисты глюкагона могут вводиться совместно с инсулином для забуферивания эффектов инсулина, с тем, чтобы поддерживать более стабильные уровни глюкозы в крови. Дополнительно, в настоящем описании приведены другие полезные варианты применения композиций, включающих модифицированные пептиды глюкагона по настоящему описанию.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Один вариант осуществления настоящего изобретения относится к пептидам глюкагона, которые сохраняют активность рецептора глюкагона и обладают улучшенной растворимостью в сравнении с нативным пептидом глюкагона (SEQ ID NO: 1). Нативный глюкагон обладает плохой растворимостью в водных растворах, особенно при физиологических значениях pH, и демонстрирует тенденцию к агрегации и осаждению с течением времени. Тогда как пептиды глюкагона по одному из вариантов осуществления настоящего изобретения демонстрируют по меньшей мере в 2 раза, в 5 раз или еще более высокую растворимость, в сравнении с нативным глюкагоном, в диапазоне значений pH от 6 до 8, или от 6 до 9, например, при значении pH 7, через 24 часа хранения при температуре 25°С.
В одном варианте осуществления настоящего изобретения, пептиды глюкагона сохраняют по меньшей мере 10%, 20%, 30%, 40%, 50%, 60%, 70%, 75% активности, 80% активности, 85% активности или 90% активности нативного глюкагона (где указанный показатель рассчитан как обратное соотношение значений EC50 для пептида глюкагона относительно самого глюкагона, например, определяемых при оценке продукции цАМФ в рамках теста, описанного в общих чертах в примере 13). В одном варианте осуществления настоящего изобретения, пептиды глюкагона по настоящему изобретению обладают такой же активностью, что и глюкагон, или еще более высокой активностью (в данном описании термины «активность» и «эффективность» используются как синонимы), чем глюкагон. В некоторых вариантах осуществления настоящего изобретения, пептиды глюкагона сохраняют примерно до 100%, 1000% 10000%, 100000% или 1000000% относительно активности нативного глюкагона.
В норме, глюкагон характеризуется примерно 1% активности от нативного GLP-1 по рецептору GLP-1. Амид GLP-1 (7-36) SEQ ID NO: 57 или кислотная форма GLP-1 (7-37) (SEQ ID NO: 58) представляют собой биологически активные формы GLP-1, которые обладают по существу эквивалентной активностью по рецептору GLP-1. Кроме того, глюкагон характеризуется в 10-20 большей селективностью по рецептору глюкагона, чем по рецептору GLP-1 (селективность рассчитывают как обратное соотношение показателя ЕС50 для глюкагона по рецептору глюкагона в сравнении с его активностью по рецептору GLP-1). Например, биотесты, в которых показатель ЕС50 глюкагона по рецептору глюкагона составляет 0,22 нМ и показатель ЕС50 для рецептора GLP-1 составляет 3,85 нМ, расчетный показатель селективности составляет 17, 5 раз. Активность может быть определена, например, по уровню продукции цАМФ с использованием методики, в общих чертах описанной в примере 13. В некоторых вариантах осуществления настоящего изобретения, пептиды глюкагона по настоящему изобретению характеризуются наличием менее чем примерно 5%, 4%, 3%, 2% или 1% активности от нативного GLP-1 по рецептору GLP-1 и/или более чем примерно 5-кратной, 10-кратной или 15-кратной селективностью для рецептора глюкагона в сравнении с рецептором GLP-1. Так, например, в некоторых вариантах осуществления настоящего изобретения, пептиды глюкагона по настоящему изобретению характеризуются наличием менее чем 5% активности нативного GLP-1 по рецептору GLP-1 и демонстрируют более чем 5-кратную селективность для рецептора глюкагона в сравнении с селективностью по рецептору GLP-1.
Любой из описанных в настоящем изобретении пептидов глюкагона может дополнительно характеризоваться улучшенной стабильностью и/или сниженным уровнем разложения, и, например, будет сохранять по меньшей мере 95% от исходной активности пептида через 24 часа при температуре 25°С. В некоторых вариантах осуществления настоящего изобретения, пептиды глюкагона по настоящему изобретению демонстрируют повышенную стабильность, так что по меньшей мере 75% (например, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, более чем 95%, вплоть до 100%) от концентрации пептида или менее чем примерно 25% (например, менее чем 20%, менее чем 15%, менее чем 10%, менее чем 5%, менее чем 4%, 3%, 2%, 1% вплоть до 0%) разложенного пептида выявляется в растворе при длине волны 280 нМ с использованием ультрафиолетового (УФ) детектора через 1 неделю или более (например, через 2 недели, 4 недели, 1 месяц, 2 месяца, четыре месяца, шесть месяцев, восемь месяцев, десять месяцев, двенадцать месяцев) при температуре, составляющей по меньшей мере 20°С (например, 21°С, 22°С, 23°С, 24°С, 25°С, 26°С, по меньшей мере 27,5°С, по меньшей мере 30°С, по меньшей мере 35°С, по меньшей мере 40°С, по меньшей мере 50°С) и меньше, чем примерно 100°С, меньше, чем 85°С, меньше, чем 75°С или меньше, чем 70°С.
Один из вариантов осуществления настоящего изобретения относится к пептиду глюкагона с улучшенной растворимостью, где указанный пептид был модифицирован за счет аминокислотных замещений и/или добавления заряженной аминокислоты в С-концевую часть пептида, и в одном варианте в положении от С-конца до 27 положения в SEQ ID NO: 1. Необязательно, в С-концевую часть могут быть введены одна, две или три заряженных аминокислоты, а в одном варианте, на участке от С-конца до положения 27. Согласно одному из вариантов, одна или обе нативные аминокислоты в положении 28 и/или 29 замещают заряженной аминокислотой, и/или одна-три заряженных аминокислоты добавляют к С-концу пептида после положения 29. В репрезентативных вариантах осуществления настоящего изобретения, одна, две или все заряженные аминокислоты заряжены отрицательно. В пептид глюкагона могут быть введены дополнительные модификации, например, консервативное замещение, что также способствует сохранению активности глюкагона.
Согласно одному репрезентативному варианту осуществления настоящего изобретения, пептид глюкагона включает аминокислотную последовательность SEQ ID NO: 11 или ее аналог, который содержит 1-3 дополнительных аминокислотных модификации, в сравнении с нативным глюкагоном, или соответствующий аналог агониста глюкагона. Последовательность SEQ ID NO: 11 обозначает модифицированный пептид глюкагона, где остаток аспарагина в положении 28 нативного белка был замещен аспарагиновой кислотой. В другом репрезентативном варианте осуществления настоящего изобретения, пептид глюкагона включает аминокислотную последовательность SEQ ID NO: 38, где остаток аспарагина в положении 28 нативного белка был замещен глютаминовой кислотой. Другие репрезентативные варианты включают пептиды глюкагона с последовательностями SEQ ID NO: 24, 25, 26, 33, 35, 36 и 37.
Согласно другому варианту осуществления настоящего изобретения, в нем рассматриваются пептида глюкагона, которые обладают повышенной активностью по рецептору глюкагона, где указанные пептиды включают модификацию аминокислоты в положении 16 нативного глюкагона (SEQ ID NO: 1). В качестве неограничивающего примера, следует отметить, что такая повышенная активность может быть получена при замещении природного серина в положении 16 глютаминовой кислотой или другой отрицательно заряженной аминокислотой, содержащей боковую цепь длиной в 4 атома, или, альтернативно, любой из следующих аминокислот: глютамин, гомоглютаминовая кислота или гомоцистеиновая кислота, или заряженной аминокислотой, которая содержит боковую цепь, включающую по меньшей мере один гетероатом (например, N, O, S, P) и где длина боковой цепи в указанной аминокислоте составляет примерно 4 (или 3-5) атомов. Замещение серина в положении 16 глютаминовой кислотой повышает активность глюкагона по меньшей мере в 2 раза, в 4 раза, в 5 раз и вплоть до 10 раз по рецептору глюкагона. В некоторых вариантах осуществления настоящего изобретения, пептид глюкагона сохраняет селективность для рецептора глюкагона относительно рецептора GLP-1, например, сохраняет селективность, которая выше в 5 раз, в 10 раз или в 15 раз.
Растворимость любого из указанных выше соединений может быть дополнительно повышена за счет присоединения гидрофильной фрагмента к пептиду. Введение таких групп также увеличивает длительность действия, например, в случае измерения пролонгирования периода полувыведения соединения из кровотока. В одном варианте осуществления настоящего изобретения, указанная гидрофильная фрагмент представляет собой полиэтиленгликолевую (ПЭГ) цепь или другой водорастворимый полимер, который ковалентно присоединяют к боковой цепи аминокислотного остатка по одному или нескольким положениям из 16, 17,21, 24, 29, 40 указанного пептида глюкагона, в пределах С-концевого расширения или по С-концевой аминокислоте. В других вариантах осуществления настоящего изобретения, нативная аминокислота в указанном положении замещается аминокислотой, содержащей боковую цепь, подходящую для перекрестной сшивки с гидрофильными фрагментами, с тем, чтобы облегчиться связывание гидрофильного фрагмента с пептидом. Репрезентативные аминокислоты включают Cys, Lys, Orn, гомо-Cys или ацетилфенилаланин (Ac-Phe). В других вариантах осуществления настоящего изобретения, аминокислоту модифицируют таким образом, чтобы она содержала гидрофильную группу, добавленную к пептиду по С-концу. Указанная полиэтиленгликолевая цепь, вводимая согласно данному варианту осуществления настоящего изобретения, имеет молекулярную массу, выбранную из масс в диапазоне от примерно 500 до примерно 40000 дальтон. В одном варианте осуществления настоящего изобретения, указанная полиэтиленгликолевая цепь имеет молекулярную массу, выбранную их значений от примерно 500 до примерно 5000 дальтон. В другом варианте осуществления настоящего изобретения, указанная полиэтиленгликолевая цепь имеет молекулярную массу от примерно 10000 до примерно 20000 дальтон. В еще других репрезентативных вариантах осуществления настоящего изобретения, указанная полиэтиленгликолевая цепь имеет молекулярную массу от примерно 20000 до примерно 40000 дальтон.
Согласно некоторым вариантам осуществления настоящего изобретения, описываемые в нем глюкагоновые пептиды модифицируют таким образом, чтобы они включали ацильную группу или алкильную группу, например, ацильную или алкильную группу, которая является ненативной для природной аминокислоты. Ацилирование или алкилирование может удлинить период полувыведения глюкагоновых пептидов из кровотока, может способствовать задержке начала действия и/или увеличить длительность действия по рецепторам глюкагона и/или GLP-1, и/или повысить резистентность к протеазам, таким как DPP-IV. Ацилирование или алкилирование может также повысить растворимость пептида при нейтральном значении pH. Как показано в настоящем описании, активность по рецептору глюкагона и по рецептору GLP-1 данного глюкагонового пептида после ацилирования сохраняется или может даже повыситься.
В некоторых аспектах настоящего изобретения, пептид глюкагона ковалентно присоединяют к ацильной или алкильной группе через спейсер, например через аминокислоту, дипептид, трипептид, гидрофильный бифункциональный спейсер или гидрофобный бифункциональный спейсер. В некоторых аспектах настоящего изобретения, повышение активности по рецепторам GLP-1 и глюкагона наблюдается при ацилировании пептида спейсером. В выбранных аспектах, таких как, например, аспект, в рамках которого пептид не содержит внутримолекулярный мостик (например, ковалентный внутримолекулярный мостик), наблюдается дальнейшее повышение активности по рецепторам GLP-1 и глюкагона при ацилировании пептида спейсером, в сравнении с ацилированием пептида, где указанная ацильная группа присоединяется к пептиду без спейсера. Согласно некоторым вариантам осуществления настоящего изобретения, спейсер представляет собой аминокислоту или дипептид, содержащий аминокислотную или пептидную скелетную структуру длиной от 3 до 10 атомов (например, от 6 до 10 атомов). Согласно некоторым конкретным вариантам осуществления настоящего изобретения, общая длина спейсера и ацильной или алкильной группы составляет 14-28 атомов, например, 17-28, 19-26 атомов, 19-21 атома. Спейсеры, подходящие для достижения цели повышения активности глюкагона, также приведены в настоящем описании. В некоторых вариантах, ацилированные или алкилированные пептиды согласно настоящему описанию также включают модификацию, которая селективно снижает активность по рецептору GLP-1, например модификацию Thr в положении 7, такую как замещение Thr в положении 7 аминокислотой, не содержащей гидроксильную группу, например аминомасляной кислотой (Abu) или Ile; делецию одной или нескольких аминокислот на участке от С-конца до положения аминокислоты 27 или 28 (например, делецию одной или обеих аминокислот в положении 28 или 29), что приводит к получению пептида длиной 27 или 28 аминокислот.
Пептиды глюкагона могут быть ацилированы или алкилированы по той же аминокислоте, где была присоединена гидрофильная фрагмент, или по другому положению аминокислоты.
В некоторых вариантах, настоящее изобретение относится к пептиду глюкагона, модифицированному таким образом, что включает ацильную группу или алкильную группу, ковалентно присоединенную к аминокислоте в положении 10 пептида глюкагона. Указанный пептид глюкагона может дополнительно включать спейсер между аминокислотой в положении 10 пептида глюкагона и ацильной группой или алкильной группой. В некоторых вариантах осуществления настоящего изобретения, ацильная группа представляет собой жирную кислоту или желчную кислоту, или их соль, например С4-С30 жирную кислоту, С8-С24 жирную кислоту, холевую кислоту, С4-С30 алкил, С8-С24 алкил, или алкил, включающий стероидную группу желчной кислоты. Спейсер представляет собой любой фрагмент с такими реактивными группами, которые подходят для присоединения алкильных и ацильных групп. В репрезентативных вариантах осуществления настоящего изобретения, указанный спейсер включает аминокислоту, дипептид, трипептид, гидрофильный бифункциональный спейсер, амино(полиалкилокси)карбоксилатный или гидрофобный бифункциональный спейсер. В некоторых вариантах осуществления настоящего изобретения, указанный спейсер выбирают из группы, состоящей из Trp, Glu, Asp, Cys, и включает спейсер, содержащий NH2(CH2CH2O)n(CH2)mCOOH, где m равно любому целому числу от 1 до 6 и n равно любому целому числу от 2 до 12. Такие ацилированные или алкилированные пептиды глюкагона могут также включать гидрофильный фрагмент, необязательно полиэтиленгликоль. Любой из указанных выше пептидов глюкагона может включать две ацильных группы или две алкильных группы или их комбинацию.
Настоящее изобретение также относится к фармацевтически приемлемым солям указанных агонистов глюкагона.
В других репрезентативных вариантах осуществления настоящего изобретения, любое из указанных выше соединений может быть дополнительно модифицировано таким образом, чтобы изменить его фармацевтические свойства, за счет добавления второго пептида к карбоксильному концу пептида глюкагона. В одном варианте, пептид глюкагона ковалентно связывают через пептидную связь со вторым пептидом, где указанный второй пептид включает последовательность, выбранную из группы, состоящей из SEQ ID NO: 20, SEQ ID NO: 21 и SEQ ID NO: 22.
В некоторых вариантах осуществления настоящего изобретения, модификации в положении 1 или 2 могут повысить устойчивость пептида к расщеплению дипептидилпептидазой IV (DPP IV). Например, аминокислота в положении 2 может быть замещена D-серином, D-аланином, валином, глицином, N-метилсерином, N-метилаланином или аминоизомасляной кислотой. Альтернативно или дополнительно, аминокислота в положении 1 может быть замещена D-гистидином (D-His), дезаминогистидином, гидроксилгистидином, ацетилгистидином. гомогистидином, N-метилгистидином, альфа-метилгистидином, имидазолуксусной кислотой или альфа,альфа-диметилимидазолуксусной кислотой (DMIA).
Было показано, что модификации в положении 2 (например, AIB в положении 2) и в некоторых случаях модификации в положении 1 (например, DMIA в положении 1) могут снизить активность глюкагона, иногда значительно; неожиданно такое снижение активности глюкагона может быть восстановлено при стабилизации альфа-спиральной структуры в С-концевой части глюкагона (в районе аминокислот 12-29). В некоторых вариантах осуществления настоящего изобретения, стабилизация осуществляется через ковалентную связь между аминокислотами в положении «i» и «i+4», где i равно любому целому числу от 12 до 25. В некоторых конкретных вариантах осуществления настоящего изобретения, «i» и «i»+4 равны 12 и 16, 16 и 20, или 20 и 24, или 24 и 28. В некоторых вариантах осуществления настоящего изобретения, указанная ковалентная связь представляет собой лактамный мостик между глютаминовой кислотой в положении 16 или лизином в положении 20. В репрезентативных вариантах осуществления настоящего изобретения, указанный мостик или линкер имеет длину из 8 (или примерно 7 или 9) атомов. В других вариантах, стабилизация осуществляется через ковалентную связь между аминокислотами в положениях «j» и «j+3», где j равно любому целому числу от 12 до 27. В репрезентативных вариантах, указанный мостик и линкер имеет длину примерно из 6 (или 5 или 7) атомов. В еще других вариантах осуществления настоящего изобретения, стабилизация осуществляется через ковалентную связь между аминокислотами в положениях «к» и «к+7», где к равно целому числу от 12 до 22. В некоторых вариантах, указанная ковалентная связь представляет собой внутримолекулярный мостик, отличный от лактамного мостика. Например, подходящие способы ковалентного связывания (например, способы образования ковалентного внутримолекулярного мостика) включают осуществление одной или нескольких реакций обмена олефиновых групп, реакций циклизации на основе лантионина, образование дисульфидного мостика или модифицированного серосодержащего мостика, использование α,ω-диаминоалкановых связок, образование мостиков с участием атома металла и другие способы циклизации пептидов.
В еще других вариантах осуществления настоящего изобретения, спиральную структуру стабилизируют посредством нековалентных связей (например, нековалентных внутримолеклярных мостиков), включающих без ограничения, водородные связи, ионные взаимодействия и солевые мостики.
В еще других вариантах осуществления настоящего изобретения, стабилизация альфа-спиральной структуры в С-концевой части пептида глюкагона (в районе аминокислот 12-29) достигается при целевом введении одной или нескольких α,α-двузамещенных аминокислот в положения, которые позволяют сохранить желательную активность. В некоторых вариантах проводят замещение α,α-двузамещенной аминокислотой по одному, двум, трем, четырем или большему числу положений из числа 16, 17, 18, 19, 20, 21, 24 или 29 в пептиде глюкагона. Так, например, замещение положения 16 в пептиде глюкагона аминоизомасляной кислотой (AIB) обеспечивает получение стабилизированной α-спиральной структуры в отсутствие солевого мостика или локтама. Такие пептиды рассматриваются в настоящем описании как пептиды, не содержащие внутримолекулярный мостик. В конкретных аспектах, стабилизация альфа-спиральной структуры достигается за счет введения одной или нескольких аминокислот без введения ковалентного внутримолекулярного мостика, например, лактамного мостика, дисульфидного мостика. Такие пептиды рассматриваются в настоящем описании как пептиды, не содержащие ковалентный внутримолекулярный мостик. В некоторых вариантах осуществления настоящего изобретения, один, два, три или больше положений из числа 16, 20, 21 или 24 замещаются AIB
Таким образом, в некоторых вариантах, настоящее изобретение относится к пептиду глюкагона с активностью агониста глюкагона, где указанный пептид включает аминокислотную последовательность:
X1-X2-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-Leu-Met-Z (SEQ ID NO: 39) при наличии модификаций 1-3 аминокислот,
где X1 и/или X2 представляет(ют) собой ненативную аминокислоту, которая снижает чувствительность (или повышает устойчивость) пептида глюкагона к расщеплению дипептидилпептидазой IV (DPP-IV),
где Z выбран из группы, состоящей из -COOH (природный С-концевой карбоксилат), -Asn-COOH, Asn-Thr-COOH и Y-COOH, где Y обозначает 1-2 аминокислоты, и
где внутримолекулярный мостик, предпочтительно, ковалентная связь, соединяет боковые цепи аминокислоты в положении «i» и аминокислоты в положении «i+4», где i равно 12, 16, 20 или 24.
В некоторых вариантах осуществления настоящего изобретения, указанный внутримолекулярный мостик представляет собой лактамный мостик. В некоторых вариантах, указанные аминокислоты в положениях «i» и «i+4» в SEQ ID NO: 39 представляют собой Lys и Glu, например, Glu16 и Lys20. В некоторых вариантах, X1 выбирают из группы, состоящей из D-His, N-метил-His, альфа-метил-His, имидазолуксусной кислоты, дез-амино-His, гидроксил-His, ацетил-His, гомо-His и альфа,альфа-диметилимидазолуксусной кислоты. (DMIA). В других вариантах осуществления настоящего изобретения, X2 выбирают из группы, состоящей из D-Ser, D-Ala, Gly, N-метил-Ser, Val, и альфа,альфа-аминоизомасляной кислоты (AIB). В некоторых вариантах осуществления настоящего изобретения, пептид глюкагона ковалентно связывают с гидрофильным фрагментом по любому из положений аминокислот 16, 17, 20, 21, 24, 29, 40 в пределах С-концевого расширения или по С-концевой аминокислоте. В репрезентативных вариантах осуществления настоящего изобретения, указанный гидрофильный фрагмент ковалентно присоединяют к Lys, Cys, Orn, гомоцистеиновому или ацетилфенилаланиновому остатку по любому из указанных положений. Репрезентативные гидрофильные фрагменты включают полиэтиленгликоль (ПЭГ), например, с молекулярной массой примерно от 1000 дальтон до 40000 дальтон или от примерно 20000 дальтон до примерно 40000 дальтон.
В других вариантах, настоящее изобретение относится к пептиду глюкагона с активностью агониста глюкагона, где указанный пептид включает аминокислотную последовательность:
Xl-X2-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-I^u-Met-Z (SEQ ID NO: 39),
где X1 и/или X2 обозначает(ют) ненативную аминокислоту, которая снижает чувствительность (или повышает устойчивость) пептида глюкагона к расщеплению дипептидилпептидазой IV (DPP-IV),
где одно, два, три, четыре или большее число положений из числа 16, 20, 21, или 24 в пептиде глюкагона замещены α,α-двузамещенной аминокислотой, и
где Z выбран из группы, состоящей из: -COOH (природный С-концевой карбоксилат), -Asn-COOH, Asn-Thr-COOH и Y-COOH, где Y обозначает 1-2 аминокислоты.
Репрезентативные варианты других модификаций указанных выше пептидов глюкагона или их аналогов включают замещение Thr в положении 7 аминокислотой, не содержащей гидроксильную группу, например, Abu или Ile, необязательно в сочетании с замещением или добавлением аминокислоты, включающей боковую цепь, ковалентно присоединенную (необязательно через спейсер) к ацильной или алкильной группе, где указанная ацильная или алкильная группа является ненативной для природной аминокислоты, замещение Lys в положении 12 Arg; замещение Asp в положении 15 Glu; замещение Ser в положении 16 Thr или AIB; замещение Gin в положении 20 Ser, Thr, Ala или AIB; замещение Asp в положении 21 Glu; замещение Gln в положении 24 Ser, Thr, Ala или AIB; замещение Met в положении 27 Leu или Nle; замещение Asn в положении 28 заряженной аминокислотой; замещение Asn в положении 28 заряженной аминокислотой, выбранной из группы, состоящей из Lys, Arg, His, Asp, Glu, цистеиновой кислоты и гомоцистеиновой кислоты; замещение в положении 28 Asn, Asp или Glu; замещение в положении 28 Asp; замещение в положении 28 Glu; замещение Thr в положении 29 заряженной аминокислотой; замещение Thr в положении 29 заряженной аминокислотой, выбранной из группы, состоящей из Lys, Arg, His, Asp, Glu, цистеиновой кислоты и гомоцистеиновой кислоты; замещение в положении 29 Asp, Glu или Lys; замещение в положении 29 Glu; вставку 1-3 заряженных аминокислот после положения 29; вставку в положении 30 (например, после положения 29) Glu или Lys; необязательно со вставкой в положении 31 Lys; добавление SEQ ID NO: 20 к С-концу, необязательно, где аминокислота в положении 29 представляет собой Thr или Gly; замещение или дополнение аминокислоты, ковалентно присоединенной к гидрофильному фрагменту; или их комбинацию.
В еще одном репрезентативном варианте осуществления настоящего изобретения, любой из указанных выше пептидов может быть дополнительно модифицирован для повышения стабильности посредством модификации аминокислоты в положении 15 в SEQ ID NO: 1, с целью уменьшения разложения пептида с течением времени, особенно в кислом или щелочном буферах. В репрезентативных вариантах, Asp в положении 15 замещен Glu, гомо-Glu, цистеиновой кислотой или гомоцистеиновой кислотой.
Альтернативно, любой из приведенных в настоящем описании пептидов глюкагона может быть дополнительно модифицирован для целей повышения стабильности, за счет введения модификации в аминокислоту в положении 16 в SEQ ID NO: 1. В репрезентативных вариантах, Ser в положении 16 замещается Thr или AIB или вводится любое из указанных выше аминокислотных замещений, которое повышает активность по рецептору глюкагона. Такие модификации снижают уровень расщепления пептидной связи между Asp15-Ser16.
Сохраняемая или повышенная активность по рецептору глюкагона может быть достигнута за счет модификации Gln в положении 3 аналогом глютамина. Например, пептид глюкагона, включающий аналог глютамина в положении 3, может демонстрировать примерно 5%, примерно 10%, примерно 20%, примерно 50% или примерно 85%, или более активности нативного глюкагона (то есть SEQ ID NO: 1) по рецептору глюкагона. В некоторых вариантах осуществления настоящего изобретения, пептид глюкагона, включающий аналог глютамина в положении 3, может демонстрировать примерно 20%, примерно 50%, примерно 75%, примерно 100%, примерно 200% или примерно 500% или более от активности соответствующего пептида глюкагона, имеющего такую же аминокислотную последовательность, что и пептид, включающий аналог глютамина, за исключением модифицированной аминокислоты в положении 3 (то есть SEQ ID NO: 69 или SEQ ID NO: 70), по рецептору глюкагона. В некоторых вариантах, пептид глюкагона, включающий аналог глютамина в положении 3, демонстрирует повышенную активность по рецептору глюкагона, но указанная повышенная активность не превышает 1000%, 10000%, 100000% или 1000000% от активности нативного глюкагона или соответствующего пептида глюкагона, имеющего такую же аминокислотную последовательность, что и пептид, включающий аналог глютамина, за исключением модифицированной аминокислоты в положении 3.
В некоторых вариантах осуществления настоящего изобретения, аналог глютамина представляет собой природную или неприродную аминокислоту, включающую боковую цепь структуры I, II или III:
Структура I
Структура II
Структура III
где R1 обозначает C0-3алкил или C0-3гетероалкил; R2 обозначает NHR4 или C1-3алкил; R3 обозначает C1-3алкил; R4 обозначает H или C1-3алкил; X обозначает NH, О или S; и Y обозначает NHR4, SR3 или OR3. В некоторых вариантах X обозначает NH или Y обозначает NHR4. В некоторых вариантах R1 обозначает C0-2алкил или C1гетероалкил. В некоторых вариантах R2 обозначает NHR4 или C1 алкил. В некоторых вариантах R4 обозначает H или C1 алкил. В репрезентативных вариантах осуществления настоящего изобретения, аминокислота, включающая боковую цепь структуры I, характеризуется тем, что R1 обозначает CH2-S, X обозначает NH, и R2 обозначает CH3 (ацетамидометилцистеин, C(Acm)); R1 обозначает CH2, X обозначает NH и R2 обозначает CH3 (ацетилдиаминбутановая кислота, Dab(Ac)); R1 обозначает C0алкил, X обозначает NH, R2 обозначает NHR4, и R4 обозначает H (карбамоилдиаминопропановая кислота Dap(мочевина)); или R1 обозначает CH2-CH2, X обозначает NH, и R2 обозначает CH3 (ацетилорнитин, Orn(Ac)). В репрезентативных вариантах осуществления настоящего изобретения, аминокислота, включающая боковую цепь Структуры II, характеризуется тем, что R1 обозначает CH2, Y обозначает NHR4, и R4 обозначает CH3 (метилглютамин, Q(Me)). В репрезентативных вариантах осуществления настоящего изобретения, аминокислота, включающая боковую цепь Структуры III, характеризуется тем, что R1 обозначает CH2 и R4 обозначает H (метионинсульфоксид, M(O)). В конкретных вариантах осуществления настоящего изобретения, аминокислота в положении 3 замещена Dab(Ac). Например: агонисты глюкагона могут включать аминокислотную последовательность SEQ ID NO: 63, SEQ ID NO: 69, SEQ ID NO: 71, SEQ ID NO: 72, SEQ ID NO: 73 и SEQ ID NO: 74.
Повышенной активности пептидов глюкагона по рецептору глюкагона можно также достичь при ковалентном присоединении ацильной или алкильной группы, например, ацильной или алкильной группы, которая является неприродной для природной аминокислоты (например, С4-С30 жирноацильная группа, С4-С30 алкильная группа) к боковой цепи аминокислоты в пептиде глюкагона. В некоторых вариантах осуществления настоящего изобретения, ацилированные или алкилированные пептиды глюкагона не содержат внутримолекулярный мостик, например, ковалентный внутримолекулярный мостик (например, лактам). В некоторых аспектах, указанную ацильную или алкильную группу присоединяют к боковой цепи аминокислоты в пептиде глюкагона через спейсер, например, спейсер, который содержит 3-10 атомов в длину. В некоторых вариантах осуществления настоящего изобретения, указанную ацильную или алкильную группу присоединяют к боковой цепи аминокислоты в положении 10 в пептиде глюкагона через спейсер. В конкретных вариантах осуществления настоящего изобретения, указанные ацилированные или алкилированные пептиды глюкагона дополнительно включают модификацию, которая селективно снижает активность пептида по рецептору GLP-1. Так, например, ацилированный или алкилированный пептид глюкагона может включать С-концевой альфа-карбоксилат, замещение Thr в положении 7 аминокислотой, не содержащей гидроксильной группы, например, Abu или Ile, делецию одной или нескольких аминокислот на участке от С-конца до аминокислоты в положении 27 или 28, что приводит к получению пептида, содержащего 27 или 28 аминокислот, или используется сочетание таких модификаций.
В некоторых вариантах осуществления настоящего изобретения, любой из приведенных в настоящем описании пептидов глюкагона может быть дополнительно модифицирован для целей снижения разложения по разным положениям аминокислотных остатков, посредством модификации пептидов в положениях аминокислот 20, 21, 24 или 27, по любому одному, двум, трем или четырем указанным положениям. Репрезентативные варианты включают замещение Gln в положении 20 Ala или AIB, замещение Asp в положении 21 Glu, замещение Gln в положении 24 Ala или AIB, замещение Met в положении 27 Leu или Nle. Удаление или замещение метионина снижает уровень разложения за счет возможного окисления метионина. Удаление или замещение Gln или Asn снижает уровень разложения за счет дезамидирования Gln или Asn. Удаление или замещение Asp снижает уровень разложения, кото