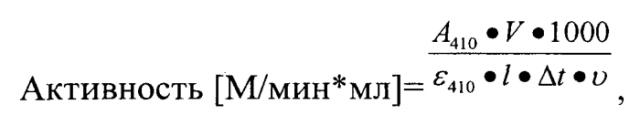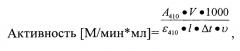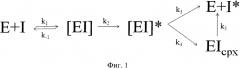Способ получения рекомбинантного ингибитора сериновых протеиназ камчатского краба
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и представляет собой способ получения рекомбинантного ингибитора сериновых протеиназ из гепатопанкреаса камчатского краба, заключающийся в том, что из гепатопанкреаса камчатского краба Paralithodes camtchaticus выделяют РНК и осуществляют синтез кДНК ингибитора PC из суммарной РНК методом обратной транскрипции, которую амплифицируют методом полимеразной цепной реакции с праймерами, полученный ПЦР-продукт, содержащий ген ингибитора PC, кодирующий ингибитор PC c аминокислотной последовательностью, показанной на фиг. 2, клонируют в экспрессионный вектор, с последующей трансформацией в клетки E. coli, полученные при этом рекомбинантные штаммы E. coli культивируют в течение не более 20 час при 37°C, а полученную биомассу подвергают центрифугированию, отмывают от остатков среды, ресуспендируют в буфере лизиса и лизируют, выделяют тельца включения из полученной биомассы разрушением ультразвуком, лизат ресуспендируют в буфере промывки и снова осаждают тельца включения, полученные тельца включения растворяют в 8 М мочевине и повергают предварительной очистке на сорбенте с градиентной элюцией буфером, содержащем 8 М мочевину и 0,7 М NaCl, после чего проводят ренатурацию растворенного ингибитора, методом снижения концентрации денатуранта в буфере 20 мМ MES-NaOH pH 6.0 или 20 мМ MES-NaOH pH 6.0, 2 М NaCl, 0,05% PEG 6000 и последующую очистку препарата ионообменной хроматографией. Изобретение позволяет получить ингибитор сериновых протеиназ, обладающий улучшенными ингибиторными свойствами по отношению к коллагеназе, трипсину и субтилизину. 5 з.п. ф-лы, 8 ил., 1 табл., 2 пр.
Реферат
Изобретение относится к биотехнологии, в частности к получению высокоочищенных и высокоактивных препаратов ингибиторов ферментов, которые могут быть использованы в медицине, косметологии, ветеринарии, а также для исследовательских целей.
Ингибиторы сериновых протеиназ (серпины, англ. serpins) представляют собой большую группу белков, которые играют важную роль во многих важных физиологических процессах, таких как свертывание крови, фибринолиз, перенос гормонов. Серпины входят в систему комплемента - комплекс белков, постоянно присутствующих в крови. Это каскадная система протеолитических ферментов, предназначенная для гуморальной защиты организма от действия чужеродных агентов. В литературе имеются сведения о роли серпинов в предотвращении адгезии раковых клеток, инвазии в стенки кровеносных сосудов, препятствии метастазирования. Например, серпин камчатского краба способен ингибировать коллагеназу камчатского краба.
Коллагенолитические ферменты устойчивы к действию известных ингибиторов трипсина и химотрипсина. Коллагеназы вызывают деградацию коллагена, что связано с преждевременным старением кожи. Поэтому ингибитор коллагеназ можно ввести в различные косметические средства (кремы, лосьоны, гели, мази) для предотвращения образования морщин или лечения атрофии кожи.
Известен способ получения ингибитора коллагеназ из промысловых видов крабов, включающий гомогенизацию сырья, содержащего протеолитические ферменты, отделение экстракта центрифугированием, обработку полученного экстракта, очистку, концентрирование, обессоливание и лиофильную сушку препарата, в качестве вышеназванного сырья используют гепатопанкреас промысловых видов крабов, обработку экстракта ведут путем добавлением сульфата аммония 60-70% насыщения, отделяют полученный комплекс ферментов центрифугированием, растворяют последний в воде с добавлением 0,1-1,0 мМ ацетата кальция до получения истинного раствора, при этом очистку, концентрирование и обессоливание ферментов ведут на поливолоконной мембране с размером пор 100 кДа с промывкой полученного супернатанта водой и последующим его прогреванием при 80-85°С в течение 25-40 мин.
Для достижения 50% ингибирования по вышеуказанному способу необходимо к 1 мкг препарата коллагеназы «Морикраза» добавить 320 мкг ингибитора.
[Патент РФ 2292393, G21N 9/64, опубл. 03.03.2005].
Известен способ получения ингибитора коллагеназ с антикоагуляционным действием. Для решения поставленной задачи используют грубый препарат ингибитора коллагеназ из гепатопанкреаса камчатского краба. Для этого гомогенизированный препарат растворяют в 0,1 М ацетате аммония (pH=6,4), центрифугируют при 12000-15000 g. Супернатант высаливают добавлением сульфата аммония до 35-43% насыщения и отделяют осадок центрифугированием. Далее осадок растворяют в 0,01 М Трис-HCl буфере pH 7,0-8,0 и нагревают при температуре 80-85°С, в течение 40 мин. С последующим центрифугированием 15 мин при 12000 g. Сульфат пасту растворяют в буфере (0,05М Трис-HCl, 0,5 М NaCl; pH 8,0) и наносят на колонку Sephadex G100. Активные фракции объединяют и концентрируют ультрафильтрацией на мембране, пропускающей белки с молекулярной массой 30-50 кДа, промывают пятью объемами дистиллированной воды и высушивают лиофильно.
[Патент РФ №2403284, G12N 9/00, опубл. 25.11.2009].
Наиболее близким является способ получения ингибитора коллагеназ с противоопухолевым действием, который заключается в следующем. В качестве источника противоопухолевого препарата используют препарат ингибитора коллагеназы из гепатопанкреаса камчатского краба, полученный по способу Патент РФ 2292393 С2, 03.03.2005, Способ получения ингибитора коллагеназы с противоопухолевым действием из гепатопанкреаса камчатского краба характеризуется проведением гомогенизации сырья в 0,1 М ацетате аммония, содержащем 0,1-1 мМ ацетата кальция при pH 6,4-7,0, гомогенат центрифугируют, к супернатанту добавляют сульфат аммония до 60-70%-ного насыщения, полученный комплекс ферментов отделяют центрифугированием, растворяют последний в дистиллированной воде с добавлением 0,1-1 мМ ацетата кальция до получения истинного раствора с последующей очисткой, концентрированием и обессоливанием ферментов на поливолоконной мембране с размером пор 100 кДа и промывкой концентрата, содержащего ингибитор коллагеназы, дистиллированной водой с последующим прогреванием до 60-100°С, отделением осадка центрифугированием, полученный при этом суммарный препарат ингибитора коллагеназы растворяют в 0,05М Трис-HCl буфере, pH 7,0-8,0 и хроматографируют на колонке с аффинным сорбентом - аргинин-силохромом, с последующей элюцией активных ферментов Трис-HCl буфером с добавлением 1 М NaCl и 20% изопропилового спирта, фракцию, содержащую ингибитор, упаривают на роторном испарителе при 60-80°С и концентрируют ультрафильтрацией на мембране с размером пор 30-50 кДа, концентрат, содержащий целевой продукт, промывают раствором хлористого натрия и лиофильно высушивают.
[Патент РФ №2412995, G12N 9/00, опубл. 25.11.2009].
Для достижения 50% ингибирования «Морикразы» необходим 96-кратный избыток препарата ингибитора. Минимальное количество препарата, которое вызывает замедление роста клеток рабдомиосаркомы человека, составляет 0,25 мг/мл. Ингибитор в таких количествах не может применяться в медицинских целях. Достижение более низких доз при использовании данного способа принципиально невозможно по ряду причин.
Особенностью серпинов, к которым относится эндогенный ингибитор камчатского краба, является конформационная подвижность их молекулы. Серпины активны только тогда, когда их реакционный центр экспонирован на поверхности белковой глобулы. Существуют латентная и метастабильная неактивные формы, когда реактивная петля втянута вглубь молекулы.
Основным механизмом, который может быть применен ко всем реакциям серпинов с сериновыми протеиназами, а также к некоторым реакциям серпинов с цистеиновыми протеиназами, является суицидный механизм ингибирования, показанный на фиг.1.
Механизм заключается в следующем: протеиназамишень признает реактивную петлю ингибитора как потенциальный субстрат. Таким образом, первым шагом является образование нековалентного комплекса Михаэлиса, дальнейшая атака активным центром сериновой протеиназы пептидной связи серпина приводит к образованию тетраэдрического переходного состояния, судьба которого двояка. Он может либо высвободить свободный фермент и расщепленный серпин (субстратный путь, первый продукт), либо, расщепив активную связь реактивной петли, «втянуть» фермент, образовав тем самым кинетически запертый комплекс (ингибирование, второй продукт), который может со временем переходить в первый продукт. Каждая реакция характеризуется своей константой, переходом кинетически запертого комплекса в первый продукт можно пренебречь, поскольку константа этого перехода обычно намного меньше константы образования первого продукта.
Таким образом, при совместном выделении препарата протеиназ и ингибитора большая часть ингибитора связывается в прочный комплекс с протеиназами, а также подвергается расщеплению протеолитическими ферментами, что отрицательно сказывается на выходе активного ингибитора. Кроме того, очистка ингибитора по способу не позволяет отделить от активного белка неактивные формы, которые отличаются только конформацией молекулы. Поэтому для полного ингибирования приходится брать, как минимум, десятикратный избыток ингибитора.
Техническая задача, решаемая настоящим изобретением, состоит в получении рекомбинантного ингибитора PC камчатского краба повышенной чистоты и активности.
Технический результат полученный при реализации предлагаемого технического решения состоит в улучшении ингибиторных свойств полученного рекомбинантного ингибитора по отношению к ряду протеолитических ферментов.
Поставленная задача достигается способом получения рекомбинантного ингибитора сериновых протеиназ из гепатопанкреаса камчатского краба, заключающимся в том, что из гепатопанкреаса камчатского краба Paralithodes camtchaticus выделяют РНК и осуществляют синтез кДНК ингибитора PC из суммарной РНК методом обратной транскрипции, которую амплифицируют методом полимеразной цепной реакции с праймерами, полученные ПЦР-продукт, содержащий ген ингибитора PC, кодирующий ингибитор PC с аминокислотной последовательностью, показанной на фиг. 2, клонируют в экспрессионный вектор, с последующей трансформацией в клетки Е.coli, полученные при этом рекомбинантные штаммы E.coli культивируют в течение не более 20 час при 37°C, а полученную биомассу подвергают центрифугированию, отмывают от остатков среды, ресуспендируют в буфере лизиса и лизируют, выделяют тельца включений из полученной биомассы разрушением ультразвуком, лизат ресуспендируют в буфере промывки и снова осаждают тельца включения, полученные тельца включений растворяют в 8 М мочевине и повергают предварительной очистке на сорбенте с градиентной элюцией буфером, содержащем 8 М мочевину и NaCl, после чего проводят ренатурацию растворенного ингибитора, методом снижения концентрации денатуранта в 20 мМ MES-NaOH буфере pH 6,0 или 20 мМ MES-NaOH pH 6,0, 2 М NaCl, 0,05% PEG 6000 и последующую очистку препарата ионообменной хроматографией.
Преимущественно к ДНК ингибитора PC амплифицируют последовательно 18 и 25 циклами ПЦР соответственно в режимах - 95° в течение 10 сек; 65°C - 20 сек; 72°C - 3 мин и при 95°C в течение 7 сек; 65°C - 20 сек; 72°C - 1 мин.
Обычно культивирование трансформированных клеток E.coli ведут в автоиндукционной среде ZYM 5052 или с использованием Lysogeny broth (LB) с дополнительной индукцией 0,4 mM IPTG, а осадок клеток биомассы ресуспендируют в буфере лизиса, содержащего 1 mM PMSF и 5 М 2-меркаптоэтанол,
Целесообразно ренатурацию растворенного ингибитора вести в 20 мМ MES-NaOH буфере pH 6,0 или 20 мМ MES-NaOH pH 6,0, 2 М NaCl, 0,05% PEG 6000.
Предварительную очистку ведут на анионообменном сорбенте DEAE-Toyopearl или на катионообменном сорбенте Mono S 5/50 GL.
Указанный технический результат достигается за счет получения следующим образом рекомбинантного ингибитора PC камчатского краба.
В качестве источника получения ингибитора вместо гепатопанкреаса камчатского краба используется штамм E.coli, трансформированный плазмидой, несущей ген ингибитора камчатского краба, для чего кДНК ингибитора PC получают на основе мРНК, выделенной из гепатопанкреаса камчатского краба Paralithodes camtchaticus любым из известных методов молекулярной биологии. Далее кДНК ингибитора PC амплифицируют методом ПЦР, встраивают в экспрессионный вектор, например вектор рЕТ28а, и трансформируют этой конструкцией соответствующий штамм. Следующим этапом является культивирование трансформированных клеток E.coli, индукция и экспрессия в течение 5-20 часов. Для выделения ингибитора PC из телец включения полученную биомассу разрушают, центрифугируют, отмывают примесные белки и растворяют в буфере с мочевиной.
Проводят предварительную очистку препарата в денатурированном виде методом хроматографии на различных колонках. После чего проводят процедуру регенерации растворенного ингибитора, т.н. рефолдинг, в различных растворах. После рефолдинга возможна очистка полученного препарата с использованием хроматографии, например ионообменной на SP-Sepharose.
Полученный препарат характеризуется аминокислотной последовательностью, изображенной на фиг.2.
Ингибиторные активности тестировали по трипсину с помощью хромогенного субстрата Bz-Arg-pNA, растворенного в DMF (5 мг/мл). Для этого 10 мкл трипсина (1 мг/мл в буфера А: 50 мМ Tris-HCl, pH 8,0) с 200 мкл раствора ингибитора инкубировали 40 минут, затем добавляли 585 мкл буфера А и 5 мкл субстрата (5 мг/мл) и выдерживали в термостате при 37°C до появления желтого окрашивания. Реакцию останавливали добавлением 100 мкл 50% уксусной кислоты, центрифугировали 5 мин при 12000 g и измеряли поглощение A410.
Активность рассчитывалась по формуле:
где
А410 - оптическое поглощение раствора при длине волны 410 нм,
1000 - коэффициент пересчета объемов к 1 мл V - общий объем смеси (мкл),
ε410 - молярный коэффициент поглощения n-нитроанилина при длине волны 410 нм (8900 М-1*см-1),
Δt - время с момента внесения фермента до остановки реакции (мин). Остаточную активность трипсина вычисляли по разности между активностью трипсина без ингибитора (100%) и таковой в присутствии ингибитора,
υ - аликвота исследуемого раствора белка.
Пример 1
Синтезируют первую цепь кДНК из суммарной РНК из гепатопанкреаса краба обратной транскрипцией с SMART Oligo II и CDS праймерами (список использованных праймеров представлен на фиг.3), амплифицируют 18 циклами ПЦР в режиме 95°C - 10 сек; 65°C - 20 сек; 72°C - 3 мин.
На фиг.4 представлен агарозный гель-электрофорез образца амплифицированной кДНК. М - маркер молекулярного веса ДНК, cDNA - образец кДНК.
Амплифицированную кДНК разбавляют в 40 раз и используют в качестве матрицы для ПЦР с праймерами Serp_Nde I (DIR-N) / SerpJHind III (KEV-М).(фиг.3). Проводят 25 циклов ПЦР в следующем режиме амплификации: 95°C - 7 сек; 65°C - 20 сек; 72°C - 1 мин. Результат - агарозный гель-электрофорез продуктов ПЦР представлен на фиг.5.
Полученный ПЦР-продукт, содержащий ген ингибитора PC, клонируют в вектор рЕТ28а (на фиг. 6 показана карта полученной конструкции) по сайтам Nde I и Hind III с последующей трансформацией в клетки E.coli BL21(DE3). Для получения биомассы клеток с рекомбинантным ингибитором PC единичную колонию трансформированных клеток E.coli BL21(DE3) pET28a/Serp-N культивируют в 1 л среды ZYM 5052 при 37°C в течение 20 часов. Далее биомассу осаждают центрифугированием. Клетки промывают и снова центрифугируют. Затем осадок клеток ресуспендируют в буфере лизиса, содержащего 1 mM PMSF и 5 тМ 2-меркаптоэтанол, и лизируют ультразвуком на ледяной бане. Супернатант удаляют, а к лизату добавляют 40 мл буфера 20 mM Tris-HCl pH 8,0, 300 мМ NaCl, 25% сахароза, 2 мМ EDTA, 1.5% Triton X-100, 1.5% дозоксихолат-Na и тщательно ресуспендируют. Лизат центрифугируют, полученные тельца включения растворяют в 8 М мочевине и подвергают предварительной очистке на анионообменном сорбенте DEAE-Toyopearl с градиентной элюцией тем же буфером, содержащим 0,7 М NaCl. Ренатурацию проводят методом снижения концентрации денатуранта в 20 мМ MES-NaOH буфер pH 6,0. Фракции денатурированного белка, прошедшие хроматографию на DEAE-Toyopearl, разбавляют по каплям в 20 раз в 20 мМ MES-NaOH буфере pH 6,0. Полученный раствор инкубируют в течение ночи при 4°С и наносят на колонку с SP-Sepharose. Сорбированный белок элюируют 500 mM NaCl в 20 мМ MES-NaOH pH 6,0 буфере.
На фиг.7 представлен SDS-PAGE электрофорез ренатурированного белка после хроматографии на SP-Sepharose, а на фиг.8 - спектр поглощения фракции ренатурированного белка.
Как видно из представленного материала, - ренатурированный ингибитор PC, прошедший хроматографическую очистку на SP-Sepharose, характеризуется высокой чистотой и типичным для белков спектром поглощения с максимумом при 280 нм. Выход ренатурированного продукта составляет 0,5 мг/литр культуры клеток.
Пример 2
Клонирование, вставку в вектор и трансформацию проводят как и в примере 1.
Для получения биомассы клеток с рекомбинантным ингибитором PC единичную колонию трансформированных клеток E.coli BL21(DE3) pET28a/Serp-N культивируют в 1 л среды LB при 37°С в течение 2 часов, проводят индукцию 0,4 mM IPTG и далее продолжают культивировать в течение 5 часов. Далее биомассу осаждают центрифугированием. Клетки промывают и снова центрифугируют. Затем осадок клеток ресуспендируют в буфере лизиса, содержащего 1 mM PMSF и 5 mM 2-меркаптоэтанол, и лизируют ультразвуком на ледяной бане. Супернатант удаляют, а к лизату добавляют 40 мл буфера 20 mM Tris-HCl pH 8,0, 300 мМ NaCl, 25% сахароза, 2 мМ EDTA, 1.5% Triton X-100, 1,5% дозоксихолат-Na и тщательно ресуспендируют. Лизат центрифугируют, полученные тельца включения растворяют в 8 М мочевине и подвергают очистке на катионообменном сорбенте Mono S 5/50 GL с градиентной элюцией тем же буфером, содержащим 0,7 М NaCl. Ренатурацию проводят методом снижения концентрации денатуранта в 20 мМ MES-NaOH буфер pH 6,0. Фракции денатурированного белка, прошедшие хроматографию на Mono S 5/50 GL, разбавляют по каплям в 20 раз в 20 мМ MES-NaOH буфере pH 6,0, 2М NaCl 0,05% PEG 6000. Выход продукта составляет 0,8 мг/литр культуры клеток E.coli.
Сравнительное ингибирование трех сериновых протеиназ нативным и рекомбинантным ингибиторами PC показало, что, например, для ингибирования одного и того же количества коллагеназы PC необходимо в 4,8 раза меньшее количество рекомбинантного ингибитора, чем нативного, а для трипсина быка в 14 раз меньшие количества. Количество ингибитора (мг), необходимое для 50% ингибирования активности 1 мг сериновых протеиназ, представлено в таблице 1.
| Таблица 1 | |||
| Протеиназа | Коллагеназа | Трипсин | Субтилизин |
| Предлагаемый способ | 2 | 0,4 | 4 |
| Прототип | 96 | 3 | 19 |
Таким образом, поставленная задача повышения активности препарата ингибитора была достигнута. Это дает возможность применять рекомбинантный ингибитор в значительно меньших количествах по сравнению с нативным.
1. Способ получения рекомбинантного ингибитора сериновых протеиназ из гепатопанкреаса камчатского краба, заключающийся в том, что из гепатопанкреаса камчатского краба Paralithodes camtchaticus выделяют РНК и осуществляют синтез кДНК ингибитора PC из суммарной РНК методом обратной транскрипции, которую амплифицируют методом полимеразной цепной реакции с праймерами, полученный ПЦР-продукт, содержащий ген ингибитора PC, кодирующий ингибитор PC c аминокислотной последовательностью, показанной на фиг. 2, клонируют в экспрессионный вектор с последующей трансформацией в клетки E. coli, полученные при этом рекомбинантные штаммы E. coli культивируют в течение не более 20 час. при 37°C, а полученную биомассу подвергают центрифугированию, отмывают от остатков среды, ресуспендируют в буфере лизиса и лизируют, выделяют тельца включения из полученной биомассы разрушением ультразвуком, лизат ресуспендируют в буфере промывки и снова осаждают тельца включения, полученные тельца включения растворяют в 8 М мочевине и повергают предварительной очистке на сорбенте с градиентной элюцией буфером, содержащем 8 М мочевину и 0,7 М NaCl, после чего проводят ренатурацию растворенного ингибитора, методом снижения концентрации денатуранта в буфере 20 мМ MES-NaOH pH 6.0 или 20 мМ MES-NaOH pH 6.0, 2 М NaCl, 0,05% PEG 6000 и последующую очистку препарата ионообменной хроматографией.
2. Способ по п. 1, отличающийся тем, что кДНК ингибитора PC амплифицируют последовательно 18 и 25 циклами ПЦР соответственно в режимах - 95°C в течение 10 сек; 65°C - 20 сек; 72°C - 3 мин и при 95°C в течение 7 сек; 65°C - 20 сек; 72°C - 1 мин.
3. Способ по п. 1, отличающийся тем, что культивирование трансформированных клеток E. coli ведут в автоиндукционной среде ZYM 5052 или с использованием Lysogeny broth (LB) с дополнительной индукцией 0,4 мМ IPTG.
4. Способ по п. 1, отличающийся тем, что осадок клеток биомассы ресуспендируют в буфере лизиса, содержащего 1 мМ PMSF и 5 М 2-меркаптоэтанол.
5. Способ по п. 1, отличающийся тем, что предварительную очистку ведут на анионообменном сорбенте DEAE-Toyopearl.
6. Способ по п. 1, отличающийся тем, что предварительную очистку ведут на катионообменном сорбенте Mono S 5/50 GL.