Способ одновременной идентификации токсигенных штаммов геновариантов возбудителя холеры эль тор и их дифференциации по эпидемическому потенциалу методом мультиплексной полимеразной цепной реакции
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности к одновременной идентификации токсигенных штаммов геновариантов Vibrio cholerae О1 серогруппы биовара Эль Тор и их дифференциации по эпидемическому потенциалу. Способ характеризуется тем, что ПЦР проводят в один прием в двух реакционных смесях, каждая из которых содержит специально подобранное сочетание праймеров: первая - к фрагментам генов rfbO1, rfbR, rtxC, ctxA, вторая - к фрагментам генов ctxBClass, vc0502, vc0514. Для штаммов с низким эпидемическим потенциалом характерно наличие ампликонов генов rfbO1, rstC, ctxA, ctxBClass, vc0502, vc0514. Для штаммов с высоким эпидемическим потенциалом характерно наличие ампликонов фрагментов генов rfbO1, rstC, ctxA, ctxBClass и vc0514. Изобретение позволяет быстро и достоверно идентифицировать токсигенные штаммы геновариантов V. cholerae O1 биовара Эль Тор и дифференцировать их на основе анализа структуры острова пандемичности VSP-II на штаммы с низким и высоким эпидемическим потенциалом. 1 з.п. ф-лы, 1 ил., 3 табл., 1 пр.
Реферат
Изобретение относится к области медицинской микробиологии, в частности к идентификации токсигенных штаммов геновариантов Vibrio cholerae O1 серогруппы биовара Эль Тор и их дифференциации по эпидемическому потенциалу, и может быть использовано в научно-исследовательских учреждениях медицинского профиля и службах Роспотребнадзора.
Эпидемиологическая ситуация в мире по холере - острой, особо опасной инфекционной болезни, остается напряженной, продолжается 7-я пандемия. Как известно, пандемии и эпидемии холеры способны вызывать только токсигенные штаммы V. cholerae O1 (классического и Эль Тор биоваров) и O139 серогрупп. Так возбудителями текущей, 7-ой, пандемии холеры, начавшейся в 1961 году в Юго-Восточной Азии, являются типичные токсигенные штаммы V. cholerae O1 серогруппы Эль Тор биовара. Имея на момент возникновения высокий эпидемический потенциал, который характеризуется как способность быстро проникать на территорию многих стран и вызывать там эпидемии, Эль Тор вибрионы полностью вытеснили возбудителя предыдущей 6-й пандемии - V. cholerae классического биовара с эндемичной территории и распространились по многим странам Азии, Африки и Латинской Америки. Однако продолжающиеся эволюционные преобразования Эль Тор вибрионов и приобретение ими генов холерных вибрионов классического биовара (ген ctxB из оперона ctxAB, кодирующего биосинтез холерного токсина) привели к появлению в 1992 году генетически измененных штаммов или геновариантов V. cholerae биовара Эль Top [9]. Геноварианты отличались повышенной вирулентностью и обладали более высоким эпидемическим потенциалом, чем типичные Эль Тор вибрионы, эпидпотенциал которых снизился. В итоге уже геноварианты заменили типичные штаммы Эль Тор вибрионов и быстро распространились по всему миру. Необходимо отметить, что на фоне 7-й пандемии в том же 1992 году в Индии возникли вспышки холеры, вызванные холерными вибрионами O139 серогруппы. Быстрое распространение данных вибрионов вызвало опасения о начале 8-й пандемии. Однако в настоящее время холерные вибрионы O139 серогруппы циркулируют только в Индии, и доминирующими являются Эль Тор вибрионы.
Завоз на новые территории, загрязнение водоемов, совместное существование во внешней среде с другими микроорганизмами и т.д., способствовали дальнейшим преобразованиям генома геновариантов V. cholerae биовара Эль Тор. В современный период причиной холеры являются новые штаммы геновариантов, одной из генетических особенностей которых является наличие обширной делеции (21 ген) в центральной части острова пандемичности VSP-II (VSP-IIΔvc0495-vc0512). Глобальное распространение штаммов геновариантов с измененной структурой VSP-II и вытеснение ими ранее возникших геновариантов, имеющих интактный VSP-II, указывает на снижение эпидпотенциала у последних и наличие более высокого эпидемического потенциала у новых штаммов геновариантов [2, 12].
Таким образом, в настоящее время в мире циркулируют штаммы геновариантов V. cholerae O1 серогруппы биовара Эль Тор с разной структурой генома и разным эпидемическим потенциалом, способные нанести в разной степени ущерб здоровью населения и экономике страны. Учитывая, что штаммы геновариантов уже с 1993 года завозятся в Российскую Федерацию, вызывая как единичные случаи болезни, так и вспышки холеры, для повышения эффективности системы эпидемиологического надзора необходима разработка быстрого и достоверного способа идентификации токсигенных штаммов геновариантов и определении их эпидемического потенциала.
Известна комплексная гено- и иммунодиагностическая тест-система, позволяющая выявлять природные штаммы холерного вибриона O1 и O139 серогрупп и определять их вирулентность [1]. Однако данная тест-система не способна идентифицировать токсигенные геноварианты V. cholerae O1 биовара Эль Тор.
Известен способ дифференциации штаммов V. cholerae O139 серогруппы на токсигенные, эпидемически значимые и нетоксигенные, не имеющие эпидемической значимости, изоляты по алкилсульфатазной активности [5]. Известен способ выявления эпидемически значимых штаммов холерных вибрионов V. cholerae eltor и V. cholerae O139 по их адгезивной способности [3]. Описанные способы предусматривают дифференциацию эпидемически значимых штаммов O139 серогруппы и типичных штаммов O1 серогруппы Эль Тор биовара на основе анализа их фенотипических свойств, проявление которых является вариабельным признаком и может утрачиваться при хранении, а также сильно зависит от качества используемых сред и реактивов. Кроме того, ни один из вышеперечисленных способов не позволяет выявлять токсигенные штаммы геновариантов V. cholerae биовара Эль Тор.
Известно изобретение по патенту WO 2004020406, в котором описан способ выявления штаммов геновариантов V. cholerae биовара Эль Тор на основе исследования структуры генов tcpA и rstR [10]. Однако применение данных ДНК мишеней является не достаточным для выявления штаммов геновариантов и не предусматривает возможность их дифференциации по эпидемическому потенциалу.
Известен способ и тест-система для идентификации токсигенных штаммов Vibrio cholerae O1, определения их биовара и дифференциации штаммов биовара Эль Тор на типичные и измененные методом мультиплексной ПЦР в один прием в двух реакционных смесях [4]. Первая реакционная смесь содержит праймеры к генам rfbO1, cas3 и ctxBClass, вторая - к генам rfbO1, rtxC и ctxBEltor. Изобретение позволяет быстро и достоверно определять серогруппу, биовар, токсигенность исследуемого штамма и проводить дифференциацию выявленных токсигенных штаммов V. cholerae биовара Эль Тор на типичные изоляты и геноварианты. Вместе с тем это изобретение не способно определять эпидемический потенциал выявленных геновариантов, что является необходимым для получения полной характеристики выявленного изолята V. cholerae.
Таким образом, в данной области существует очевидная потребность в разработке простого, надежного и быстрого способа одновременного выявления токсигенных штаммов геновариантов холерных вибрионов биовара Эль Тор и их дифференциации по эпидемическому потенциалу.
Технический результат заключается в расширении диагностических возможностей способа за счет одновременного выявления токсигенных геновариантов V. cholerae O1 серогруппы биовара Эль Тор и их дифференцировании по эпидемическому потенциалу.
Технический результат достигается благодаря тому, что способ идентификации и дифференциации токсигенных штаммов геновариантов включает выделение ДНК исследуемого штамма, проведение одностадийной мультиплексной полимеразной цепной реакцией в двух реакционных смесях, каждая из которых содержит специально подобранное сочетание праймеров к генам rfbO1, rfbR, rstC, ctxA в первой, и ctxBClass, vc0502, vc0514 во второй, с температурой отжига праймеров 58°C в течение 10 сек при числе циклов амплификации, равном 25, с последующим анализом полученных амплифицированных фрагментов генов исследуемых и контрольных штаммов. Для токсигенных штаммов геновариантов V. cholerae биовара Эль Тор с низким эпидемическим потенциалом характерно наличие ампликонов генов rfbO1, rstC, ctxA, ctxBClass, vc0502, vc0514, у токсигенных геновариантов V. cholerae биовара Эль Тор с высоким эпидемическим потенциалом определяются ампликоны фрагментов генов rfbO1, rstC, ctxA, ctxBClass, vc0514.
Праймеры к участкам генов rfbO1, rfbR, rstC, ctxA, и аллель-специфические праймеры для гена ctxBClass взяты из литературных источников [1, 6, 7, 8, 11]. Праймеры rfbO1-F - rfbO1-R к участкам генов из кластера rfbO1, кодирующего биосинтез O1-антигена, образуют амлликон размером 638 п.н., праймеры rfbR-F - rfbR-R к участку гена rfbR, входящего в кластер генов, кодирующих биосинтез O139 антигена, формируют ПЦР-продукт размером 428 п.н., праймеры rstC-F - rstC-R на участок гена rstC, входящего в состав профага RS1, присутствующего только у холерных вибрионов биовара Эль Тор, обеспечивают образование фрагмента размером 238 п.н., праймеры ctxA-F - ctxA-R к участку гена ctxA, кодирующего А субъединицу холерного токсина, обеспечивают специфическую амплификацию фрагмента ДНК размером 564 п.н., праймеры ctxBClass-F - ctxBClass-R на аллель гена ctxB классического типа обеспечивают образование фрагмента размером 189 п.н.
Выбор ДНК-мишеней для определения эпидемического потенциала геновариантов осуществляли на основании анализа нуклеотидных последовательностей острова пандемичности VSP-II у токсигенных штаммов геновариантов V. cholerae биовара Эль Тор, изолированных в современный период 7-й пандемии и содержащих разные типы этого геномного острова. В качестве первой мишени был выбран ген vc0514, кодирующий метил-акцепторный белок хемотаксиса, наличие которого характерно для всех типов VSP-II. В качестве второй мишени был выбран ген vc0502, кодирующий пили IV-ого типа, отсутствующий у штаммов с протяженной делецией данного геномного острова и имеющих высокий эпидемический потенциал. Праймеры сконструированы с помощью программы Oligo 6.0 на основании представленных в базе данных нуклеотидных последовательностей выбранного гена и являются высокоспецифичными. Праймеры VSPIIpilin-F - 5′-CTGTGATTCGGGCTTTATCGG-3′ и VSPIIpilin-R - 5′-GCGTAAACTGAGCCAATAAGC-3′ к участку гена vc0502 обеспечивают образование фрагмента размером 761 п.н., праймеры VSPIIchem-F - 5′-CTTGATGGAGCGGAGAAAAC-3′, VSPIIchem-R - 5′-CGATGAATAGCCTGTTGAAC-3′ к участку гена vc0514 обеспечивают образование фрагмента размером 604 п.н.
Праймеры на гены vc0514, vc0502 подобраны таким образом, чтобы минимизировать вероятность их неспецифического отжига. Праймеры были проверены на возможность образования шпилечных структур с высокими температурами плавления, а также образования димерных соединений как одноименных праймеров, так и разноименных праймеров между собой. Размер получаемых фрагментов был подобран для упрощения процесса визуализации и учета результатов.
Оптимизация концентраций праймеров была достигнута при их смешивании в различных соотношениях, в результате предлагаемые концентрации позволяют получить легко детектируемые ампликоны. Концентрация каждого из дезоксинуклеозидтрифосфатов дАТФ, дГТФ, дЦТФ, дТТФ составляет 2 мМ. Экспериментально отработаны качественный и количественный состав буфера для амплификации и являются оптимальными для проведения исследования, определен режим постановки ПЦР.
Заявляемый способ идентификации включает следующие этапы:
а) выделение ДНК;
б) проведение ПЦР;
в) анализ результатов.
Выделение ДНК
ДНК извлекают из клеток с помощью любого комплекта реагентов для выделения ДНК (например, «Набор реагентов для выделения ДНК» Рег. уд. № ФСР 2011/11172-280611 производства РосНИПЧИ «Микроб», содержащий водную суспензию нуклеосорбента, буфер 1, включающий гуанидинзотиоцианат и ЭДТА, буферы 2, 3 - для отмывки и элюент для ДНК (ТЕ-буфер).
Проведение ПЦР
ПЦР проводят в один этап по следующей программе: предварительная денатурация при температуре 96°C - 2 мин, 25 циклов, включающих 96°C - 10 с, 58°C - 10 с, 72°C - 30 с, заключительная достройка цепи при температуре 72°C - 7 мин 20 сек.
Анализ результатов
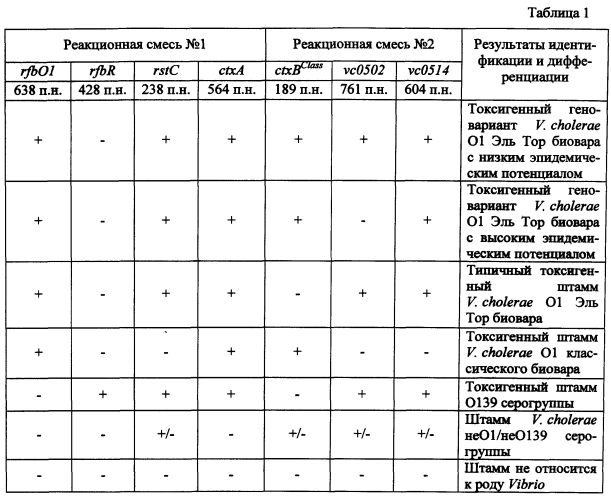
Детекцию амплифицированной ДНК после ПЦР осуществляют методом горизонтального гель-электрофореза в 2% агарозном геле. Учет результатов ПЦР проводят путем сравнения полученных ампликонов с контрольными образцами в соответствии с идентификационной таблицей (табл.1).
Способ осуществляют следующим образом.
1. Подготовку проб проводят согласно МУ 1.3.2569-09 «Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I-IV групп патогенности» в боксе биологической безопасности II класса в противочумном костюме IV типа в резиновых или латексных перчатках. Клетки холерных вибрионов, выращенные на LB-агаре в течение 18 часов, ресуспендируют в 0,9% растворе натрия хлорида до концентрации 109 микробных клеток в 1 мл и последующим разведением в деионизованной воде доводят до концентрации 1×107 м.к./мл. Затем к суспензии добавляют мертиолят натрия до конечной концентрации 1:10000 (0,01%) и прогревают при температуре 56°C в течение 30 мин. Далее, 100 мкл образца переносят в микроцентрифужную пробирку объемом 1,5 мл, добавляют лизирующий раствор, приготовленный на основе 6М гуанидинизотиоцианата, и инкубируют 15 мин при температуре 65°C. После выполнения данных процедур материал считается обеззараженным.
2. Выделение ДНК исследуемых штаммов холерного вибриона проводят с использованием комплекта реагентов для выделения ДНК. Комплект для выделения ДНК извлекают из холодильника и выдерживают при комнатной температуре. Выделение ДНК проводят согласно инструкции к набору. Очищенную ДНК хранят при температуре +4°C.
3. Для проведения ПЦР готовят необходимое количество микропробирок, соответствующее числу исследуемых проб, а также еще по шесть для каждой реакционной смеси: пять дифференцирующих положительных контролей и одного отрицательного контроля (деионизованная вода).
ПЦР проводят в объеме 25 мкл реакционной смеси на 1 пробу ДНК. Составы реакционной смеси №1 и №2 представлены в таблице 2. Для предотвращения испарения реакционной пробы в пробирки сверху осторожно наслаивают минеральное масло. В подготовленную смесь под масло вносят по 10 мкл пробы. В пробирку, обозначенную как отрицательный контроль, вносят 10 мкл деионизованной воды, а в пробирки с положительными контролями соответственно по 10 мкл ДНК контрольных штаммов. В качестве положительных контролей используют ДНК токсигенного штамма V. cholerae 569В O1 серо-группы классического биовара (rfbO1+, rfbR-, rstC-, ctxA+, ctxBClass+, vc0502-, vc0514-), типичного токсигенного штамма V. cholerae M738 O1 серогруппы биовара Эль Top (rfbO1+, rfbR-, rstC+, ctxA+, ctxBClass-, vc0502+, vc0514+), токсигенного штамма геноварианта V. cholerae M1266 Эль Top с интактным островом пандемичности VSP-II и низким эпидемическим потенциалом (rfbO1+, rfbR-, rstC+, ctxA+, ctxBClass+, vc0502+, vc0514+), токсигенного штамма геноварианта V. cholerae M1509 Эль Top, содержащего VSP-II с протяженной делецией и имеющего высокий эпидемический потенциал (rfbO1+, rfbR-, rstC+, ctxA+, ctxBClass+, vc0502-, vc0514+), токсигенного штамма V. cholerae P16064 O139 серогруппы (rfbO1-, rfbR+, rstC+, ctxA+, ctxBClass-, vc0502+, vc0514+).
Амплификацию ДНК осуществляют с использованием программируемого амплификатора «Терцик» (ДНК-Технология, Россия) при следующих температурных режимах (по матричному способу регулирования): температура денатурации - 96°C в течение 2 мин; 25 циклов - денатурация ДНК при температуре 96°C в течение 10 сек, отжиг праймеров 58°C - 10 сек, синтез комплементарной цепи при температуре 72°C - 30 сек; заключительный синтез комплементарной цепи при температуре 72°C в течение 7 мин 20 сек. Амплификацию контрольных образцов проводят одновременно с исследуемыми пробами в том же приборе и при тех же условиях.
4. Для анализа результатов ПЦР готовят 2% агарозный гель. Для этого к 1 г агарозы добавляют 50 мл ТАЕ буфера. Агарозу доводят до кипения, охлаждают при комнатной температуре примерно до температуры +65°C, добавляют 5 мкл этидиума бромида, осторожно перемешивают содержимое колбы равномерными вращательными движениями и заливают в специальный мостик, чтобы толщина геля составила примерно 4 мм. Затем устанавливают гребенку и оставляют застывать. После полимеризации осторожно извлекают гребенку и переносят гель в камеру для проведения электрофореза. К полученным ампликонам добавляют 5 мкл буфера для нанесения проб, перемешивают при помощи того же наконечника и вносят в лунки геля под буферный раствор. Камеру подключают к источнику тока и задают напряжение 7-10 В/см. Электрофоретическое разделение продолжают в течение 80 мин до прохождения лидирующим красителем около 4/5 длины трека (рекомендуемая длина трека - 10 см), после чего гель извлекают из камеры и помещают на стекло траисиллюминатора с УФ-излучением 310 нм. Фрагменты анализируемой ДНК проявляются в виде оранжево-красных полос.
Результаты оценивают путем сравнения полученных в ПЦР ампликонов с маркерными фрагментами контрольных штаммов V. cholerae. Учет результатов проводят в соответствии с идентификационной таблицей (табл.1).
С помощью праймеров, содержащихся в первой реакционной смеси, определяют серогруппу исследуемого штамма V. cholerae - O1 (rfbO1+) или 0139 (rfbR+), биовар (классический - rstC-, Эль Top - rstC+) и токсигенность (ctxA+). Праймеры, входящие в состав второй реакционной смеси, позволяют разделять штаммы V. cholerae O1 серогруппы биовара Эль Тор на типичные изоляты (ctxBClass-) и геноварианты (ctxBClass+) и дифференцировать геноварианты по структуре острова пандемичности VSP-II на штаммы с низким (vc0502+, vc0514+) и высоким (vc0502-, vc0514+) эпидемическим потенциалом.
На фиг. 1 приведена электрофореграмма ампликонов, полученных при постановке мультиплексной ПЦР с контрольными штаммами V. cholerae. На дорожке 1 показано положение ампликонов токсигенного штамма V. cholerae 569B O1 серогруппы классического биовара; на дорожке 2 - типичного токсигенного штамма V. cholerae M738 O1 серогруппы Эль Тор биовара, на дорожке 3 - токсигенного штамма геноварианта V. cholerae М1266 O1 серогруппы биовара Эль Тор с интактным островом пандемичности VSP-II и низким эпидемическим потенциалом, на дорожке 4 - токсигенного штамма геноварианта V. cholerae M1509 O1 серогруппы биовара Эль Top, несущего VSP-II с протяженной делецией, и имеющего высокий эпидемический потенциал, на дорожке 5 - токсигенного штамма V. cholerae P16064 O139 серогруппы. Дорожка 6 - отрицательный контроль.
Специфичность заявляемого способа подтверждена на основе использования штаммов близкородственных видов - V. mimicus, V. anguillarum, V. parahaemolyticus, a также энтеробактерий - Е. coli, S. enteritidis, Sh. flexneri. Результаты ПЦР тестирования указанных штаммов были отрицательными, что указывает на специфичность способа.
Изобретение иллюстрируется следующим примером.
Пример 1. Для определения эффективности заявляемого способа исследовано 28 клинических штаммов V. cholerae, выделенных на различных территориях и в разные годы.
У 22 исследуемых штаммов выявлены ампликоны размером 638 п.н. и 564 п.н., свидетельствующие об их принадлежности к токсигенным штаммам O1 серогруппы, два штамма (V. cholerae 14300 и М14380) были атоксигенными, так как у них отсутствовал ампликон размером 564 п.н. (табл.3). У 18 штаммов V. cholerae при ПЦР-анализе кроме гена rfbO1 обнаружен биовароспецифический ген rstC, выявляемый с помощью реакционной смеси №1, поскольку идентифицировался ампликон размером 238 п.н., что указывает на их принадлежность к токсигенным холерным вибрионам O1 биовара Эль Тор. При этом у 6 штаммов отсутствует ген ctxBClass (ампликон размером 189 п.н. в реакционной смеси №2), как и у штамма М738, взятого в качестве контрольного, что указывает на их отношение к типичным токсигенным штаммами V. cholerae O1 биовара Эль Тор (фиг 1., дорожка 2, табл.3). В то же время у остальных 12 изолятов обнаружено присутствие данного гена, что доказывает их принадлежность к токсигенным геновариантам V. cholerae 01 биовара Эль Тор. При анализе структуры острова пандемичности VSP-II данная группа штаммов была разделена на две. Первая состояла из 7 штаммов, которые содержали в реакционной смеси №2 два фрагмента размером 761 п.н. и 604 п.н. (табл.3). Данные штаммы геновариантов имеют низкий эпидемический потенциал. В то же время у второй группы, включающей 5 изолятов, амплифицировался только фрагмент размером 604 п.н., как у контрольного V. cholerae M1509, содержащего VSP-II с протяженной делецией (фиг. 1, дорожка 4, табл.3). Данные штаммы, изолированные в последние годы (2004-2012), являются геновариантами с высоким эпидемическим потенциалом, которые практически вытеснили геноварианты с низким эпидемическим потенциалом во многих регионах мира.
Кроме того, с помощью данной ПЦР можно также идентифицировать штаммы O1 серогруппы классического биовара и штаммы O139 серогруппы. Так, среди исследованных нами изолятов пять штаммов идентифицированы как токсигенные штаммы классического биовара. У данных штаммов происходила амплификация фрагментов ДНК размером 638 и 564 п.н. в реакционной смеси №1 и 189 п.н. в реакционной смеси №2, что свидетельствует о присутствии в их геноме генов rfbO1, ctxA и ctxBClass (фиг. 1., дорожка 1, табл.3). По присутствию ампликонов размером 428, 238 и 564 п.н. в реакционной смеси №1 и 761, 604 п.н. в реакционной смеси №2, что указывает на наличие соответственно генов rfbR, rstC, ctxA, vc0502, vc0514 пять исследованных штаммов отнесены к токсигенным штаммам V. cholerae O139 серогруппы (фиг. 1., дорожка 5, табл.3).
Таким образом, разработанный способ позволяет быстро и достоверно выявлять токсигенные штаммы геновариантов V. cholerae O1 серогруппы биовара Эль Тор, несущие в геноме ген ctxB классического типа, и дифференцировать их на основе анализа структуры острова пандемичности VSP-II на геноварианты с высоким и низким эпидемическим потенциалом.
Список литературы
1. Комплексная гено- и иммунодиагностическая тест-система для идентификации холерных вибрионов O1 и O139 серогрупп и оценки их вирулентности. Патент на изобретение №2404257, опубликован 20.11.2010 г.
2. Смирнова Н.И., Заднова С.П., Агафонов ДА., Шашкова А.В., Челдышова Н.Б., Черкасов А.В. Сравнительный молекулярно-генетический анализ мобильных элементов природных штаммов возбудителя холеры. 2013; 49(9): 1036-1047.
3. Способ выявления эпидемически значимых холерных вибрионов Vibrio cholerae eltor и Vibrio cholerae 0139 по их адгезивной способности. Патент РФ №2332460, опубликован 27.08.2008 г.
4. Способ идентификации токсигенных штаммов V. cholerae O1, определения их биовара и дифференциации штаммов биовара эльтор на типичные и измененные методом мультиплексной полимеразной цепной реакции и тест-система для его осуществления. Патент РФ №2458141, опубликован 10.08.2012 г.
5. Способ дифференциации штаммов Vibrio cholerae O139 серогруппы по алкилсульфатазной активности. Патент РФ №2473697, опубликован 21.01.2013 г.
6. Fields P.I., Popovic Т., Wachsmuth K., Olsvik O. Use of polymerase chain reaction for detection of toxigenic Vibrio cholerae O1 strains from the Latin American cholera epidemic. J. Clin. Microbiol. 1992; 30: 2118-2121.
7. Goel A.K., Ponmariappan S., Kamboj D.V., Singh L. Single multiplex polymerase chain reaction for environmental surveillance of toxigenic-pathogenic O1 and non-O1 Vibrio cholerae. Folia Microbiol. 2007, 52: 81-85.
8. Morita M., Ohnishi M., Arakawa E. et al. Development and validation of a mismatch amplification mutation PCR assay to monitor the dissemination of an emerging variant of Vibrio cholerae O1 biotype E1 Tor. Microbiol. bnmunol. 2008, 52 (6): 314-317.
9. Nair G.B., Faruque S.M., Bhuiyan N.A. et al. New Variants of Vibrio cholerae O1 biotype El Tor with attributes of the classical biotype from hospitalized patients with acute diarrhea in Bangladesh. J. Clin. Microbiol. 2002, 40(9): 3296-3299.
10. Variants of Vibrio cholerae O1 biotype El Tor with attributes of classical biotype. Invention WO 2004020406, publication 03.11.2004.
11. Waldor M.K., Rubin E.J., Pearson G.D.N. et al. Regulation, replication, and integration functions of the Vibrio cholerae CTXφ are encoded by region RS2. Mol. Microbiol. 1997, 24 (5): 917-926.
12. Taviani E., Grim C.J., Choi J. et al. Discovery of novel Vibrio cholerae VSP-II genomic islands using comparative genomic analysis. FEMS Microbiol. Lett 2010; 308: 130-137.
1. Способ одновременной идентификации токсигенных штаммов геновариантов возбудителя холеры Эль Тор и их дифференциации по эпидемическому потенциалу методом мультиплексной полимеразной цепной реакции, характеризующихся тем, что полимеразную цепную реакцию проводят в один прием в двух реакционных смесях, каждая из которых содержит специально подобранное сочетание праймеров к генам rfbO1, rfbR, rstC, ctxA в первой, и ctxBClass, vc0502, vc0514 во второй, с температурой отжига праймеров 58°C в течение 10 сек при числе циклов амплификации, равном 25, с последующим анализом полученных амплифицированных фрагментов генов исследуемых и контрольных штаммов; для токсигенных штаммов геновариантов V. cholerae O1 биовара Эль Тор с низким эпидемическим потенциалом характерно наличие ампликонов генов rfbO1, rstC, ctxA, ctxBClass, vc0502, vc0514, у токсигенных геновариантов V. cholerae O1 биовара Эль Тор с высоким эпидемическим потенциалом определяются ампликоны фрагментов генов rfbO1, rstC, ctxA, ctxBClass, vc0514.
2. Способ по п. 1, отличающийся тем, что праймеры, сконструированные на участки генов vc0502, vc0514, имеют следующие нуклеотидные последовательности:VSPIIpilin-F - 5′-CTGTGATTCGGGCTTTATCGG-3′, VSPIIpilin-R - 5′-GCGTAAACTGAGCCAATAAGC-3′, VSPIIchem-F - 5′-CTTGATGGAGCGGAGAAAAC-3′ VSPIIchem-R - 5′-CGATGAATAGCCTGTTGAAC-3′.