Способ комплексного лечения и профилактики рецидивов мышечно-неинвазивных форм рака мочевого пузыря
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к онкологии и онкохирургии, и может быть использовано для комплексного эндоуретрального лечения и профилактики рецидивов мышечно-неинвазивных форм рака мочевого пузыря. Для этого осуществляют биполярную трансуретральную резекцию опухоли мочевого пузыря в физиологическом растворе. После этого на 25-30-е сутки один раз в неделю проводят 1,5-2-месячный индукционный курс внутрипузырной иммунотерапии лекарственной композицией, которую готовят непосредственно перед введением в мочевой пузырь путём механического перемешивания вакцины БЦЖ Имурон 100-120 мг и геля Тизоль 10 г в 50 мл физиологического раствора. Время выдержки лекарственной композиции в мочевом пузыре составляет 30 минут. Через 1 месяц перерыва при отсутствии рецидива опухоли и удовлетворительной переносимости лечения проводят первый курс поддерживающей внутрипузырной терапии этой лекарственной композицией однократно ежемесячно продолжительностью 12 месяцев. По окончании первого курса делают перерыв в течение 1 месяца. При отсутствии рецидива опухоли и удовлетворительной переносимости лечения проводят второй курс поддерживающей внутрипузырной терапии однократно ежемесячно продолжительностью 12 месяцев. Способ обеспечивает увеличение длительности безрецидивного периода и улучшение качества жизни пациентов при уменьшении токсичности лечения и снижении осложнений проводимой лекарственной терапии. 2 ил., 5 табл., 2 пр.
Реферат
Изобретение относится к медицине, в частности к онкологии, а именно к онкоурологии, и может быть использовано в комплексном эндоуретральном лечении мышечно-неинвазивных (Та, T1, Tis) форм рака мочевого пузыря (РМП), в том числе высокого риска прогрессии, а также в профилактике рецидивов после трансуретрального удаления опухолей. Способ может быть использован как в условиях стационара, так и при амбулаторном лечении.
В настоящее время основным методом лечения больных мышечно-неинвазивным раком мочевого пузыря (понятия-синонимы - немышечно-инвазивный рак мочевого пузыря, поверхностный рак мочевого пузыря, рак мочевого пузыря без инвазии в мышечный слой) является хирургическое лечение в объеме трансуретральной резекции (ТУР).
К сожалению, результаты только хирургического лечения не удовлетворяют урологов: частота возникновения рецидивов после трансуретральной резекции (ТУР) крайне высока и составляет в среднем 80% [1, 2, 11]. У 20% больных мышечно-неинвазивным раком мочевого пузыря (РМП), с течением времени, отмечается прогрессия основного заболевания, т.е. появление инвазивного роста и/или увеличение степени злокачественности опухоли [1, 2, 11]. Согласно современным представлениям, лечение мышечно-неинвазивного РМП состоит из этапов удаления опухоли, профилактики рецидивов и предупреждения прогрессии опухоли [1, 3, 10, 12].
Известен способ внутрипузырной химиотерапии мышечно-неинвазивного РМП в адъювантном (послеоперационном) режиме, когда после трансуретрального удаления опухоли (ТУР) в мочевой пузырь вводят противоопухолевые химиопрепараты [1]. Внутрипузырная химиотерапия приводит к снижению вероятности развития рецидива на 44%, 39%, 36% и 39% для ТиоТЭФа, адриамицина, митомицина С и эпирубицина соответственно [4].
К недостаткам данного способа следует отнести, то, что он не оказывает влияния на прогрессирование опухолевого процесса у больных с высоким риском прогрессии заболевания.
Кроме того, наличие повреждения стенки мочевого пузыря во время трансуретральной резекции является противопоказанием к проведению внутрипузырной химиотерапии. А при наличии внебрюшной перфорации стенки мочевого пузыря и экстравазации препарата (проникновения в общий кровоток) возникают тяжелые токсические реакции [5].
В работах J. L. Au et al., 2001 г. [6] доказано, что кислотность мочи напрямую влияет на стабильность химиопрепарата, его поглощение клетками, а также на глубину проникновения. Кроме того, идеальный химиопрепарат для внутрипузырной терапии должен быть липофильным, легко проникать через уротелий и не попадать в системный кровоток. Однако большинство применяемых химиопрепаратов представлено гидрофильными соединениями.
К недостаткам данного способа следует отнести высокую стоимость препаратов.
Известен способ, предложенный в 1976 году A. Morales и соавт. [7], включающий внутрипузырное введении вакцины БЦЖ в разовой дозе от 100-120 мг один раз в неделю. Курс иммунопрофилактики состоит из 6 еженедельных внутрипузырных инстилляций и поддерживающей иммунотерапии по 100-120 мг 1 раз в 3 месяца до 2 лет.
Контролируемые сравнительные исследования продемонстрировали превосходство внутрипузырной БЦЖ-терапии перед введением химиопрепаратов (тиоТЭФ, или доксорубицина, или митомицина С) [4]. Девять рандомизированных исследований [4] доказали, что полная регрессия опухоли наступает у 51,0% больных, получавших внутрипузырную химиотерапию доксорубицином, и у 68,1% больных, получавших инстилляции вакциной БЦЖ.
Однако, несмотря на высокую противоопухолевую эффективность, этот способ имеет недостатки.
К недостаткам данного способа следует отнести: выраженные дизурические явления и цистит, появление которых отмечается у 80% больных; макрогематурию, которая наблюдается у 40% пациентов [1, 8], и вследствие этого - тяжелое общее состояние больного, невозможность проведения повторных курсов внутрипузырной иммунотерапии чаще, чем через 3-4 недели, отсюда снижение эффективности лечения. Осложнения при проведении данного способа внутрипузырной БЦЖ-терапии возникают после 2-3 введений вакцины и начинаются через 2-3 часа после инстилляции, длятся в течение 1-2 суток и требуют дополнительного лечения, а в некоторых случаях и госпитализации пациента. С увеличением количества инстилляций выраженность побочных проявлений нарастает. Появление макрогематурии увеличивает риск попадания вакцины БЦЖ в общий кровоток, что приводит к развитию системных поражений. У 20% пациентов в результате выраженной дизурии, не проходящей к моменту следующей инстилляции, лечение прерывается или откладывается. После окончания лечения мочевой инфекции БЦЖ-терапия может быть продолжена, но уже со снижением дозы на 30%. При тяжелых циститах, длящихся более 10 дней, лечение прекращается, назначаются фторхинолоны в течение 3-6 недель; могут быть назначены стероидные гормоны, если симптомы сохраняются более 2 недель. У 3-5% возникают локальные осложнения в виде симптоматических гранулематозных циститов, простатитов, эпидидимитов. У 40% пациентов в день инстилляции повышается температура тела до 38,5°C. Доказано, что наиболее чаще осложнения БЦЖ-терапии возникают у больных пожилого и старческого возраста, в связи с чем поддерживающая терапия у данной категории больных проводится с ограничениями. Некоторой сложностью известного способа является необходимость длительного удержания вакцины БЦЖ в просвете мочевого пузыря, в течение 2 часов.
Наиболее близким аналогом, принятым за прототип, является способ послеоперационной терапии мышечно-неинвазивного рака мочевого пузыря ([9], патент RU 2443423, оп. 27.02.2012), включающий проведение после трансуретральной резекции мочевого пузыря (ТУР) адъювантной внутрипузырной терапии противоопухолевыми химиопрепаратами, предварительно разведенными в водном растворе Тизоля. Сущность способа заключается в инстилляциях лекарственной композиции состава: 40% водного раствора Тизоль и химиопрепарат (доксорубицин 50 мг или митомицин 40 мг) через катетер, установленный в мочевом пузыре у больных мышечно-неинвазивным РМП с низким (Та, G1, первичные, единичные, размером <3 см) и промежуточным (Та, T1, G1, G2, ≤1 рецидива в год, число опухолей от 2 до 7, размером <3 см) риском рецидива и прогрессии, в следующем режиме: однократная инстилляция химиопрепарата - цитостатика непосредственно тотчас после оперативного лечения ТУР с последующим 6-недельным курсом введения химиопрепаратов с частотой - 1 раз в неделю.
Однако этот способ имеет ограничения. Несмотря на то что способ повышает переносимость противоопухолевых химиопрепаратов, клиническая эффективность способа специфична только у больных с низким и промежуточным риском рецидива (более благоприятные клинические формы мышечно-неинвазивного РМП) и не предотвращает прогрессирования опухоли мочевого пузыря у больных с высоким риском прогрессии (T1, G3, множественные более 8, размером ≥3 см, часто рецидивирующие опухоли) и carcinoma in situ.
К недостаткам известного прототипа следует отнести длительное время удержания раствора противоопухолевого химиопрепарата внутри полости мочевого пузыря - не менее одного часа, что вызывает существенный дискомфорт у больного, особенно непосредственно после оперативного вмешательства. В первые часы у больного возникает проблема удержания мочи с противоопухолевым препаратом в полости мочевого пузыря в результате послеоперационного болевого синдрома, массивной перфузии жидкости почками и форсированного поступления мочи в мочевой пузырь.
Существенным недостатком прототипа является использование стандартного оперативного лечения, проводимого у больных мышечно-неинвазивными (поверхностными) формами рака мочевого пузыря - трансуретральной резекции (ТУР) мочевого пузыря в монополярном режиме, широко используемой в клинической практике в Российской Федерации. К недостаткам монополярной хирургии относят: глубокое термическое повреждение тканей, что затрудняет применение данного метода у больных с опухолью мочевого пузыря, близко расположенной к устью мочеточника или в проекции запирательного нерва; невозможность применения данного метода у больных с кардиостимулятором; при опухолях больших размеров, что связано с ограничением времени проведения операции, обусловленным высоким риском развития ТУР-синдрома.
Указанные недостатки снижают эффективность лечения мышечно-неинвазивного рака мочевого пузыря.
Задачей, на решение которой направлено заявляемое изобретение, является повышение эффективности лечения рака мочевого пузыря, уменьшение токсичности лечения, снижение количества осложнений лекарственной терапии, сокращение частоты рецидивирования и прогрессирования рака мочевого пузыря, уменьшение времени удержания противоопухолевого препарата в полости мочевого пузыря без изменения разовой дозы противоопухолевого препарата, увеличение длительности безрецидивного периода и продолжительности жизни, а также улучшение качества жизни пациентов.
Для решения поставленной задачи в способе комплексного эндоуретрального лечения и профилактики рецидивов мышечно-неинвазивных форм рака мочевого пузыря, включающем трансуретральную резекцию опухоли мочевого пузыря и последующее проведение внутрипузырной терапии противоопухолевым препаратом с добавлением Тизоля, согласно изобретению осуществляют биполярную трансуретральную резекцию опухоли мочевого пузыря в физиологическом растворе (0,9% NaCl), затем на 25-30-е сутки проводят один раз в неделю 1,5-2-месячный индукционный курс внутрипузырной иммунотерапии лекарственной композицией, содержащей противоопухолевый препарат -вакцину БЦЖ Имурон и гель Тизоль, и далее через 1 месяц перерыва после индукционного курса при отсутствии рецидива опухоли мочевого пузыря и удовлетворительной переносимости лечения проводят первый курс поддерживающей внутрипузырной терапии указанной лекарственной композицией однократно ежемесячно продолжительностью 12 месяцев, по окончании делают перерыв в течение 1 месяца, далее при отсутствии рецидива опухоли мочевого пузыря и удовлетворительной переносимости лечения проводят второй курс поддерживающей внутрипузырной терапии указанной лекарственной композицией однократно ежемесячно продолжительностью 12 месяцев, при этом лекарственную композицию готовят непосредственно перед введением в мочевой пузырь путем механического перемешивания вакцины БЦЖ Имурон 100-120 мг и геля Тизоль 10 г в физиологическом растворе 50 мл (0,9% NaCl) и время выдержки лекарственной композиции в мочевом пузыре составляет 30 минут.
В качестве противоопухолевого препарата используют вакцину БЦЖ Имурон.
Отличительные приемы заявляемого способа заключаются в том, что внутрипузырная лекарственная терапия проводится после эндоуретрального оперативного лечения - биполярной трансуретральной резекции мочевого пузыря в физиологическом растворе (0,9% NaCl). Принципиальное отличие биполярного от монополярного электрического воздействия заключается в том, что ток при нем не проходит через весь организм больного, а ограничивается расстоянием между электродами (активным и пассивным).
Биполярная трансуретральная резекция опухоли мочевого пузыря в физиологическом растворе (0,9% NaCl) не вызывает глубокого термического повреждения тканей, поэтому может быть использована у больных с опухолью мочевого пузыря, близко расположенной к устью мочеточника и в проекции запирательного нерва, при опухолях больших размеров, а также у больных с наличием кардиостимулятора. Кроме того, биполярная трансуретральная резекция опухоли мочевого пузыря в физиологическом растворе не вызывает развития ТУР-синдрома. Отличительными преимуществами биполярной трансуретральной резекции мышечно-неинвазивного РМП в физиологическом растворе перед монополярной трансуретральной резекцией является сокращение продолжительности оперативного вмешательства и обеспечение более качественного интраоперационного гемостаза. Применение биполярной резекции в физиологическом растворе повышает радикальность эндоуретрального оперативного лечения мышечно-неинвазивного РМП.
Другим отличительным признаком заявляемого способа является то, что при внутрипузырной лекарственной терапии используется более эффективный противоопухолевый препарат - вакцина БЦЖ Имурон. Вакцина БЦЖ - это взвесь жизнеспособных бацилл Кальметта-Герена (Calmette-Guerin), внутриклеточно размножаясь, они стимулируют местный иммунитет, в котором задействованы макрофаги, Т-лимфоциты и цитокины. Несмотря на то что механизм противоопухолевого действия вакцины окончательно не изучен, доказано, что внутрипузырная БЦЖ-терапия наиболее эффективна при поверхностных опухолях мочевого пузыря с достаточно высоким риском рецидивирования и прогрессирования по сравнению с внутрипузырной химиотерапией. БЦЖ-терапия после трансуретральных операций обладает собственно лечебным эффектом в отношении мышечно-неинвазивных форм РМП. БЦЖ-терапия имеет преимущества перед химиотерапией, так как снижает темпы прогрессирования, что объясняется более глубоким течением воспалительной реакции на введение иммунопрепарата.
В отличие от прототипа заявляемый способ может быть использован при лечении carcinoma in situ, а также быть альтернативой противоопухолевого лечения рака мочевого пузыря у больных, плохо переносящих внутрипузырную химиотерапию.
Комбинация вакцины БЦЖ Имурон и геля Тизоль при внутрипузырном адъювантном лечении мышечно-неинвазивного рака мочевого пузыря снижает частоту рецидивирования опухоли у больных с низким, промежуточным и высоким риском рецидива, уменьшает токсичность вакцины БЦЖ Имурон. Биоадгезивные свойства геля Тизоль сокращают время удержания вакцины БЦЖ Имурон в полости мочевого пузыря до 30 минут, что способствует уменьшению риска развития выраженных общих токсических и локальных осложнений, не снижая высокую противоопухолевую эффективность вакцины. Таким образом, заявленный способ является одним из возможных путей преодоления токсичности внутрипузырной иммунотерапии вакциной БЦЖ Имурон без уменьшения разовой дозы основного противоопухолевого препарата.
Применяемый в способе гель Тизоль используется в качестве основного по массе компонента. Гель Тизоль, смешиваясь с противоопухолевым препаратом основного действия - вакциной БЦЖ Имурон, усиливает ее связывание со слизистой оболочкой мочевого пузыря, потенцирует ее проницаемость в стенку мочевого пузыря для развития местной иммунной реакции, сокращает время удержания вакцины БЦЖ Имурон в полости мочевого пузыря, снижает частоту общих токсических и локальных осложнений и улучшает качество жизни пациентов. Вакцина БЦЖ и гель Тизоль биологически совместимы, что позволяет вводить их в полость мочевого пузыря совместно и обладает большей эффективностью по сравнению с монотерапией вакциной БЦЖ.
Использование в заявляемом способе биполярной трансуретральной резекции мышечно-неизвазивной опухоли мочевого пузыря в физиологическом растворе по сравнению с монополярной ТУР способствует сокращению: продолжительности оперативного вмешательства, частоты хирургических осложнений, сроков послеоперационной катетеризации мочевого пузыря и количества койко-дней.
Технические и методологические аспекты применения биполярной трансуретральной резекции мышечно-неинвазивного РМП в физиологическом растворе по сравнению с монополярной ТУР позволяют добиться большей надежности и безопасности эндоуретрального оперативного вмешательства у большинства пациентов, повысить радикальность оперативного лечения: снизить частоту рецидивирования, увеличить длительность безрецидивного периода и пятилетней выживаемости.
Заявляемый способ отличается от прототипа также тем, что внутрипузырную лекарственную терапию проводят на 25-30 сутки после оперативного вмешательства. За этот промежуток времени у больного в послеоперационной ране появляется грануляционный вал, препятствующий массивному попаданию препарата в кровь. Отсутствует макрогематурия. Проведение внутрипузырной лекарственной терапии на 25-30 сутки снижает частоту осложнений и способствует улучшению качества жизни пациентов, больных раком мочевого пузыря.
Предлагаемая схема проведения внутрипузырной иммунотерапии вакциной противоопухолевым препаратом БЦЖ Имурон с добавлением Тизоля, при которой на 25-30-е сутки проводят 1,5-2-месячный индукционный курс внутрипузырной иммунотерапии указанной лекарственной композицией один раз в неделю и далее через 1 месяц перерыва после индукционного курса при отсутствии рецидива опухоли мочевого пузыря и удовлетворительной переносимости лечения проводят поддерживающую внутрипузырную терапию из двух курсов указанной лекарственной композицией однократно ежемесячно продолжительностью 12 месяцев каждый, с перерывом между курсами в 1 месяц с сохранением времени выдержки лекарственной композиции в мочевом пузыре 30 минут, позволяет достичь сокращения времени удержания вакцины БЦЖ Имурон в полости мочевого пузыря (с 2 часов до 30 минут), что способствует уменьшению риска развития выраженных токсических и локальных осложнений, не снижая высокую противоопухолевую эффективность вакцины; уменьшение частоты рецидирования и прогрессирования мышечно-неинвазивного рака мочевого пузыря, увеличивает безрецидивную выживаемость и длительность безрецидивного периода, а также способствует улучшению качества жизни больных.
В проанализированной авторами научно-медицинской и патентной литературе не найдена заявляемая в изобретении совокупность существенных признаков, следовательно, изобретение соответствует критерию «новизна».
В ходе поиска не выявлено решений, имеющих признаки, совпадающие с отличительными признаками заявляемого изобретения, указанные отличительные признаки для специалиста явным образом не следуют из уровня техники, следовательно, заявляемое изобретение обладает критерием «изобретательский уровень»
Данный способ прошел клинические испытания в ГБОУ ВПО Иркутский государственный медицинский университет и ГБОУ ИГМАПО Минздрава России, г. Иркутск. Изобретение "Способ комплексного лечения и профилактики рецидивов мышечно-неинвазивных форм рака мочевого пузыря" является промышленно применимым, так как может быть использован в здравоохранении, в научно-исследовательских онкологических институтах, в онкодиспансерах и других медицинских учреждениях, занимающихся лечением рака мочевого пузыря.
Таким образом, данное техническое решение соответствует критериям изобретения «новизна», «изобретательский уровень» и «промышленная применимость».
Способ осуществляется следующим образом.
Проводят операцию - биполярную трансуретральную резекцию (TURis) опухоли мочевого пузыря в физиологическом растворе (0,9% NaCl) под спинномозговой анестезией на генераторе OLYMPUS VES-40 Surg. Master. Окончательную стадию онкологического процесса определяют на основании морфологического исследования операционного материала. На 25-30-е сутки в условиях медицинского учреждения, соответствующего санитарно-эпидемиологическим правилам СП 3.3.2.1120-02, проводят внутрипузырную иммунотерапию лекарственной композицией, содержащей противоопухолевый препарат - вакцину БЦЖ Имурон 100-120 г, гель Тизоль 10 г, разведенные в 50 мл физиологического раствора (0,9% NaCl). В ходе процедуры в асептических условиях мочевой пузырь катетеризируют тонким уретральным катетером Нелатона диаметром 12 Fr., освобождают от мочи и дважды промывают физиологическим раствором (0,9% NaCl) с целью максимального удаления электролитов мочи и контроля отсутствия в промывной жидкости примеси крови. После этого в одноразовом шприце смешивают вакцину БЦЖ Имурон (100-120 мг), гель Тизоль (10 г) и 50 мл физиологического раствора (0,9% NaCl). Готовую лекарственную композицию в виде суспензии после механического перемешивания вводят по катетеру в мочевой пузырь. Лекарственную композицию удерживают в мочевом пузыре в течение 30 минут. Пациенту предлагают менять положение тела для равномерного контакта вакцины со стенками мочевого пузыря. Через 30 минут мочевой пузырь опорожняется в емкость, содержащую не менее 500 мл дезинфицирующего раствора (5% хлорамин). Рекомендуемая разовая доза вакцины БЦЖ Имурон - 100-120 мг. Введение лекарственной композиции осуществляют 1 раз в неделю в течение 1,5-2 месяцев. Суммарная доза вакцины БЦЖ Имурон составляет 600-720 мг÷800-960 мг. Через 4 недели после окончания основного (индукционного) 1,5-2-месячного курса проводят контрольную фиброуретроцистоскопию. Пациенты с отсутствием рецидива опухоли мочевого пузыря и удовлетворительной переносимостью лечения переводятся на поддерживающую терапию, состоящую из двух курсов. Первый курс поддерживающей терапии заключается в том, что через 1 месяц перерыва после основного (индукционного) курса иммунотерапии внутрипузырно вводят лекарственную композицию состава вакцины БЦЖ Имурон (120 мг) и геля Тизоль (10 г), разведенные в 50 мл физиологического раствора (0,9% NaCl) один раз в месяц в течение 12 месяцев. По завершении первого курса поддерживающей терапии делают перерыв в течение 1 месяца и всем больным проводят контрольное обследование, включающее: ультразвуковое исследование почек, мочевого пузыря; эндоскопическое исследование мочевого пузыря с целью определения состояния стенок органа и верхних мочевыводящих путей. Из участков очаговой гиперемии в мочевом пузыре берут биопсию. Всем больным проводят цитологическое исследование мочи. Пациенты с отсутствием рецидива опухоли мочевого пузыря и удовлетворительной переносимостью лечения переводятся на второй курс поддерживающей терапии. Второй курс поддерживающей терапии указанной лекарственной композицией состава: вакцина БЦЖ Имурон (120 мг) и гель Тизоль (10 г) с разведением физиологическим раствором (50 мл) 1 раз в месяц в течение 12 месяцев. Контрольное обследование проводят после окончания курса лечения и каждые 3 месяца в течение 2 лет, при отсутствии рецидива опухоли мочевого пузыря - ежегодно.
Авторами были проведены клинические исследования.
Пример 1. В период с 2004 по 2010 гг. в исследование были включены 120 больных мышечно-неинвазивным РМП, находившиеся на обследовании и лечении в ГБУЗ «Областной онкологический диспансер». Из них 82 мужчин и 38 женщин в возрасте от 41 до 82 лет (средний возраст составил 56,6±1,0). Критериями отбора больных в исследование служило наличие у них гистологически верифицированного мышечно-неинвазивного переходно-клеточного РМП с неблагоприятным (категория Т1, низкая степень дифференцировки - G3, множественные, часто рецидивирующие опухоли, наличие рака in situ) и промежуточным (категория Та, высокая - G1 или средняя - G2 степень дифференцировки, множественные рецидивные опухоли диаметром >3 см) прогнозом, отсутствие уретерогидронефроза, отдаленных либо регионарных метастазов, а также информированное согласие пациента на лечение и участие в исследовании. Перед включением в протокол пациенты проходили стандартное обследование. После выполнения биполярной трансуретральной резекции опухоли мочевого пузыря в физиологическом растворе (TURis) под спинномозговой анестезией и получения гистологического заключения об отсутствии мышечной инвазии и соответствии критериям включения проводилась рандомизация. Больные разделялись на 2 группы: первая контрольная группа (n=60) - у которых адъювантная внутрипузырная лекарственная терапия применялась в виде инстилляций композиции химиопрепаратов (доксорубицин 50 мг или митомицин С 40 мг) и 40% водного раствора Тизоль через катетер, установленный в мочевом пузыре, в течение часа после операции, и вторая основная группа (n=60) - на 30-е сутки после TURis назначался 1,5-месячный индукционный курс внутрипузырных инстилляций лекарственной композиции - вакцина БЦЖ Имурон 120 мг и гель Тизоль 10 г в 50 мл физиологического раствора (0,9% NaCl) один раз в неделю.
Контрольное обследование пациентов проводилось через 3 месяца после операции, затем каждые 3 месяца в течение первых 2 лет наблюдения, затем каждые 6 месяцев. При контрольном обследовании проводили цитологическое исследование мочи, диагностическую уретроцистоскопию, ультразвуковое исследование, рентгенологическое исследование грудной клетки, сцинтиграфию костей скелета с целью выявления рецидива и отдаленных метастазов. В случае обнаружения рецидивирования и прогрессирования заболевания проводилось соответствующее лечение по показаниям. Ранним признавался рецидив, наступивший в течение первого года наблюдения.
Пациенты с отсутствием рецидива опухоли мочевого пузыря и удовлетворительной переносимостью внутрипузырной иммунотерапии переводились на первый курс поддерживающей терапии. Первый курс поддерживающей терапии заключался в том, что через 1 месяц перерыва после основного (индукционного) курса иммунотерапии внутрипузырно вводили лекарственную композицию состава вакцины БЦЖ Имурон (120 мг) и геля Тизоль (10 г), разведенные в 50 мл физиологического раствора (0,9% NaCl) один раз в месяц в течение 12 месяцев. По завершении первого курса поддерживающей терапии и перерыва в течение 1 месяца больным проводили контрольное обследование. Пациенты с отсутствием рецидива опухоли мочевого пузыря и удовлетворительной переносимостью лечения переводились на второй курс поддерживающей терапии. Второй курс поддерживающей терапии указанной лекарственной композицией: вакцину БЦЖ Имурон (120 мг) и гель Тизоль (10 г) с разведением физиологическим раствором (50 мл) вводили 1 раз в месяц в течение 12 месяцев. Контрольное обследование проводили после окончания курса лечения и каждые 3 месяца в течение последующих 2 лет, при отсутствии рецидива опухоли мочевого пузыря - ежегодно.
Медиана наблюдения для всей когорты пациентов составила 30,9 месяцев. В течение этого периода рецидивы выявлены у 26 (43,3%) больных в первой, у 8 (13,3%) - во второй группе.
При оценке выживаемости во второй группе трехлетняя безрецидивная выживаемость оказалась выше (78,5±6,8%), чем в первой (62,6±6,3%), различия признаны статистически не значимыми (Dks=0,43; р-value=0,999), λэмп=0,43<1,36=λкр.
Прогрессирование наблюдалось у 11 (9,7%) больных: у 9 (15,0%) - в первой группе и у 2 (7,0%) - из второй группе. Достоверных различий в выживаемости до прогрессирования в группах не выявлено (p-value=0,83). Полный курс лечения закончили 44 (73,3%) больных первой группы и 57 (95%) - второй группы. Курс лечения был прерван из-за развившихся осложнений у 16 (26,6%) больных в первой группе, у 3 (5,0%) больных - во второй.
Из системных побочных эффектов зарегистрированы 2 случая аллергической реакции в первой группе. Гипертермия >38,5°С наблюдалась у 5 (8,3%) больных первой группы и у 1 (1,7%) - второй группы. Развитие легочных осложнений в виде БЦЖ-пневмонита зафиксировано у 1 (1,7%) пациента во второй группе. В данном случае потребовалось назначение длительной противотуберкулезной терапии.
Среди местных токсических проявлений внутрипузырной терапии отмечены дизурические явления у 11 (18,3%) пациентов первой группы и у 2 (3,3%) больных из второй группы. Гематурия развилась соответственно у 5 (8,3%) и 1 (1,7%) пациентов первой и второй групп. Сравнение числа осложнений в группах с учетом степени токсичности и общего количества осложнений показало статистически значимые различия между группами (p-value=0,011 и p-value=0,045, соответственно). Сравнение частоты осложнений в исследуемых группах показало, что в группе с использованием лекарственной композиции состава: вакцина БЦЖ + гель Тизоль наблюдалось меньшее число осложнений, причем это различие было статистически значимо (p-value=0,024). Кроме того, отмечено статистически значимое различие в частоте осложнений II-III степени токсичности в пользу второй группы по сравнению с химиотерапией в комбинации с Тизолем (p-value=0,013).
Выводы. Таким образом, проведенные исследования продемонстрировали, что основными клиническими преимуществами внутрипузырной адъювантной иммунотерапии лекарственной композицией вакцины БЦЖ (Имурон) и геля Тизоль, используемой в эндоуретральном лечении больных мышечно-неинвазивным РМП, перед адъювантной внутрипузырной лекарственной химиотерапией для большинства пациентов являются: сокращение местных и системных токсических проявлений; уменьшение частоты рецидирования и прогрессирования мышечно-неинвазивного рака мочевого пузыря, а также увеличение трехлетней безрецидивной выживаемости.
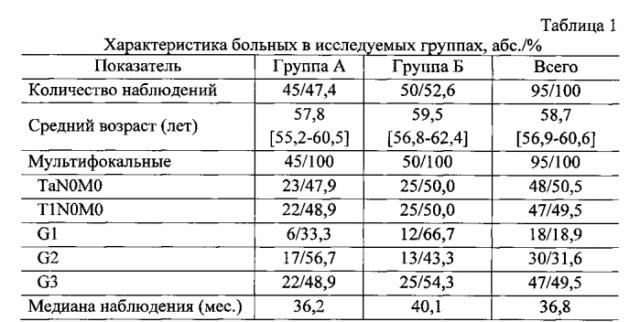
Пример 2. В период с 2004 по 2011 гг. в исследование было включено 95 больных, получавших лечение по поводу переходно-клеточного мышечно-неинвазивного РМП: TaN0M0 - у 48 (50,5%), T1N0M0 - у 42 (44,2%) на базе ГБУЗ «Областной онкологический диспансер» г. Иркутска. Степень дифференцировки опухоли G1 диагностирована у 18 (18,9%), G2 - у 30 (31,6%) и G3 - у 46 (48,4%) пациентов. Размер опухоли МП варьировался от 3,5 см до 6,3 см.
В соответствии с критериями включения проводилась рандомизация, больные разделялись на 2 группы. В группе А (n=45) пациенты получали предлагаемый нами новый способ иммунотерапии комбинацией вакцины БЦЖ и геля Тизоль. На 25-30-е сутки после проведенной биполярной трансуретральной резекции (TURis) в физиологическом растворе (0,9% NaCl) по поводу мышечно-неинвазивного РМП (генератор OLYMPUS VES-40 Surg. Master) проводили внутрипузырную иммунотерапию лекарственной композицией, содержащей противоопухолевый препарат - вакцину БЦЖ Имурон 100-120 г, гель Тизоль 10 г, разведенные в 50 мл физиологического раствора (0,9% NaCl). В ходе процедуры в асептических условиях мочевой пузырь катетеризировали тонким уретральным катетером Нелатона диаметром 12 Fr., освобождали от мочи и дважды промывали физиологическим раствором (0,9% NaCl) с целью максимального удаления электролитов мочи и контроля отсутствия в промывной жидкости примеси крови. После этого в одноразовом шприце смешивали вакцину БЦЖ Имурон (100-120 мг), гель Тизоль (10 г) и 50 мл физиологического раствора (0,9% NaCl). Готовую лекарственную композицию в виде суспензии после механического перемешивания вводили по катетеру в мочевой пузырь. Лекарственную композицию предлагали пациенту удерживать в полости мочевого пузыря в течение 30 минут. Для равномерного контакта вакцины со стенками мочевого пузыря пациенту предлагали менять положение тела. Через 30 минут мочевой пузырь предлагали опорожнить в емкость, содержащую не менее 500 мл дезинфицирующего раствора (5% хлорамин). Рекомендуемая разовая доза вакцины БЦЖ Имурон - 100-120 мг. Введение лекарственной композиции осуществляют 1 раз в неделю в течение 1,5-2 месяцев. Суммарная доза вакцины БЦЖ Имурон составляла 600-720 мг÷800-960 мг. Через 4 недели после окончания основного (индукционного) 1,5-2-месячного курса проводили контрольную фиброуретроцистоскопию. Пациентов с отсутствием рецидива опухоли мочевого пузыря и удовлетворительной переносимостью лечения переводили на поддерживающую терапию, состоящую из двух курсов. Первый курс поддерживающей терапии заключается в том, что через 1 месяц перерыва после основного (индукционного) курса иммунотерапии внутрипузырно вводили лекарственную композицию состава вакцины БЦЖ Имурон (120 мг) и геля Тизоль (10 г), разведенные в 50 мл физиологического раствореа (0,9% NaCl) один раз в месяц в течение 12 месяцев. По завершении первого курса поддерживающей терапии и перерыва в течение 1 месяца больным проводили контрольное обследование, включающее: ультразвуковое исследование почек, мочевого пузыря; эндоскопическое исследование мочевого пузыря с целью определения состояния стенок органа и верхних мочевыводящих путей. Из участков очаговой гиперемии в мочевом пузыре брали биопсию для исключения рецидива. Пациенты с отсутствием рецидива опухоли мочевого пузыря и удовлетворительной переносимостью лечения переводятся на второй курс поддерживающей терапии. Второй курс поддерживающей терапии указанной лекарственной композицией: вакцина БЦЖ Имурон (120 мг) и гель Тизоль (10 г) с разведением физиологическим раствором (50 мл) 1 раз в месяц в течение 12 месяцев. Контрольное обследование проводили после окончания курса лечения и каждые 3 месяца в течение 2 лет, при отсутствии рецидива опухоли мочевого пузыря - ежегодно.
Больным из группы Б (n=50) после проведения биполярной трансуретральной резекции на 25-30 сутки назначался стандартный 6-недельный индукционный курс внутрипузырных инстилляций 120 мг вакцины БЦЖ (один раз в неделю) и поддерживающий курс: 12 внутрипузырных инстилляций вакцины БЦЖ (120 мг) 1 раз в месяц с интервалом 4 недели и затем, после очередного контрольного обследования, последующие 12 инстилляций по 120 мг вакцины БЦЖ 1 раз в месяц. Время удержания вакцины в полости МП составляло 2 часа.
Возраст 95 больных, включенных в исследование, среди которых 59 (62,1%) мужчин и 36 (37,9%) женщин, представлен следующими данными сводной статистики: среднее 58,7; мода мн.; минимум 40; 1-квартиль 52 лет; медиана 60; 3-квартиль 66; максимум 79 [95% (ДИ) 56,9-60,6].
Медиана наблюдения за больными составила 36,8 мес. Полный курс лечения закончили 44 (97,8%) пациента из группы А и 31 (62,0%) из группы Б.
Непосредственные и отдаленные результаты лечения больных мышечно-неинвазивным РМП в исследуемых группах при использовании различных методик адъювантной внутрипузырной иммунотерапии вакциной БЦЖ анализировали путем сравнения частоты и характера локальных и системных побочных явлений, особенностей переносимости лечения, влияния инстилляций на частоту рецидивирования и прогрессирования РМП, а также 3-летнюю выживаемость (общую, скорректированную, безрецидивную и безрецидивную скорректированную).
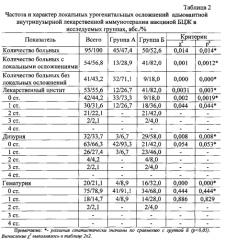
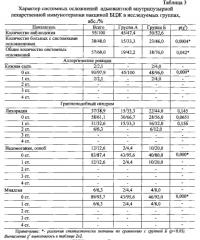
Гематурия значительно реже возникала в группе А - у 4 (8,9%) наблюдаемых, в группе Б - в 16 (32,0%) случаев. Сравнение частоты возникновения гематурии в исследуемых группах показало статистически значимые различия между группами (р(χ2)=0,00001).
Системные побочные эффекты адъювантной внутрипузырной иммунотерапии вакциной БЦЖ в нашем исследовании встречались значительно реже, чем местные. После проведения иммунотерапии вакциной БЦЖ мы зарегистрировали 57 различных системных осложнений у 38 (40,0%) больных, из них у 15 (33,3%) пациентов из группы А и у 23 (46,0%) из группы Б (р(χ2)=0,0004).
Аллергические реакции в виде кожной сыпи отмечены в 2 (2,1%) случаях после второй и третьей инстилляции вакцины БЦЖ, что потребовало временного назначения Н2-гистаминоблокаторов. Все аллергические реакции возникли в группе клинического сравнения Б (4,0%).
Комбинация вакцины БЦЖ и геля Тизоль показала статистически значимо более низкую токсичность по сравнению с монотерапией вакциной БЦЖ в отношении частоты развития локальных урогенитальных (группа А - 28,9% и группа Б - 82,0%, р=0,0012) и системных осложнений (группа А - 42,2% и группа Б - 76,0%, р=0,042).
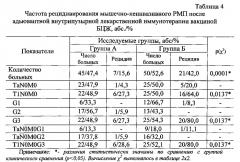
Критерий χ2 подтвердил статистически значимое уменьшение частоты рецидивирования (группа А - 15,6% и группа Б - 42,0%, р=0,0001) и прогрессирования РМП (группа А - не зарегистрировано и группа Б -10,0%, р=0,0023) при использовании вакцины БЦЖ и геля Тизоль по сравнению с монотерапией вакциной БЦЖ.
Анализ эффективности нового метода адъювантной внутрипузырной иммунотерапии вакциной БЦЖ (Имурон) и гелем Тизоль обеспечивает статистически значимое улучшение на 27,8% безрецидивной (pLog-Rank=0,00759) и на 26,2% - безрецидивной скорректированной (pLog-Rank=0,03420) выживаемости (Рисунок 1 и 2). Наиболее выраженная статистически значимая тенденция к улучшению 3-летней выживаемости (безрецидивной и безрецидивной скорректированной) отмечается при мышечно-неинвазивных опухолях с глубиной инвазии T1N0M0 и степенью дифференцировки G3: группа А - 72,7% и группа Б - 20,0% (pLog-Rank=0,00644).
Таким образом, использование в комплексном лечении 45 больных мышечно-неинвазивным РМП промежуточного и высокого риска рецидивирования и прогрессирования новой методики адъювантной внутрипузырной лекарственной терапии вакциной БЦЖ (Имурон) и аквакомплексом глицеросольвата титана - гелем Тизоль позволило добиться статистически значимого (р(χ2)=0,0012) снижения частоты локальных осложнений в 2,8 раза (28,9%) по сравнению с группой клинического сравнения Б (82,0%), где использо