Способ, компьютерный программный продукт и система обеспечения поддержки принятия клинического решения
Иллюстрации
Показать всеИзобретение относится к области компьютерной медицины. Предложен способ поддержки принятия клинического решения, где в компьютерный механизм принятия решений вводят данные, указывающие группу носителей аллергена и значения носителя аллергена, которые получают путем количественного определения антител IgE в биологической жидкости; идентификации носителей с помощью предварительно определенной структуры, представляющей известные взаимосвязи между антителами IgE и носителями аллергена, где по меньшей мере один носитель аллергена ассоциирован с множеством антител IgE; и присваивания значений носителям аллергенов на основании результатов теста антител IgE. Также рассмотрены машиночитаемый носитель, включающий инструкции, предписывающие выполнение компьютером способа по изобретению, и система поддержки принятия клинического решения. Данное изобретение позволяет уменьшить сложность механизма принятия решений за счет сокращения количества данных, вводимых в механизм принятия решений, и может найти применение в диагностике аллергий и других заболеваний. 3 н. и 11 з.п. ф-лы, 8 ил., 3 табл., 9 пр.
Реферат
Изобретение относится к области диагностики заболеваний и, в частности, к диагностике аллергических и/или аутоиммунных заболеваний с использованием множества тестов для множества биомаркеров пациента, типично уровней иммуноглобулинов в крови. Конкретно, изобретение относится к компьютеризированному инструменту для улучшения такой диагностики.
Уровень техники
Правильная диагностика всегда была одной из основ здравоохранения. Процесс постановки диагноза может принимать множество форм, таких как основанная на симптомах, основанная на истории пациента и основанная на тестах диагностика. В диагностике, основанной на тестах, измеряемые уровни биомаркеров в биологических жидкостях (например, IgE в крови является показателем аллергии, и сахар в моче является показателем диабета) используются для точного определения заболевания пациента. Кроме того, врачи стремятся к сочетанию диагностики, основанной на симптомах и основанной на тестах для точного определения основного заболевания.
В последние годы возможность использования тестов для молекулярных биомаркеров необычайно возросла. Сейчас является общепринятым, что выполняется панель тестов и по их результату совместно с историей пациента формируется основа для диагноза. До тех пор пока количество тестов составляет менее чем приблизительно 10, является приемлемым для среднего врача обрабатывать их вручную “в своей голове”. Однако когда врач имеет в работе решения, основанные на 20-100 результатах индивидуальных тестов, риск неверной интерпретации и путаницы радикально возрастает.
С целью улучшения принятия решений, принимаемых врачом, или уменьшения количества неверных интерпретаций и сделанных ошибок были разработаны системы поддержки принятия клинического решения (CDSS), предназначенные для улучшения принятия клинического решения, относящегося к диагностике или терапевтическому процессу лечения. Деятельность CDSS адресована к нескольким областям, таким как выбор лекарственных средств (см., например, "A computer-assisted management program for antibiotics and other antiinfective agents" под авторством Evans и других, N Engl J Med. 1998; 338:232-238) и скрининг для латентной туберкулезной инфекции (см., например, "Using computerized clinical decision support for latent tuberculosis infection screening" под авторством Steele и других, Am J Prev Med. 2005; 28(3):281-4). Кроме того, имеются различные вспомогательные инструменты для интерпретации изображений (см., например, "Automated evidence-based critiquing of orders for abdominal radiographs: impact on utilization and appropriateness" под авторством Harpole и других, J Am Med Inform Assoc. 1997; 4:511-521, и US 2005/0102315).
Большинство CDSS имеют приблизительно одинаковую структуру, например, как описано в документе "Clinical decision support systems: perspectives in dentistry", принадлежащем Mendonca in J Dent Educ. 2004 Jun; 68(6):589-97, который включен в настоящее описание посредством ссылки. В типичной CDSS имеется оперативная память (часто упоминаемая как база данных), содержащая данные пациента, механизм принятия решений (или предположений), который использует классифицированную базу знаний (содержащую, например, вероятные заболевания, дающие результат теста). Может быть доступным разъясняющий модуль, который трансформирует вывод с механизма принятия решений в контекстные сообщения.
Одна CDSS для интерпретации результатов тестов в диагностической ситуации раскрыта в WO 2005/103300, в которой статистический алгоритм распознавания образов применяется к панели результатов тестов, имеющих отношение к аутоиммунным заболеваниям. Алгоритм сличает панель результатов тестов с множеством наборов опорных данных от ранее диагностированных пациентов, каждый набор опорных данных включает оценки для каждого из множества специфических аутоантител и диагностированного заболевания. Алгоритм применяет процесс ближайших k-соседей к панели результатов тестов и наборам опорных данных, производя статистически выведенное решение, показывающее, является ли панель результатов тестов связанной или нет с одним или более специфическим заболеванием.
WO 96/12187 раскрывает автоматизированную диагностическую систему, способную выполнять комплексное распознавание образов из многоэлементных лабораторных данных с использованием обученной нейронной сети.
Уровень техники также включает в себя документ US 2006/0013773, который раскрывает методику установления соотношения типов крови с пищевыми аллергиями и гиперчувствительностью к пище.
US 5692220 раскрывает систему поддержки принятия решения для гематологической диагностики, в которой результаты тестов вводятся в механизм принятия решений, который сверяет их с образцами, соответствующими специфическим состояниям пациента. Подобранные образцы систематизируются в иерархическом порядке в соответствии с заранее определенными критериями.
Общей проблемой в проектировании CDSS в уровне техники является то, что сложность ее механизма принятия решений быстро увеличивается с количеством доступных результатов тестов. Очевидно, это служит причиной проблем в тех областях, где является доступным большое количество тестов на биомаркеры, и где постоянно разрабатываются новые тесты. Одной из таких областей являются аллергические и аутоиммунные заболевания, где являются доступными несколько сотен, если не тысяч различных тестов на биомаркеры.
Кроме того, может быть желательным сочетание результатов тестов с демографическими данными и наблюдаемыми симптомами с целью улучшения точности диагноза, предоставляемого механизмом принятия решений, и предоставления возможности механизму принятия решений предлагать значимые последующие тесты. Это усложнит механизм принятия решений.
Сущность изобретения
Целью изобретения является преодоление или смягчение по меньшей мере некоторых из определенных выше ограничений предшествующего уровня техники.
Данная и другие цели, которые могут следовать из описания ниже, по меньшей мере, частично достигаются посредством способа обеспечения поддержки принятия клинического решения, компьютерного программного продукта и системы обеспечения поддержки принятия клинического решения соответственно независимым пунктам формулы изобретения, их вариантов осуществления, определенных в зависимых пунктах формулы изобретения.
В соответствии с первым аспектом изобретения предоставляется способ обеспечения поддержки принятия клинического решения на основе результатов тестов для множества протестированных биомаркеров, причем каждый результат теста дан с первым разрешением значений. Способ включает в себя этапы, на которых: принимают упомянутые результаты тестов; получают доступ к предварительно определенной структуре, в которой доступные биомаркеры ассоциированы с носителями, причем, по меньшей мере, один носитель ассоциирован с множеством биомаркеров; идентифицируют группу носителей посредством установления соответствия тестированных биомаркеров со структурой; присваивают значение носителя каждому носителю в группе носителей на основании результатов теста протестированного биомаркера (биомаркеров), для которого установлено соответствие с носителем, причем значение носителя дано со вторым разрешением значений; и предоставляют исходные данные, указывающие на группу носителей и присвоенные значения носителя для ввода в механизм принятия решений для генерации поддержки принятия клинических решений.
Посредством правильной модели предварительно определенной структуры, которая является соответственно спланированной, основываясь на клиническом опыте и исследовании, представляющих известные взаимосвязи между биомаркерами и носителями, предоставляется возможность уменьшения количества вводимых данных для механизма принятия решений. По существу, данные возможности уменьшают сложность механизма принятия решений. Кроме того, в первом аспекте механизм принятия решений выполнен с возможностью обработки носителей и значений носителей вместо результатов тестов индивидуальных биомаркеров для предоставления желательной поддержки принятия клинического решения. Обработка данных в механизме принятия решений соответственно также основана на предварительно определенной структуре. Это также обеспечивает возможность уменьшения сложности механизма принятия решений, так как исходные данные будут, по существу, отражать клинический опыт и исследования. Разработанные позже тесты для новых биомаркеров могут быть легко приспособлены посредством обновления предварительно определенной структуры, типично посредством ассоциирования новых биомаркеров с одним или более существующими носителями и/или посредством добавления одного или более носителей.
В одном варианте осуществления структура включает в себя носителей в порядке иерархии уровней. Такая структура может использоваться для отражения клинического опыта или исследования, определяя подтип-надтип взаимосвязей между носителями/биомаркерами. Например, различные уровни структуры могут представлять классификации носителей в различных степенях детализации. Использование иерархической структуры может давать возможность эффективной обработки, например, в отношении установления соответствия протестированных биомаркеров. Также установление соответствия биомаркеров может осуществляться на одном или более выбранных уровнях структуры в зависимости от желаемой детализации итоговых исходных данных.
С целью дальнейшего уменьшения сложности механизма принятия решений второе разрешение может быть меньше, чем первое разрешение. Это будет уменьшать количество исходных данных для механизма принятия решений для заданного набора результатов тестов.
В еще одном варианте осуществления результаты тестов или значения носителей распределяются, основываясь на основных данных, характерных для пациентов с данными результатами тестов. Характерные для пациентов основные данные могут включать, по меньшей мере, одно из: демографических данных, анамнеза, наследственных факторов, модели реагирования, истории пациента и генетических данных. Это предоставляет возможность уменьшения сложности механизма принятия решений, который, например, может предназначаться для среднего пациента.
Результаты тестов также могут быть распределены соответственно шкале реагирования между различными биомаркерами. Это дает возможность механизму принятия решений пренебрегать различиями в шкале реагирования, таким образом, упрощая конструкцию механизма принятия решений.
В одном варианте осуществления протестированные биомаркеры являются членами надсемейства Иммуноглобулинов и проверяются в крови. Например, протестированные биомаркеры могут быть антителами.
В одном частном варианте осуществления поддержка принятия клинического решения относится к диагностике аллергии или аутоиммунных заболеваний.
Соответственно второму аспекту изобретения предоставляется компьютерный программный продукт, включающий в себя инструкции, предписывающие выполнение компьютером способа по первому аспекту.
Соответственно третьему аспекту изобретения предоставляется система обеспечения поддержки принятия клинического решения на основе результатов тестов для множества исследованных биомаркеров, причем каждый результат теста дан с первым разрешением значений. Система включает в себя компонент для приема упомянутых результатов тестов; компонент для получения доступа к предварительно определенной структуре, в которой доступные биомаркеры ассоциированы с носителями, причем, по меньшей мере, один носитель ассоциирован с множеством биомаркеров; компонент для идентификации группы носителей посредством установления соответствия тестированных биомаркеров со структурой; компонент для присвоения значения носителя для каждого носителя в группе носителей на основе результатов тестов протестированного биомаркера(ов), для которых установлено соответствие с носителем, причем значение носителя дано со вторым разрешением значений; и компонент для предоставления исходных данных, показывающих группу носителей и присвоенные значения носителей для ввода в компьютерный механизм принятия решений для генерирования поддержки принятия клинического решения. Каждый такой компонент может быть осуществлен как программное обеспечение, аппаратное обеспечение или как их сочетание.
В одном варианте осуществления компьютерный механизм принятия решений включен в систему.
В одном варианте осуществления все компоненты интегрированы в единое устройство, которое может быть сервером, персональным компьютером, аналитическим инструментом или каким-либо другим устройством с возможностью обработки данных.
Система может дополнительно включать в себя компонент для масштабирования результатов тестов или значений носителей на основе характерных для пациента основных данных для результатов тестов.
Система может дополнительно включать в себя компонент для генерации результатов тестов. В одном варианте осуществления данный компонент включает аналитический инструмент, специально предназначенный для тестирования предварительно определенных подгрупп биомаркеров, предпочтительно используемых в методике обнаружения in vitro IgE.
Компьютерный программный продукт и система соответственно второму и третьему аспектам дают возможность получения тех же результатов и преимуществ, что и способ соответственно первому аспекту. Также понятно, что различные варианты осуществления, описанные в отношении первого аспекта, и связанные с ними преимущества и результаты являются в равной степени применимыми для второго и третьего аспектов.
Кроме того, другие цели, признаки, аспекты и преимущества настоящего изобретения будут явствовать из последующего подробного описания, из зависимых пунктов формулы изобретения, а также из фигур.
Краткое описание чертежей
Варианты осуществления изобретения сейчас будут описаны более детально со ссылкой на сопутствующие схематические чертежи, на которых подобные элементы обозначены посредством одинаковой ссылочной нумерации.
Фиг.1 представляет собой структурную схему системы поддержки клинической диагностики, включающую вариант осуществления изобретения.
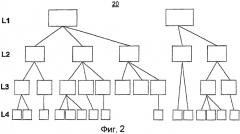
Фиг 2. показывает пример иерархической структуры носителей.
Фиг.3 представляет собой возможное графическое соотношение значений биомаркера IgE для различных пищевых аллергенов.
Фиг.4 показывает часть предварительно определенной структуры для высших уровней носителей “Пыльца” и “Пища” соответственно варианту осуществления изобретения.
Фиг.5 представляет собой схематическое изображение реализации оборудования для варианта осуществления настоящего изобретения.
Фиг.6 представляет собой схему последовательности операций способа обеспечения поддержки принятия клинического решения соответственно варианту осуществления изобретения.
Фиг.7 представляет собой структурную схему, иллюстрирующую систему для осуществления способа на Фиг.6.
Фиг.8 представляет собой график отношения вероятности аллергической реакции к характерным значениям антител IgE к аллергену молока для пациентов различного возраста.
Для определения предмета последующего описания и для внесения ясности сделаны следующие определения:
Пациент означает субъекта, который может иметь или не иметь заболевание. Пациент типично является человеком, но может быть каким-либо другим живым организмом, в частности млекопитающим.
Биологическая жидкость означает жидкость живого организма, включающую (без ограничения перечисленным) кровь, мочу, слезы, слюну, лимфу, семенную жидкость, фекалии и т.п.
Биомаркер представляет собой компонент биологической жидкости, который может быть выявлен или количественно определен с использованием аналитического инструмента. Биомаркеры включают в себя, без ограничения перечисленным, белки и метаболиты.
Иммуноглобулин означает класс биомаркеров, являющихся членами надсемейства Иммуноглобулинов. Данное семейство включает в себя, без ограничения перечисленным, Антитела (например, IgA, IgD, IgE, IgG, IgM), цепочки рецепторов T-клетки, MHC (главный комплекс гистосовместимости) I Класса, MHC II Класса, beta-2 микроглобулин, CD4, CD8, CD 19, CD3-γ, -δ и -ε цепочки, CD79a, CD79b, CD28, CD80, CD86, иммуноглобулинподобные рецепторы Клеток-киллеров (KIR), CD2, CD48, CD22, CD83, CTX, JAM, BT-IgSF, CAR, VSIG, ESAM), молекулы межклеточной адгезии (ICAM), Молекулы адгезии сосудистого эндотелия (например, VCAM-I), Молекулу Адгезии Нервных Клеток (NCAM), IL-1R-2, IL-lR-beta, антиген CD121b, PDGFR, IL-6R-alpha, антиген CD126, CSF-I-R, антиген CD115, SCFR, c-kit, антиген CD117, FGFR-I, CEKl, PIGR, CD147, CD90, CD7, Butyrophilins и многое другое.
Аллергия означает приобретенную анормальную чувствительность к чужеродным субстанциям, вызывающим симптомы аллергии.
Аллерген означает нечто, вызывающее аллергию.
Тест означает измерение реакции пациента на определенный аллерген.
Носитель означает объект/организм, служащий носителем или ассоциированный с одним или более специфическим аллергеном(ами).
Класс носителей означает группу или семейство носителей.
Подробное описание вариантов осуществления изобретения
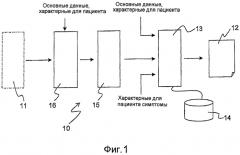
Фиг.1 представляет собой структурную схему системы 10 обработки данных, в которой используется вариант осуществления настоящего изобретения. Система 10 получает данные теста из тестирующего оборудования 11, которое включает аналитический инструмент для измерения количества ряда биомаркеров в биологической жидкости, типично крови, пациента. Измерение может быть выполнено in vivo или in vitro. Итоговые данные теста, например измерение значения (результат теста) для каждого протестированного биомаркера, типично даются с высоким разрешением в диапазоне измерений. Например, количество этапов измерения в диапазоне измерений может быть, по меньшей мере, 10, типично приблизительно 50-100 или более. Данные теста могут содержать какое-либо количество результатов теста, типично более чем приблизительно 10.
Система 10 получает и обрабатывает данные теста вместе с дополнительными данными, относящимися к пациенту, в заключение, генерируя характерный для пациента диагностический отчет 12, который может помочь врачу уточнить диагноз пациента. Диагностический отчет 12 может, например, включать предполагаемый диагноз и предложение о проведении дальнейших значимых тестов, а также полную или сокращенную распечатку результатов тестов.
В иллюстрируемом варианте осуществления система 10 включает механизм 13 принятия решений или предположений, который оперирует, например, предварительно обработанными данными теста для генерации диагностического отчета. Механизм 13 принятия решений может иметь конфигурацию соответственно общепринятой технологии для использования базы 14 знаний, в которой хранятся значимые знания в машиночитаемой форме. Механизм 13 принятия решений может включать набор правил в отношении набора доступных биомаркеров, полученных от экспертов и основанных на доказательной медицине. Набор правил может соответственно определять характерные для пациента комментарии, полученные из базы 14 знаний, появляющиеся в отчете 12, основанном на исходных данных.
Исходные данные для механизма 13 принятия решений также могут включать данные о характерных для пациента симптомах, показывающие один или более симптомов, отмеченных у пациента врачом.
Исходные данные для механизма 13 принятия решений могут также включать основные данные, характерные для пациента, такие как демографические данные (возраст, национальность, постоянное местожительство и т.п.) анамнез, наследственные факторы, модель реагирования, генетические данные и т.п.
В одном варианте осуществления механизм 13 принятия решений основан на правилах технологии понижающей пульсации. Такой механизм принятия решений может работать, используя коммерчески доступное программное обеспечение, такое как Lab Wizard®, поставляемое компанией Pacific Knowledge Systems.
Обычно может быть довольно сложным создать механизм принятия решений, который может оперировать большим количеством различных результатов тестов и симптомов пациента. Например, если тестирование является доступным для более 100 различных биомаркеров, каждый результат теста может принимать значение какого-либо целого числа в диапазоне 0-100 и обрабатываются 7 различных симптомов, традиционному механизму принятия решений было бы необходимо включать правила для 101100·27-3,5·10202 различных комбинаций.
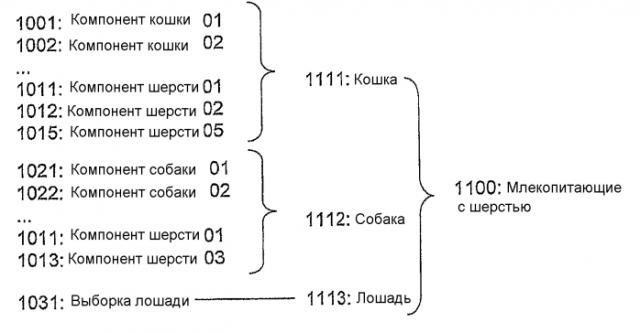
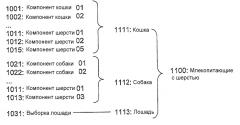
С целью уменьшения сложности механизма принятия решений для данного количества результатов тестов система на Фиг.1 включает модуль 15 предварительного преобразования данных. Модуль 15 выполнен с возможностью уменьшения количества данных, обрабатывающихся посредством механизма 13 принятия решений. С этой целью модуль 15 использует структуру, в которой доступные биомаркеры, например биомаркеры, обработанные посредством механизма 13 принятия решений, присваиваются различным носителям. Каждый носитель включает или представляет один или более биомаркеров. Общий пример такой структуры 20 показан на Фиг.2, в которой носители организованы по номерам уровней L1-L4. Структура 20 представляет известные взаимосвязи между биомаркерами и носителями и построена на основе клинического опыта и исследования.
Модуль 15 устанавливает соответствие протестированных биомаркеров с носителями, определенными посредством предварительно определенной структуры 20, и таким образом идентифицирует группу носителей, в которой каждый носитель включает один или более протестированных биомаркеров. Модуль 15 также присваивает каждому такому носителю значение, основанное на результате(ах) тестирования биомаркера(ов), содержащегося в носителе. Данное значение может быть дано посредством какой-либо подходящей статистической функции, оперирующей результатами тестов для носителя, такой как максимум, среднее, среднее арифметическое, среднее геометрическое, среднее гармоническое и т.п.
Группа носителей и присвоенные значения подаются как исходные данные в механизм 13 принятия решений. Исходные данные для механизма принятия решений могут быть представлены в каком-либо подходящем формате, например, как текст или как числа в какой-либо системе отсчета (двоичной, шестнадцатиричной и т.п.) или их сочетании.
Например, для биомаркеров, указывающих на присутствие специфических аллергенов, носитель может означать класс объектов/организмов, несущих один или более специфических аллергенов. В одном примере предварительно определенная структура разделяет доступные биомаркеры на пять различных основных групп или носителей: "Пища", "Пыльца", "Клещ", "Плесень" и "Животные". Как показано на Фиг.2, структура 20 может быть организована как иерархия носителей на различных уровнях L1-L4. Вышеупомянутые основные группы могут быть организованы на родовом уровне Ll и иметь подгруппы (носителей) в одном или многих подуровнях L2-L4. В одном примере основная группа "Пыльца" может иметь подгруппы (на уровне L2) "Деревья", "Трава" и "Травы определенных видов", и подгруппа "Деревья" может иметь подгруппы (на уровне L3) "Дуб", "Береза" и "Вяз", и т.п. Независимо от числа подгрупп сложность механизма принятия решений определяется числом основных групп. Является осуществимым заметное уменьшение сложности механизма принятия решений.
Для модулей предварительного преобразования данных имеются некоторые возможные варианты выборки носителей, подлежащих включению в исходные данные для механизма принятия решений. В одном варианте все носители в предварительно определенной структуре 20, для которых может быть установлено соответствие с протестированными биомаркерами, могут быть включены в исходные данные. Например, если был протестирован биомаркер для березы, модуль может включить в исходные данные носители "Береза", "Деревья" и "Пыльца".
В еще одном варианте модуль предварительного преобразования данных может включать набор заранее заданных правил, которые контролируют выборку носителей, основываясь на значениях теста и/или биомаркеров, включенных в данные теста. Например, если данные теста включают результаты теста (необязательно с дополнительным условием, что данные результаты теста являются достоверными) для более чем трех различных видов пыльцы, данные результаты тестов могут быть сгруппированы в носитель для лиственных деревьев. Если данные теста включают только результаты тестов для пыльцы, относящейся к березам, данные результаты тестов могут быть сгруппированы в носитель для березы. В еще одном примере все результаты тестов, относящиеся к клещам, по умолчанию группируются в соответствующий главный носитель. Если количество результатов является очень большим, правила могут оговаривать в качестве особого условия, что все результаты тестов должны быть сгруппированы в главные носители или, по меньшей мере, носители уровней L1 или L2.
В еще одном другом варианте выборка носителей контролируется посредством исходных параметров модуля предварительного преобразования данных. Например, исходные параметры могут показывать уровень квалификации человека, интерпретирующего диагностический отчет. Если данный человек является специалистом, то является приемлемым/желательным, чтобы диагностический отчет включал больше деталей о предлагаемом диагнозе и результатах тестов и, соответственно, исходные данные должны включать носители низших уровней структуры 20 (cf. L3 и L4). Если человек является врачом общей практики, диагностический отчет должен быть простым и незатейливым и исходные данные должны, прежде всего, основываться на носителях высших уровней структуры 20 (cf. L1 и L2)
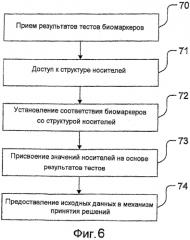
Модуль 15 предварительного преобразования данных может использоваться для уменьшения видимого количества исходных переменных для механизма 13 принятия решений. Данная функция может эксплуатироваться для уменьшения сложности механизма 13 принятия решений и/или для предоставления возможности использования в качестве исходных переменных для механизма 13 принятия решений другой информации, кроме результатов тестов без чрезмерного увеличения его сложности. Как показано на Фиг.1, исходные переменные могут быть использованы как данные о характерных для пациента симптомах. Например, механизм принятия решений выполнен с возможностью обработки данного набора симптомов со значением каждого 0 или 1, показывающим отсутствие или наличие симптома соответственно. Подобным образом могут быть использованы в качестве одной или более исходной переменной(ых) для механизма принятия решений основные характерные для пациента данные (анамнез, демография и т.п.).
Должно быть понятно, что механизм 13 принятия решений должен быть предназначен для предоставления диагностической поддержки, основанной на исходных данных, предоставленных модулем 15 предварительного преобразования данных, например носители и значения носителей. С этой целью механизм 13 принятия решений может включать набор правил, которые основаны на предварительно определенной структуре, подобной той, которая используется модулем 15 предварительного преобразования данных.
Как отмечено выше, данная предварительно определенная структура представляет известные взаимосвязи между биомаркерами и носителями, основанные на клиническом опыте и исследовании. Таким образом, даже несмотря на то что механизм принятия решений оперирует множеством разрозненных исходных данных, он выполнен с возможностью предоставления точного диагноза, основанного на клиническом опыте. Например, знания о перекрестной реактивности, демографии аллергии и зависимости от возраста делают возможным с большой вероятностью прогнозировать высокий риск специфической аллергии у пациента, для которого специфический для значимого аллергена IgE не был протестирован в панели тестов на аллергены. Таким образом реализуется то, что механизм принятия решений способен предоставить точные диагностические руководящие указания, основанные на немногих исходных вероятностях, вышеописанная система делает возможным использование немногочисленных панелей биомаркеров.
Кроме того, сокращение исходных данных до носителей и значений носителя также делает возможным сжатие выходных данных механизма принятия решений в короткие и быстрочитаемые сообщения.
Для дальнейшего уменьшения количества исходных данных, обрабатываемых механизмом 13 принятия решений, модуль 15 может иметь конфигурацию для уменьшения разрешения назначаемых значений носителя соответственно разрешению значений теста. Это может быть достигнуто путем дискретизации каждого из значений тестов или значений, присвоенных группе носителей перед вышеупомянутым установлением соответствия. Дискретизация значений может включать присвоение значения одной из числа групп значений. Например, значения теста могут быть присвоены одной из следующих групп значений: Недиагностированный, Очень Низкий, Низкий, Средний, Высокий, Очень высокий. Данные группы значений могут, например, быть представлены в виде значений 0-5.
Таким образом, мы получаем 5 носителей, которые можно принимать за целое значение 0-5. С 7 различными симптомами мы достигаем 65·27=995000 различных комбинаций, обрабатываемых механизмом принятия решений, что является значительно меньшим, чем 3,5·10202 различных комбинаций, обрабатываемых при результатах теста, которые не были подвергнуты преобразованию.
Возвращаясь к Фиг.1, иллюстрируемый вариант осуществления также включает модуль 16 масштабирования для эффективного селективного контекстного масштабирования результатов теста. Модуль 16 может выполняться для упорядочивания результатов теста, основанных на основных характерных для данного пациента данных. Это дает возможность механизму 13 принятия решений основываться на правилах для средней популяции, таким образом, упрощая конструкцию механизма принятия решений. Например, при тестировании детей шкала реакций может отличаться от взрослых. Так, модуль может иметь конфигурацию для шкалы (типично возрастающей) результатов тестов для, по меньшей мере, определенных биомаркеров.
Дополнительно или альтернативно, модуль 16 может иметь конфигурацию для изменения масштаба результатов тестов для того, чтобы привести в соответствие шкалу реакций между различными биомаркерами. Например, различные аллергены могут иметь различные уровни отсечки, частично зависящие от внутренней аллергенности соответствующего аллергена. Так, низкое значение теста для одного биомаркера может иметь следствием более высокую вероятность аллергии, имеющей высокое значение теста для другого биомаркера. Это имеет силу, даже если биомаркеры являются очень схожими, такими антитела IgE, направленные против множества аллергенов. Как показано на Фиг.3, вероятность низких значений (~1 kUA/1) IgE, являющегося биомаркером для аллергенов c и d, является более высокой, чем вероятность высоких значений (~10 kU/1) IgE, являющегося биомаркером для аллергена a. Контекстное масштабирование может устранять данную проблему посредством масштабирования одного или более результатов тестов для приведения в соответствие вероятностей реакции. Это дает возможность механизму принятия решений игнорировать различия в шкале реакций, таким образом, упрощая конструкцию механизма принятия решений.
В альтернативном варианте осуществления (не показан) модуль 16 масштабирования расположен после модуля 15 предварительного преобразования данных, оперируя значениями, присвоенными набору носителей вместо результатов тестов из тестирующего оборудования. В еще одном варианте осуществления все или часть функций масштабирования могут быть включены в состав механизма 13 принятия решений.
В последующем будет дополнительно показана работа механизма принятия решений и использование им правил. Примеры 1-6 даются со ссылкой на Фиг.4, которая иллюстрирует небольшую часть предварительно определенной структуры для главных носителей "Пыльца" и "Пища". Отмечается, что последующие примеры являются упрощенными для облегчения понимания. Переменные и значения в примерах указываются курсивом.
Пример 1
Симптом: Экзема
Значение носителя: Береза в диапазоне Низкий
Правило: ЕСЛИ (Симптом=Экзема) И (КАКАЯ-ЛИБО Пыльца>Недиагностировано)
=> Поясняющий комментарий: "Экзема, вероятно, не обусловлена Пыльцой"
Пример 2
Симптом: Астма
Значение носителя: Береза в диапазоне Высокий
Правило: ЕСЛИ (Симптом=Астма) И (КАКАЯ-ЛИБО Пыльца в диапазоне от Высокий до Очень Высокий)=>Поясняющий комментарий: "Антитела IgE, обнаруженные для Береза, вероятно, ассоциированы с Симптомами Астмы"
Пример 3
Симптом: Астма
Значения носителей: Береза в диапазоне Высокий, Дуб в диапазоне Средний и Вяз в диапазоне Низкий
Правило: ЕСЛИ (Симптом=Астма) И (КАКАЯ-ЛИБО Пыльца в диапазоне от Высокий ДО Очень Высокий)=>Поясняющий комментарий: "Антитела IgE, обнаруженные для Дерево Пыльца, вероятно, являются ассоциированными с Симптомами Астмы"
Пример 4
Симптом: Экзема
Значение носителя: Треска в диапазоне Очень высокий
Правило: ЕСЛИ (Симптом=Экзема) И (КАКАЯ-ЛИБО Пища в диапазоне Очень Высокий)=>Поясняющий комментарий: "Экзема может быть обусловлена Треской"
Пример 5
Симптом: Экзема
Значения носителя: Треска в диапазоне Средний
Правило: ЕСЛИ (Симптом=Экзема) И (КАКАЯ-ЛИБО Пища в диапазоне Средний)=>Поясняющий комментарий: "Экзема может быть обусловлена Треской"
Пример 6
Симптом: Экзема
Значение носителя: Треска в диапазоне Очень Низкий
Правило: ЕСЛИ (Симптом=Экзема) И (КАКАЯ-ЛИБО Пища в диапазоне Очень Низкий)
=> Поясняющий комментарий: "Очень низкий уровень IgE для Трески, вероятно, не ассоциирован с Экземой"
Пример 7
Пациент с Симптомами Астмы и Экземы тестирован in vitro на антитела IgE. Получены следующие результаты тестов:
Кошка = 51 kU/l
Полынь = 23 kU/1
Береза = 3 kU/1
Собака = 2,7 kU/1
Амброзия = 0,7 kU/1
Тимофеевка = 0,6 kU/1
Лошадь = 0,45 kU/1
Кролик = 0,41 kU/1
Клещ_dl-0,57 kU/1
В данном упрощенном Примере модуль предварительного преобразования данных выполнен с возможностью присвоения результатов тестов следующим предварительно определенным главным носителям: "Пыльца", "Пища", "Животное", "Клещ" и "Плесень". Каждому главному носителю присваивается значение носителя, данное путем присвоения носителю максимального значения теста. Кроме того, модуль предварительного преобразования данных сконфигурирован для группы значений носителей соответственно следующим предварительно определенным диапазонам IgE (данным в kU/1): Недиагностировано: <0,1, Очень Низкий: [0,1-0,5], Низкий: [0,5-2], Средний: [2-15], Высокий: [15-50], и Очень Высокий: >50.
После предварительной обработки модулем предварительного преобразования данных получены следующие исходные данные для механизма принятия решений:
Животное = Очень Высокий
Пыльца = Высокий
Клещ = Низкий
Предварительно обработанные данные отправляются в механизм принятия решений, который генерирует поясняющие комментарии в соответствии со следующим набором правил:
Правило: ЕСЛИ (Симптом=Астма ИЛИ Ринит) И (Животное в диапазоне Очень Высокий)>Поясняющий комментарий: "Наблюдаемые абсолютные величины IgE для Животного с высокой степенью вероятности ассоциированы с Симптомами Астмы."
Правило: ЕСЛИ (Симптом=Астма ИЛИ Ринит) И (Пыльца в диапазоне Высокий)
=> Поясняющий комментарий: "Наблюдаемые абсолютные величины IgE для Пыльцы, вероятно, ассоциированы с Симптомами Астмы."
Правило: ЕСЛИ (Симптом=Астма ИЛИ Ринит) И (Клещ в диапазоне Низкий) => Поясняющий комментарий: "Наблюдаемые абсолютные величины IgE для Клеща могут способствовать возникновению Симптомов Астмы."
Правило: ЕСЛИ (Симптом=Экзема) И (Пыльца в КАКОМ-ЛИБО диапазоне)
=> Поясняющий комментарий: "Наблюдаемые абсолютные значения IgE для Пыльцы не могут быть ассоциированы с описанной Экземой."
Правило: ЕСЛИ (Симптом=Экзема) И ((Клещ ИЛИ Животное) в КАКОМ-ЛИБО диапаз