Способ получения полимеров из белков шелка пауков
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и может быть использовано для получения полимеров из белка шелка паука. Получают белок шелка паука из 240-760 аминокислотных остатков, соответствующий формуле NT2-REP-CT или NT-REP-CT, где: NT - N-концевой фрагмент от 100 до 160 аминокислот, происходящий из белка шелка паука, с по меньшей мере 80% идентичностью с SEQ ID NO: 6; REP - белковый фрагмент от 70 до 300 аминокислот, выбранный из L(AG)nL, L(AG)nAL, L(GA)nL, L(GA)nGL, где: n - целое число от 2 до 10; А состоит из 8-18 аминокислот, где от 0 до 3 аминокислот не являются Ala, а остальные аминокислоты - Ala; G состоит из 12-30 аминокислот, где по меньшей мере 40% аминокислот - Gly; и L - линкер из 0-20 аминокислот; СТ - С-концевой фрагмент от 70 до 120 аминокислот, происходящий из белка шелка паука, с по меньшей мере 80% идентичностью с SEQ ID NO: 7. Способ включает растворение полученного белка шелка паука в жидкой среде с pH 6,4 или выше и/или ионной силой более 300 мМ для предотвращения полимеризации и увеличения растворимости белка шелка паука с возможным удалением липополисахаридов и других пирогенов. Далее корректируют свойства указанной жидкой среды до pH 6,3 или ниже и ионной силы менее 300 мМ для обеспечения полимеризации, после полимеризации выделяют полимеры белка шелка паука из жидкой среды. Изобретение позволяет контролировать сборку полимеров спидроина. 5 н. и 9 з.п. ф-лы, 8 ил., 3 табл., 15 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к области рекомбинантного получения белков и, более конкретно, к рекомбинантному получению белков шелка пауков (спидроинов). В настоящем изобретении предложен способ получения полимеров из выделенного белка шелка паука. Также предложены новые белки шелка пауков, способы и молекулы полинуклеиновых кислот для получения таких белков и их полимеров.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Шелка пауков представляют собой высокоэффективные природные полимеры, приобретающие исключительную упругость и растяжимость благодаря комбинации прочности на разрыв и эластичности. Пауки имеют вплоть до семи различных желез, которые продуцируют целый ряд типов шелка с различными механическими свойствами и функциями. Канатный шелк, продуцируемый большой ампуловидной железой, является самым прочным волокном, и на основе массы превосходит сделанные человеком материалы, такие как высокопрочная сталь. Свойства канатного шелка являются привлекательными при разработке новых материалов для медицинских или технических целей.
Канатный шелк состоит из двух основных полипептидов, в основном известных как спидроин большой ампуловидной железы (MaSp) 1 и 2, но, например, и как ADF-3 и ADF-4 у Araneus diadematus. Эти белки имеют молекулярные массы в диапазоне 200-720 кДа. Гены, кодирующие канатные белки Latrodectus hesperus, являются единственными генами, которые были полностью охарактеризованы, и гены MaSp1 и MaSp2 кодируют 3129 и 3379 аминокислот, соответственно (Ayoub NA et al. PLos ONE 2(6): e514, 2007). Свойства полипептидов канатного шелка обсуждаются в Huemmerich, D. et al., Curr. Biol. 14, 2070-2074 (2004).
Белки канатного шелка пауков, или MaSp, имеют трехкомпонентный состав: неповторяющийся N-концевой домен, центральную повторяющуюся область, состоящую из многих повторяющихся сегментов поли-Ala/Gly, и неповторяющийся C-концевой домен. Обычно считается, что данная повторяющаяся область образует межмолекулярные контакты в волокнах шелка, тогда как точные функции концевых доменов меньше ясны. Также считается, что в связи с образованием волокна повторяющаяся область претерпевает структурную конверсию из случайной спирали и α-спиральной конформации в β-складчатый слой. C-концевая область спидроинов обычно является консервативной среди видов пауков и типов шелка. N-концевой домен шелка пауков является наиболее консервативной областью, но его функция не понятна. В Rising, A. et al. Biomacromolecules 7, 3120-3124 (2006) охарактеризован 5'-конец гена MaSp1 Euprosthenops australis и выведена соответствующая аминокислотная последовательность. N-концевой домен белка MaSp1 рекомбинантно экспрессируют.
Белки шелка пауков и их фрагменты трудно получать рекомбинантно в растворимой форме. Большинство предыдущих попыток получить искусственные волокна шелка пауков включали стадии солюбилизации в нефизиологических растворителях. Несколько факторов затрудняют экспрессию белков канатного шелка. Благодаря чрезвычайно повторяющейся природе данных генов и сопутствующему ограниченному аминокислотному составу белков наблюдаются ошибки транскрипции и трансляции. Другой причиной может быть истощение пулов тРНК в микробных системах экспрессии с последующей прерывистой трансляцией, приводящей к преждевременному завершению синтеза белка. Другими обсуждавшимися причинами ограничения белкового синтеза являются образование вторичной структуры мРНК и рекомбинация генов. Было показано, что нативные гены MaSp более 2,5 т.п.н. являются нестабильными в бактериальных хозяевах. Кроме того, существуют трудности в поддержании рекомбинантных белков шелка в растворимой форме, поскольку и фрагменты канатного шелка природного происхождения, и сконструированные блок-сополимеры, особенно белки, происходящие из MaSp1/ADF-4, легко подвергаются самосборке в аморфные агрегаты, что приводит к осаждению и потере белка. См. Huemmerich, D. et al. Biochemistry 43, 13604-13612 (2004) и Lazaris, A. et al. Science 295, 472-476 (2002).
При попытках получить искусственные шелка пауков использовали природные или синтетические генные фрагменты, кодирующие белки канатного шелка. Рекомбинантные белки канатного шелка были экспрессированы в различных системах, включая бактерии, дрожжи, клетки млекопитающих, растения, клетки насекомых, трансгенных тутовых шелкопрядов и трансгенных коз. См., например, Lewis, R.V. et al. Protein Expr. Purif. 7, 400-406 (1996); Fahnestock, S. R. & Irwin, S. L. Appl. Microbiol. Biotechnol. 47, 23-32 (1997); Arcidiacono, S. et al. Appl. Microbiol. Biotechnol. 49, 31-38 (1998); Fahnestock, S. R. & Bedzyk, L. A. Appl. Microbiol. Biotechnol. 47, 33-39 (1997); и Lazaris, A. et al. Science 295, 472-476 (2002).
В Huemmerich, D. et al. Biochemistry 43, 13604-13612 (2004) описан синтетический ген "(AQ)12NR3", кодирующий повторяющиеся Ala-богатые и Gly/Gln-богатые фрагменты и неповторяющийся фрагмент, которые все происходят из ADF3 из Araneus. Этот ген экспрессируется в растворимый белок, который агрегирует, но не образует полимеры или волокна.
В WO 03/057727 описана экспрессия растворимых рекомбинантных полипептидов шелка в линиях клеток млекопитающих и животных. Полученные полипептиды шелка демонстрируют плохую растворимость в водных средах и/или образуют осадки. Поскольку полученные полипептиды шелка не полимеризуются спонтанно, требуется вытягивание нити для получения полимеров или волокон. Экспрессирующиеся полипептиды шелка содержат множество повторяющихся звеньев и неповторяющееся звено, происходящее из карбоксильной концевой области белков шелка пауков.
В WO 07/078239 и Stark, M. et al. Biomacromolecules 8, 1695-1701, (2007) описан миниатюрный белок шелка паука, состоящий из повторяющегося фрагмента с высоким содержанием Ala и Gly и C-концевого фрагмента белка, а также растворимые слитые белки, содержащие белок шелка паука. Волокна белка шелка паука получают спонтанно при освобождении белка шелка паука от его партнера по слиянию. Небольшое звено слияния является необходимым и достаточным для образования волокна.
В Hedhammar, M. et al. Biochemistry 47, 3407-3417, (2008) исследуются эффекты нагревания, рН и соли на структуру и агрегацию, и/или полимеризацию рекомбинантных N- и C-концевых доменов спидроина и повторяющегося домена спидроина, содержащего четыре поли-Ala и Gly-богатых соблоков. Описано, что вторичная и третичная структура N-концевого домена остается неизменной, независимо от рН, и только детектированные стабильные агрегаты, которые образуются N-концевым доменом, представляют собой димеры. Вместо этого предполагают, что C-концевой домен играет главную роль в сборке белков шелка пауков.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Цель настоящего изобретения состоит в том, чтобы предложить способ получения полимеров из белков шелка пауков, где контролируется растворимость и полимеризация белков шелка пауков.
Цель настоящего изобретения состоит также в том, чтобы предложить способ получения волокон из белков шелка пауков, где контролируется растворимость белков шелка пауков и образование волокон.
Другая цель настоящего изобретения состоит в том, чтобы предложить новый белок шелка паука, который может давать волокна, пленки, пены, сети и ячеистые структуры из шелка паука.
Одна цель настоящего изобретения состоит в том, чтобы предложить водорастворимый белок шелка паука, с которым можно легко обращаться для полимеризации в волокна, при желании. Это свойство позволяет осуществлять все следующие стадии при физиологических условиях, что снижает риск токсичности и денатурации белка.
Еще одна цель настоящего изобретения состоит в том, чтобы предложить волокна нового белка шелка паука.
Одна цель настоящего изобретения состоит в том, чтобы предложить белки шелка пауков в крупном масштабе, с которыми можно легко обращаться для полимеризации в волокна, при желании.
Цель изобретения также состоит в том, чтобы предложить способы получения белков шелка пауков и волокон из белков шелка пауков.
Для этих и других целей, которые будут очевидны из следующего описания, согласно первому аспекту настоящего изобретения предложен способ получения полимеров из выделенного белка шелка паука, включающий стадии, на которых:
(1) берут белок шелка паука, состоящий из 170-760 аминокислотных остатков и содержащий:
N-концевой фрагмент, состоящий по меньшей мере из одного фрагмента из 100-160 аминокислотных остатков, происходящих из N-концевого фрагмента белка шелка паука; и
повторяющийся фрагмент из 70-300 аминокислотных остатков, происходящих из повторяющегося фрагмента белка шелка паука; и возможно
C-концевой фрагмент из 70-120 аминокислотных остатков, который происходит из C-концевого фрагмента белка шелка паука;
(2) берут раствор указанного белка шелка паука в жидкой среде при рН 6,4 или выше и/или ионной композицией, которая предотвращает полимеризацию указанного белка шелка паука, возможно, включают удаление липополисахаридов и других пирогенов;
(3) корректируют свойства указанной жидкой среды до рН 6,3 или ниже и ионной композиции, которая обеспечивает полимеризацию указанного белка шелка паука;
(4) оставляют белок шелка паука для образования полимеров, предпочтительно твердых полимеров, в жидкой среде, имеющей рН 6,3 или ниже и ионную композицию, которая обеспечивает полимеризацию указанного белка шелка паука; и
(5) выделяют белок шелка паука из указанной жидкой среды.
В одном воплощении рН жидкой среды со стадий (3) и (4) составляет 6,2 или ниже, например 6,0 или ниже. В одном воплощении рН жидкой среды со стадий (3) и (4) составляет 3 или выше, например 4,2 или выше. В некоторых воплощениях ионная сила жидкой среды со стадий (3) и (4) находится в диапазоне от 1 до 250 мМ.
В одном воплощении рН жидкой среды со стадии (2) составляет 6,7 или выше, например 7,0 или выше. В одном воплощении рН жидкой среды со стадии (2) находится в диапазоне от 6,4 до 6,8.
Согласно другому аспекту в настоящем изобретении предложен полимер из белка шелка паука, состоящий из 170-760 аминокислотных остатков и содержащий:
N-концевой фрагмент, состоящий по меньшей мере из одного фрагмента из 100-160 аминокислотных остатков, происходящих из N-концевого фрагмента белка шелка паука; и
повторяющийся фрагмент из 70-300 аминокислотных остатков, происходящих из повторяющегося фрагмента белка шелка паука; и возможно
C-концевой фрагмент из 70-120 аминокислотных остатков, который происходит из C-концевого фрагмента белка шелка паука.
В некоторых воплощениях этих двух аспектов белок шелка паука состоит из 170-600 аминокислотных остатков и содержит одиночный N-концевой фрагмент из 100-160 аминокислотных остатков, происходящих из N-концевого фрагмента белка шелка паука. В некоторых других воплощениях этих двух аспектов N-концевой фрагмент белка шелка паука содержит по меньшей мере два фрагмента из 100-160 аминокислотных остатков, происходящих из N-концевого фрагмента белка шелка паука.
В предпочтительных воплощениях этих двух аспектов белок выбран из группы белков, определенных формулами NT2-REP-CT, NT-REP-CT, NT2-REP и NT-REP, где:
NT представляет собой белковый фрагмент, имеющий от 100 до 160 аминокислотных остатков, который представляет собой N-концевой фрагмент, происходящий из белка шелка паука.
REP представляет собой белковый фрагмент, имеющий от 70 до 300 аминокислотных остатков, где указанный фрагмент выбран из группы L(AG)nL, L(AG)nAL, L(GA)nL, L(GA)nGL, где:
n представляет собой целое число от 2 до 10;
каждый индивидуальный сегмент А представляет собой аминокислотную последовательность из 8-18 аминокислотных остатков, где от 0 до 3 аминокислотных остатков не являются Ala, а остальные аминокислотные остатки представляют собой Ala;
каждый индивидуальный сегмент G представляет собой аминокислотную последовательность из 12-30 аминокислотных остатков, где по меньшей мере 40% аминокислотных остатков представляют собой Gly; и
каждый индивидуальный сегмент L представляет собой линкерную аминокислотную последовательность из 0-20 аминокислотных остатков; и
СТ представляет собой белковый фрагмент, имеющий от 70 до 120 аминокислотных остатков, который представляет собой C-концевой фрагмент, происходящий из белка шелка паука.
В одном воплощении полимер состоит из полимеризованных димеров белка шелка паука.
В предпочтительных воплощениях содержание липополисахаридов и других пирогенов составляет 1 EU(эндотоксиновая единица)/мг выделенного белка или ниже.
В одном воплощении полимер представляет собой волокно, пленку, пену, сеть или ячеистую структуру. В предпочтительном воплощении полимер представляет собой волокно, имеющее диаметр более 0,1 мкм и длину более 5 мм.
Согласно одному аспекту в настоящем изобретении предложен способ получения димеров выделенного белка шелка паука, включающий стадии, на которых:
(1) берут белок шелка паука из 170-760 аминокислотных остатков, содержащий:
N-концевой фрагмент, состоящий по меньшей мере из одного фрагмента из 100-160 аминокислотных остатков, происходящих из N-концевого фрагмента белка шелка паука; и
повторяющийся фрагмент из 70-300 аминокислотных остатков, происходящих из повторяющегося фрагмента белка шелка паука; и возможно
C-концевой фрагмент из 70-120 аминокислотных остатков, который происходит из C-концевого фрагмента белка шелка паука;
(2) берут раствор димеров белка шелка паука в жидкой среде с рН 6,4 или выше и/или ионной композицией, которая предотвращает полимеризацию указанного белка шелка паука; и
(3) выделяют димеры, полученные на стадии (2), возможно включают удаление липополисахаридов и других пирогенов.
В одном воплощении рН жидкой среды со стадии (2) составляет 6,7 или выше, например 7,0 или выше. В одном воплощении рН жидкой среды со стадии (2) находится в диапазоне от 6,4 до 6,8.
В одном воплощении стадия (1), на которой берут белок шелка паука, включает подстадии, на которых:
(а) экспрессируют молекулу полинуклеиновой кислоты, которая кодирует указанный белок шелка паука в подходящем хозяине; и
(б) выделяют белок, полученный на подстадии (а), возможно включают удаление липополисахаридов и других пирогенов.
Согласно одному аспекту в настоящем изобретении предложен димер белка шелка паука, состоящий из 170-760 аминокислотных остатков и содержащий:
N-концевой фрагмент, состоящий по меньшей мере из одного фрагмента из 100-160 аминокислотных остатков, происходящих из N-концевого фрагмента белка шелка паука; и
повторяющийся фрагмент из 70-300 аминокислотных остатков, происходящих из повторяющегося фрагмента белка шелка паука; и возможно
C-концевой фрагмент из 70-120 аминокислотных остатков, который происходит из C-концевого фрагмента белка шелка паука.
В некоторых воплощениях этих двух аспектов белок шелка паука состоит из 170-600 аминокислотных остатков и содержит один N-концевой фрагмент из 100-160 аминокислотных остатков, происходящих из N-концевого фрагмента белка шелка паука. В некоторых других воплощениях этих двух аспектов N-концевой фрагмент белка шелка паука содержит по меньшей мере два фрагмента из 100-160 аминокислотных остатков, происходящих из N-концевого фрагмента белка шелка паука.
Согласно другому аспекту в настоящем изобретении предложен выделенный белок шелка паука, который состоит из 170-760 аминокислотных остатков и выбран из группы белков, определенных формулами NT2-REP-CT, NT-REP-CT, NT2-REP и NT-REP, где:
NT представляет собой белковый фрагмент, имеющий от 100 до 160 аминокислотных остатков, который представляет собой N-концевой фрагмент, происходящий из белка шелка паука.
REP представляет собой белковый фрагмент, имеющий от 70 до 300 аминокислотных остатков, где указанный фрагмент выбран из группы L(AG)nL, L(AG)nAL, L(GA)nL, L(GA)nGL, где:
n представляет собой целое число от 2 до 10;
каждый индивидуальный сегмент А представляет собой аминокислотную последовательность из 8-18 аминокислотных остатков, где от 0 до 3 аминокислотных остатков не являются Ala, а остальные аминокислотные остатки представляют собой Ala;
каждый индивидуальный сегмент G представляет собой аминокислотную последовательность из 12-30 аминокислотных остатков, где по меньшей мере 40% аминокислотных остатков представляют собой Gly; и каждый индивидуальный сегмент L представляет собой линкерную аминокислотную последовательность из 0-20 аминокислотных остатков; и
СТ представляет собой белковый фрагмент, имеющий от 70 до 120 аминокислотных остатков, который представляет собой C-концевой фрагмент, происходящий из белка шелка паука.
В одном воплощении белок шелка паука состоит из 170-600 аминокислотных остатков и выбран из группы белков, определенных формулами NT-REP-CT и NT-REP.
В некоторых воплощениях белок шелка паука выбран из группы, состоящей из SEQ ID NO:3-5, 17, 19-23, 25 и 31.
Согласно одному аспекту в настоящем изобретении предложено применение белков шелка пауков по изобретению для получения димеров белка шелка паука.
Согласно одному аспекту в настоящем изобретении предложено применение белков шелка пауков по изобретению для получения полимеров белка шелка паука.
Согласно одному аспекту в настоящем изобретении предложено применение димера белка шелка паука по изобретению для получения полимеров из выделенного белка шелка паука.
В предпочтительных воплощениях этих аспектов указанные полимеры получают в жидкой среде, имеющей рН 6,3 или ниже и ионную композицию, которая обеспечивает полимеризацию указанного белка шелка паука.
Согласно одному аспекту в настоящем изобретении предложена композиция, содержащая выделенный белок шелка паука по изобретению, растворенный в жидкой среде, имеющей рН 6,4 или выше и/или ионную композицию, которая предотвращает полимеризацию указанного белка шелка паука.
В одном воплощении рН жидкой среды составляет 7,0 или выше. В одном воплощении рН жидкой среды находится в диапазоне от 6,4 до 6,8.
В некоторых воплощениях содержание липополисахаридов и других пирогенов в композиции составляет 1 EU/мг выделенного белка или ниже.
Согласно другому аспекту в настоящем изобретении предложена выделенная молекула полинуклеиновой кислоты, содержащая последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO:14-16, 18 и 24; последовательности нуклеиновой кислоты, кодирующие SEQ ID NO:3-5, 17, 19-23, 25 и 31; последовательности нуклеиновой кислоты, которые кодируют белок шелка паука согласно изобретению; и их комплементарные последовательности нуклеиновых кислот.
Согласно еще одному другому аспекту в настоящем изобретении предложен способ получения белка шелка паука согласно изобретению, включающий стадии, на которых:
(1) экспрессируют молекулу полинуклеиновой кислоты, которая кодирует указанный белок шелка паука в подходящем хозяине; и
(2) выделяют белок, полученный на стадии (1), возможно включают удаление липополисахаридов и других пирогенов.
Более того, предложен способ обратимой сборки полимера или олигомера из молекул одного типа или молекул нескольких разных типов, включающий стадии, на которых:
(1) берут указанные молекулы, причем каждая молекула включает:
(а) по меньшей мере одну первую связывающую группировку из 100-160 аминокислотных остатков, которые происходят из N-концевого фрагмента белка шелка паука, и
(б) вторую группировку, которая индивидуально выбрана из белков, нуклеиновых кислот, углеводов и липидов;
(2) берут раствор указанных молекул в жидкой среде с рН 6,4 или выше и/или ионной композицией, которая предотвращает полимеризацию или олигомеризацию указанных(ой) молекул(ы) через указанные связывающие группировки;
(3) корректируют свойства указанной жидкой среды до рН 6,3 или ниже и ионной композиции, которая обеспечивает полимеризацию или олигомеризацию указанных молекул через указанные связывающие группировки;
(4) обеспечивают сборку указанных молекул в полимер или олигомер через указанные связывающие группировки в жидкой среде, имеющей рН 6,3 или ниже и ионную композицию, которая обеспечивает полимеризацию или олигомеризацию указанных молекул через указанные связывающие группировки.
В одном воплощении указанные молекулы со стадии (1) являются идентичными, и указанный полимер или олигомер со стадии (4) является гомополимером или гомоолигомером. В другом воплощении указанные молекулы со стадии (1) не являются идентичными, и указанный полимер или олигомер со стадии (4) является гетерополимером или гетероолигомером.
В предпочтительных воплощениях указанный полимер или олигомер со стадии (4) растворяют в указанной жидкой среде, имеющей рН 6,3 или ниже и ионную композицию, которая обеспечивает полимеризацию или олигомеризацию указанных молекул.
В одном воплощении рН жидкой среды со стадий (3) и (4) составляет 6,2 или ниже, например 6,0 или ниже, и/или рН жидкой среды со стадий (3) и (4) составляет 3 или выше, например 4,2 или выше.
В некоторых воплощениях ионная сила жидкой среды со стадии (4) находится в диапазоне от 1 до 250 мМ.
В одном воплощении рН жидкой среды со стадии (2) составляет 6,7 или выше, например 7,0 или выше. В одном воплощении рН жидкой среды со стадии (2) находится в диапазоне от 6,4 до 6,8.
В предпочтительном воплощении указанная вторая группировка представляет собой белок.
В одном воплощении способ дополнительно включает стадию, на которой:
(5) корректируют свойства указанной жидкой среды до рН 6,4 или выше и/или ионной композиции, которая предотвращает полимеризацию или олигомеризацию указанных молекул, для разборки указанного полимера или олигомера.
В одном воплощении рН жидкой среды со стадии (2) и/или стадии (5) составляет 6,7 или выше, например 7,0 или выше. В одном воплощении рН жидкой среды со стадии (2) и/или стадии (5) находится в диапазоне от 6,4 до 6,8.
В предпочтительном воплощении полимер или олигомер со стадии (4) используют в исследованиях взаимодействия, разделении, индуцировании активности ферментных комплексов или FRET-анализе (резонансный перенос энергии флуоресценции).
В одном воплощении по меньшей мере один тип молекулы со стадии (1) иммобилизован на твердой подложке или на матрице аффинной среды.
Также предложен способ детектирования взаимодействий связывания между поднабором молекул, содержащимся в наборе молекул, включающий стадии, на которых:
(1) берут указанный набор молекул, где каждая молекула содержит:
(а) по меньшей мере одну первую связывающую группировку из 100-160 аминокислотных остатков, которая происходит из N-концевого фрагмента белка шелка паука, и
(б) вторую группировку, которая индивидуально выбрана из белков, нуклеиновых кислот, углеводов и липидов;
(2) берут раствор указанного набора молекул в жидкой среде с рН 6,4 или выше и/или ионной композицией, которая предотвращает полимеризацию или олигомеризацию указанных молекул;
(3) корректируют свойства указанной жидкой среды до рН 6,3 или ниже и ионной композиции, которая обеспечивает полимеризацию или олигомеризацию указанных молекул;
(4) обеспечивают сборку указанных молекул в полимер или олигомер через указанные связывающие группировки в жидкой среде, имеющей рН 6,3 или ниже и ионную композицию, которая обеспечивает полимеризацию или олигомеризацию указанных молекул;
(5) корректируют свойства указанной жидкой среды до рН 6,4 или выше и/или ионной композиции, которая предотвращает полимеризацию или олигомеризацию указанных молекул, для разборки указанного полимера или олигомера; и
(6) определяют присутствие взаимодействий связывания, которые не опосредованы указанные связывающие группировки, между двумя или более чем двумя разными молекулами, которые образуют указанный поднабор молекул.
Также предложено новое применение одной или более молекул, каждая из которых содержит:
(а) по меньшей мере одну первую связывающую группировку из 100-160 аминокислотных остатков, которые происходят из N-концевого фрагмента белка шелка паука, и
(б) вторую группировку, которая индивидуально выбрана из белков, нуклеиновых кислот, углеводов и липидов;
для обратимой сборки полимера или олигомера из указанных молекул через указанные связывающие группировки в растворе с рН 6,3 или ниже и ионной композицией, которая обеспечивает полимеризацию или олигомеризацию указанных молекул.
В предпочтительном воплощении полимер или олигомер используют в исследованиях взаимодействия, разделении, индуцировании активности ферментных комплексов или FRET-анализе.
В другом аспекте в настоящем изобретении предложена аффинная среда, содержащая матрицу и лиганд для аффинных взаимодействий, связанный с указанной матрицей, который содержит по меньшей мере один фрагмент из 100-160 аминокислотных остатков, который происходит из N-концевого фрагмента белка шелка паука.
В предпочтительном воплощении матрица выбрана из группы, состоящей из частиц и фильтров.
Другие аспекты и воплощения изобретения будут очевидны из описания изобретения.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На Фиг.1 показано выравнивание последовательности N-концевых фрагментов спидроина.
На Фиг.2 показано выравнивание последовательности C-концевых фрагментов спидроина.
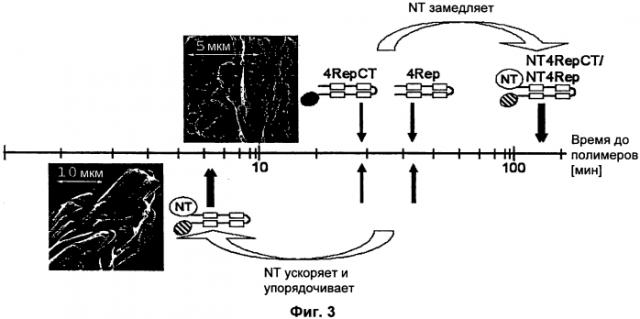
На Фиг.3 проиллюстрирована рН-индуцированная и солезависимая полимеризация NT4Rep, NT4RepCT, 4Rep и 4RepCT.
На Фиг.4 показана турбидиметрия NT и NT4Rep при разных рН.
На Фиг.5 показано динамическое рассеяние света NT при рН 6 и 7.
На Фиг.6 показано динамическое рассеяние света NT при рН 6,1-7,2 в разных ионных композициях.
На Фиг.7 схематично показана рН-зависимая сборка белков, слитых с NT.
На Фиг.8 показаны электрофорезные гели слитых белков.
Список прилагаемых последовательностей:
SEQ ID NO:
1 4Rep
2 4RepCT
3 NT4Rep
4 NT5Rep
5 NT4RepCTHis
6 NT
7 CT
8 консенсусная последовательность NT
9 консенсусная последовательность CT
10 повторяющаяся последовательность из MaSp1 Euprosthenops australis
11 консенсусная последовательность 1 сегмента G
12 консенсусная последовательность 2 сегмента G
13 консенсусная последовательность 3 сегмента G
14 NT4Rep (ДНК)
15 NT4RepCT (ДНК)
16 NT5Rep (ДНК)
17 NT4RepCTHis2
18 NT4RepCTHis2 (ДНК)
19 ZbasicNT4RepCT
20 NT4RepCT
21 HisTrxHisThrNT4RepCT
22 NT4RepCT 2
23 HisNTNT4RepCT
24 HisNTNT4RepCT (ДНК)
25 NTSRepCT
26 HisNTMetSP-C33Leu
27 HisNTMetSP-C33Leu (ДНК)
28 HisNTNTMetSP-C33Leu
29 HisNTNTMetSP-C33Leu (ДНК)
30 NTHis
31 NTNT8RepCT
32 NTNTBrichos
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение в общем основано на изобретательском представлении о том, что ранее малопонятный N-концевой неповторяющийся фрагмент белков шелка пауков вовлечен в полимеризацию этих белков и, в частности, что образование полимеров, включающих этот фрагмент, можно точно контролировать путем варьирования некоторых параметров. Это представление было развито в новый способ получения полимеров выделенного белка шелка паука. Хотя примеры в силу необходимости относятся к конкретным белкам, в данном случае к белкам, происходящим из спидроина 1 (MaSp1, major spidroin 1) большой ампуловидной железы из Euprosthenops australis, считается, что описанный в данной заявке способ применим к любому аналогичному белку с целью получения полимеров.
Это представление также привело к идентификации нового мотива белка шелка паука, который является достаточным для рекомбинантной продукции волокон шелка пауков. Отсюда следует, что новый мотив белка шелка паука является полезным в качестве отправной точки для конструирования новых белков и генов шелка пауков, таких как белки и гены, о которых сообщается в данной заявке. Полимеры, которые образуются из белков, возникающих из новых спидроинов, являются полезными благодаря их физическим свойствам, особенно полезной комбинации высокой прочности, эластичности и легкой массы. Они также являются полезными благодаря их способности поддерживать прикрепление и рост клеток. Свойства канатного шелка являются привлекательными при разработке новых материалов для медицинских или технических целей. В частности, шелка пауков согласно изобретению являются полезными в медицинских устройствах, таких как имплантаты, и медицинских продуктах, таких как системы для ушивания ран, пластыри, шовные материалы, повязки на раны и каркасы для тканевой инженерии и направленной регенерации клеток. Шелка пауков согласно изобретению также являются особенно полезными для применения в качестве текстильного материала или ткани, таких как в парашютах, пуленепробиваемой одежде, ремнях безопасности и т.д. При применении этого способа больше не требуется введение отщепляемого партнера слияния, который отщепляется с использованием отщепляющих агентов во время процесса, когда полимеризация является желательной. Это облегчает получение и выход белков шелка пауков и их полимеров и обеспечивает преимущество в способе промышленного производства.
Термин "волокно", используемый в данном описании, относится к полимерам, имеющим толщину по меньшей мере 0,1 мкм, предпочтительно макроскопическим полимерам, которые различимы человеческим глазом, т.е. имеющим толщину по меньшей мере 1 мкм, и имеют значительную протяженность в длину по сравнению с их толщиной, предпочтительно превышающую 5 мм. Термин "волокно" не охватывает неструктурированные агрегаты или осадки.
Термины "спидроины" и "белки шелка пауков" используются взаимозаменяемо во всем описании и охватывают все известные белки шелка пауков, включая белки шелка пауков из большой ампуловидной железы, которые обычно сокращают как "MaSp", или "ADF" в случае Araneus diadematus. Эти белки шелка пауков из большой ампуловидной железы обычно относятся к двум типам - 1 и 2. Кроме того, эти термины включают новые белки согласно изобретению, как определено в прилагаемой формуле изобретения и детализированных воплощениях, и другие неприродные белки с высокой степенью идентичности и/или сходства с известными белками шелка пауков.
Таким образом, в настоящем изобретении предложен способ получения полимеров из выделенного белка шелка паука. На первой стадии берут рекомбинантный белок шелка паука. Белок шелка паука типично состоит из 170-760 аминокислотных остатков, например, из 170-600 аминокислотных остатков, предпочтительно из 280-600 аминокислотных остатков, например, из 300-400 аминокислотных остатков, более предпочтительно из 340-380 аминокислотных остатков. Маленький размер является выгодным, поскольку более длинные белки шелка пауков имеют тенденцию к образованию аморфных агрегатов, для солюбилизации и полимеризации которых требуется применение жестких растворителей. Рекомбинантный белок шелка паука может содержать более 760 остатков, в частности, в тех случаях, когда белок шелка паука содержит более двух фрагментов, происходящих из N-концевой части белка шелка паука, белок шелка паука содержит N-концевой фрагмент, состоящий по меньшей мере из одного фрагмента (NT), происходящего из соответствующей части белка шелка паука, и повторяющийся фрагмент (REP), происходящий из соответствующего внутреннего фрагмента белка шелка паука. Возможно, белок шелка паука содержит C-концевой фрагмент (СТ), происходящий из соответствующего фрагмента белка шелка паука. Белок шелка паука типично содержит единичный фрагмент (NT), происходящий из N-концевой части белка шелка паука, но в предпочтительных воплощениях N-концевой фрагмент включает по меньшей мере два, например два фрагмента (NT), происходящих из N-концевой части белка шелка паука. Таким образом, спидроин схематично можно представить формулой NTm-REP и, альтернативно, NTm-REP-CT, где m представляет собой целое число, которое равно 1 или более, например 2 или более, предпочтительно в диапазонах 1-2, 1-4, 1-6, 2-4 или 2-6. Предпочтительные спидроины можно схематично представить формулами NT2-REP или NT-REP и, альтернативно, NT2-REP-CT или NT-REP-CT. Данные фрагменты белка связаны ковалентно, типично посредством пептидной связи. В одном воплощении белок шелка паука состоит из фрагмента(тов) NT, связанного(ых) с фрагментом REP, который возможно связан с фрагментом СТ.
Фрагмент NT имеет высокую степень сходства с N-концевой аминокислотной последовательностью белков шелка пауков. Как показано на Фиг.1, эта аминокислотная последовательность является весьма консервативной среди различных видов и белков шелка пауков, включая MaSp1 и MaSp2. На Фиг.1 выровнены следующие фрагменты NT спидроина, обозначенные входящими номерами GenBank, когда это применимо:
| ТАБЛИЦА 1 | ||
| Фрагменты NT спидооина | ||
| Код | Вид и спидроиновый белок | Номер доступа в GenBank |
| Еа MaSp1 | MaSp1 Euprosthenops australis | АМ259067 |
| Lg MaSp1 | MaSp1 Latrodectus geometricus | ABY67420 |
| Lh MaSp1 | MaSp1 Latrodectus hesperus | ABY67414 |
| Nc MaSp1 | MaSp1 Nephila clavipes | ACF19411 |
| At MaSp2 | MaSp2 Argiope trifasciata | AAZ15371 |
| Lg MaSp2 | MaSp2 Latrodectus geometricus | ABY67417 |
| Lh MaSp2 | MaSp2 Latrodectus hesperus | ABR68855 |
| Nim MaSp2 | MaSp2 Nephila inaurata madagascariensis | AAZ15322 |
| Nc MaSp2 | MaSp2 Nephila clavipes | ACF19413 |
| Ab CySp1 | Цилиндрический спидроин 1 Argiope bruennichi | ВАЕ86855 |
| Ncl CySp1 | Цилиндрический спидроин 1 Nephila clavata | ВАЕ54451 |
| Lh TuSp1 | Трубочковидный спидроин Latrodectus hesperus | ABD24296 |
| Nc Flag | Жгутиковидный белок шелка Nephila clavipes | AF027972 |
| Nim Flag | Жгутиковидный белок шелка Nephila inaurata madagascariensis | AF218623 транслированный |
Для каждой последовательности показана только часть, соответствующая N-концевому фрагменту, исключая сигнальный пептид. Nc flag и Nlm flag транслируются и редактируются согласно Rising А. et al. Biomacromolecules 7, 3120-3124 (2006)).
Отмечают, что NT имеет очевидный дипольный момент, поскольку кислотные и основные остатки локализуются в кластерах на противоположных полюсах. Не желая ограничиваться этим, подразумевают, что наблюдаемая полимеризация NT может вовлекать образование линейных массивов димеров NT, сложенных полюс к полюсу с отрицательной поверхностью одной субъединицы, обращенной к положительной поверхности соседней субъединицы в следующем димере в данном массиве.
Не является критичным, какой конкретный фрагмент NT присутствует в белках шелка пауков согласно изобретению, пока фрагмент NT не отсутствует полностью. Таким образом, фрагмент NT согласно изобретению может быть выбран из любой из аминокислотных последовательностей, показанных на Фиг.1, или последовательностей с высокой степенью сходства. В белке шелка паука согласно изобретению можно использовать широкий спектр N-концевых последовательностей. На основе гомологичных последовательностей, представленных на Фиг.1, следующая последовательность составляет консенсусную аминокислотную последовательность NT:
QANTPWSSPNLADAFINSF(M/L)SA(A/I)SSSGAFSADQLDDMSTIG(D/N/Q)TLMSAMD(N/S/K)MGRSG(K/R)STKSKLQALNMAFASSMAEIAAAESGG(G/Q)SVGVKTNAISDALSSAFYQTTGSVNPQFV(N/S)EIRSLI(G/N)M(F/L)(A/S)QASANEV(SEQ ID NO:8).
Последовательность фрагмента NT согласно изобретению имеет по меньшей мере 50%-ную идентичность, предпочтительно по меньшей мере 60%-ную идентичность с консенсусной аминокислотной последовательностью SEQ ID NO:8, которая основана на аминокислотных последовательностях, представленных на Фиг.1. В предпочтительном воплощении последовательность фрагмента NT согласно изобретению имеет по меньшей мере 65%-ную идентичность, предпочтительно по меньшей мере 70%-ную идентичность с консенсусной аминокислотной последовательностью SEQ ID NO:8. В предпочтительных воплощениях фрагмент NT согласно изобретению, кроме того, имеет 70%-ное, предпочтительно 80%-ное сходство с консенсусной аминокислотной последовательностью SEQ ID NO:8.
Репрезентативный фрагмент NT согласно изобретению представляет собой последовательность SEQ ID NO:6 Euprosthenops australis. Согласно предпочтительному воплощению изобретения фрагмент NT имеет по меньшей мере 80%-ную идентичность с SEQ ID NO:6 или любой индивидуальной аминокислотной последовательностью на Фиг.1. В предпочтительных воплощениях изобретения фрагмент NT имеет по меньшей мере 90%-ную, например, по меньшей мере 95%-ную идентичность с SEQ ID NO:6 или любой индивидуальной аминокислотной последовательностью на Фиг.1. В предпочтительных воплощениях изобретения фрагмент NT идентичен SEQ ID NO:6 или любой индивидуальной аминокислотной последовательности на Фиг.1, конкретно Еа MaSp1.
Фрагмент NT содержит от 100 до 160 аминокислотных остатков. Предпочтительно, чтобы фрагмент NT содержал по меньшей мере 100 или более 110, предпочтительно более 120 аминокислотных остатков. Также предпочтительно, чтобы фрагмент NT содержал самое большее 160 или менее 140 аминокислотных остатков. Типичный фрагмент NT содержит приблизительно 130-140 аминокислотных остатков.
Когда N-концевой фрагмент белка шелка паука содержит два или более фрагментов (NT), происходящих из N-концевого фрагмента белка шелка паука, он также может содерж