Способ диагностики йерсиниоза лососевых рыб, вызываемого yersinia ruckeri, методом полимеразной цепной реакции и диагностический набор для осуществления способа
Иллюстрации
Показать всеПредлагаемая группа изобретений относится к области биотехнологии, а именно к способу диагностики йерсиниоза лососевых рыб и набору для его осуществления. Данная группа изобретений может быть использована для выявления возбудителя йерсиниоза лососевых - Yersinia ruckeri - в пробах для диагностики болезней рыб в ветеринарии. Способ включает проведение полимеразной цепной реакции для выявления соответствующих фрагментов нуклеиновых кислот с использованием праймеров, имеющих следующую структуру: 5'CTAACACTACAGGTTATCGCCTCTG3' (Yr-rA-1), 5'GGCTCATCATACGAGCGGCAAGTCC3' (Yr-rA-2), 5'CTTGTTTGACGATATTCGCTTTGGC3' (Yr-gA-1), 5'CTGGGGGAACCGGGAAGTAACC3' (Yr-gA-2), 5'GCGAAAGCTTGCGTGAGCTGTCG3' (Yr-gB-1), 5'GGAAACCATCATTCCACTGCAAG3' (Yr-gB-2). О наличии в образце ДНК Yersinia ruckeri судят по специфическому фрагменту размером 294 п.о. для пары Yr-rA-1,2; размером 154 п.о. для пары Yr-gA-1,2; размером 225 п.о. для пары Yr-gB-1,2. Предложенное изобретение позволяет диагностировать йерсиниоз лососевых рыб с высокой специфичностью. 2 н.п. ф-лы, 3 ил., 1 табл., 3 пр.
Реферат
Предлагаемое изобретение относится к области ветеринарной биотехнологии, молекулярной биологии и может быть использовано для выявления генетического материала возбудителя йерсиниоза лососевых - Yersinia ruckeri - в пробах как для диагностики болезней рыб в ветеринарии, так и для научных исследований.
Среди инфекционных болезней радужной форели, выращиваемой в пресной воде, серьезную опасность представляет йерсиниоз - ERM (Enteric Red Month, «кишечная красноротость»), вызываемый бактерией Yersinia ruckeri, представителем семейства Enterobacteriaceae. Симптомы йерсиниоза у больной рыбы включают геморрагии различных тканей и органов, особенно около рта, в жабрах, мускулатуре, брюшной стенке, полостном жире, а также в переднем и заднем отделе кишечника. При заболевании характерны желтые выделения из анального отверстия.
Йерсиниоз признан энзоотической инфекцией в ряде регионов, активно занимающихся форелеводством - в Северной Америке, Европе, Австралии, Южной Африке. Впервые заболевание зарегистрировано в аквакультуре в 60-е годы в США, позднее, в 1981 году, во Франции, далее в Германии. В настоящее время в связи с массовыми, но практически бесконтрольными международными перевозками рыбопосадочного материала болезнь распространена достаточно широко.
С 2010 года йерсиниоз выявляется и в Российской Федерации, где в список карантинных заболеваний не входит, но за счет массовой гибели и порчи товарного вида продукции наносит тяжелый урон рыбоводческим хозяйствам. Помимо форели Yersinia ruckeri выделена от разных видов лососевых, сиговых рыб, в частности кумжи, гольца, сига, а также щуки, угря, карпа, окуня, плотвы, осетров и налима, более того, известны случаи выявления возбудителя от других пресноводных гидробионтов, что может быть вектором передачи бактерий в окружающей среде культивируемой рыбе.
Полимеразная цепная реакция является прямым методом выявления ДНК, он обладает высокой специфичностью и чувствительностью. В основе метода ПЦР лежит естественный процесс репликации ДНК - комплементарное достраивание ДНК матрицы, осуществляемое с помощью фермента ДНК-полимеразы. Процесс удвоения нуклеиновых кислот можно использовать для получения копий коротких участков ДНК, специфичных для конкретных микроорганизмов, т.е. целенаправленный поиск специфичных участков является целью генодиагностики для выявления возбудителя йерсиниоза. Для эффективного проведения ПЦР необходимы ДНК-затравки - праймеры (синтетические олигонуклеотиды) определенного размера, строго специфичные для искомого возбудителя. Сложность выбора праймеров обусловлена их требованием строгой видоспецифичности. Праймеры должны быть комплементарны нуклеотидным последовательностям ДНК на границах специфического фрагмента и ориентированы таким образом, что достраивание новой цепи ДНК, катализируемое ДНК-полимеразой, протекает только между ними. В целом выбор специфического фрагмента и подбор праймеров играет решающую роль в специфичности проведения амплификации, что сказывается на качестве проведения анализа, а значит, обеспечивает точность диагностики заболевания.
В доступной литературе нами обнаружено только три статьи, авторы которых использовали ПЦР для работы с Yersinia ruckeri. В публикациях Jeffrey T. LeJeune & Fred R. Rurangirwa [J. Vet. Diagn.Invest., 2000, №12, p. 558-561] и A. del Cerro, I. Marquez & J.A. Guijarro [J. App. & Env. Microbiol., 2002, Vol. 68., №10, p. 5177-5180] используются праймеры, разработанные на основе гена 16S рРНК, это, несомненно, консервативный участок гена, однако современными исследованиями показано, что использование праймеров, сконструированных на основе рибосомальных генов, часто дает ложноположительные результаты. То есть было показано, что праймеры, комплементарные последовательностям гена 16S рРНК, детектируют не только Yersinia ruckeri, но и ДНК других представителей семейства Enterobacteriaceae, что недопустимо при дифференциальной диагностике, поэтому авторы в работе рекомендуют дополнительно использовать секвенирование для подтверждения специфичности синтезируемых в реакции ампликонов, что, в свою очередь, затратно и не всегда доступно.
В статье M. Kotetishvili, A. Kreger, G. Wauters, J.G. Morris, A. Sulakvelidze & O.C. Stine [Jour.of Clin.Microbiol., 2005, Vol. 43, №6, p. 2674-2684] использовали праймеры на основе фрагментов генов рибосомальной РНК, глютаминсинтетазы А, гиразы Б, рекомбинантного белка А для мультилокусного секвенирования и изучения филогенетических взаимоотношений йерсиний разных видов, а именно Yersinia aldovae, Y.bercovieri, Y.intermedia, Y.pestis, Y.pseudotuberculosis, Y.rohdei, Y.ruckeri, Y.enterocolitica, Y.frederiksenii, Y.kristensenii, Y.molaretii. В ходе исследования было установлено, что Yersinia ruckeri является наиболее генетически однородной и наиболее отдаленной группой внутри рода, однако вопросы достоверных межвидовых отличий от других представителей семейства Enterobacteriaceae не изучались.
Задача настоящего изобретения - разработка олигонуклеотидных праймеров для идентификации Yersinia ruckeri методом полимеразной цепной реакции и создание на их основе диагностического набора для дифференциальной диагностики йерсиниоза лососевых рыб.
Предлагаемое изобретение позволяет обнаруживать ДНК Yersinia ruckeri, которая вызывает йерсиниоз лососевых рыб, при этом аналогичные диагностические наборы не известны.
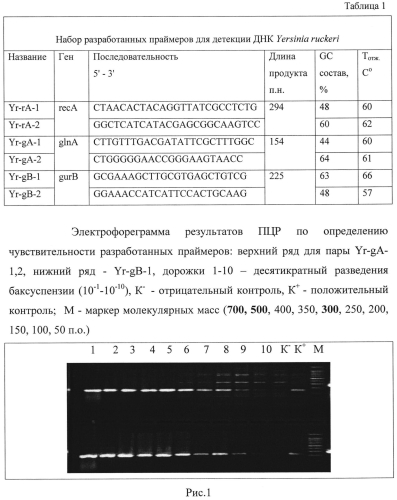
Задачу достигают конструированием специфичных олигонуклеотидных праймеров для идентификации ДНК Yersinia ruckeri методом мультилокусной полимеразной цепной реакции, имеющих следующие характеристики (Таблица 1 - см. в конце описания).
Подбор синтетических олигонуклеотидов проводили с использованием компьютерных программ Primer Select (Laser Gene 7.0) и Oligo 7.0 (США) на основе нуклеотидных последовательностей, представленных в международной базе данных GeneBank NCBI (www.ncbi.nlm.nih.gov), проанализированных с помощью пакета программ DNAStar Lasergene (США). Праймеры проверяли на отсутствие гомологии с последовательностями других бактерий и генома человека программой Blast с помощью web-ресурса Национального центра биотехнологической информации (NCBI). Оценка специфичности сконструированных праймеров подтвердила гомологичность с нуклеотидной последовательностью генов recA, glnA и gurB и отсутствие значимой гомологии с нуклеотидными последовательностями бактерий семейства Enterobacteriaceae и других видов. При анализе выбранных праймеров установлено отсутствие самокомлементарных участков внутри праймеров и комплементарности друг к другу, во избежание возникновения вторичных структур и «димеров» праймеров, которые могут блокировать реакцию или привести к неспецифической амплификации.
Разработанные олигонуклеотидные праймеры заказываются в коммерческом сервисном центре и являются составной частью набора следующих веществ:
- Пробирки с ПЦР-реакционной смесью, запаянной парафином, в состав которой входят указанные праймеры, дезоксирибонуклеотидтрифосфаты четырех типов, MgCl2, буферный раствор (ПЦР-смесь-2-blue) и деионизированная вода - приготовленную таким образом смесь можно хранить при t +8°C до 6 мес;
- Раствор фермента Taq-полимеразы;
- Положительный контрольный образец - ДНК генома Yersinia ruckeri, который вносится в пробирку по аналогии с исследуемыми (опытными) образцами, чтобы иметь возможность сравнивать результаты этих образцов с заведомо положительными;
- Отрицательный контрольный образец, который входит в состав набора для контроля загрязнения реактивов продуктами ранее проведенных реакций. Положительный результат в этом образце свидетельствует о необходимости поверить реактивы и переставить эксперимент.
ПРИМЕР 1. Амплификация специфических фрагментов ДНК генома Yersinia ruckeri с помощью предлагаемого набора на основе разработанных праймеров.
Эксперименты проводили на 12 штаммах Y. ruckeri из коллекции лаборатории ихтиопатологии ВИЭВ имени Я.Р. Коваленко, видовая принадлежность которых была ранее определена культурально-биохимическими и серологическими методами.
Для исключения неспецифического отжига праймеров до достижения заданных температурных параметров использовали режим «горячего старта», который обеспечивается приготовлением реакционной смеси, состоящей из двух слоев, разделенных прослойкой воска.
До начала ПЦР-анализа с помощью набора предлагаемых компонентов проводили пробоподготовку, заключающуюся в выделении ДНК из биоматериала с помощью любого коммерческого набора для выделения нуклеиновых кислот (что не является отличием данного патента).
Отбирали и маркировали необходимое количество пробирок с реакционной смесью, равное количеству анализируемых проб плюс два контроля (положительный и отрицательный).
В каждую промаркированную пробирку, не повреждая слой парафина, вносили раствор Taq-полимеразы в объеме 0,5 мкл. В пробирки вносили образцы анализируемой ДНК в объеме 5 мкл, в пробирку К- - отрицательный контроль, К+ - положительный контроль. Сверху наслаивали по 30 мкл минерального масла.
Пробирки устанавливали в блок амплификатора, условия проведения реакции: 1) 95°C - 5 мин - 1 цикл; 2) 94°C - 45 с, 61°C - 45 с, и 72°C - 60 с - 35 циклов; 3) 72°C - 5 мин - 1 цикл. Могут быть использованы амплификаторы любых производителей.
Анализ результатов амплификации проводили путем электрофореза продуктов реакции в 2% агарозном геле с добавление бромистого этидия, сравнивая их подвижность с подвижностью полос маркеров молекулярного веса (50+bp). При использовании разработанного набора в реакции амплификации с ДНК возбудителя йерсиниоза Y. ruckeri синтезируемые ампликоны соответствуют расчетным данным (табл. 1).
ПРИМЕР 2. Определение чувствительности реакции амплификации на основе разработанных праймеров.
Анализировали пробы ДНК, выделенные из серийных десятикратных разведений чистых культур возбудителя йерсиниоза. Исследование проводили по методике, описанной в примере 1. Последним разведением, в котором на электрофореграмме обнаруживалась специфическая полоса, считали 10-8 от исходной концентрации, что соответствует 1×102-1×104м.кл./мл. Электрофореграмма результатов ПЦР представлена на Рисунке 1.
ПРИМЕР 3. Определение специфичности диагностического набора на основе разработанных олигонуклеотидных праймеров проводили по методике, описанной в примере 1 в одном из двух вариантов.
-1-й (моноспецифический) вариант - «ПЦР в разных пробирках» - предусматривает проведение реакции в трех разных пробирках на одну пробу, содержащих реакционную смесь и одну пару праймеров.
-2-й (мультилокусный) вариант - «ПЦР в одной пробирке» - предусматривает проведение реакции в одной пробирке, содержащей реакционную смесь и три пары праймеров.
Специфичность диагностикума проверяли на образцах Y. ruckeri, других представителях рода Yersinia - Y. enterocolitica; микроорганизмах других семейств - Pseudomonadaceae, Vibrionaceae и гетерологичных организмов - Homo sapiens. Положительный результат получали только с образцами ДНК Y. ruckeri, с другими пробами в 100% случаев получен отрицательный результат (рис. 2 и рис. 3).
Полученные результаты свидетельствуют о высокой специфичности сконструированных праймеров и разработанного набора в отношении Yersinia ruckeri, что позволяет использовать их для дифференциальной диагностики йерсиниоза лососевых рыб в пробах биологического материала в короткие сроки с достоверностью 100%.
Диагностикум разработан и апробирован с положительным результатом в лаборатории ихтиопатологии ВИЭВ имени Я.Р. Коваленко в период октябрь 2013 - март 2014 года.
Предложенный способ может быть применен в научных исследованиях для получения новых знаний о распространении и закономерностях циркуляции йерсиний вида Yersinia ruckeri в аквакультуре, а также представляет практический интерес использования данного набора для диагностики в системе мониторинга, проводимого органами ветеринарной службы страны, что позволит контролировать заболеваемость йерсиниозом и сохранять здоровье культивируемых рыб.
Источники информации
1. Jeffrey T.LeJeune & Fred R.Rurangirwa. Polimerase chain reaction for definitive identification of Yersinia ruckeri / J.Vet.Diagn.Invest., 2000, №12, p.558-561.
2. A.del Cerro, I.Marquez & J.A.Guijarro. Simultaneous detection of Aeromonas salmonicida, Flavobacterium psychrophilum, and Yersinia ruckeri, three major fish pathogens, by Multiplex PCR / J. App.&Env.Microbiol., 2002, Vol.68., №10, p.5177-5180.
3. M.Kotetishvili, A.Kreger, G.Wauters, J.G.Morris, A.Sulakvelidze & O.C.Stine. Multilocus sequence typing for studying genetic relationships among Yersinia species / Jour.of Clin.Microbiol., 2005, Vol.43, №6, p.2674-2684 (прототип).
1. Способ диагностики йерсиниоза лососевых рыб, вызываемого Yersinia ruckeri, методом полимеразной цепной реакции, отличающийся тем, что для выявления соответствующих фрагментов нуклеиновых кислот используют праймеры, имеющие следующую структуру:Yr-rA-1 - 5′CTAACACTACAGGTTATCGCCTCTG 3′;Yr-rA-2 - 5′GGCTCATCATACGAGCGGCAAGTCC 3′;Yr-gA-1 - 5′CTTGTTTGACGATATTCGCTTTGGC 3′;Yr-gA-2 - 5′CTGGGGGAACCGGGAAGTAACC 3′;Yr-gB-1 - 5′GCGAAAGCTTGCGTGAGCTGTCG 3′;Yr-gB-2 - 5′GGAAACCATCATTCCACTGCAAG 3′;о наличии в образце ДНК Yersinia ruckeri судят по специфическому фрагменту размером 294 п. о. для пары Yr-rA-1,2; размером 154 п. о. для пары Yr-gA-1,2; размером 225 п. о. для пары Yr-gB-1,2.
2. Диагностический набор для осуществления способа диагностики йерсиниоза, вызываемого Yersinia ruckeri, содержащий ПЦР-реакционную смесь, отличающийся тем, что ПЦР-реакционная смесь включает разработанные пары праймеров Yr-rA-1, 2; Yr-gA-1, 2; Yr-gB-1,2, аналогичные п. 1 в моноспецифическом и в мультилокусном варианте.