Fgf-r-fc слитый белок и его использование
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к гибридным белкам рецептора фактора роста фибробластов (FGFR), и может быть использовано в медицине для лечения заболеваний, связанных с избыточной экспрессией FGF. Конструируют растворимый слитый белок FGFR, состоящий из фрагмента, полученного из промежуточной функциональной последовательности (IFS) Ig-подобного домена FGFR, второго Ig-подобного домена FGFR (D2), третьего Ig-подобного домена FGFR (D3), и Fc области иммуноглобулина. Полученный слитый белок используют для ингибирования ангиогенеза у млекопитающих. Изобретение позволяет повысить сродство связывания с FGF. 8 н. и 3 з.п. ф-лы, 6 ил., 3 табл., 7 пр.
Реферат
Область техники
[01] Настоящее изобретение относится к области биотехнологии, а также относится к лечению заболеваний, особенно лечению заболеваний, связанных с избыточной экспрессией FGF. В частности, настоящее изобретение относится к FGFR-Fc слитому белку и его использованию в лечении заболеваний, связанных с регулированием ангиогенеза. Более конкретно, настоящее изобретение относится к выделенному растворимому FGFR-Fc слитому белку и использованию его в получении лекарственного средства для лечения заболеваний, связанных с регулированием ангиогенеза.
Предшествующий уровень техники
[02] Ангиогенез (Angiogenesis) представляет собой один из основных элементов, которые вызывают рост и метастазу злокачественных опухолей [1]. Процесс ангиогенеза регулируется множеством цитокинов, некоторые факторы стимулируют ангиогенез, некоторые факторы ингибируют ангиогенез, таким образом, регуляция ангиогенеза является очень сложным динамическим процессом [2]. Антиангиогенная терапия направлена на предотвращение ангиогенеза опухоли путем блокировки фактора, стимулирующего рост кровеносных сосудов, или препятствия ангиогенезу опухоли при помощи ингибитора ангиогенеза, с тем чтобы достичь целей контроля роста опухоли. Уже известно довольно много стимулирующих факторов ангиогенеза, таких, как фактор роста эндотелия сосудов (Vascular endothelial growth factor, VEGF), фактор роста фибробластов (фактор роста фибробластов, FGF), фактор роста гепатоцитов (Фактор роста гепатоцитов, HGF). Эти факторы могут стимулировать деление, эндотелий, дифференцировку, морфогенез эндотелиальных клеток кровеносных сосудов. В чем, VEGF, как известно, является наиболее унитарным наиболее эффективным фактором роста ангиогенеза [3, 4].
[03] В гипоксической среде опухолевой ткани, опухолевые клетки секретируют большое количество VEGF, вызывают деление, миграцию сосудистых эндотелиальных клеток, и в результате этого установлена сосудистая сеть опухоли. Многочисленные исследования на животных показывают, что VEGF для ингибирования ангиогенеза может предотвратить ангиогенез сосудов опухоли, подавляя тем самым рост опухоли. Из-за этого, VEGF и его рецептором является самым важным таргетингом нового препарата анти-ангиогенеза. В настоящее время в клинических испытаниях проявляет существенный лечебный эффект препарат анти-ангиогенеза бевацизумаб (бевацизумаб, торговое название Авастин), который может непосредственно блокировать VEGF, ингибировать опухолевый ангиогенез, в 2004 году был утвержден FDA США, представляет собой препарат первой линии, предназначенный для лечения колоректального рака, является первым препаратом, который был одобрен для продажи, путем ингибирования ангиогенеза играет роль в противораковом лечении. Авастин представляет собой гуманизированное моноклональное антитело против VEGF, которая проводили известной американской биотехнологической компанией Genentech. В крупномасштабных клинических испытаниях фазы III, применение Авастина в комбинации с химиотерапевтическими препаратами может значительно продлить время выживания пациентов с различными опухолями, в том числе рак толстой кишки, рак легких, рак молочной железы, рак почек и т.д. [5, 6]. Успех Авастина в клинических испытаниях имеет всемирно-историческое значение, антиангиогенная терапия, направленная на сосудистую сеть является клинически эффективной терапией для лечения различных опухолей, откроет совершенно новый способ для лечения разных опухолей. В западных странах Авастин широко использовали в лечении рака, в настоящее время является одним из важных лекарственных средств по сумме мировых продаж.
[04] В дополнение к Авастину, в разных странах есть ряд лекарственных средств анти- VEGF сигналов, которые находятся в поздней стадии клинических испытаний на человеке, как ожидается, клиническое применение их будет проводиться в ближайшие несколько лет. Среди них, Афлиберцепт (или VEGF -Трап), который проводили на основе сотрудничества между биотехническими американскими компаниями Regeneron и Sanofi-Aventist, в настоящее время находится в крупномасштабных клинических испытаниях [7]. Препарат моноклонального антитела IMC-1121B на основе рецептора II против VEGF(VEGFR2), разработанный компанией Imclone, находится в клинических испытаниях фазы III также [8]. В Китае, противоопухолевый препарат для таргетинга опухолевого ангиогенеза в настоящее время является горячей точкой разработки новых лекарств. Есть целый ряд отечественных компаний и исследовательских институтов, которые разрабатывают препараты на основе VEGF и его рецептора или других таргетингов ангиогенеза. Несомненно, что эти новые препараты будут обеспечивать новые возможности лечения рака, приносить пациентам новую надежду.
[05] Препарат анти-VEGF добился значительного прогресса в клиническом лечении рака, но клинические испытания также показали, что у терапии анти-VEGF существуют значительные ограничения. Исходя из эффектов лечения рака, Авастин может продлить время жизни у половины больных с колоректальным раком на около 3-4 мес. [9, 10], у половины больных раком молочной железы - на около 7-8 мес. [11], Таким образом, Авастин не может эффективно долгосрочно ингибировать опухолевый рост кровеносных сосудов. Поэтому, дальнейшее совершенствование антиангиогенного эффекта при клиническом лечении рака является задачей исследователей, также как и направление научного исследования и разработки лекарственных средств анти-ангиогенеза следующего поколения.
[06] Причина, приводящая к неэффективности лечения или возникновению сопротивляемости к анти-VEGF, может заключаться в том, что опухолевый ангиогенез контролируется различными факторами, хотя VEGF играет важную роль анти-VEGF, но он не единственный фактор для стимуляции ангиогенеза. Между тем, из-за гетерогенности и сложности микроокружения опухоли, а также компенсационной реакции организма, когда активность VEGF подавляется в долгосрочное время, другие стимулирующие факторы ангиогенеза будут экспрессируемы [12], в результате этого опухолевый рост кровеносных сосудов больше не зависит от VEGF сигнальных путей. Команда Hanahan университета Калифорнии в Сан-Франциско изучила изменения экспрессирующего фактора рост ангиогенеза во время лечения опухолей поджелудочной железы с применением анти VEGFR2, обнаружила, что некоторые фрагменты гена изменены, из которых наиболее известно, что уровень экспрессии FGF-2 значительно увеличивается. Исследования показали, что в процессе лечения опухолей с применением анти-VEGF увеличивалась толерантность к FGF, особенно цувеличивалась уровень экспрессии FGF-2, значительно, ангиогенез активирована снова, и после блокирования FGF сигнальных путей ингибировалась опухолевая регенерация [13]. Это показывает, что избыточная экспрессия FGF-2 и лекарственноустойчивость при лечении от опухоли с применением анти VEGFR тесно связаны друг с другом. По-нашему, блокирование каналов может эффективно ингибировать ангиогенез опухоли, отдельно или в сочетании с анти VEGF эффективно лечить от болезней, связанных с регулированием ангиогенеза.
[07] Фактор роста фибробластов (FGF) является одним из группы гепаринсвязывающих факторов, у млекопитающих есть 22 вида таких факторов (FGF 1-14, 16-23). FGF играет важную роль в различных биологических функциях, таких как клеточная пролиферация, дифференцировка, миграция, ангиогенез и онкогенез. Путем связывания и активации рецепторов FGF (FGFR) на поверхности клеток, он выполняет свои разнообразные биологические функции. (См. Eswarakumar et al. Cytokine Growth Factor Rev. 16: 139-149, 2005). Рецептор фактора роста фибробластов (broblast growth factor receptor, FGFR) является рецептором, связывающим с членом семейства факторов роста фибробластов. Фрагменты рецептора фактора роста фибробластов участвуют в процессе заболевания. FGFR может связываться с FGF, активировать сигнальные пути вниз по течению в процессе эмбриогенеза, роста, развития кровеносных сосудов, расширения кровеносных сосудов, нервной регуляции, защиты от ишемии, заживления ран и онкогенеза и играют важную роль в других физиологических и патологических процессах [14, 15]. Было подтверждено, что избыточная экспрессия FGF/FGFR в естественных условиях тесно связана с опухолями (такими как фибромы, глиомы, меланомы, опухоли предстательной железы, лимфомы, лейкемии, рак мочеполовой системы), заболеваниями костей (карликовый рост, краниосиностоз, ахондроплазия, акантоз) и почечной недостаточностью и другими заболеваниями [14-19]. Сообщается, что повышенные уровни экспрессии FGF и рецептора могут непосредственно способствовать выживанию и пролиферации клеток опухоли, понижение FGF посредством миРНК значительно снижает выживание раковых клеток печени [22]. Таким образом, создание FGF FGFR-Fc слитого белка, обладающего способностью антагонизма, может блокировать FGF пути и лечить от болезней, связанных с избыточной экспрессией FGF.
[08] В настоящее время относительно небольшое количество антиангиогенных новых лекарственных средств на основе таргетинга FGF и его рецептора, находится в фазе клинических испытаний работы исследования и разработки. Препарат FP-1039, разработанный американской фирмой Five Prime, находится в фазе клинических испытаний, теперь производится вербовка добровольцев, FP-1039 является слитым белком, который состоит из внеклеточного домена человека FGFR1, фрагмента Fc человеческого домена IgG1. В то время исследования Ван и Olsen и других специалистов показывают, что линкерный фрагмент между первым Ig-подобным доменом и вторым Ig-подобным доменом внеклеточного человеческого домена FGFR1 ингибирует связывание между FGFR1 и FGF [20, 21].
[09] Поэтому, создание FGF FGFR-Fc слитого белка, обладающего способностью антагонизма, может блокировать FGF пути, эффективно ингибирует ангиогенез или непосредственно воздействует на опухолевые клетки и ингибирует их рост, в результате этого может лечить от болезней, связанных с избыточной экспрессией FGF, лечит от опухолей, и других болезней, связанных с регулированием ангиогенеза.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[10] Пространственная структура белка имеет близкую связь с его биологической функцией. Конформация каждых IG-подобных доменов внеклеточного домена FGFR и связанных фрагментов непосредственно влияет на его способность связывания с FGF, способом генной инженерии создается слитый белок из фрагмента IG-подобного домена внеклеточного домена FGFR, фрагмента Fc-области IgG разных длин, чтобы формировать слитый белок, имеющий различные конформации, способом рассортировки получаются слитые белки, имеющие способность связывания с FGF, высокую биологическую активность.
[11] Млекопитающие имеют четыре гена FGFR: fgfR 1-fgfR4. Рецептор фактора роста фибробластов состоит из трансмембранного домена, и внутриклеточного домена внеклеточной области, семейство FGFR имеет множество членов, свойства его лигана не такие, как другой домен киназы, но они имеют сходные внеклеточные области. Их внеклеточные области содержат три иммуноглобулин-подобных (Ig-подобных) доменов: первый Ig-подобный домен, второй Ig-подобный домен и третий Ig-подобный домен, промежуток между первым и вторым Ig-подобными доменами также включает в себя участок последовательности, в настоящем техническом решении, участок последовательности между первым и вторым Ig-подобными доменами также называется промежуточной функциональной последовательностью Ig -подобного домена FGFR (В этой статье последовательность между первым Ig-подобным доменом и вторым Ig-подобным доменом называется IFS). Указанная область промежуточной функциональной последовательности содержит один фрагмент последовательности кислой аминокислоты под названием кислая ячейка (acidic box, AB).
[12] Настоящее изобретение относится к слитому белку рецептора выделенного растворимого фактора роста фибробластов (FGFR), содержащему: участок области промежуточной функциональной последовательности, полученный из Ig -подобного домена FGFR (далее IFS), 2-й Ig подобный домен FGFR (далее D2), 3-й Ig подобный домен FGFR (далее D3), Fc область иммуноглобулина (далее Fc).
[13] Настоящее изобретение относится к слитому белку, содержавшему или состоящему из следующих частей: участок области промежуточной функциональной последовательности, полученный из Ig -подобного домена FGFR, 2-й Ig подобный домен FGFR, 3-й Ig подобный домен FGFR (далее D3), Fc область иммуноглобулина. В некоторых вариантах осуществления, фрагмент, полученный из IFS не не содержит кислотной ячейки. В другом варианте осуществления указанный IFS фрагмент имеет аминокислотную последовательность SEQ ID NO: 1 № 134-162, № 145-162 или № 151-162, или имеет аминокислотную последовательность, которая обладает, по меньшей мере, 70%-ной идентичностью последовательности, предпочтительно по меньшей мере 80%, 90%, 93%, 95%, 97%, 98% или 99% с аминокислотной последовательностью SEQ ID NO: 1 № 134-162, № 145-162 или № 151-162.
[14] Настоящее изобретение также относится к слитому белку, содержавшему или состоящему из следующих частей: 1-й Ig подобный домен FGFR (далее D1) или его часть, участок области промежуточной функциональной последовательности, полученный из Ig-подобного домена FGFR (далее IFS), 2-й Ig подобный домен FGFR, 3-й Ig подобный домен FGFR, Fc область иммуноглобулина. Предпочтительно, D1 домен или его часть, содержащая:
[15] аминокислотную последовательность SEQ ID NO: 1 № 40-118, или имеет аминокислотную последовательность, которая обладает, по меньшей мере, 70%-ной идентичностью последовательности, предпочтительно по меньшей мере 80%, 90%, 93%, 95%, 97%, 98% или 99% с аминокислотной последовательностью SEQ ID NO: 1 № 40-118; или
[16] аминокислотную последовательность SEQ ID NO: 1 № 77-118, или имеет аминокислотную последовательность, которая обладает, по меньшей мере, 70%-ной идентичностью последовательности, предпочтительно по меньшей мере80%, 90%, 93%, 95%, 97%, 98% или 99% с аминокислотной последовательностью SEQ ID NO: 1 № 77-118; или
[17] В одном аспекте настоящее изобретение относится к слитому белку, содержащему или состоящему из следующих частей: участок области промежуточной функциональной последовательности, полученный из Ig -подобного домена FGFR или его часть, 2-й Ig подобный домен FGFR, 3-й Ig подобный домен FGFR, Fc область иммуноглобулина. Предпочтительно, D1 домен или его часть, где:
[18] 2-й Ig подобный домен FGFR имеет аминокислотную последовательность SEQ ID NO: 1 № 163-247, или имеет аминокислотную последовательность, которая обладает, по меньшей мере, 70%-ной идентичностью последовательности, предпочтительно по меньшей мере 80%, 90%, 93%, 95%, 97%, 98% или 99% с аминокислотной последовательностью SEQ ID NO: 1 №163-247; или
[19] 3-й Ig подобный домен FGFR имеет аминокислотную последовательность SEQ ID NO: 1 №270-359, или имеет аминокислотную последовательность, которая обладает, по меньшей мере, 70%-ной идентичностью последовательности, предпочтительно по меньшей мере80%, 90%, 93%, 95%, 97%, 98% или 99% с аминокислотной последовательностью SEQ ID NO: 1 № 270-359.
[20] Настоящее изобретение также относится к слитому белку, содержащему или состоящему из следующих частей: внеклеточную область FGFR, Fc область иммуноглобулина, где указанная внеклеточная область FGFR:
[21] (1) имеет любую аминокислотную последовательность из SEQ ID NO: 9 № 358-580, SEQ ID NO: 10 № 304-526, SEQ ID NO: 11 № 278-500, SEQ ID NO: 12 № 246-468, SEQ ID NO: 13 № 235-457, SEQ ID NO: 14 № 229-451 и SEQ ID NO: 15 № 224-446, или аминокислотную последовательность, кодируемую любой нуклеотидной последовательностью из SEQ ID NO: 16 № 1074-1740, SEQ ID NO: 17 № 912-1578, SEQ ID NO: 18 № 834-1500, SEQ ID NO: 19 № 738-1404, SEQ ID NO: 20 № 705-1371, SEQ ID NO: 21 № 687-1353, SEQ ID NO: 22 № 672-1338;
[22] (2) имеет аминокислотную последовательность, которая обладает, по меньшей мере, 70%-ной идентичностью последовательности, предпочтительно по меньшей мере 80%, 90%, 93%, 95%, 97%, 98% или 99% с любой аминокислотной последовательностью SEQ ID NO: 9 № 358-580, SEQ ID NO: 10 № 304-526, SEQ ID NO: 11 № 278-500, SEQ ID NO: 12 № 246-468, SEQ ID NO: 13 № 235-457, SEQ ID NO: 14 № 229-451 и SEQ ID NO: 15 № 224-446, и состоит из них; или
[23] (3) имеет любую аминокислотную последовательность, по крайней мере, идентичность которой 70%, предпочтительно по меньшей мере 80%, 90%, 93%, 95%, 97%, 98% или 99% с любой аминокислотной последовательностью, кодируемой нуклеотидной последовательностью из SEQ ID NO: 16 № 1074-1740, SEQ ID NO: 17 № 912-1578, SEQ ID NO: 18 № 834-1500, SEQ ID NO: 19 № 738-1404, SEQ ID NO: 20 № 705-1371, SEQ ID NO: 21 № 687-1353 и SEQ ID NO: 22 № 672-1338.
[24] Настоящее изобретение также относится к слитому белку, указанный белок:
[25] (1) имеет любую аминокислотную последовательность из SEQ ID NO: 9-15, или аминокислотную последовательность, кодируемую любой нуклеотидной последовательностью из SEQ ID NO: 16-22;
[26] (2) имеет аминокислотную последовательность, которая обладает, по меньшей мере, 70%-ной идентичностью последовательности, предпочтительно по меньшей мере 80%, 90%, 93%, 95%, 97%, 98% или 99% с любой аминокислотной последовательностью из SEQ ID NO: 9-15; или
[27] (3) имеет любую аминокислотную последовательность, по крайней мере, идентичность которой 70%, предпочтительно по меньшей мере 80%, 90%,93%, 95%, 97%, 98% или 99% с любой аминокислотной последовательностью, кодируемой нуклеотидной последовательностью из SEQ ID NO: 16-22.
[28] Слитый белок по настоящему изобретению, предпочтительно содержащий Fc-область иммуноглобулина, более предпочтительно Fc -область человека IgG1, еще более предпочтительно указанную Fc человека IgG1, содержащую:
[29] аминокислотную последовательность SEQ ID NO: 7, или аминокислотную последовательность, которая обладает, по меньшей мере, 70%-ной идентичностью последовательности, предпочтительно по меньшей мере 80%, 90%,93%, 95%, 97%, 98% или 99% с аминокислотной последовательностью SEQ ID NO: 7; или
[30] аминокислотную последовательность, кодируемую нуклеотидной последовательностью SEQ ID NO: 8, или аминокислотную последовательность, которая обладает, по меньшей мере, 70%-ной идентичностью последовательности, предпочтительно по меньшей мере 80%, 90%, 93%, 95%, 97%, 98% или 99% с такой аминокислотной последовательностью, кодируемой нуклеотидной последовательностью SEQ ID NO: 8.
[31] В одном варианте осуществления настоящего изобретения, указанная Fc область иммуноглобулина расположена в конце С слитого белка.
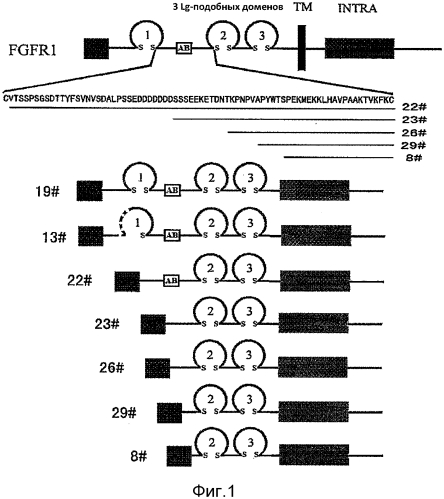
[32] Предпочтительно, настоящее изобретение также относится к предшественнику слитого белка, содержащему области секреторного сигнала пептида, такие как области сигнального пептида секретируемого белка VEGFR1, предпочтительно содержащие аминокислотную последовательность SEQ ID NO: 2 № 1-26, или аминокислотную последовательность, кодируемую такой нуклеотидной последовательностью, или SEQ ID NO: 23. Указанная область сигнального пептида предпочтительно находится на конце N указанного предшественника.
[33] В другом аспекте настоящее изобретение относится к слитому белку, содержащему последовательности от конца N- к концу С: фрагменты, полученные из IFR, D2, D3, Fc область иммуноглобулина.
[34] В еще одном аспекте настоящего изобретения, домены и/или участки фрагментов, содержащиеся в слитом белке по настоящему изобретению, непосредственно соединены друг с другом или через линкер. В одном варианте осуществления, фрагменты, полученные из внеклеточной области VEGFR,, фрагменты, полученные из области Fc иммуноглобулина, непосредственно соединены. В другом варианте, фрагменты, полученные из внеклеточной области FGFR, фрагменты, полученные из области Fc иммуноглобулина, соединены через линкер.
[35] В одном из аспектов, слитый белок по настоящему изобретению ингибирует ангиогенез. В другом своем аспекте, слитый белок по настоящему изобретению в естественных условиях и/или в пробирке связывается FGF, предпочтительно связывается с FGF2. В еще одном аспекте слитый белок по настоящему изобретению непосредственно ингибирует рост опухолевых клеток.
[36] Настоящее изобретение также относится к FGFR-Fc-слитому белку, содержащему фрагмент, полученный из внеклеточной области FGFR, фрагмент, полученный из Fc-области иммуноглобулина. В частности, фрагмент, полученный из внеклеточной области FGFR, представляет собой фрагмент, полученный из внеклеточной области FGFR1. Предпочтительно, указанная Fc область иммуноглобулина является Fc областью человеческого иммуноглобулина, как Fc-область IgG1 человека. В одном аспекте настоящего изобретения, FGFR-Fc слитый белок имеет способность связывания с FGF и/или способность противодействия фрагменту FGF, тем самым может ингибировать ангиогенез.
[37] FGFR-Fc слитый белок по настоящему изобретению, содержащий фрагмент, полученный из внеклеточной области FGFR, который включает в себя один или более фрагментов, выбранных из следующих кластеров: D1 домен или его часть, участок, полученный из IFS, D2 домен или его часть, D3 домен или его часть. В одном варианте осуществления, фрагмент, полученный из внеклеточной области FGFR, включает в себя участок, полученный из IFS, D2 домен и D3 домен, указанный участок, полученный из IFS, предпочтительно содержащий аминокислотную последовательность, представленную в SEQ ID NO: 1 № 134-162, № 145-162 или № 151-162. В некоторых предпочтительных вариантах осуществления настоящего изобретения, FGFR-Fc-слитый белок не содержит D1 или его часть. В другом предпочтительном варианте осуществления настоящего изобретения, FGFR-Fc-слитый белок не содержит IFS, за исключением аминокислотной последовательности, представленной в SEQ ID NO: 1 № 134 162, № 145-162 или № 151-162.
[38] В некоторых вариантах осуществления настоящего изобретения, последовательность каждых фрагментов и/или отдельных доменов, содержащихся в FGFR-Fc слитом белке от конца N- к концу С может быть произвольной, или она может быть приведенной на фиг 1. В еще одном варианте осуществления, указанная последовательность может другой, которая не показана на фиг 1.
[39] В некоторых вариантах осуществления настоящего изобретения, FGFR -Fc слитый белок еще содержит один или более дисульфидных связей, предпочтительно, Ig -подобный домен содержит один или более дисульфидных связей.
[40] В одном аспекте настоящего изобретения, FGFR-Fc слитый белок может быть получен с использованием молекулы нуклеиновых кислот, содержащей любую нуклеиновую последовательность из SEQ ID NO: 16-22, экспрессируемых в линии клеток млекопитающих. В частности, указанная линия клеток млекопитающего представляет собой СНО клеточную линию
[41] Кроме того, настоящее изобретение также обеспечит FGFR-Fc слитые белки, содержащие домены и/или области, которые могут быть непосредственно соединены или соединены через линкер.
[42] В другом аспекте, настоящее изобретение относится к выделенной молекуле нуклеиновой кислоты, кодирующей слитый белок по изобретению или его предшественник. Предпочтительно, указанная молекула нуклеиновой кислоты содержит любую нуклеотидную последовательность из SEQ ID NO: 16-22.
[43] В еще одном аспекте настоящее изобретение обеспечивает вектор, содержащий молекулу нуклеиновой кислоты по настоящему изобретению.
[44]В еще другом аспекте настоящее изобретение также обеспечивает клетки, трансформированные/трансформируемые указанным вектором, которые предпочтительно представляют собой клетки СНО.
[45] Настоящее изобретение также обеспечивает композицию, которая содержит слитый белок по настоящему изобретению, и смешивается с фармацевтически приемлемым вектором.
[46] В еще другом аспекте настоящее изобретение обеспечивает фармацевтическую композицию, содержащую слитый белок, молекулу нуклеиновой кислоты, вектор или клетки, и фармацевтически приемлемый вектор.
[47] В еще другом аспекте настоящее изобретение обеспечивает способ получения слитого белка, ингибирующего развитие кровеносных сосудов, указанный слитый белок может быть получен с использованием клеточных линий в прокариотических клетках или эукариотических клетках, особенно клетках млекопитающих, экспрессирующих слитый белок по настоящему изобретению.
[48] Настоящее изобретение также относится к способу получения слитых белков, ингибирующих ангиогенез, с использованием молекулы нуклеиновой кислоты в линии клеток млекопитающих, экспрессирующей слитый белок по настоящему изобретению. Предпочтительно, указанная линия клеток млекопитающего представляет собой СНО клеточную линию.
[49] В другом аспекте настоящее изобретение относится к способу ингибирования ангиогенеза, включающему введение эффективного количества FGFR-Fc слитого белка по настоящему изобретению, кодирующей молекулы нуклеиновой кислоты, вектора, содержащего молекулу нуклеиновой кислоты, и/или фармацевтической композицию, содержащей любой из предшествующих пунктов. Предпочтительно, указанный способ осуществляется у млекопитающего.
[50] В еще другом аспекте, настоящее изобретение относится к способу лечения или профилактики опухолей у млекопитающего, включающий введение эффективного количества FGFR-Fc слитого белка по настоящему изобретению, кодирующей молекулы нуклеиновой кислоты, вектора, содержащего молекулу нуклеиновой кислоты, и/или фармацевтическую композицию, содержащей любой из предшествующих пунктов объекту, нуждающемуся в лечении, предпочтительно, указанная опухоль представляет собой солидную опухоль.
[51] В еще другом аспекте, настоящее изобретение обеспечивает способ лечения или профилактики глазных связанных с ангиогенезом заболеваний у млекопитающих, включающий введение эффективного количества FGFR-Fc слитого белка по настоящему изобретению, кодирующей молекулы нуклеиновой кислоты, вектора, содержащего молекулу нуклеиновой кислоты, и/или фармацевтической композицию, содержащей любой из предшествующих пунктов объекту, нуждающемуся в лечении. Указанные заболевания глазного ангиогенеза, предпочтительно представляют собой возрастную макулярную дегенерацию и т.д.
[52] Настоящее изобретение также относится к использованию FGFR-Fc слитого белка по настоящему изобретению, кодирующей молекулы нуклеиновой кислоты, вектора, содержащего молекулу нуклеиновой кислоты, и/или фармацевтической композицию, содержащей любой из предшествующих пунктов в изготовлении лекарства, ингибирующего ангиогенез. Кроме того, настоящее изобретение также относится к использованию FGFR-Fc слитого белка по настоящему изобретению, кодирующей молекулы нуклеиновой кислоты, вектора, содержащего молекулу нуклеиновой кислоты, и/или фармацевтической композицию, содержащей любой из предшествующих пунктов в изготовлении лекарства, предназначенного для лечения или профилактики заболеваний, связанных с регулированием ангиогенеза, предпочтительно, связанные с регулированием ангиогенеза заболевания представляют собой опухоль или глазные заболевания, связанные с регулированием ангиогенеза.
[53] С учетом того, что в различных странах патентная система имеет разные положения по теме защиты изображения, настоящее изобретение также обеспечивает соответствующие фармацевтические применения вышеуказанным способам, препараты для назначенных применений. Эти различные фармацевтические цели и лекарственные средства также входят в объем настоящего изобретения, как они были конкретно описаны в настоящем описании.
[54] Настоящее раскрытое описание лишь иллюстрирует некоторые конкретные варианты, которые входят в объем изобретения, технические функции, описанные в одном или нескольких технических решениях, могут быть композицией любого одного или более технических решений, эти технические решения по композициям также входят в объем изобретения, как они были раскрыты в настоящем описании.
[55] В сочетании с прилагаемыми чертежами и нижеследующим подробным описанием дополнительно иллюстрируется настоящее изобретение. Следует отметить, что последующее описание только иллюстрирует технические решения примерами, входящими в объем изобретения, но не любые ограничения на эти технические решения. Объем изобретения, содержащийся в прилагаемой формуле изобретения, имеет преимущественную силу.
Краткое описание чертежей
[56] Фиг. 1 представляет собой структурную схему FGFR-Fc слитого белка, FGFR1- Fc слитый белок показан сплошными линиями, делеция аминокислоты обозначена пунктирной линией; Подобный домен антитела обозначен кольцом; тип подобного домена разного антитела представлен в виде букв 1-3, дисульфидная связь представлена в виде s s; Человеческий Fc область IgG1 человека показана как серое поле. SP представляет собой VEGFR1 сигнальный пептид; Последовательность кислой ячейки показана как квадратную рамку с буквами AB.
[57] Фиг. 2 представляет собой схему сравнения связывания FGFR1-Fc слитого белка с FGF-2, где метод ELISA предназначен для определения уровня связывания Fc слитого белка (20 нг/мл) со покрытыми белками VEGF165 и/или FGF-2 (содержание гепарина 100).
[58] Фиг. 3 представляет собой схему ДСН-ПААГ слитого белка FGFR1-Fc №26.
[59] На Фиг. 4 представлен градиент связывания слитого белка FGFR1-Fc № 26 с FGF-2.
[60] На Фиг. 5 представлен аффинитет слитого белка FGFR1-Fc № 26с FGF-2.
[61] На фиг. 6 показано влияние слитого белка FGFR1-Fc № 26 на деление HUVEC клеток, индуцированное FGF-2.
ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Определения
[62] Если не указано иное, все термины, используемые в данном описании, имеют такое же значение, как понятно специалистам в данной области. Касательно определения и терминологий в данной области, конкретные специалисты могут прочитать Current Protocols in Molecular Biology (Ausubel). Аббревиатура аминокислотных остатков, используемая в данной области, представляет собой одну из 20 стандартных 3-букв L-аминокислоты и/или 1-буквенный код.
[63] Несмотря на то, что численные диапазоны и параметры, показанные в широком объеме настоящего изобретения приблизительны, но конкретные значения, указанные в варианте осуществления, описаны как можно точнее. Тем не менее, любой числовое значение собственно содержит определенные ошибки, особенно отклонение стандартов в их соответствующих измерениях. Кроме того, все диапазоны, описанные здесь, должны охватывать содержащие любые и все поддиапазоны. Например, как описанный диапазон «1 до 10» должен содержать любые и все под диапазоны, содержащие минимальное значение 1 и максимальное значение 10 (включая концы); То есть, любые все поддиапазоны, содержащие минимальное значение 1 или больше стартовое значение, например, 1-6,1, любые все поддиапазоны, содержащие максимальное значение 10 или меньше значение прекращения, например, 5,5-10. Кроме того, любые ссылочные документы, называемые "включенный текст в настоящее описание”, должны рассматриваться как включенные документы в полном объеме.
[64] Следует также отметить, например, используемая в данном описании форма единственного числа также включает в себя форму множественного числа описанного объекта, если ясно не ограничивается одним предметом. Термин "или", термин "и/или" использовали взаимозаменяемо, если контекст четко не указан.
[65] Используемые здесь термины "Fc", "Fc-область", "Fc-фрагмент" или "Fc-область иммуноглобулина" означают кристаллизующийся фрагмент иммуноглобулина, в настоящем изобретении Fc область предпочтительно представляет собой IgG1 Fc-область человека.
[66] Термин "Fc-слитый белок" относится к антитело-подобной молекуле, обладающей специфичностью связывания гетерологичного белка, эффекторной функцией константного домена иммуноглобулина. С точки зрения структуры, Fc-слитый белок содержит аминокислотную последовательность, имеющую специфичность связывания, последовательность константного домена иммуноглобулина. Fc-слитый белок обычно содержит сайт связывания рецептора или лиганда. Указанная последовательность константного домена иммуноглобулина может быть получена из любого иммуноглобулина, например IgG-1, IgG-2, IgG-3 или IgG-4 подтипов, IgA (включая IgA-1 и IgA-2), IgE IgD или IgM.
[67] Используемый термин "растворимый" белок относится к белку, который может быть растворен в водном растворе при биологически значимых температурах, рН и осмотическом напряжении. Используемый термин "растворимый слитый белок" означает, что слитый белок не содержит трансмембранный участок и внутриклеточный участок.
[68] Используемый в данном описании термин "выделенный" относится к веществу и/или предмету (1), при начальном производстве (в естественной окружающей среде и/или в испытательной установке), который выделяется от исходных связанных некоторых компонентов, и/или (2) проводили путем искусственного изготовления, подготовки и/или производства. Выделяемые вещества и/или предметы, по крайней мере, около 10%, около 20%, около 30%, около 40%, около 50%, около 60%, около 70%, около 80%, около 90%, около 95% около 98% до около 99%, почти 100% или 100% выделены от его исходных связанных других компонентов.
[69] Термины "участок" и "фрагмент" относятся к взаимозаменяемой части полипептида, нуклеиновой кислоте или других строений молекулы.
[70] Используемый в данном описании термин "Ig-подобный домен" относится к домену иммуноглобулина, который встречается в различных семействах белков, участвуют в разнообразных биологических функциях, включая клетки - признание клетки, рецепторы клеточной поверхности, иммунную функцию, и так далее.
[71] Фактор роста фибробластов (FGF) является одним из гуппы гепаринсвязывающих факторов, у млекопитающих есть 22 видов таких факторов (FGF 1-14, 16-23). FGF играет важную роль в различных биологических функциях, таких как клеточную пролиферацию, дифференцировку, миграцию, ангиогенез и онкогенеза. Путем связывания и активации рецепторов FGF (FGFR) на поверхности клеток, он выполняет свои разнообразные биологические функции. (См., например Eswarakumar et al. Cytokine Growth Factor Rev. 16: 139-149, 2005). Рецептор фактора роста фибробластов (broblast growth factor receptor, FGFR) является рецептором, связывающим с членом семейства факторов роста фибробластов. Фрагменты рецептора фактора роста фибробластов участвуют в процессе заболевания. Есть четыре FGFR генов у млекопитающих: FGFR1-fgfR4. Рецептор фактора роста фибробластов состоит из внеклеточного домена, трансмембранного домена и внутриклеточного домена. В FGFR семействе, у каждых видов факторов есть разные свойства связывания, домен киназы, схожие внеклеточные области. Их внеклеточные области содержат три иммуноглобулин- подобных (Ig-подобных) доменов: 1-й Ig-подобный домен, 2-й Ig-подобный домен и 3-й Ig-подобный домен, между первым и вторым Ig-подобными доменами также содержится один фрагмент последовательности, в данном описании, фрагмент между 1-й и 2- й Ig-подобными доменами называется областью промежуточной функциональной последовательности. Указанная область промежуточной функциональной последовательности содержит один фрагмент последовательности кислой аминокислоты под названием кислая ячейка (acidic box, AB).
[72] Используемый в данном описании термин "1-й Ig-подобный домен FGFR "или " 1-й Ig-подобный домен "относится к первому Ig-подобному домену от конца N белка FGFR, имеющему последовательность аминокислотных остатков 40-118 SEQ ID NO: 1. Аналогично, 2-й Ig-подобный домен FGFR "или " 2-й Ig-подобный домен "относится ко второму Ig-подобному домену от конца N белка FGFR, имеющему последовательность аминокислотных остатков 163-247 SEQ ID NO: 1; 3-й Ig-подобный домен FGFR "или " 3-й Ig-подобный домен "относится к третьему Ig-подобному домену от конца N белка FGFR, имеющему последовательность аминокислотных остатков 270-359 SEQ ID NO: 1. Предпочтительно, FGFR является FGFR1, 1-й Ig-подобный домен FGFR представляет собой 1-й Ig-подобный домен FGFR1, 2-й Ig-подобный домен FGFR представляет собой 2-й Ig-подобный домен FGFR1, 3-й Ig-подобный домен FGFR представляет собой 3-й Ig-подобный домен FGFR1.
[73] Частичная последовательность hFGFR1 приведена ниже, заштрихованные части последовательно иллюстрируют различные Ig-подобные домены, см. http://www.ncbi.nlm.nih.gov/protein/AAH15035.1
MWSWKCLLFWAVLVTATLCTARPSPTLPEQAQPWGAPVEVESFLVHPGDLLQLRCRLRDDVQSINWLRDGVQLAESNRTRITGEEVEVQDSVPADSGLYACVTSSPSGSDTTYFSVNVSDALPSSEDDDDDDDSSSEEKETDNTKPNPVAPYWTSPEKMEKKLHAVPAAKTVKFKCPSSG180TPNPTLRWLKNGKEFKPDHRIGGYKVRYATWSIIMDSVVPSDKGNYTCIVENEYGSINHTYQLDVVERSPHRPILQAGLPANKTVALGSNVEFMCKVYSDPQPHIQWLKHIEVNGSKIGP300DNLPYVQILKTAGVNTTDKEMEVLHLRNVSFEDAGEYTCLAGNSIGLSHHSAWLTVLEALEER
[74] FGFR1 аминокислотная последовательность представлена в SEQ ID NO: 1 кодирующая нуклеотидная последовательность см. SEQ ID NO: 4.
[75] Используемый в данном описании термин "область промежуточной функциональной последовательности Ig-подобного домена FGFR" или "IFS", относится к последовательности между первым Ig-подобным доменом и вторым Ig-подобным доменом белка FGFR, предпочтительно, последовательность IFS имеет аминокислотную последовательность 118-162 SEQ ID NO: 1. Авторы настоящего изобретения неожиданно обнаружили, что указанная область промежуточной функциональной последовательности имеет существенное влияние на функцию Ig-подобного домена. Где указанный FGFR белок предпочтительно представляет собой FGFR1 (SEQ ID NO: 1), в частности FGFR1 белок человека. Аминокислотная последовательность, кодирующая FGFR1 белок человека, показана как SEQ ID NO: 1, последовательность cDNA представлена в SEQ ID NO: 4.
[76] Используемый в данном описании термин "FGFR" относится к рецептору фактора роста фиброб