Антитела к her3 и их применения
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности к антителам, которые связываются с человеческим HER3, к способу их производства, к фармацевтическим композициям, содержащим указанные антитела, и к их применению для лечения рака. Изобретение позволяет эффективно тормозить рост раковых клеток, экспрессирующих HER3, и HER3-опосредованную передачу сигнала. 7 н. и 7 з.п. ф-лы, 6 ил., 13 табл., 6 пр.
Реферат
Данное изобретение относится к антителам, связывающимся с человеческим HER3 (анти-HER3-антителам), к способам их производства, к фармацевтическим композициям, содержащим указанные антитела, и к их применениям.
Уровень техники
Человеческий HER3 (ErbB-3, ERBB3, с-erbB-3, с-erbB3, тирозин-киназный рецептор erbB-3, SEQ ID №17) кодирует рецептор эпидермального фактора роста (EGFR), член семейства тирозинкиназных рецепторов, которое также включает HER1 (также известный как EGFR), HER2 и HER4 (Kraus, M.H. et al, PNAS 86 (1989) 9193-9197; Plowman, G.D. et al, PNAS 87 (1990) 4905-4909; Kraus, M.H. et al, PNAS 90 (1993) 2900-2904). Как и прототипичный рецептор эпидермального фактора роста, трансмембранный рецептор HER3 состоит из внеклеточного лиганд-связывающего домена (ECD, extracellular ligand-binding domain), домена димеризации с ECD, трансмембранного домена, внутриклеточного домена тирозинкиназного белка (TKD) и C-концевого фосфорилированного домена. Этот связанный с мембраной белок имеет херегулин (HRG)-связывающий домен HER3 во внеклеточном домене, но не имеет активного киназного домена. Таким образом, он может связывать этот лиганд, но не передает сигнал внутрь клетки через фосфорилирование белка. Тем не менее, он формирует гетеродимеры с другими членами HER-семейства, которые обладают киназной активностью. Гетеродимеризация приводит к активации рецептор-опосредованного сигнального пути и трансфосфорилированию его внутриклеточного домена. Образование димеров между членами HER-семейства расширяет возможности передачи сигнала HER3 и является средством не только распределения сигнала, но и усиления сигнала. Например, гетеродимер HER2/HER3 индуцирует один из наиболее важных митогенных сигналов через путь PI3K и AKT среди членов семейства HER (Sliwkowski M.X., et al, J. Biol. Chem. 269 (1994) 14661-14665; Alimandi M, et al, Oncogene. 10 (1995) 1813-1821; Hellyer, N.J., J. Biol. Chem. 276 (2001) 42153-4261; Singer, E., J. Biol. Chem. 276 (2001) 44266-44274; Schaefer, K.L, Neoplasia 8 (2006) 613-622).
Амплификация этого гена и/или сверхэкспрессия его белка были обнаружены при многих раковых заболеваниях, в том числе при опухолях предстательной железы, мочевого пузыря и молочной железы. Были охарактеризованы транскрипционные варианты альтернативного сплайсинга, кодирующие различные изоформы. У одной изоформы отсутствует межмембранная область, и эта изоформа секретируется за пределы клетки. Эта форма действует путем модуляции активности формы, связанной с мембраной. Также сообщалось о дополнительных вариантах сплайсинга, но они не были детально описаны.
WO 97/35885 относится к HER3-антителам. WO 2003/013602 относится к ингибиторам HER-активности, включая HER-антитела. WO 2007/077028 и WO 2008/100624 также относятся к HER3-антителам.
Сущность изобретения
Изобретение включает антитело, которое связывается с человеческим HER3, характеризующееся тем, что вариабельный домен тяжелой цепи содержит CDR3H-область SEQ ID №1, CDR2H-область SEQ ID №2, CDR1H-область SEQ ID №3, а вариабельный домен легкой цепи содержит CDR3L-область SEQ ID №4, CDR2L-область SEQ ID №5, CDR1L-область SEQ ID №6 или CDR1L-область SEQ ID №7.
Кроме того, изобретение включает антитело в соответствии с изобретением, которое характеризуется тем, что вариабельный домен тяжелой цепи VH представляет собой SEQ ID №8; а вариабельный домен легкой цепи VL представляет собой SEQ ID №9, либо вариабельный домен легкой цепи VL представляет собой SEQ ID №10, либо вариабельный домен легкой цепи VL представляет собой SEQ ID №11; или ее гуманизированную версию.
Кроме того, изобретение включает антитело, включающее вариабельный домен тяжелой цепи, содержащий CDR3H-область SEQ ID №1, CDR2H-область SEQ ID №2, CDR1H-область SEQ ID №3, и вариабельный домен легкой цепи, содержащий CDR3L-область SEQ ID №4, CDR2L-область SEQ ID №5 и CDR1L-область SEQ ID №6.
Кроме того, изобретение включает антитело, включающее вариабельный домен тяжелой цепи VH SEQ ID №8 и вариабельный домен легкой цепи VL SEQ ID №9 или SEQ ID №11.
Кроме того, изобретение включает антитело, включающее вариабельный домен тяжелой цепи, содержащий CDR3H-область SEQ ID №1, CDR2H-область SEQ ID №2 и CDR1H-область SEQ ID №3, и вариабельный домен легкой цепи, содержащий CDR3L-область SEQ ID №4, CDR2L-область SEQ ID №5 и CDR1L-область SEQ ID №7.
Кроме того, изобретение включает антитело, включающее вариабельный домен тяжелой цепи VH SEQ ID №8 и вариабельный домен легкой цепи VL SEQ ID №10.
Другой аспект изобретения предусматривает антитело, которое связывается с человеческим HER3 и которое состоит из вариабельного домена тяжелой цепи VH, имеющего по меньшей мере 95% идентичность последовательности с SEQ ID №8, и вариабельного домена легкой цепи VL, имеющего по меньшей мере 95% идентичность последовательности с SEQ ID №9, SEQ ID №10 или SEQ ID №11.
В одном воплощении антитело в соответствии с изобретением характеризуется тем, что оно является моноклональным.
В одном воплощении антитело в соответствии с изобретением характеризуется тем, что оно является гуманизированным.
В одном воплощении антитело в соответствии с изобретением характеризуется тем, что оно относится к подклассу IgG1 или IgG4.
Кроме того, изобретение включает фармацевтическую композицию, которая характеризуется тем, что содержит антитело в соответствии с изобретением.
Кроме того, изобретение включает антитело в соответствии с изобретением для лечения рака.
Кроме того, изобретение включает применение антитела в соответствии с изобретением для изготовления лекарственного препарата для лечения рака.
Кроме того, изобретение включает способ лечения пациента, страдающего от рака, который характеризуется введением пациенту антитела в соответствии с изобретением.
Другой аспект изобретения предусматривает нуклеиновую кислоту, кодирующую тяжелую и легкую цепь анти-HER3-антитела по изобретению. В одном воплощении антитело состоит из вариабельного домена тяжелой цепи VH, имеющего по меньшей мере 95% идентичность последовательности с SEQ ID №8, и вариабельного домена легкой цепи VL, имеющего по меньшей мере 95% идентичность последовательности с SEQ ID №9, SEQ ID №10 или SEQ ID №11.
Кроме того, изобретение включает нуклеиновую кислоту, кодирующую тяжелую и легкую цепи антитела, связывающегося с человеческим HER3, которая характеризуется тем, что указанное антитело состоит из вариабельного домена VH SEQ ID №8 и вариабельного домена легкой цепи VL SEQ ID №8, SEQ ID №10 или SEQ ID №11; или ее гуманизированной версии.
Кроме того, изобретение включает экспрессионный вектор, который характеризуется тем, что включает нуклеиновую кислоту в соответствии с изобретением для экспрессии антитела в соответствии с изобретением в прокариотической или эукариотической клетке-хозяине.
Кроме того, изобретение включает прокариотическую или эукариотическую клетку-хозяина, содержащую вектор в соответствии с изобретением.
Кроме того, изобретение включает способ производства рекомбинантного антитела в соответствии с изобретением, который характеризуется экспрессией нуклеиновой кислоты в соответствии с изобретением в прокариотической или эукариотической клетке-хозяине и восстановлением указанного антитела из указанной клетки или клеточного культурального супернатанта.
Неожиданно было установлено, что антитела в соответствии с изобретением обладают весьма ценными свойствами, такими как сильное торможение роста раковых клеток, экспрессирующих HER3, сильное торможение HER3-опосредованной передачи сигнала (такой как, например, HER3-фосфорилирование и AKT-фосфорилирование), что связано с пролиферацией раковых клеток, высокой аффинностью к HER3 или превосходными фармакокинетическими свойствами (например, долгим временем полужизни и т.д.).
Подробное описание изобретения
Изобретение включает антитело, которое связывается с человеческим HER3, характеризующееся тем, что вариабельный домен тяжелой цепи содержит CDR3H-область SEQ ID №1, CDR2H-область SEQ ID №2 и CDR1H-область SEQ ID №3, а вариабельный домен легкой цепи содержит CDR3L-область SEQ ID №4, CDR2L-область SEQ ID №5, CDR1L-область SEQ ID №6 или CDR-IL-область SEQ ID №7.
Кроме того, изобретение включает антитело в соответствии с изобретением, которое характеризуется тем, что вариабельный домен тяжелой цепи VH представляет собой SEQ ID №8; а вариабельный домен легкой цепи VL представляет собой SEQ ID №9, либо вариабельный домен легкой цепи VL представляет собой SEQ ID №10, либо вариабельный домен легкой цепи VL представляет собой SEQ ID №11, либо ее гуманизированную версию.
Кроме того, изобретение включает антитело в соответствии с изобретением, которое характеризуется тем, что вариабельный домен тяжелой цепи VH представляет собой SEQ ID №8; а вариабельный домен легкой цепи VL представляет собой SEQ ID №9, либо вариабельный домен легкой цепи VL представляет собой SEQ ID №10, либо вариабельный домен легкой цепи VL представляет собой SEQ ID №11.
В одном воплощении антитело в соответствии с изобретением характеризуется тем, что включает вариабельный домен тяжелой цепи, содержащий CDR3H-область SEQ ID №1, CDR2H-область SEQ ID №2 и CDR1H-область SEQ ID №3, и вариабельный домен легкой цепи, содержащий CDR3L-область SEQ ID №4, CDR2L-область SEQ ID №5 и CDR1L-область SEQ ID №6.
В одном воплощении антитело в соответствии с изобретением характеризуется тем, что вариабельный домен тяжелой цепи VH представляет собой SEQ ID №8, а вариабельный домен легкой цепи VL представляет собой SEQ ID №9, либо вариабельный домен легкой цепи VL представляет собой SEQ ID №11.
В одном воплощении антитело в соответствии с изобретением характеризуется тем, что включает в качестве вариабельного домена тяжелой цепи CDR3H-область SEQ ID №1, CDR2H-область SEQ ID №2, CDR1H-область SEQ ID №3, а вариабельный домен легкой цепи содержит CDR3L-область SEQ ID №4, CDR2L-область SEQ ID №5 и CDR1L-область SEQ ID №7.
В одном воплощении антитело в соответствии с изобретением характеризуется тем, что вариабельный домен тяжелой цепи VH представляет собой SEQ ID №8, а вариабельный домен легкой цепи VL представляет собой SEQ ID №10.
В одном воплощении антитело в соответствии с изобретением является моноклональным. В одном воплощении антитело в соответствии с изобретением является гуманизированным или человеческим. В одном воплощении антитело в соответствии с изобретением относится к подклассу IgG1 и IgG4. В одном воплощении антитело в соответствии с изобретением представляет собой моноклональное гуманизированное антитело подкласса IgG1. В одном воплощении антитело в соответствии с изобретением характеризуется тем, что указанное антитело является гликозилированным с сахарной цепочкой на Asn297, где количество фукозы в указанной сахарной цепочке составляет 65% или ниже.
Изобретение включает гуманизированные антитела Mab 205.10.1, Mab 205.10.2 и Mab 205.10.3 с их соответствующими VH и VL или CDR.
| Антитело | VH | VL | ||||
| Mab 205.10.1 | SEQ ID №8 | SEQ ID №9 | ||||
| Mab 205.10.2 | SEQ ID №8 | SEQ ID №10 | ||||
| Mab 205.10.3 | SEQ ID №8 | SEQ ID №11 | ||||
| Антитело | CDR3H | CDR2H | CDR1H | CDR3L | CDR2L | CDR1L |
| Mab 205.10.1 | SEQ ID №1 | SEQ ID №2 | SEQ ID №3 | SEQ ID №4 | SEQ ID №5 | SEQ ID №6 |
| Mab 205.10.2 | SEQ ID №1 | SEQ ID №2 | SEQ ID №3 | SEQ ID №4 | SEQ ID №5 | SEQ ID №7 |
| Mab 205.10.3 | SEQ ID №1 | SEQ ID №2 | SEQ ID №3 | SEQ ID №4 | SEQ ID №5 | SEQ ID №6 |
В одном воплощении такие антитела содержат константные области человеческого происхождения, например, SEQ ID №12-16, предпочтительно SEQ ID №12-13.
Термин «антитело» включает различные формы структур антитела, в том числе, но не ограничиваясь ими, целые антитела и фрагменты антител. Антитело в соответствии с изобретением предпочтительно представляет собой человеческое антитело, гуманизированное антитело, химерное антитело или антитело, полученное путем генной инженерии, до тех пор, пока сохраняются их характерные свойства в соответствии с изобретением.
«Фрагменты антитела» включают часть антитела полной длины, предпочтительно, его вариабельную область или по меньшей мере антиген-связывающий сайт. Примеры фрагментов антитела включают двойные антитела, одноцепочечные молекулы антител и полиспецифические антитела, сформированные из фрагментов антител. Например, scFv-антитела описаны в Huston, J.S., Methods in Enzymol. 203 (1991) 46-88. Кроме того, фрагменты антител включают одноцепочечные полипептиды, имеющие характеристики домена VH, a именно возможность объединяться с доменом VL, или характеристики домена VL, связывающего HER3, а именно возможность объединяться с доменом VH для формирования функционального антиген-связывающего сайта и, таким образом, обеспечивать свойства антитела в соответствии с изобретением.
Используемые в данном документе термины «моноклональное антитело» или «композиция с монокпональным антителом» относятся к препарату молекул антитела единого аминокислотного состава.
Термин «химерное антитело» относится к моноклональному антителу, содержащему вариабельную область, т.е. связывающую область, от мыши и по меньшей мере часть константной области, полученной из другого источника или вида, как правило полученному с помощью методик рекомбинантной ДНК. Особенно предпочтительными являются химерные антитела, содержащие мышиную вариабельную область и человеческую константную область. Такие мышиные/человеческие химерные антитела являются продуктом экспрессированных генов иммуноглобулинов, содержащих сегменты ДНК, кодирующие вариабельные области мышиного иммуноглобулина, и сегменты ДНК, кодирующие константные области человеческого иммуноглобулина. Другими формами «химерных антител», охватываемыми данным изобретением, являются те, в которых класс или подкласс был модифицирован или изменен по сравнению с исходным антителом. Такие «химерные» антитела также называют «антителами с переключением класса». Способы получения химерных антител включают обычные методики рекомбинантной ДНК и генной трансфекции, в настоящее время хорошо известные в данной области. См., например, Morrison, S.L, et al., Proc. Natl. Acad Sci. USA 81 (1984) 6851-6855; патенты США 5202238 и 5204244.
Термин «гуманизированное антитело» или «гуманизированная версия антитела» относится к антителам, в которых были изменены каркасные области или «области, определяющие комплементарность» (CDR) так, чтобы они содержали CDR иммуноглобулина другой специфичности, отличной от родительского иммуноглобулина. В предпочтительном воплощении мышиный CDR из VH или VL прививают каркасной области человеческого антитела для получения «гуманизированного антитела». См., например, Riechmann, L, et al., Nature 332 (1988) 323-327; и Neuberger, M.S., et al., Nature 314 (1985) 268-270. Каркасные вариабельные области тяжелой и легкой цепей могут быть получены из одной или разных человеческих последовательностей антител. Последовательности человеческого антитела могут быть последовательностями природных человеческих антител. Каркасные вариабельные области тяжелой и легкой цепей перечислены, например, в Lefranc, M.-P., Current Protocols in Immunology (2000) - Appendix 1P A.1P.1-A.1P.37, и доступны через IMGT, международную информационную систему иммуногенетики ImMunoGeneTics® (http://imgt.cines.fr) или через сайт http://vbase.mrc-cpe.cam.ac.uk. Каркасная область может быть дополнительно модифицирована путем дальнейших мутаций. Особенно предпочтительные CDR соответствуют тем, которые представляют последовательности, распознающие антигены, отмеченные выше для химерных антител. Предпочтительно такая гуманизированная версия химеризована с человеческой константной области (см., например, последовательности SEQ ID №12-16). Термин «гуманизированное антитело», используемый в данном документе, включает также такие антитела, которые были модифицированы в константной области для создания свойств в соответствии с изобретением, особенно в отношении C1q-связывания и/или FcR-связывания, например, путем «переключения класса», т.е. путем изменения или мутации Fc-частей (например, из IgG1 в IgG4 и/или мутация IgG1/IgG4).
Термин «человеческое антитело», используемый в данном документе, включает антитела с вариабельными и константными областями, полученными из человеческих зародышевых последовательностей иммуноглобулина. Человеческие антитела хорошо известны в данной области (van Dijk, M.A., and van de Winkel, J.G., Curr. Opin. Pharmacol. 5 (2001) 368-374). Человеческие антитела могут быть также получены на трансгенных животных (например, мышах), которые способны после иммунизации продуцировать полный репертуар или выборку человеческих антител в отсутствие эндогенной продукции иммуноглобулина. Перенос совокупности человеческих зародышевых последовательностей иммуноглобулина в такую мышь, мутантную по зародышевой линии, приведет к продукции человеческих антител в ответ на антигенную стимуляцию (см., например, Jakobovits, A., et al., Proc. Natl. Acad. Sci. USA 90 (1993) 2551-2555; Jakobovits, A., et al., Nature 362 (1993) 255-258; Brueggemann, M.D., et al., Year Immunol. 7 (1993) 33-40). Человеческие антитела могут быть также получены в библиотеках фагового дисплея (Hoogenboom, H.R„ and Winter, G., J. Mol. Biol. 227 (1992) 381-388; Marks, J.D., et al., J. Mol. Biol. 222 (1991) 581-597). Методики Cole, A., et al. и Boerner, P., et al. также доступны для изготовления человеческих моноклональных антител (Cole, A., et al., Monoclonal Antibodies and Cancer Therapy, Liss, A.L, p.77 (1985); и Boerner, P., et al., J. Immunol. 147 (1991) 86-95). Как уже было упомянуто по отношению к гуманизированным антителам в соответствии с изобретением, термин «человеческое антитело», используемый в данном документе, включает также такие антитела, которые были модифицированы в константной области для создания свойств в соответствии с изобретением, особенно в отношении C1q-связывания и/или FcR-связывания, например, путем «переключения класса», т.е. путем изменения или мутации Fc-частей (например, из IgG1 в IgG4 и/или мутации IgG1/IgG4).
Термин «рекомбинантное человеческое антитело», используемый в данном документе, охватывает все человеческие антитела, которые получают, экспрессируют, создают или выделяют с помощью рекомбинантных средств, например, антитела, выделенные из клетки-хозяина, такой как клетка NSO или СНО, или животного (например, мыши), которое является трансгенным для человеческих генов иммуноглобулинов или антител, экспрессируемых с помощью рекомбинантного экспрессионного вектора, трансфицированного в клетку-хозяина. Такие рекомбинантные человеческие антитела имеют вариабельные и константные области в перегруппированной форме. Рекомбинантные человеческие антитела в соответствии с изобретением подвергали соматическому гипермутированию in vivo. Таким образом, аминокислотные последовательности областей VH и VL рекомбинантных антител являются последовательностями, которые, будучи полученными из и связанными с человеческими зародышевыми последовательностями VH и VL, не могут естественным образом существовать в репертуаре человеческих зародышевых антител in vivo.
Используемые в данном документе термины «связывающийся с человеческим HER3», или «специфически связывающийся с человеческим HER3», или «анти-HER3-антитело» являются взаимозаменяемыми и относятся к антителу, специфически связывающемуся с человеческим HER3-антигеном с аффинностью связывания, которая имеет значение KD 1×10-8 моль/л или ниже при 25°С, в одном воплощении имеет значение KD 1×10-9 моль/л или ниже при 25°С. Аффинность связывания определяют в стандартном анализе связывания при 25°С, таком как методика поверхностного плазменного резонанса (BIAcore®, GE-Healthcare, Упсала, Швеция). Способ определения значения KD аффинности связывания описан в примере 2b). Таким образом, термин «антитело, связывающееся с человеческим HER3», используемый в данном документе, относится к антителу, специфически связывающемуся с человеческим HER3-антигеном с аффинностью связывания со значением KD 1×10-8 моль/л или ниже (предпочтительно 1×10-8 моль/л - 1,0×10-12 моль/л) при 25°С.
Человеческий HER3 (ErbB-3, ERBB3, c-erbB-3, с-erbB3, тирозин-киназный рецептор erbB-3, SEQ ID №17) кодирует рецептор эпидермального фактора роста (EGFR), член семейства тирозинкиназных рецепторов, которое также включает HER1 (также известный как EGFR), HER2 и HER4 (Kraus, M.H. et al, PNAS 86 (1989) 9193-9197; Plowman, G.D. et al, PNAS 87 (1990) 4905-4909; Kraus, M.H. et al, PNAS 90 (1993) 2900-2904). Как и прототипичный рецептор эпидермального фактора роста, трансмембранный рецептор HER3 состоит из внеклеточного лиганд-связывающего домена (ECD), домена димеризации с ECD, трансмембранного домена, внутриклеточного домена тирозинкиназного белка (TKD) и C-концевого фосфорилированного домена. Этот связанный с мембраной белок имеет херегулин (HRG)-связывающий домен HER3 во внеклеточном домене, но не имеет активного киназного домена. Таким образом, он может связывать этот лиганд, но не передает сигнал внутрь клетки через фосфорилирование белка. Тем не менее, он формирует гетеродимеры с другими членами HER-семейства, которые обладают киназной активностью. Гетеродимеризация приводит к активации рецептор-опосредованного сигнального пути и трансфосфорилированию его внутриклеточного домена. Образование димеров между членами HER-семейства расширяет возможности передачи сигнала HER3 и является средством не только распределения сигнала, но и усиления сигнала. Например, гетеродимер HER2/HER3 индуцирует один из наиболее важных митогенных сигналов через путь PI3K и AKT среди членов семейства HER (Sliwkowski M.X., et at, J. Biol. Chem. 269 (1994) 14661-14665; Alimandi M, etal, Oncogene. 10 (1995) 1813-1821; Hellyer, N.J., J. Biol. Chem. 276 (2001) 42153-4261; Singer, E., J. Biol. Chem. 276 (2001) 44266-44274; Schaefer, K.L, Neoplasia 8 (2006) 613-622).
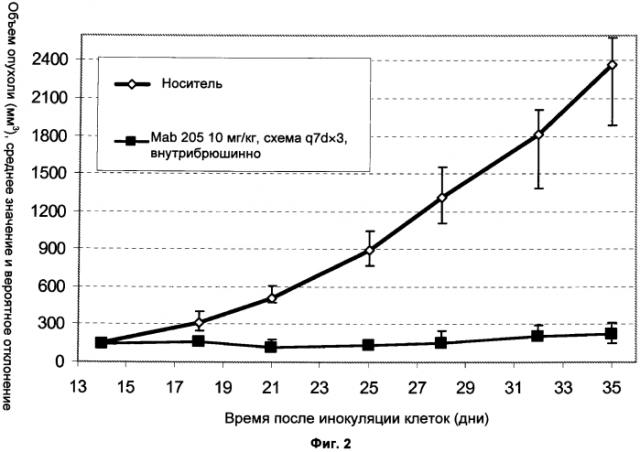
HER3-антитела Mab205.10.1, Mab205.10.2 и Mab205.10.3 показали конкурентное с лигандом херегулином (HRG) связывание с HER3.
Амплификация этого гена и/или сверхэкспрессия его белка были обнаружены при многих раковых заболеваниях, в том числе при опухолях предстательной железы, мочевого пузыря и молочной железы. Были охарактеризованы транскрипционные варианты альтернативного сплайсинга, кодирующие различные изоформы. У одной изоформы отсутствует межмембранная область, и эта изоформа секретируется за пределы клетки. Эта форма действует путем модуляции активности формы, связанной с мембраной. Также сообщалось о дополнительных вариантах сплайсинга, но они не были детально описаны.
Термин «эпитоп» включает любую полипептидную детерминанту, способную специфически связываться с антителом. В некоторых воплощениях эпитопная детерминанта включает химически активные поверхностные группировки молекул, такие как аминокислоты, сахарные боковые цепочки, фосфорил или сульфонил, а в некоторых воплощениях может иметь специфические трехмерные структурные характеристики и/или специфические характеристики заряда. Эпитоп является областью антигена, которая связывается антителом.
Термин «вариабельный домен антитела в соответствии с изобретением» (вариабельный домен легкой цепи (VL), вариабельный домен тяжелой цепи (VH)), используемый в данном документе, означает каждую пару доменов легкой и тяжелой цепей, которые непосредственно участвуют в связывании антитела с антигеном. Вариабельные домены легкой и тяжелой цепей имеют одинаковую общую структуру, и каждый домен содержит четыре каркасные области (framework region, FR), последовательности которых в значительной степени консервативны, соединенные тремя «гипервариабельными областями» (или областями, определяющими комплементарность, CDR). Каркасные области принимают конформацию β-скпадчатости, а CDR могут образовывать петли, связывающие β-складчатую структуру. CDR в каждой цепи удерживаются в их трехмерной структуре с помощью каркасных областей и образуют вместе с CDR из другой цепи антигенсвязывающий сайт. CDR3-области тяжелой и легкой цепи антитела играют особенно важную роль в специфичности связывания/аффинности антител в соответствии с изобретением и, следовательно, обеспечивают дальнейший предмет изобретения.
Термин «антигенсвязывающая часть антитела», используемый в данном документе, относится к аминокислотным остаткам антитела, которые отвечают за связывание антигена. Антигенсвязывающая часть антитела содержит аминокислотные остатки из «областей, определяющих комплементарность», или «CDR». Термин «антигенсвязывающая часть» антитела изобретения включает шесть областей, определяющих комплементарность (CDR), которые в разной степени способствуют аффинности сайта связывания с антигеном. Существует три CDR вариабельного домена тяжелой цепи домена (CDRH1, CDRH2 и CDRH3) и три CDR вариабельного домена легкой цепи (CDRL1, CDRL2 и CDRL3). Термин «CDRH1» означает CDR1-область вариабельной области тяжелой цепи, рассчитанной по Кабату. CDRH2, CDRH3, CDRL1, CDRL2 и CDRL3 означают соответствующие области тяжелой (Н) или легкой (L) цепей. Протяженность CDR и каркасных областей (FR) определяют путем сравнения с собранной базой данных аминокислотных последовательностей, в которых эти области определены в соответствии с вариабельностью среди последовательностей по Kabat, et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD. (1991)).
«Fc-часть» антитела непосредственно не участвует в связывании антитела с антигеном, но проявляет различные эффекторные функции. «Fc-часть антитела» является термином, хорошо известным специалистам в данной области, и определяется на основе расщепления антител папаином. В зависимости от аминокислотной последовательности константной области их тяжелых цепей антитела или иммуноглобулины делятся на классы: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут быть разделены на подклассы (изотипы), например, IgG1, IgG2, IgG3 и IgG4, IgA1 и IgA2. В соответствии с константными областями тяжелой цепи различные классы иммуноглобулинов называются α, δ, ε, γ и µ, соответственно. Fc-часть антитела непосредственно участвует в ADCC (антитело-зависимой клеточной цитотоксичности) и CDC (комплемент-зависимой цитотоксичности), которые основаны на активации комплемента, C1q-связывании и Fc-рецепторном связывании. Термин «комплемент-зависимая цитотоксичность (CDC)» означает процесс, начинающийся при связывании фактора комплемента C1q с Fc-частью большинства подклассов IgG-антител. Связывание C1q с антителом обусловлено определенными белок-белковыми взаимодействиями в так называемом сайте связывания. Такие сайты связывания известны в настоящее время и описаны, например, Boackle, R.J., et al., Nature 282 (1979) 742-743, Lukas, T.J., et al., J. Immunol. 127 (1981) 2555-2560, Brunhouse, R., and Cebra, J.J., Mol. Immunol. 16 (1979) 907-917, Burton, D.R., et al., Nature 288 (1980) 338-344, Thommesen, J.E., et al., Mol. Immunol. 37 (2000) 995-1004, Idusogie, E.E., et al., J. lmmunol. 164 (2000) 4178-4184, Hezareh, M., et al., J. Virology 75 (2001) 12161-12168, Morgan, A., et al., Immunology 86 (1995) 319-324, EP 0307434. Такими сайтами связывания являются, например, L234, L235, D270, N297, Е318, K320, K322, Р331 и Р329 (нумерация в соответствии с EU индексом Кабата, см. ниже). Антитела подклассов IgG1, IgG2 и IgG3 обычно демонстрируют активацию комплемента и связывание C1q и С3, в то время как IgG4 не активируют систему комплемента и не связывают C1q и С3.
В одном воплощении антитело в соответствии с изобретением содержит Fc-часть человеческого происхождения и, предпочтительно, все другие части из человеческих константных областей. Используемый в данном документе термин «Fc-часть человеческого происхождения» означает Fc-часть, которая является либо Fc-частью человеческого антитела подкласса IgG1, IgG2, IgG3 или IgG4, например, Fc-частью человеческого антитела подкласса IgG1, мутированной Fc-частью из человеческого антитела подкласса IgG1 (предпочтительно с мутацией L234A+L235A), Fc-частью человеческого антитела подкласса IgG4, либо мутированной Fc-частью человеческого подкласса IgG4 (предпочтительно с мутацией S228P). Предпочтительными являются человеческие константные области тяжелой цепи SEQ ID №13 (человеческий подкласс IgG1), SEQ ID №14 (человеческий подкласс IgG1 с мутациями L234A и L235A).
В одном воплощении антитело в соответствии с изобретением относится к человеческому антителу подкласса IgG1 или человеческому антителу подкласса IgG3. В одном воплощении антитело в соответствии с изобретением относится к человеческому антителу подкласса IgG1.
В одном воплощении антитело в соответствии с изобретением характеризуется тем, что константные цепи имеют человеческое происхождение. Такие константные цепи хорошо известны в настоящее время и описаны, например, Kabat, Е.А., (см., например, Johnson, G. and Wu, T.T., Nucleic Acids Res. 28 (2000) 214-218). Например, используемая человеческая константная область тяжелой цепи состоит из аминокислотной последовательности SEQ ID №13. Например, используемая человеческая константная область легкой цепи состоит из аминокислотной последовательности константной области легкой цепи каппа SEQ ID №12.
Термин «аминокислота», используемый в данной заявке, обозначает группу природных карбокси-α-аминокислот, включающую аланин (трехбуквенный код: ala, однобуквенный код: А), аргинин (arg, R), аспарагин (asn, N), аспарагиновую кислоту (asp, D), цистеин (cys, С), глутамин (gln, Q), глутаминовую кислоту (glu, E), глицин (gly, G), гистидин (his, Н), изолейцин (ile, I), лейцин (leu, L), лизин (lys, K), метионин (met, М), фенилаланин (phe, F), пролин (pro, Р), серин (ser, S), треонин (thr, Т), триптофан (trp, W), тирозин (tyr, Y) и валин (val, V).
Термин «нуклеиновая кислота» или «нуклеиновокислотная молекула», используемый в данном документе, включает молекулы ДНК и молекулы РНК. Нуклеиновокислотная молекула может быть одноцепочечной или двуцепочечной, но предпочтительной является двуцепочечная ДНК. Нуклеиновая кислота является «функционально связанной», когда она находится в функциональной взаимосвязи с другой нуклеиновой кислотой. Например, ДНК предпоследовательности или секреторной лидерной последовательности функционально связана с ДНК полипептида, если она экспрессируется как пребелок, который участвует в секреции полипептида; промотор или энхансер функционально связан с кодирующей последовательностью, если он влияет на транскрипцию последовательности; или сайт связывания рибосомы функционально связан с кодирующей последовательностью, если он расположен так, чтобы облегчить трансляцию. Как правило, «функционально связан» означает, что последовательности ДНК, будучи линейными, являются коллинеарными, и в случае секреторного лидера смежными и одной рамке считывания. Тем не менее, энхансеры не обязаны быть смежными. Связь осуществляется путем лигирования подходящих сайтов рестрикции. Если таких сайтов не существует, в соответствии с обычной практикой используются синтетические олигонуклеотидные адаптеры или линкеры. Используемые в данном документе выражения «клетка», «клеточная линия» и «клеточная культура» используются как синонимы, и все такие обозначения включают потомство. Таким образом, слова «трансформанты» и «трансформированные клетки» включают первичную клетку-объект и культуры, полученные из нее, независимо от количества переносов. Также понятно, что все потомство может не быть точно идентичным по содержанию ДНК из-за преднамеренных или случайных мутаций. Подразумевается вариантное потомство, которое имеет такие же функции или биологическую активность, как и у исходной трансформированной клетки.
Антитело в соответствии с изобретением предпочтительно характеризуется тем, что константные цепи имеют человеческое происхождение. Такие константные цепи хорошо известны в настоящее время и описаны, например, Kabat et al., Sequences of Proteins of Immunological Interest, 5th ed., Public Health Service, National Institutes of Health, Bethesda, MD (1991). Например, используемая константная область человеческой легкой цепи включает аминокислотную последовательность константной области легкой цепи каппа SEQ ID №12. Например, используемая константная область человеческой тяжелой цепи включает SEQ ID №13-16.
Другое воплощение изобретения представляет собой нуклеиновую кислоту, кодирующую тяжелую и легкую цепи антитела в соответствии с изобретением.
Антитела в соответствии с изобретением включают, кроме того, такие антитела, которые имеют «консервативные модификации последовательности» (вариантные антитела), модификации нуклеотидной и аминокислотной последовательностей, которые не влияют или изменяют указанные выше характеристики антитела в соответствии с изобретением. Модификации могут быть внесены с помощью стандартных методик, известных в данной области, таких как сайт-направленный мутагенез и ПЦР-опосредованный мутагенез. Консервативные аминокислотные замены включают те, при которых аминокислотный остаток заменен аминокислотным остатком с аналогичной боковой цепью. Семейства аминокислотных остатков, имеющих сходные боковые цепи, определены в данной области. Эти семейства включают аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), кислыми боковыми цепями (например, аспарагиновую кислоту, глутаминовую кислоту), незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин, триптофан), неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин), бета-разветвленными боковыми цепями (например, треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан, гистидин). Таким образом, предсказанный заменимый аминокислотный остаток в человеческом анти-HER3-антителе может быть предпочтительно заменен другим аминокислотным остатком из семейства с такой же боковой цепью. Таким образом, «вариантное» анти-HER3-антитело в данном документе относится к молекуле, аминокислотная последовательность которой отличается от аминокислотной последовательности «родительского» анти-HER3-антитела на десять, предпочтительно от двух до пяти, добавлений, удалений и/или замен в одной или более чем одной вариабельной области родительского антитела. Аминокислотные замены могут быть выполнены путем мутагенеза на основании молекулярного моделирования, как описано в Riechmann, L, et al., Nature 332 (1988) 323-327 и Queen, С., et al., Proc. Natl. Acad. Sci. USA 86 (1989) 10029-10033.
В другом аспекте анти-НЕР3-антитело в соответствии с изобретением содержит последовательность вариабельного домена тяжелой цепи (VH), имеющую по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность последовательности с аминокислотной последовательностью SEQ ID №8. В некоторых воплощениях последовательность VH, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичность, содержит замены (например, консервативные замены), вставки или удаления по сравнению с референсной последовательностью, но анти-HER3-антитело, включающее эту последовательность, сохраняет способность связываться с HER3. В некоторых воплощениях в SEQ ID №8 было заменено, вставлено и/или удалено в общей сложности от 1 до 10 аминокислот. В некоторых воплощениях замены, вставки или удаления произведены в областях за пределами CDR (т.е., в FR). Возможно, анти-HER3-антитело включает VH-последовательность SEQ ID №8, в том числе посттрансляционные модификации этой последовательности. В конкретном воплощении VH состоит из одной, двух или трех CDR, выбранных среди: (a) CDR1H, содержащей аминокислотную последовательность SEQ ID №3, (б) CDR2H, содержащей аминокислотную последовательность SEQ ID №2; и (в) CDR3H, содержащей аминокислотную последовательность SEQ ID №1.
В другом аспекте анти-HER3-антитело в соответствии с изобретением включает вариабельный домен легкой цепи (VL), имеющий по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность последовательности с аминокислотной последовательностью SEQ ID №9, SEQ ID №10 или SEQ ID №11. В некоторых воплощениях VL-последовательность, имеющая по меньшей мере 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичность, содержит замены (например, консервативные замены), вставки или удаления по сравнению с референсной последовательностью, но анти-HER-антитело, включающее эту последовательность, сохраняет способность связываться с HER. В некоторых воплощениях в SEQ ID №9, SEQ ID №10 ил SEQ ID №11 было заменено, вставлено и/или удалено в общей сложности от 1 до 10 аминокислот. В некоторых воплощениях замены, вставки или удаления произведены в областях за пределами CDR (т.е., в FR). Возможно, анти-HER3-антитело включает VL-последовательность SEQ ID №9, SEQ ID №10 или SEQ ID №11, в том числе посттрансляционные модификации этой последовательности. В конкретном воплощении VL состоит из одной, двух или трех CDR, выбранных среди: (a) CDR1L, содержащей аминокислотную последовательность SEQ ID №6 или SEQ ID №7; (б) CDR2L, содержащей аминокислотную последовательность SEQ ID №5; и (в) CDR3L, содержащей аминокислотную последовательность SEQ ID №4.
В другом аспекте предложено анти-HER3-антитело, которое содержит VH, как в любом из воплощений, приведенных выше, и VL, как в любом из воплощений, приведенных выше. В одном воплощении антитело содержит VH- и VL-последовательности SEQ ID №8 и SEQ ID №10, соответственно, в том числе посттрансляционные модификации этих последовательностей; а также обладает одним или более чем одним из следующих свойств (определяемых в анализах, описанных в примере 3 и 2):
- анти-HER3-антитело ингибирует HER3-фосфорилирование в опухолевых клетках, таких как клетки MCF7, клетки FaDu или клетки Mel-Juso (в одном воплощении анти-HER3-антитело демонстрирует ингибирование HER3-фосфорилирования в клетках MCF7 по меньшей мере на 80% (в одном воплощении по меньшей мере на 90%) в концентрации 1,0 мкг/мл; в одном воплощени