Стабилизирующий эксципиент для вакцины с инактивированными целыми вирусами
Иллюстрации
Показать всеГруппа изобретений относится к вакцинной композиции, содержащей: a) препарат инактивированных целых вирусов бешенства; b) стабилизирующий эксципиент, содержащий:
и полоксамер 188 в концентрации 0,02 г/л или 0,01 г/л, а также способу получения данной вакцинной композиции и стабилизирующему эксципиенту. Группа изобретений эффективна в стабилизации вакцин, содержащих трудно консервируемые инактивированные целые вирусы бешенства. 4 н. и 12 з.п. ф-лы, 2 ил., 16 табл., 3 пр.
Реферат
Настоящее изобретение относится к вакцинной композиции, содержащей инактивированные целые вирусы и эксципиент, стабилизирующий вакцинную композицию, причем композиция эксципиента содержит буферный раствор, смесь незаменимых и заменимых аминокислот, дисахарид, полиол, хелатообразующий агент, мочевину или производное мочевины и неионогенное поверхностно-активное вещество. Изобретение относится также к способу получения этой вакцинной композиции, а также к композиции эксципиента.
В области вирусных вакцин традиционно различают 3 типа вирусных вакцин: вакцины с живыми вирусами, вакцины с инактивированными целыми вирусами и субъединичные вирусные вакцины. Эти 3 типа вакцин различаются характеристиками, свойственными им и обусловливающими композицию эксципиентов, используемых для их консервации. Субъединичные вакцины, содержащие ограниченное количество вирусных антигенов, в общем случае легче сохранять, чем вакцины с инактивированными целыми вирусами, в которых пытаются сохранять структурную целостность вирусов, даже если они убиты, или вакцины с живыми вирусами, в которых пытаются сохранять также инфицирующую способность вирусов. Для каждого типа вирусных вакцин получали соответствующие эксципиенты. Для вирусных вакцин с различными аттенуированными вирусами стабилизирующие эксципиенты получали в зависимости от препарата аттенуированных вирусов, подлежащих консервации. В JP 57007423 описан эксципиент на основе дисахарида и полиспирта в фосфатном буферном растворе для стабилизации аттенуированного штамма вируса кори. В EP 065905 описан эксципиент, содержащий одну или несколько аминокислот, выбранных из группы одиннадцати аминокислот, лактозу и сорбит в фосфатном буферном растворе, для стабилизации аттенуированного штамма вируса лихорадки денге. Наконец, в EP 0869814 описана вакцинная композиция, содержащая аттенуированный штамм вируса ветряной оспы и стабилизирующий агент, содержащий сорбит, маннит, сахарозу, декстран, смесь аминокислот, мочевину и ЭДТА.
В области вакцин с инактивированными вирусами вакцинные композиции, готовые для введения, часто содержат белки животного происхождения, такие, как бычий или человеческий альбумин, желатин или казеин. Известны белки для улучшения консервации (стабилизации) таких вакцин, в частности, вакцин, содержащих трудно консервируемые вирусы. Вакцинные композиции, содержащие инактивированный вирус бешенства, представляют собой именно такой случай. Frazatti-Gallina и соавт. в публикации "Vaccine" (2004), vol. 23, pp. 511-517, подчеркивают важную роль белков в стабилизации антирабической вакцины, так как эксципиент содержит альбумин.
Тем не менее, присутствие белков в вакцинах, помимо того, что они могут представлять собой потенциальный риск передачи болезней, если их происхождение контролируется нестрого, может представлять собой также потенциальный риск аллергии, который пытаются избегать, в частности, в случае, когда вакцины содержат сывороточные белки, такие, как альбумин или производные альбумина.
Таким образом, существует потребность в стабилизирующем эксципиенте, композиция которого не содержит белок, для стабилизации вирусных вакцин с инактивированными целыми вирусами, в частности, для стабилизации вакцин, содержащих трудно консервируемые инактивированные целые вирусы, такие, как вирус бешенства.
Существует также потребность в стабилизирующем эксципиенте, который является приемлемым также для стабилизации вакцин с низким содержанием инактивированных вирусов, то есть вакцин, содержащих малое количество общего белка в эффективной дозе вакцины. Эта потребность еще более важна для высокоочищенных вакцин, имеющих очень малое содержание остаточных белковых примесей. Остаточные белковые примеси, даже если они представляют собой потенциальный риск аллергии, могут способствовать в некоторой мере стабилизации вакцин с низким содержанием инактивированных вирусов. Они могут препятствовать явлениям агрегации, структурной деградации или адсорбции вируса, которые могут снижать эффективность вакцины.
С этой целью настоящее изобретение относится к вакцинной композиции, содержащей:
a) препарат инактивированных целых вирусов;
b) стабилизирующий эксципиент, содержащий:
i. буферный раствор;
ii. смесь незаменимых и заменимых аминокислот;
iii. дисахарид;
iv. полиол;
v. хелатообразующий агент;
vi. мочевину или производное мочевины;
vii. неионогенное поверхностно-активное вещество.
Инактивированный целый вирус предпочтительно представляет собой вирус бешенства.
Согласно варианту настоящего изобретения вакцинная композиция не содержит также никакого сывороточного белка.
Согласно другому варианту вакцинная композиция не содержит также никакого экзогенного белка животного происхождения и предпочтительно не содержит никакого экзогенного вещества животного происхождения.
В еще одном варианте белки вируса составляют по меньшей мере 70% общего белка, содержащегося в вакцинной композиции.
Согласно еще одному варианту концентрация общего белка в вакцинной композиции ≤100 мкг/мл и предпочтительно ≤80 мкг/мл.
В предпочтительном варианте количество общего белка, содержащегося в эффективной дозе вакцинной композиции, ≤100 мкг.
В другом предпочтительном варианте количество общего белка, содержащегося в эффективной дозе вакцинной композиции, находится в интервале от 1 до 50 мкг.
В другом варианте настоящего изобретения стабилизирующий эксципиент не содержит никакого белка или никакого белка и никакого пептида или предпочтительно не содержит никакого белка, никакого пептида и никакого олигопептида.
Согласно другому варианту смесь незаменимых и заменимых аминокислот, содержащаяся в вакцинной композиции, включает в себя по меньшей мере аргинин или соль аргинина и глутаминовую кислоту или соль глутаминовой кислоты.
Согласно предпочтительному варианту количество незаменимых и заменимых аминокислот, содержащихся в эффективной дозе вакцинной композиции, находится в интервале от 0,5 до 2,5 мг.
Согласно другому варианту дисахарид, содержащийся в эксципиенте, представляет собой мальтозу.
Согласно еще одному варианту полиол, содержащийся в вакцинной композиции, представляет собой сорбит.
Согласно предпочтительному варианту общее количество дисахарида и полиола, содержащихся в эффективной дозе вакцинной композиции, находится в интервале от 10 до 50 мг.
В другом варианте хелатообразующий агент, содержащийся в вакцинной композиции, представляет собой ЭДТА или соль ЭДТА.
Согласно предпочтительному варианту количество хелатообразующего агента, содержащегося в эффективной дозе вакцинной композиции, находится в интервале от 0,01 до 0,1 мг.
Согласно другому предпочтительному варианту количество мочевины или производного мочевины, содержащееся в эффективной дозе вакцинной композиции, находится в интервале от 0,3 до 1,5 мг.
В другом варианте неионогенное поверхностно-активное вещество, содержащееся в вакцинной композиции, представляет собой полоксамер.
Полоксамер предпочтительно представляет собой полоксамер 188.
Согласно предпочтительному варианту количество неионогенного поверхностно-активного вещества, содержащегося в эффективной дозе вакцинной композиции, находится в интервале от 0,001 до 0,5 мг.
Согласно другому варианту значение pH вакцинной композиции находится в интервале от 7,0 до 10,0 и предпочтительно в интервале от 7,0 до 9,0.
В другом варианте буферный раствор, содержащийся в вакцинной композиции, представляет собой фосфатный буферный раствор, буферный раствор Tris, буферный раствор HEPES или их смесь.
В предпочтительном варианте буферный раствор представляет собой фосфатный буферный раствор, молярность которого находится в интервале от 10 до 100 мМ.
Настоящее изобретение относится также к способу получения вакцинной композиции, содержащей препарат очищенных и инактивированных целых вирусов, по которому:
a. получают препарат целых вирусов, собирая надосадочную жидкость культуры клеток, инфицированных вирусом;
b. очищают и инактивируют препарат целых вирусов или альтернативно инактивируют и очищают препарат целых вирусов;
c. разбавляют препарат очищенных и инактивированных целых вирусов стабилизирующим эксципиентом, композиция которого содержит:
i. буферный раствор;
ii. смесь незаменимых и заменимых аминокислот;
iii. дисахарид;
iv. полиол;
v. хелатообразующий агент;
vi. мочевину или производное мочевины;
vii. неионогенное поверхностно-активное вещество.
Согласно предпочтительному варианту способ по настоящему изобретению осуществляют без введения экзогенного вещества животного происхождения.
В предпочтительном варианте осуществления способа по настоящему изобретению вирус представляет собой вирус бешенства.
В другом варианте способ по настоящему изобретению после разбавления препарата очищенных и инактивированных целых вирусов включает в себя стадию распределения полученной таким образом вакцинной композиции по упаковочным единицам и при необходимости стадию лиофилизации вакцинной композиции.
Настоящее изобретение относится также к вакцинной композиции, содержащей препарат очищенных и инактивированных целых вирусов, в лиофилизованной форме, полученной согласно одному из вариантов осуществления способа по настоящему изобретению.
Настоящее изобретение относится также к стабилизирующему эксципиенту для вакцины с инактивированными целыми вирусами, композиция которого содержит:
i. буферный раствор;
ii. смесь незаменимых и заменимых аминокислот;
iii. дисахарид;
iv. полиол;
v. хелатообразующий агент;
vi. мочевину или производное мочевины;
vii. неионогенное поверхностно-активное вещество.
Композиция стабилизирующего эксципиента предпочтительно также не содержит никакого белка или никакого белка и никакого пептида или предпочтительно не содержит никакого белка, никакого пептида и никакого олигопептида.
Более предпочтительно композиция стабилизирующего эксципиента не содержит также никакого вещества животного происхождения.
Подробное описание изобретения
Вакцинная композиция по настоящему изобретению содержит инактивированные целые вирусы (или препарат инактивированных целых вирусов) и стабилизирующий эксципиент, композиция которого содержит буферный раствор, смесь незаменимых и заменимых аминокислот, дисахарид, полиол, хелатообразующий агент, мочевину или производное мочевины и неионогенное поверхностно-активное вещество. Композиция эксципиента с положительным эффектом заменяет эксципиенты предшествующего уровня техники, содержащие в своем составе белок. Особый интерес состоит в том, что она стабилизирует трудно консервируемые вакцинные композиции и наиболее предпочтительно вакцинные композиции, содержащие вирус бешенства в качестве целого инактивированного вируса, без необходимости прибавлять белок.
Вакцинная композиция по настоящему изобретению стабильна одновременно в жидком виде, в виде замороженной жидкости или в виде лиофилизата, что предоставляет очень большую гибкость при применении.
Стабилизирующий эксципиент по настоящему изобретению предохраняет биологическую активность вакцинной композиции во времени независимо от того, находится ли она в замороженной, жидкой или лиофилизованной форме. Температура хранения замороженных вакцинных композиций в общем случае ≤-35°C; она составляет от +2°C до +8°C для композиций в жидком виде и приблизительно +5°C для композиций в лиофилизованном виде. Преимущественно эксципиент предохраняет также биологическую активность и физическую целостность вирусов в вакцинных композициях, хранящихся в неблагоприятных условиях, например, при хранении вакцинных композиций в жидком виде при +37°C или в случае, когда вакцинные композиции подвергают последовательности размораживаний и замораживаний.
Биологическую активность вируса в вакцинной композиции оценивают, определяя в зависимости от времени количество конститутивного иммуногена вируса, являющегося существенным для индуцирования защитного иммунитета против вируса и/или испытывая его эффективность в испытании на официально признанной модели с животным. В случае вакцинной композиции, содержащей инактивированный вирус бешенства, стабильность вакцинной композиции оценивают, определяя в зависимости от времени (или в ходе последовательных размораживаний) титр вируса, который оценивают на основании измерения концентрации гликопротеина G в неденатурированной форме и/или испытывая эффективность вакцинной композиции в официальном тесте NIH. Для оценки содержания гликопротеина G можно использовать способ ELISA типа "сэндвич", при котором распознают по меньшей мере один и предпочтительно два конформационных эпитопа гликопротеина G соответственно описанию в примере 1. При использовании способа ELISA, при котором распознают два конформационных эпитопа белка G, в качестве антитела-ловушки традиционно используют нейтрализующее вирус бешенства антитело, которое распознает конформационный эпитоп, локализованный на антигенном сайте II гликопротеина G, (Journal of Clinical investigation (1989), vol. 84, p. 971-975), а в качестве антитела-проявителя используют нейтрализующее антитело, которое распознает конформационный эпитоп, локализованный на антигенном сайте III белка G (Biologicals (2003), vol. 31, p. 9-16). Результаты выражают в международных единицах, поскольку в качестве сравнительного образца традиционно используют эталон, откалиброванный относительно международного стандартного образца NIBSC. Также можно использовать технологию BIAcore, считающуюся интересной альтернативой способу ELISA и основанную на использовании поверхностного плазмонного резонанса для количественного определения титра вируса.
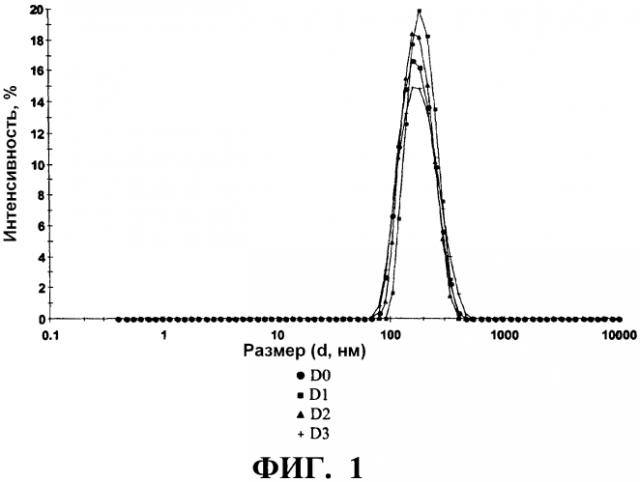
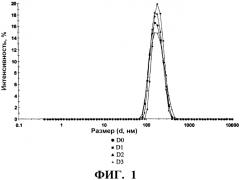
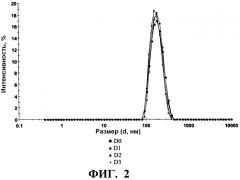
Стабилизирующий эксципиент по настоящему изобретению действует также в отношении сохранения физической целостности вирусных частиц. В частности, он препятствует образованию агрегатов и/или деградации структуры вирусных частиц с течением времени. Это свойство может быть проверено посредством прибора, такого, как Zetasizer Nano ZS (Malvern instrument), который позволяет детектировать агрегаты и выявлять профиль распределения размеров вирусных частиц в вакцинной композиции.
Вирус или препарат вируса находится в форме целых вирусных частиц, инактивированных в общем случае химической обработкой формалином, формальдегидом или β-пропиолактоном. Также могут быть использованы другие способы инактивации, такие, как способ, описанный в WO 2005/093049. Принципиально используемые препараты инактивированных целых вирусов содержат вирусы с оболочками, хотя они часто более трудно поддаются консервации и требуют использования специфических композиций эксципиентов для обеспечения их консервации. В частности, речь идет о препаратах инактивированных целых вирусов японского энцефалита. Препараты инактивированных целых вирусов более предпочтительно содержат вирус бешенства.
Препараты вирусов происходят из образцов, которые в общем случае представляют собой отбираемые фракции надосадочных жидкостей культур клеток, инфицированных вирусом. Для получения исходного материала клеток и инфицирования клеток можно использовать традиционные среды, содержащие сыворотку животного происхождения. Среды, используемые для культивирования и инфицирования клеток, предпочтительно не содержат сывороточный белок и также вещества животного происхождения. Белки, которые при необходимости содержатся в таких средах, в общем случае представляют собой низкомолекулярные белки (≤10 кД) или скорее пептиды в очень низких концентрациях, что соответственно уменьшает риски аллергии. Именно такие среды представляют собой, например, среды, реализуемые под названиями VP SFM (InVitrogen), Opti Pro™ serum-free (InVitrogen), Episerf (InVitrogen), Ex-cell® MDCK (Sigma-Aldrich), Ex-Cell™ Vero (SAFC biosciences), MP-BHK® serum free (MP Biomedicals), SFC-10 BHK express serum free (Promo cell), SFC-20 BHK express protein free (Promo cell), HyQ PF Vero (Hyclone, позиция по каталогу SH30352.02), Hyclone SFM4 Megavir, среда MDSS2 (Axcell biotechnology), модифицированная среда DMEM Iscove (Hyclone), питательные среды Ham (Ham-F10, Ham-F12), среда Лейбовица L-15 (Hyclone). Например, образцы вирусов бешенства получают исходя из исходного материала клеток Vero, которые были получены и затем инфицированы при использовании сред для культивирования и вирусного инфицирования, предпочтительно не содержащих никакого сывороточного белка, никакого белка животного происхождения и также никакого вещества животного происхождения, таких, как среда VP SFM.
Препарат целых и инактивированных вирусов, содержащийся в вакцинной композиции по настоящему изобретению, хорошо очищают. Традиционно сначала очищают и затем инактивируют или наоборот сначала инактивируют и затем очищают вирус, происходящий от образцов. В случае, когда все стадии продуцирования и очистки вируса осуществляют без использования сывороточного белка, без использования экзогенного белка животного происхождения или также без использования экзогенного вещества животного происхождения, вакцинная композиция по настоящему изобретению предпочтительно не содержит никакого сывороточного белка для максимального уменьшения рисков аллергии и не содержит никакого экзогенного белка животного происхождения или также никакого вещества животного происхождения для максимального уменьшения рисков передачи болезней. Под выражением "белок или вещество животного происхождения" понимают белок или вещество, способ получения которого включает в себя по меньшей мере одну стадию, на которой используют материал, происходящий от животного или человека. Под выражением "экзогенный белок или экзогенное вещество" понимают белок или вещество, вводимое на одной из стадий способа продуцирования и/или очистки вируса. Например, белки или вещества, содержащиеся при необходимости в композиции сред для культивирования, ферменты, такие, как трипсин или бензоназа, используемые на стадиях продуцирования и/или очистки вируса, представляют собой экзогенные белки или вещества. Экзогенные белки или вещества имеют животное происхождения, если их способ получения включает в себя по меньшей мере одну стадию, на которой используют материал, происходящий от животного или человека. Экзогенные белки или вещества имеют неживотное происхождение в том случае, когда они изготовлены иными способами, например, при использовании растительного материала, материала, полученного химическим синтезом или генетической рекомбинацией при использовании дрожжей, бактерий или растений. Белки или вещества, происходящие от клеток, исходя из которых получают вирусы для получения вакцинной композиции по настоящему изобретению, напротив, представляют собой эндогенные белки или вещества, поскольку они продуцируются (или высвобождаются) в то же самое время, что и вирус.
В рамках настоящего изобретения предпочтительно можно использовать особо эффективные способы очистки, которые позволяют получать очень чистые вирусные препараты. В качестве примера можно упомянуть способ очистки вирусов, включающий в себя последовательное осуществление анионообменной хроматографии, катионообменной хроматографии и аффинной хроматографии, основанной на образовании хелатов металлов, и описанный в WO 97/06243. Для очистки и инактивации вируса бешенства исходя из надосадочной жидкости культуры инфицированных клеток наилучший способ представляет собой способ, описанный в заявке на патент, поданной во Франции 14 апреля 2009 года под номером 0952310, и включающий стадию катионообменной хроматографии на подложке, содержащей полиметакрилатную матрицу, к которой привиты сульфоизобутильные группы, стадию обработки бензоназой, стадию ультрацентрифугирования с градиентом сахарозы и стадию инактивации β-пропиолактоном. Полученные препараты целых и инактивированных вирусов бешенства являются особенно чистыми, но более трудно поддаются консервации (стабилизации), поскольку содержат очень малое количество остаточных белковых примесей. Это затруднение возрастает по мере уменьшения количества вирусов в вакцинной композиции.
Благодаря композиции эксципиента вакцинная композиция по настоящему изобретению остается стабильной даже в случае, когда концентрация общего белка ≤100 мкг/мл, ≤80 мкг/мл, ≤50 мкг/мл или даже ≤20 мкг/мл. В общем случае белки вируса составляют по меньшей мере 70% общего белка, предпочтительно по меньшей мере 80% общего белка и более предпочтительно по меньшей мере 90% общего белка, содержащегося в вакцинной композиции по настоящему изобретению. В эффективной дозе вакцины упомянутые концентрации традиционно соответствуют количеству общего белка ≤100 мкг или ≤50 мкг, или даже ≤20 мкг. Например, остаточное количество ДНК составляет <100 пг и предпочтительно <50 пг на эффективную дозу вакцины. Под выражением "эффективная доза вакцины (или эффективная доза вакцинной композиции)" понимают количество инактивированных вирусов, содержащихся в дозе, необходимой для индуцирования защитного иммунитета у человека или животного после введения в зависимости от пути и методики иммунизации, рекомендованных для первичной или повторной вакцинации. В случае вакцинации против вируса бешенства эффективность антирабической вакцины определяют в официальном испытании, принятом ВОЗ, а именно в тесте NIH (описан в статье ВОЗ "Бешенство" (WHO Technical Series Report 941, январь 2007 года)). Доза инактивированной антирабической вакцины является эффективной, если согласно данному тесту она содержит по меньшей мере 2,5 МЕ. Внутримышечное введение такой дозы человеку по традиционно рекомендуемым методикам вакцинации или серовакцинации индуцирует развитие защитного иммунитета против бешенства.
"Общий белок" соответствует количеству всех белков, содержащихся в вакцинной композиции. Он представлен вирусными белками, остаточными белками, которые не были удалены во время очистки, такими, как клеточные белки, белки сред для культивирования клеток и вирусного инфицирования, и белками, которые при необходимости были введены в процессе очистки (например, бензоназа в случае очистки упомянутого ранее вируса бешенства). В общем случае для количественного определения общего белка используют способ Брэдфорда. Для количественного определения доли вирусных белков в общем белке осуществляют электрофорез образца вакцинной композиции на полиакриламидном геле в денатурирующих и восстановительных условиях с последующим проявлением синим кумасси и денситометрическим анализом электрофоретического профиля. В случае вакцинной композиции, содержащей инактивированные целые вирусы бешенства, вирусные белки, представленные оболочечным гликопротеином G, нуклеопротеином N, фосфопротеином P, матричным белком M и РНК РНК-зависимой полимеразы L, легко идентифицируются при электрофорезе на полиакриламидном геле. Количество общего белка, содержащегося в эффективной дозе вакцинной композиции по настоящему изобретению, в общем случае находится в интервале от 1 до 50 мкг и предпочтительно в интервале от 2 до 20 мкг. Более предпочтительно по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85% или даже по меньшей мере 90% общего белка составляют вирусные белки. Эксципиент по настоящему изобретению является особенно предпочтительным, поскольку он стабилизирует трудно консервируемые вакцинные композиции, такие, как вакцинные композиции, которые содержат инактивированные целые вирусы бешенства и в которых в эффективной дозе вакцины содержатся:
- вирусные белки в количестве, составляющем по меньшей мере 70% общего белка, и/или
- менее 100 мкг общего белка, причем наиболее часто количество общего белка находится в интервале от 1 до 50 мкг и предпочтительно в интервале от 2 до 20 мкг.
Композиция эксципиента по настоящему изобретению предпочтительно не содержит никакого белка, никакого пептида и также никакого олигопептида и в общем случае не содержит вещества животного происхождения для максимального уменьшения проблем биологической и/или аллергической безопасности, которые могут быть связаны с их применением.
В контексте настоящего изобретения выражение "стабилизирующий эксципиент не содержит никакого белка" следует понимать как выражение, означающее стабилизирующий эксципиент, композиция которого не содержит никаких биологических макромолекул, имеющих цепи из более 50 аминокислот, связанных между собой посредством пептидных связей. Выражение "стабилизирующий эксципиент не содержит никакого белка и никакого пептида" следует понимать как выражение, означающее стабилизирующий эксципиент, композиция которого не содержит никаких биологических макромолекул, имеющих цепи из более 20 аминокислот, связанных между собой посредством пептидных связей. Выражение "стабилизирующий эксципиент не содержит никакого белка, никакого пептида и никакого олигопептида" следует понимать как выражение, означающее стабилизирующий эксципиент, композиция которого не содержит никаких биологических молекул, включающие в себя аминокислоты, связанные между собой одной или несколькими пептидными связями. Например, дипептид, содержащий две аминокислоты, связанные между собой только одной пептидной связью, исключен из композиции стабилизирующего эксципиента, не содержащего никакого белка, никакого пептида и никакого олигопептида, но может входить в композицию стабилизирующего эксципиента, не содержащего никакого белка и никакого пептида.
Смесь аминокислот, входящих в композицию эксципиента, содержит по меньшей мере одну незаменимую аминокислоту из группы незаменимых аминокислот, представляющих собой цистин, тирозин, аргинин, гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин, и по меньшей мере одну заменимую аминокислоту из группы заменимых аминокислот, представляющих собой аспарагиновую кислоту, глутаминовую кислоту, аланин, аспарагин, глутамин, глицин, пролин и серин. Аминокислоты, обладающие кислотной функциональной группой, могут находиться в виде кислот или солей. Аналогичным образом данное положение относится к аминокислотам с основным характером.
Эксципиент по настоящему изобретению предпочтительно содержит по меньшей мере аргинин или соль аргинина, такую, как гидрохлорид аргинина, и глутаминовую кислоту или соль глутаминовой кислоты, такую, как глутамат натрия. Как результат, смесь аминокислот предпочтительно содержит от 1 до 12 незаменимых аминокислот, в число которых входит по меньшей мере аргинин или его соль, и от 1 до 8 заменимых аминокислот, в число которых входит по меньшей мере глутаминовая кислота или ее соль. Общая концентрация аминокислот в вакцинной композиции в общем случае ≤20 г/л и наиболее часто находится в интервале от 2 до 10 г/л. В эффективной дозе вакцинной композиции по настоящему изобретению упомянутые концентрации соответствуют общему количеству незаменимых и заменимых аминокислот ≤5 мг, предпочтительно в интервале от 0,5 до 2,5 мг и более предпочтительно в интервале от 0,8 до 1,8 мг. Соотношение между количеством аргинина (в виде гидрохлорида) и общим количеством аминокислот, содержащихся в эксципиенте, в общем случае больше 0,5, в то время как соотношение между количеством глутаминовой кислоты (в виде глутамата натрия) и общим количеством аминокислот, содержащихся в эксципиенте, меньше 0,5.
Эксципиент по настоящему изобретению содержит также дисахарид. Дисахариды, полученные из исходного материала животного происхождения, такого, как молоко, исключаются. В качестве дисахарида, приемлемого для цели настоящего изобретения, можно упомянуть сахарозу, мальтозу или трегалозу, но предпочтительно используют мальтозу индивидуально или в комбинации с другим дисахаридом, таким, как сахароза. Полиол, который также включен в композицию эксципиента, представляет собой полиол неживотного происхождения. Предпочтительно речь идет о шестиатомном спирте, таком, как сорбит и/или маннит. Предпочтительно используют сорбит, поскольку маннит обладает тем недостатком, что он кристаллизуется в случае, когда вакцинная композиция по настоящему изобретению находится в лиофилизованной форме. Общая концентрация дисахарида и полиола в вакцинной композиции в общем случае находится в интервале от 30 до 100 г/л. Эксципиент по настоящему изобретению предпочтительно содержит мальтозу и сорбит. В эффективной дозе вакцинной композиции упомянутые концентрации традиционно соответствуют количеству в интервале от 10 до 50 мг и предпочтительно в интервале от 20 до 25 мг. Количество мальтозы в общем случае составляет по меньшей мере 70% общего количества мальтозы и сорбита.
Хелатообразующий агент является также одним из компонентов эксципиента по настоящему изобретению. Предпочтительно речь идет о ЭДТА (этилендиаминтетрауксусная кислота) или о ее соли (Na+, K+ и т.п.). Концентрация ЭДТА или соли ЭДТА в вакцинной композиции в общем случае находится в интервале от 0,02 до 0,5 г/л и предпочтительно в интервале от 0,02 до 0,2 г/л. В эффективной дозе вакцинной композиции упомянутые концентрации традиционно соответствуют количеству в интервале от 0,01 до 0,1 мг, предпочтительно в интервале от 0,01 и 0,05 мг и более предпочтительно в интервале от 0,01 до 0,04 мг ЭДТА или соли ЭДТА.
Мочевина или производное мочевины, такое, как аллилмочевина, ацетамид, метилкарбамат или бутилкарбамат, также входят в композицию эксципиента. Предпочтительно вакцинная композиция содержит мочевину с концентрацией в общем случае в интервале от 1 до 10 г/л и предпочтительно с концентрацией в интервале от 1 до 5 г/л. В эффективной дозе вакцинной композиции упомянутые концентрации традиционно соответствуют количеству в интервале от 0,3 до 3 мг, предпочтительно в интервале от 0,3 до 1,5 мг и более предпочтительно в интервале от 0,4 до 1,2 мг мочевины.
Эксципиент по настоящему изобретению содержит также неионогенное поверхностно-активное вещество, способствующее стабилизации вакцинной композиции. Вне зависимости от привязки к теории оно способствует сохранению биологической активности вирусов и сохранению физической целостности вирусных частиц, препятствуя образованию агрегатов или деградации структуры вирусов. Оно может также противодействовать адсорбции вирусов на стенках упаковки, в частности, в случае, когда стенки выполнены из стекла или пластмассы. Неионогенное поверхностно-активное вещество, приемлемое для цели настоящего изобретения, получают из исходного материала неживотного происхождения, при этом оно совместимо в фармацевтическом отношении с введением парентеральным путем. В качестве класса неионогенных поверхностно-активных веществ, предпочтительно приемлемых для цели настоящего изобретения, можно упомянуть полоксамеры, которые представляют собой этиленоксидные и пропиленоксидные "блок-сополимеры", имеющие химическую формулу HO(C2H4O)a(C3H6O)b(C2H4O)aH, где a означает число этиленоксидных звеньев, а b означает число пропиленоксидных звеньев. Полоксамеры имеют молекулярную массу в общем случае в интервале от 1000 до 16000 дальтон. Полоксамеры, представляющие особый интерес, имеют молекулярную массу в интервале от 5000 до 15500 дальтон. Полоксамеры коммерчески реализуются, в частности, под торговым названием Pluronic®, среди которых pluronic® F68 или полоксамер 188, который при комнатной температуре представляет собой полоксамер в виде твердого вещества и молекулярная масса полиоксипропиленовой части которого составляет приблизительно 1750 дальтон, а полиоксиэтиленовая часть которого составляет приблизительно 80% общей массы молекулы. Среди полоксамеров предпочтительно можно рекомендовать полоксамер 188 (pluronic® F68). При необходимости можно использовать сложный эфир сорбитана, в частности, сложный полиоксиэтиленированный эфир сорбитана, реализуемый под коммерческим названием Tween®, такой, как tween® 20 (сорбитанполиоксиэтилен(20)монолаурат или полисорбат 20) или tween® 80 (сорбитанполиоксиэтилен(20)моноолеат или полисорбат 80). Неионогенное поверхностно-активное вещество, приемлемое для цели настоящего изобретения, используют в очень низкой концентрации, предохраняющей структуру и размер инактивированных вирусных частиц, который должен оставаться подобным размеру живых вирусов. При очень высокой концентрации поверхностно-активное вещество может разрушать или изменять структуру вирусных частиц, в частности, структуру вирусов с оболочками, что может влиять на иммуногенность вакцинной композиции. При использовании в качестве поверхностно-активного вещества pluronic® F68 общая концентрация в вакцинной композиции ≤1 г/л и в общем случае находится в интервале от 0,005 до 1 г/л и более предпочтительно в интервале от 0,01 до 0,1 г/л. В данном диапазоне концентраций полоксамер 188 не оказывает адъювантного действия на иммунную систему. В эффективной дозе вакцинной композиции упомянутые концентрации традиционно соответствуют количеству в интервале от 0,001 до 0,5 мг и предпочтительно в интервале от 0,003 до 0,3 мг. Наиболее предпочтительно вакцинная композиция содержит полоксамер 188 или при необходимости смесь полоксамера 188 и полисорбата 20.
Буферный раствор эксципиента по настоящему изобретению выбирают так, чтобы значение pH вакцинной композиции находилось в интервале от 7,0 до 10,0 и предпочтительно в интервале от 7,0 до 9,0 и более предпочтительно в интервале от 7,3 до 8,3. Именно в данном диапазоне значений pH физическая термостабильность частиц инактивированных вирусов, в частности, термостабильность частиц вирусов бешенства максимальна. Изучение фазовой диаграммы показывает, что препарат вирусов бешенства необходимо нагревать до температуры по меньшей мере 60°C, чтобы наблюдать агрегацию частиц вирусов бешенства в случае, когда значение pH находится в интервале от 7,3 до 8,3, тогда как при pH <6,0 наблюдается значительная агрегация при комнатной температуре. Буферный раствор традиционно представляет собой фосфатный буферный раствор, буферный раствор Tris или буферный раствор HEPES или их смесь. Их концентрация в общем случае находится в интервале от 10 до 100 мМ. Композиция эксципиента предпочтительно содержит фосфатный буферный раствор, молярность которого традиционно находится в интервале от 10 до 100 мМ, или смесь фосфатного буферного раствора и буферного раствора Tris.
Более предпочтительная вакцинная композиция по настоящему изобретению содержит:
препарат целых и инактивированных вирусов бешенства и стабилизирующий эксципиент, содержащий:
фосфатный буферный раствор;
смесь незаменимых и заменимых аминокислот, включающая в себя по меньшей мере аргинин или соль аргинина и глутаминовую кислоту или соль глутаминовой кислоты;
мальтозу;
сорбит;
ЭДТА или соль ЭДТА;
мочевину;
полоксамер 188;
причем значение pH вакцинной композиции находится в интервале от 7,3 до 8,3.
В эту вакцинную композицию при необходимости может быть введен Tween 20 в качестве дополнительного неионогенного поверхностно-активного вещества. Эта вакцинная композиция предпочтительно не содержит никакого сывороточного белка и никакого экзогенного вещества животного происхождения и в общем случае содержит высокоочищенный препарат вирусов бешенства. Концентрация полоксамера 188 в вакцинной композиции <1 г/л и более предпочтительно находится в интервале от 0,01 до 0,1 г/л. Молярность фосфатного буферного раствора в общем случае находится в интервале от 10 до 100 мМ. Аргинин и глутаминовая кислота или их соответствующие соли представляют собой очень важные компоненты смеси аминокислот, поскольку в общем случае по массе они составляют по меньшей мере 2/3 общего количества незаменимых и заменимых аминокислот. Смесь незаменимых и заменимых аминокислот обычно содержится с концентрацией в интервале от 2 до 10 г/л, общая концентрация мальтозы и сорбита традиционно находится в интервале от 50 до 100 г/л, концентрация ЭДТА или соли ЭДТА традиционно находится в интервале от 0,02 до 0,2 г/л, а мочевина традиционно содержится с концентрацией в интервале от 1 до 5 г/л. Концентрация общего белка в вакцинной композиции традиционно находится в интервале от 5 до 50 мкг/мл. В эффективной дозе антирабической вакцины упомянутые концентр