Способ профилактики вредных эффектов общетоксического и генотоксического действия наночастиц оксида меди на организм
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к профилактике вредных эффектов токсического и генотоксического действия наночастиц оксида меди на организм. Способ заключается в том, что лицам, относящимся к группе риска, назначают комплекс биологически активных препаратов, включающий глютаминовую кислоту, глицин, цистеин, пектиновый энтеросорбент, препарат рыбьего жира, богатый неэстерифицированными жирными кислотами класса омега-3, а также поливитаминно-полиминеральный комплекс, содержащий такие биомикроэлементы, как молибден, марганец, цинк и железо, причем лица группы риска принимают препараты комплекса повторными курсами 1-2 раза в год в течение 4-6-недель ежедневно в дозах, обеспечивающих получение в день 300 мг глицина, 600 мг цистеина, 4 г глутаминовой кислоты, 25 мл рыбьего жира с 12-15%-ным содержанием неэстерифицированных жирных кислот класса омега-3, 4-5 г пектина, а также микроэлементы и витамины в дозах, обеспечивающих нормальные физиологические потребности организма. Изобретение обеспечивает эффективное снижение субхронической системной токсичности и генотоксичности при пероральном назначении предложенной комбинации препаратов биопротектора. 8 ил., 5 табл.
Реферат
Изобретение относится к медицине, в частности к нанотоксикологии, точнее токсикологии наночастиц, и может быть использовано для снижения общетоксического и генотоксического эффектов действия наночастиц оксида меди на организм в группах риска, охватывающих лиц, которые подвергаются воздействию этого вещества в производственных условиях.
Наряду с производством и применением искусственных медных нанопорошков при плавке и разливке меди и медных сплавов нанометровые частицы оксида меди загрязняют воздух в составе образующихся при этих процессах и воздействующих на рабочих аэрозолей конденсации. Это является причиной изучения токсических эффектов этого нановещества и поиска способов снижения его общетоксического и генотоксического действия на организм.
Опубликованы работы, в которых различными тестами и на различных биологических объектах демонстрируется высокое цитотоксическое, системно-токсическое и генотоксическое действие медьсодержащих (преимущественно, медно-оксидных) наночастиц, например (Bondarenko О, Ivask A, Käkinen A, Kahru A. Sub-toxic effects of CuO nanoparticles on bacteria: Kinetics, role of Cu ions and possible mechanisms of action. Environ Pollut (2012) 169: 81-89) [1]; (Magaye R, Zhao J, Bowman L, Ding M. Genotoxicity and carcinogenicity of cobalt-, nickel- and copper-based nanoparticles. Exp Ther Med (2012) 4: 551-561) [2]. Однако примеров испытания средств биологической защиты от вредных эффектов воздействия наночастиц оксида меди на организм информационный поиск не обнаружил.
С практических позиций профилактической токсикологии и оценки рисков для здоровья, обусловленных воздействием наночастиц, существенно, что системная токсичность (в том числе поражение печени, почек и головного мозга), а также генотоксичность наночастиц оксида меди «ин виво», позволяющая прогнозировать его канцерогенность, показаны при относительно низком уровне экспозиции (Privalova LI, Katsnelson BA, Loginova NV, Gurvich VB, Shur VY, Valamina IE, et al. Subchronic Toxicity of Copper Oxide Nanoparticles and Its Attenuation with the Help of a Combination of Bioprotectors. Int J Mol Sci (2014) 15: 12379-12406. doi:10.3390/ijms150712379) [3]·
Поэтому задачей изобретения является создание способа защиты, основанного на повышении устойчивости организма как к общетоксическому, так и к генотоксическому эффектам действия наночастиц оксида меди.
Разработан способ профилактики вредных эффектов общетоксического и генотоксического действия наночастиц оксида меди на организм. Он заключается в том, что лицам, относящимся к группе риска этого действия, назначают комплекс биологически активных препаратов, включающий глютаминовую кислоту, глицин, цистеин, пектиновый энтеросорбент, препарат рыбьего жира, богатый неэстерифицированными жирными кислотами класса омега-3, а также поливитаминно-полиминеральный комплекс, содержащий такие биомикроэлементы, как молибден, марганец, цинк и железо, причем лица группы риска принимают препараты комплекса повторными курсами 1-2 раза в год в течение 4-6-недель ежедневно в дозах, обеспечивающих получение в день 300 мг глицина, 600 мг цистеина, 4 г глутаминовой кислоты, 25 мл рыбьего жира с 12-15%-ным содержанием неэстерифицированных жирных кислот класса омега-3, 4-5 г пектина, а также микроэлементы и витамины в дозах, обеспечивающих нормальные физиологические потребности организма.
Входящие в комплекс аминокислоты, а именно глютамат, глицин и цистеин, как предшественники биосинтеза восстановленного глютатиона, который является системным протектором от оксидативного и свободно-радикального повреждения, притом что глютамат является еще и мощным стабилизатором клеточных мембран. Пектиновый энтеросорбент в заявленном комплексе предназначен для блокирования кишечной абсорбции ионов меди, образующихся при растворении наночастиц оксида меди, перенесенных в желудочно-кишечный тракт после отложения в дыхательных путях, а также реабсорбции ионов меди, выделенной печенью с желчью. Заявленный комплекс содержит также препарат рыбьего жира, богатый неэстерифицированными жирными кислотами класса омега-3, внутриклеточными производными которых являются эйкозаноиды, активирующие репликацию ДНК, тем самым играя важную роль в репарации ее повреждений. Поливитаминно-полиминеральный комплекс, используемый в заявленном способе, содержит такие биомикроэлементы, как молибден, марганец, цинк и железо, выполняющие функцию антагонистов меди в живом организме. То, что лица группы риска принимают препараты комплекса повторными курсами 1-2 раза в год в течение 4-6-недель ежедневно в дозах, обеспечивающих получение в день 300 мг глицина, 600 мг цистеина, 4 г глутаминовой кислоты, 25 мл рыбьего жира с 12-15%-ным содержанием неэстерифицированных жирных кислот класса омега-3, 4-5 г пектина, биомикроэлементы - молибден, марганец, цинк, железо, а также витамины в дозах, обеспечивающих нормальные физиологические потребности организма, обосновано пересчетом содержания перечисленных активных факторов (биопротекторов) в биопрофилактическом комплексе (БПК), защитная эффективность которого доказана в эксперименте, проведенном на лабораторных белых крысах, причем пересчет в дозы для человеческого применения осуществлен на основе соотношения уровней основного обмена крысы и человека с учетом также справочных и литературных данных о суточной потребности человека в этих факторах. При этом дозы биомикроэлементов - молибдена, марганца, цинка, железа, а также витаминов обусловлены нормальными физиологическими потребностями организма, включая компенсацию микроэлементного дисбаланса, возникающего при действии меди.
Механизмы защитного действия входящих в комплекс биопротекторов сложны и, по-видимому, взаимно потенцируют друг друга. Важное значение могут иметь: (а) разное по молекулярным механизмам противорадикальное (в том числе антиоксидантное) действие, в той или иной степени присущее ряду биопротекторов заявляемого комплекса (антиоксидантный синергизм); (б) мембрано-стабилизирующее действие глютамата, поскольку оно может препятствовать повреждению митохондрий наночастицами оксида меди и тем самым - оксидативному стрессу, являющемуся по современным представлениям одним из основных механизмов цитотоксического и генотоксического действия металлических наночастиц (например, Fröhlich, E. Cellular targets and mechanisms in the cytotoxic action of non-biodegradable engineered nanoparticles. J. Curr. Drug. Metab. 2013, 14, 976-988) [4]); (в) микроэлементный, физиологический и токсикологический антагонизм некоторых металлов (молибден, цинк, железо, марганец) по отношению к меди.
Характерной особенностью заявленного способа является комплексное использование всех вышеперечисленных механизмов. Впервые показано, что на фоне перорального назначения предложенной комбинации препаратов биопротектора субхроническая системная токсичность и генотоксичность наночастиц оксида меди могут быть существенно ослаблены. В результате поиска по источникам научно-технической и патентной литературы не выявлены средства, направленные на решение такой задачи. Новый технический результат, достигаемый заявленным изобретением, заключается в снижении вредных эффектов токсического и генотоксического действия наночастиц оксида меди на организм.
Заявленный способ экспериментально опробован на белых аутбредных крысах-самках с начальным весом тела 150-220 г. Животные содержались в условиях специально организованного вивария, соответствующих ветеринарным требованиям. В питье они получали артезианскую воду, доочищенную до первой категории качества, в пищу - полнорационный комбикорм ООО «Лабораторкорм». Суспензия (коллоидный раствор) наночастиц оксида меди изготавливалась методом лазерной абляции чистого (99,99%) металла в деионизированной воде с помощью лазерной системы для обработки материалов Fmark-20 RL (ЦЛТ, Россия). Характеристика распределения размеров наночастиц давалась их прямым измерением при сканирующей электронной микроскопии и методом динамического рассеяния света с помощью анализатора Zetasizer Nano ZS (Malvern Instruments, UK). Средний диаметр частиц (±σ) составлял 20±10 нм и сохранялся стабильным на протяжении недели после приготовления. Тем не менее, для каждого введения животным использовались свежеприготовленные суспензии. Элементный состав наночастиц определялся методом рентгеновского энергодисперсионного анализа, проведенного с помощью сканирующего электронного микроскопа Auriga CrossBeam (Carl Zeiss, Германия), оснащенного рентгеновским детектором X-Max (Oxford, Великобритания). В составе полученных наночастиц атомное соотношение Cu:O было найдено близким к 1:1. Это же соотношение получено при аналогичном анализе химического состава наночастиц, отобранных на поликарбнатный фильтр из воздуха на рабочем месте разливщика чистой (катодной) меди, что подтверждает адекватность использованной экспериментальной модели.
Водные суспензии наночастиц с концентрацией 0,5 мг/мл вводили крысам внутрибрюшинно в дозе 10 мг/кг массы тела по 3 раза в неделю. Контрольным животным аналогичным образом вводили соответствующей объем той же стерильной деионизированной воды, на которой готовились суспензии. Каждой крысе всего осуществлено по 19 введений. Отдельные группы животных получали те же инъекции на фоне перорального приема биопрофилактического комплекса. Введение наночастиц оксида меди или воды и умерщвление животных разных групп проводились параллельно.
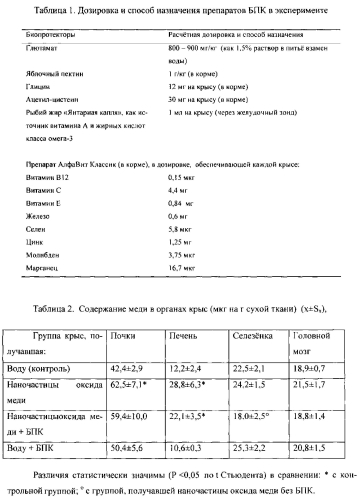
Крысам давали глютаминовую кислоту в форме натриевой соли в виде 1,5% раствора в неограниченное питье вместо воды. Яблочный пектин производства «Промавтоматика» (Белгород, Россия) давали в качестве добавки в корм в количестве, соответствующем средней потребляемой дозе приблизительно 1000 мг/кг веса тела. Глицин, цистеин (в более доступной и метаболически активной форме ацетилцестеина) использовались в таблетках, которые измельчали и добавляли к другой порции корма в расчете на среднюю потребляемую дозу в соответствии с рекомендуемыми потребностями организма крысы. В качестве препарата рыбьего жира, богатого неэстерифицированными жирными кислотами класса омега-3, использовали препарат «Янтарная капля», который давали внутрижелудочно через зонд, а в качестве поливитаминно-полиминерального препарата, служащего источником биомикроэлементов - антагонистов меди, таких как молибден, марганец, цинк и железо, а также других микроэлементов и витаминов в дозах, обеспечивающих нормальные физиологические потребности организма в них, использовали препарат «АлфаВит Классик», содержащий 10 микроэлементов и 13 витаминов. Препарат «АлфаВит Классик» использовали в таблетках, которые измельчали и добавляли к другой порции корма в расчете на среднюю потребляемую дозу в соответствии с рекомендуемыми потребностями организма крысы. В таблице 1 приведена расчетная дозировка препаратов и способы их назначения.
Состояние организма крыс во всех группах оценивалось по большому числу (свыше 40) общепризнанных функциональных, биохимических и морфологических (с морфометрией) критериев токсического действия. Для оценки генотоксического действия наночастиц оксида меди «ин виво» использовали ПДАФ анализ (ПДАФ - полиморфизм длин амплифицированных фрагментов ДНК).
Эта методика позволяет количественно определить степень фрагментации ДНК, как показатель генотоксичности оцениваемых повреждающих агентов и эффекта воздействия исследованного комплекса биопротекторов.
Основой метода является то, что в отличие от фрагментированной ДНК, образующей при электрофорезе в агарозном геле так называемый «хвост кометы», не фрагментированная ДНК имеет крайне низкую степень миграции и остается практически на месте («ядро кометы»), причем степень миграции прямо пропорциональна степени фрагментации ДНК. Для характеристики степени повреждения ДНК использовали «коэффициент фрагментации», то есть отношение суммарной радиоактивности всех фракций «хвоста» к радиоактивности «ядра».
В таблице 2 приведено содержание меди в органах крыс в мкг на г сухой ткани. Данные таблицы 2 демонстрируют снижение под влиянием БПК задержки меди в организме крыс, подвергавшихся воздействию наночастиц оксида меди (однозначное во всех исследованных органах, в том числе статистически значимое - в селезенке).
В таблице 3 приведены те функциональные показатели состояния организма, по которым при действии наночастиц оксида меди были выявлены неблагоприятные сдвиги по сравнению с контрольными величинами, причем на фоне действия БПК эти сдвиги были по ряду показателей ослаблены и ни по одному не усилены.
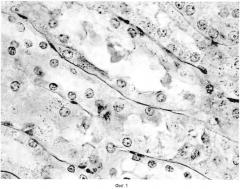
Гистологическое изучение тканей печени, почек, селезенки и головного мозга, сочетавшееся с морфометрией, выявило у крыс, подвергавшихся субхроническому воздействию наночастиц оксида меди, ряд выраженных патологических изменений, существенно ослабленных при том же воздействии на фоне приема БПК. Некоторые примеры, иллюстрирующие это, приводятся в таблице 4 и на фиг. 1, где изображена почка крысы после субхронического воздействия наночастиц оксида меди. Видны выраженные дегенеративные некробиотические изменения клеток канальцевого эпителия, частичное разрушение щеточной каемки, мелкие гранулы пигмента в клетках и в просвете канальцев (окраска ШИК увеличение ×40).
На фиг. 2 представлена диаграмма, обозначающая число клеток Купфера на 100 клеток печени крыс, получавших повторные в/б инъекции (A) воды (контроль), (B) суспензии наночастиц оксида меди, (C) суспензии наночастиц оксида меди на фоне приема БПК, (D) воды на фоне приема БПК (средние показатели и 95% ДИ). Различия статистически значимы между (B) и (A), между (C) и (B) (P<0,05 по t Стьюдента).
Согласно данным таблицы 2, функциональные признаки гемолитической анемии, видные из таблицы 4, соответствуют выраженному гемосидерозу селезенки, значимо ослабленному на фоне приема БПК. На фиг. 3 виден гемосидерин в красной пульпе селезенки крыс, получавших повторные в/б инъекции воды (контроль); на фиг. 4 - гемосидерин в красной пульпе селезенки крыс, получавших суспензии наночастиц оксида меди; на фиг. 5 - гемосидерин в красной пульпе селезенки крыс, получавших суспензии наночастиц оксида меди на фоне приема БПК (окраска по Перлу, увеличение ×60).
На фиг. 6 представлена диаграмма, обозначающая число микроагрегатов коричневого пигмента (гемосидерина) на квадрат сетки Автандилова в красной пульпе селезенки крыс, получавших повторные в/б инъекции (A) воды (контроль), (B) суспензии наночастиц оксида меди, (C) суспензии наночастиц оксида меди на фоне приема БПК, (D) воды на фоне приема БПК (средние показатели и 95% ДИ). Различия статистически значимы между (B) и (A), между (C) и (B) (P<0,05 по t Стьюдента).
На фиг. 7 изображен головной мозг крысы после субхронического воздействия наночастиц оксида меди (окраска гематоксилином и эозином, увеличение ×400). Ядра нейронов слабо прокрашены с нечеткой мембраной (стрелка 1); ядрышки пикнотичны (стрелка 2), часто отсутствуют (стрелка 3) или смещены в сторону ядерной мембраны (стрелка 4).
Эти специфичные для медной интоксикации повреждения нейронов базальных ядер головного мозга также существенно ослаблены на фоне приема БПК, что подтверждается диаграммой, представленной на фиг. 8, обозначающей число клеток с исчезнувшим ядрышком на 100 нейронов Гольджи в области хвостатого ядра головного мозга крыс, получавших повторные в/б инъекции (A) воды (контроль), (B) суспензии наночастиц оксида меди, (C) суспензии наночастиц оксида меди на фоне приема БПК, (D) воды на фоне приема БПК (средние показатели и 95% ДИ). Различия статистически значимы между (B) и (A), между (C) и (B) (P<0,05 по t Стьюдента).
Таблица 5 иллюстрирует влияние БПК и/или наночастиц оксида меди на коэффициент фрагментации геномной ДНК (ПДАФ-тест) в клетках различных органов (x±Sx). Из данных таблицы 5 следует, что на фоне приема БПК оказалась значимо ослабленной фрагментация ДНК клеток печени, селезенки и головного мозга, вызываемая субхронической интоксикацией крыс наночастицами оксида меди, то есть ослаблен ее генотоксический эффект.
Сопоставление полученных данных с литературными свидетельствует о том, что впервые в субхроническом токсикологическом эксперименте на целостном организме убедительно продемонстрированы: нефротоксичность наночастиц оксида меди и вызываемый этим веществом симптомо-комплекс, специфичный для болезней, связанных с избыточным накоплением меди (повреждение печени и головного мозга, гемолитическая анемия), а также полиорганная генотоксичность. При этом показано, что при использовании заявленного способа все эти вредные эффекты ослаблены или даже полностью предупреждены.
Способ профилактики вредных эффектов общетоксического и генотоксического действия наночастиц оксида меди на организм, заключающийся в том, что лицам, относящимся к группе риска этого действия, назначают комплекс биологически активных препаратов, включающий глютаминовую кислоту, глицин, цистеин, пектиновый энтеросорбент, препарат рыбьего жира, богатый неэстерифицированными жирными кислотами класса омега-3, а также поливитаминно-полиминеральный комплекс, содержащий такие биомикроэлементы, как молибден, марганец, цинк и железо, причем лица группы риска принимают препараты комплекса повторными курсами 1-2 раза в год в течение 4-6-недель ежедневно в дозах, обеспечивающих получение в день 300 мг глицина, 600 мг цистеина, 4 г глутаминовой кислоты, 25 мл рыбьего жира с 12-15%-ным содержанием неэстерифицированных жирных кислот класса омега-3, 4-5 г пектина, а также микроэлементы и витамины в дозах, обеспечивающих нормальные физиологические потребности организма.