Способ комплексной терапии преинвазивного и инвазивного рака шейки матки
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к онкогинекологии, и может быть использовано для комплексной терапии преинвазивного и инвазивного рака шейки матки. Для этого после хирургическое удаления опухоли на шейке матки вводят иммунокоррегирующий индуктора на основе пептида Аллоферон-1. При этом в качестве лекарственного препарата на основе пептида Аллоферон-1 используют инъекции препарата «Аллокин-альфа» лиофилизат для приготовления раствора для подкожного введения. Препарат вводят одним курсом из шести инъекций с интервалом в один день между инъекциями. Использование данного способа позволяет на послеоперационном этапе лечения инвазивного рака шейки матки проводить иммунокоррегирующую терапию препаратом «Аллокин-альфа», обеспечивая повышение результативности и эффективности комплексной терапии. При этом маркерами эффективности и адекватности комплексного лечения будут экспрессия CD3, CD4, CD8, CD4+CD25+, CD95+ и активность каспаз в лимфоцитах периферической крови. 9 табл., 8 ил.
Реферат
Изобретение относится к медицине, а именно к способам иммунокоррегирующей терапии на послеоперационном этапе лечения инвазивного рака шейки матки, и может быть использовано в гинекологии и онкологии для повышения результативности и эффективности комплексной терапии преинвазивного и инвазивного рака шейки матки.
Термины, используемые в настоящем описании
Цитокины - это гормоноподобные молекулы белково-пептидной природы, которые продуцируются клетками организма. Цитокины осуществляют короткодистантную регуляцию межклеточных и межсистемных взаимодействий, определяют выживаемость клеток, стимуляцию или ингибирование их роста, а также дифференцировку, функциональную активацию и апоптоз клеток.
Интерфероны - гликопротеины, представители группы цитокинов. В зависимости от происхождения и, соответственно, строения молекулы интерфероны человека делятся на 3 основных типа: IFNα, продуцентами которого преимущественно являются макрофаги и В-клетки; IFNβ, продуцируемый фибробластами, и IFNγ, который синтезируют главным образом активированные Т-лимфоциты и натуральные киллеры. Молекулярная масса интерферонов варьирует в пределах от 17-45 кДа у IFNα и IFNβ и от 20 до 80 кДа у IFNγ. Считается, что IFNα и IFNβ обладают преимущественно антивирусной, а IFNγ - иммуномодулирующей активностью.
Интерлейкины - это большая группа цитокинов, синтезируемых в основном Т-лимфоцитами, но в некоторых случаях также натуральными киллерами или другими тканевыми клетками. Интерлейкины обладают разнообразными функциями, но большинство их стимулирует другие клетки для лечения или дифференцировки, при этом каждый из них действует на отдельную, ограниченную группу клеток, экспрессирующих специфичные для данного интерлейкина рецепторы. Это растворимые пептиды, сильные иммунорегуляторы локального действия; активируют Т-клетки.
Натуральные (естественные) киллеры (НК) - это лимфоциты, участвующие в системе врожденного иммунитета. НК были открыты по своей способности убивать клетки опухолей, откуда и получили свое название. Основной функцией активированных НК является распознавание и уничтожение собственных клеток организма, в которых имеются нарушения - опухолевые клетки и клетки, инфицированные патогеном. НК обладают характерной морфологией: основная часть обильной цитоплазмы содержит несколько митохондрий, свободные рибосомы с отдельными элементами шероховатого эндоплазматического ретикулума, аппарат Гольджи и характерные электроноплотные гранулы, связанные с мембраной. На поверхности НК находится множество рецепторов для активации самих клеток с помощью цитокинов, а также для распознавания лигандов на поверхности опухолевых и инфицированных клеток.
Вирус папилломы человека (ВПЧ) - инфекция, вызывающая рак шейки матки за счет развития цервикальных интраэпителиальных неоплазий, причиной которых является нарушение контроля пролиферации клетки. Усиление пролиферации инфицированных ВПЧ супрабазальных клеток цервикального эпителия сопровождается экспрессией вирусных онкогенов - белков Е6 и Е7. Способность к неограниченно долгому персистированию в организме больного обусловлена особенностями жизненной стратегии этих вирусов, основанной на блокировании механизмов врожденного и адаптивного антивирусного иммунитета. Риск злокачественного перерождения связан с несколькими типами папилломавирусной инфекции. Их обозначают как вирусы высокого риска онкогенного риска. Это типы 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 и 68. К вирусам низкого риска относят 5 типов - 6, 11, 42, 43, 44.
Способ комплексной терапии преинвазивного и инвазивного рака шейки матки - сочетание хирургического метода и иммунокоррегирующего лечения.
Согласно статистическим данным WHO/ICO (http://www.who.int/hpvcentre) рак шейки матки (РШМ) - второе по встречаемости онкологическое заболевание среди женщин и является одной из главных причин смертности женщин, страдающих онкологическими заболеваниями. Согласно статистическим отчетам Всемирной организации здравоохранения каждый год РШМ диагностируется более чем у 500 тыс. женщин (в России - более чем у 14 тыс.) [Мерабишвили В.М., и соавт., 2012; Мерабишвили В.М., Лалианци Э.И., Субботина О.Ю. Рак шейки матки: заболеваемость, смертность (популяционное исследование) // Вопросы онкологии. 2012, Т.58. №1. С.41-44].
При этом около 40% на момент выявления, имеют III-IY стадии, а смертность в течение первого года с момента установления диагноза РШМ достигает 19,5% [Чиссов В.И. и соавт., 2012; Чиссов В.И. Злокачественные новообразования в России в 2010 году (заболеваемость и смертность) / Под ред. В.И. Чиссова, В.В. Старинского, Г.В. Петровой. М.: ФГУ «МНИОИ им. П.А. Герцена Росмедтехнологий», 2012. 260 с. Давыдов М.И. и соавт., 2011; Давыдов М.И. Заболеваемость злокачественными новообразованиями населения России и стран СНГ в 2009 г. / М.И. Давыдов, Е.М. Аксель // Вестник РОНЦ им. Н.Н. Блохина РАМН. 2011. Т.22. №3, прил.1. С.54-92]. Следует отметить, что меры вторичной профилактики приводят к снижению смертности от РШМ за счет увеличения частоты выявления ранних, доклинических форм рака (преинвазивного и инвазивного РШМ). Однако используемые подходы к терапии РШМ недостаточно эффективны из-за ограниченности методов в отношении точности постановки диагноза, возможности прогнозирования лечения заболевания.
Исследователи считают, что в подавляющем большинстве случаев при развитии РШМ именно иммунная система формирует эффективный противовирусный/противоопухолевый ответ, при этом признана ведущая роль Т-хелперов и регуляторных Т-клеток [Айбину О.А. Молекулярный патогенез цервикального рака // Биология и Терапия рака. - 2011. - Т11. - №3. - Стр.295-306].
Одним из механизмов супрессорного воздействия опухоли на иммунитет является индукция апоптоза иммунокомпетентных клеток [Джагер Р., Звака P.M. Энигматическая роль каспазы в развитии опухоли // Рак. - 2010. - Разд.2. - №4. - Стр.1952-1979].
Поэтому анализ текущего иммунного статуса женщин с преинвазивным и инвазивным РШМ может помочь в выборе тактики лечения, а также характеризовать результат и эффективность терапии.
Апоптоз, или программируемая клеточная гибель, - это процесс, направленный на предотвращение передачи дефектного наследственного материала дочерним клеткам и контролирование их численности. Поэтому компоненты апоптотического пути функционально являются онкосупрессорами. Существует большое разнообразие факторов и рецепторов, индуцирующих реакции апоптоза в клетке, однако все сигнальные пути, так или иначе, конвергируют на общих эффекторных молекулах - каспазах.
Каспазы - это семейство внутриклеточных цистеиновых эндопептидаз, продуцируемых на конститутивном уровне и в случае поступления соответствующего сигнала активирующихся по каскадному принципу. Активация каспаз осуществляется по двум механизмам: 1) олигомеризация на специальных «молекулярных платформах»; 2) ограниченный протеолиз. Первый способ активации характерен для т.н. инициаторных каспаз, к которым относятся каспазы-2, -8, -9 и -10. Инициаторные каспазы способны воспринимать вне- или внутриклеточные сигналы и активировать соответственно «внешний» или «внутренний» путь апоптоза. «Внешний» путь, как правило, начинается с активации рецептора клеточной смерти: взаимодействие внеклеточного домена рецептора с лигандом приводит к конформационным изменениям его цитоплазматического домена, вокруг которого далее осуществляется сборка макромолекулярного сигнального комплекса (DISC). DISC-комплекс служит «платформой» для сборки и активации мультимеров каспазы-8 или -10. В случае «внутреннего» пути апоптоза такими молекулярными «платформами» являются т.н. апоптосома и PIDD-комплекс, в составе которых происходит активация каспаз-9 и -2 соответственно. Сборка этих комплексов инициируется в ответ на метаболический стресс, нарушение целостности мембран митохондрий или на возникновение нерепарируемых повреждений ДНК. Активированные инициаторные каспазы осуществляют процессинг эффекторных каспаз-3, -6 и -7, мишенями которых являются многочисленные структурные, регуляторные и каталитические белки.
Развитие злокачественного процесса всегда сопровождается подавлением функций каспаз. В инфицированных клетках значительно снижается мембранная экспрессия основного рецептора клеточной смерти CD95/Fas, нарушается сборка DISC-комплекса в результате усиленной деградации адапторного белка FADD, также происходит деградация каспазы-8 и эндогенных активаторов митохондриального пути апоптоза Bid, Bad и Bax (антагонистов Bcl-2) [Ду Дж. Чен Г.Г., Влантис А.С., et al. Устойчивость к апоптозу вируса папилломы человека 16-инфицированных гортанных раковых клеток, ассоциирующихся с пониженным бензалкония хлоридом или повышенным выражением Б-клетки // Раковые письма. - 2004. - Т.205. - №1. - Стр.81-88. Кабш К., Алонсо А. Вирус папилломы человека типа 16 Е5 вызывает TRAIL- и FasL-опосредованный апоптоз в клетках HaCaT с помощью разных механизмов // Журнал о вирусологии. - 2002. - Т.76. - №23. - Стр.12162-12172. Тунгтеаккхун С.С, Филиппова М., Фодор Н. и др. Полна изоформа папилломавируса человека 16 Е6 и его сплайс-варианта Е6*, связанного с разными местами на доменах прокаспазы 8 // Журнал о вирусологии. - 2010. - Т.84. - №3. - Стр.1453-1463].
Инактивация каспаз в опухолевых клетках происходит в результате гиперэкспрессии их ингибиторов или вследствие подавления экспрессии вышестоящих компонентов сигнального пути апоптоза [Филченков А., Завелевич М., Крощак Т. Дж. и др. Каспазы и рак: механизмы инактивации и новые способы лечения // Экспериментальная онкология. - 2004. - Т.26. - №2. - Стр.82-97].
В настоящее время препаратов, избирательно воздействующих на ВПЧ, не существует. Наиболее часто для лечения ВПЧ-инфекции используются интерфероны (ИФН). Они представляют собой семейство белков, которые вырабатываются клетками иммунной системы в ответ на стимуляцию вирусными антигенами, митогенами. Чаще используется рекомбинантный препарат а-ИФН, имеющий разные торговые названия: «Этферон» (Egis), «Велферон» (Wellcome), «Реаферон», «Интераль» (Россия), «Реальдирон» (Литва) и др. [Серебряная, 2005; Серебряная Н.Б. Иммунные дисфункции при герпесвирусной инфекции: новые подходы к терапии / Н.Б. Серебряная // Медицинская иммунология. 2005. Т.7. №2-3. С.321-322]. Но в 60% случаев даже длительная ИФН-терапия не приводит к клиническому улучшению. Показано, что эффективность лечения напрямую зависит от уровня синтеза онкобелка Е7. Было установлено, что белок Е7 нейтрализует противовирусную активность а-ИФН за счет того, что избирательно блокирует большинство генов, индуцируемых ИФН. Кроме того, Е7 внутриклеточно инактивирует IRF (фактор регуляции ИФН), который включает транскрипцию генов, кодирующих синтез противовирусных белков. Это говорит о том, что белок Е7 не только выполняет функции основного фактора малигнизации, но и определяет устойчивость клеток к ИФН-терапии. Поэтому перед ИФН-терапией целесообразно определять уровень онкобелка Е7. Его высокие значения могут свидетельствовать о нецелесообразности применения ИФН на первом этапе лечения ВПЧ-зависимой патологии шейки матки.
В 1999 году группой ученых (Черныш С.И., Ким Су Ин, Веккер Г.П., Махалдиани П., Хоффманн Ж., Вюле Ф., Патент РФ №2172322) были выделены противовирусные пептиды из насекомых с общим названием Аллофероны. Затем на основе пептида Аллоферон-1 был разработан лекарственный препарат «Аллокин-альфа» лиофилизат для приготовления раствора для подкожного введения. Аллоферон-1 индуцирует синтез эндогенных интерферонов и является селективным специфическим стимулятором функциональной активности натуральных киллеров (НК), что связано с непосредственным усилением цитотоксической активности этих клеток, а не с увеличением их количества [Черныш С.И., Ким С.И., Беккер Г. и др. Противовирусные и противораковые пептиды, полученные из насекомых // Доклады Национальной академии наук США. - 2002. - Т.9, - №.20. - Стр.12628-12632, Черныш С.И. Аллокины (цитокиноподобные пептиды насекомых) как модуляторы иммунного ответа человека и других млекопитающих // Russian Journal of Immunology. - 2004. - Vol.9. - S.1. - P.36]. НК узнают определенные структуры высокомолекулярных гликопротеинов, которые экспрессируются на мембране инфицированных вирусом клеток. НК не являются антигенспецифическими клетками, вызывают независимый от антител и комплемента лизис клеток-мишеней, распознают свои клетки-мишени без участия антигенов гистосовместимости и относятся к факторам естественной резистентности. Клетка реагирует на стимулы, к которым есть рецепторы на мембране. У них есть рецепторы для цитокинов (IL-2, 4, 10, 12, IFN-gamma), для антигенов МНС-1, CD16 (Fc-gammaRIIIA), что ведет к литическому эффекту клетки с помощью инициации процессов апоптоза [Хирата Дж., Коган и Дж., Аояма М., Кашивамура С., Уеда X., Курода И., Усами М., Окамура X., Марукава С. Роль IL-18 в апоптозе нейтрофила человека. Шок. 2008 Дек; 30(6):628-331.
Известен способ лечения папилломавирусных инфекций, реализуемый через индукцию интерлейкина-18. Для этого в качестве индуктора используют лекарственные препараты на основе пептида аллоферона с применением механического удаления папилломных образований любого типа. В качестве индуктора используют инъекции препарата «Аллокин-альфа лиофилизат для приготовления раствора для подкожного введения», курсом из 3 инъекций с интервалом 1 день между инъекциями, причем курс может повторяться. В качестве индуктора используют суппозитории на основе аллоферона. В качестве индуктора используют мази, содержащие аллоферон. В способе эффективное лечение достигается за счет стимуляции врожденного иммунитета через индукцию интерлейкина-18 (Патент РФ №2482866, МПК A61K 38/03, A61P 31/22, 27.05.2013 г. - прототип).
Недостатком известного способа является то обстоятельство, что в нем рассматривается только снижение титра папилломавирусной инфекции до полной ее элиминации в отличие от данного способа, где речь не только о снижении вирусной нагрузки, но прежде всего о коррекции молекулярно-генетических и иммунологических нарушений у больных раком шейки матки на послеоперационном периоде.
Технической задачей, на решение которой направлено заявляемое изобретение, является создание нового способа иммунокоррегирующей терапии на послеоперационном этапе лечения инвазивного рака шейки матки, обеспечивающего повышение результативности и эффективности комплексной терапии.
Поставленная техническая задача достигается тем, что согласно предложенному изобретению, в способе комплексной терапии преинвазивного и инвазивного рака после хирургического удаления опухоли на шейке матки в качестве иммунокоррегирующего индуктора используют лекарственные препараты на основе пептида Аллоферон-1.
Кроме того, в качестве лекарственного препарата на основе пептида Аллоферон-1 используют инъекции препарата «Аллокин-альфа лиофилизат для приготовления раствора для подкожного введения», по меньшей мере, одним курсом из шести инъекций по 1 мг с интервалом в один день между инъекциями.
Кроме того, в качестве индуктора используют вагинальные и ректальные суппозитории на основе пептида Аллоферон-1.
Кроме того, в качестве индуктора используют гели, крема и мази на основе пептида Аллоферон-1.
Технический результат, достижение которого обеспечивается реализацией всех существенных признаков заявляемого изобретения, состоит в повышении результативности и эффективности комплексной терапии преинвазивного и инвазивного рака шейки матки.
Препарат «Аллокин-альфа» с действующим веществом Аллоферон-1, выбранный в качестве послеоперационного индуктора, позитивно влияет на снижение вирусной нагрузки (71,9%) у больных с CIN2-3/CIS шейки матки [Короленкова Л.И. Снижение вирусной нагрузки, определенной методом гибридного захвата (НС2 DNA HPV HR), у больных тяжелыми интраэнителиальными неоплазиями шейки матки как результат эффективной предэксцизионной терапии аллокином-альфа // Акушерство и гинекология. 2012. №4-2. С.78-82].
Благодаря этим свойствам использование «Аллокин-альфа» в послеоперационном периоде в заявляемом способе используется в качестве среде для иммунотерапии и профилактики развития рецидива папилломавирусной инфекции, что и повышает эффективность комплексной терапии.
Сущность изобретения поясняется рисунками, где
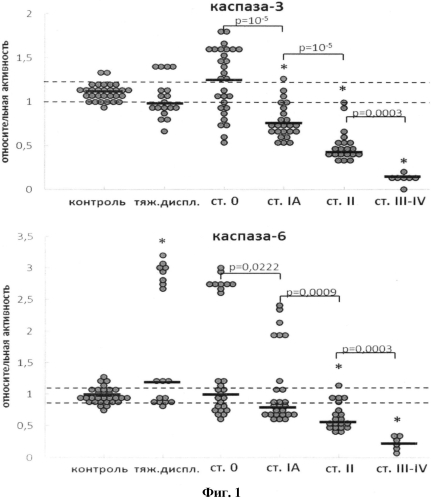
На фиг.1 представлено изменение относительной активности каспаз-3, - 6 в клетках цервикального эпителия при развитии РШМ. Пунктирными линиями (здесь и далее) обозначены стандартные отклонения для группы контроля, жирными линиями - медианное значение активности в группе. Относительную активность каспаз вычисляли как ΔS/Δt, где ΔS - изменение интенсивности флуоресценции (оптической плотности) (отн. ед.) за промежуток времени Δt (мин). Для удобства полученную величину умножали на 104. Оценка статистической достоверности изменений активности каспаз проводилась в соответствии с критерием Уилкоксона-Манна-Уитни; n=30 (морфологически нормальный эпителий, «контроль»), n=18 (тяжелая дисплазия), n=26 (РШМ ст.0), n=24 (РШМ IA), n=20 (РШМ II), n=6 (РШМ III-IV). Символом «*» маркированы группы (РШМ), в которых активность каспаз достоверно отличается от контроля (p<0,05). На диаграммах приведены значения p, полученные при сравнении последовательных стадий РШМ.
На фиг.2 представлено изменение относительной активности каспаз-9 в клетках цервикального эпителия при развитии РШМ. Пунктирными линиями (здесь и далее) обозначены стандартные отклонения для группы контроля, жирными линиями - медианное значение активности в группе. Относительную активность каспаз вычисляли как ΔS/Δt, где ΔS - изменение интенсивности флуоресценции (оптической плотности) (отн. ед.) за промежуток времени Δt (мин). Для удобства полученную величину умножали на 104. Оценка статистической достоверности изменений активности каспаз проводилась в соответствии с критерием Уилкоксона-Манна-Уитни; n=30 (морфологически нормальный эпителий, «контроль»), n=18 (тяжелая дисплазия), n=26 (РШМ ст.0), n=24 (РШМ IA), n=20 (РШМ II), n=6 (РШМ III-IV). Символом «*» маркированы группы (РШМ), в которых активность каспаз достоверно отличается от контроля (p<0,05). На диаграммах приведены значения p, полученные при сравнении последовательных стадий РШМ.
На фиг.3 Изменение относительной активности каспаз-8 и -6 в МНПК при развитии РШМ. Пунктирными линиями обозначены стандартные отклонения для группы контроля, жирными линиями - медианное значение активности в группе. Относительную активность каспаз вычисляли как ΔS/Δt, где ΔS - изменение интенсивности флуоресценции (оптической плотности) (отн. ед.) за промежуток времени Δt (мин). Для удобства полученную величину умножали на 104. Оценка статистической достоверности изменений активности каспаз проводилась в соответствии с критерием Уилкоксона-Манна-Уитни; n=30 (группа контроля), n=21 (тяжелая дисплазия), n=32 (РШМ ст.0), n=30 (РШМ ст.IA), n=21 (РШМ ст.II), n=14 (РШМ ст.III-IV). Символом «*» маркированы группы, в которых активность каспаз достоверно отличается от контроля. На диаграммах приведены значения p<0,05, полученные при сравнении последовательных стадий РШМ.
На фиг.4 представлено изменение относительной активности каспаз-3, и -9 в МНПК при развитии РШМ. Пунктирными линиями обозначены стандартные отклонения для группы контроля, жирными линиями - медианное значение активности в группе. Относительную активность каспаз вычисляли как ΔS/Δt, где ΔS - изменение интенсивности флуоресценции (оптической плотности) (отн. ед.) за промежуток времени Δt (мин). Для удобства полученную величину умножали на 104. Оценка статистической достоверности изменений активности каспаз проводилась в соответствии с критерием Уилкоксона-Манна-Уитни; n=30 (группа контроля), n=21 (тяжелая дисплазия), n=32 (РШМ ст.0), n=30 (РШМ ст.IA), n=21 (РШМ ст.II), n=14 (РШМ ст.III-IV). Символом «*» маркированы группы, в которых активность каспаз достоверно отличается от контроля. На диаграммах приведены значения p<0,05, полученные при сравнении последовательных стадий РШМ.
На фиг.5 представлено изменение уровня экспрессии мРНК каспаз-3 в МНПК при развитии РШМ. Пунктирными линиями обозначены стандартные отклонения для группы контроля, жирными линиями - медианное значение относительной экспрессии в группе. Относительную экспрессию определяли в соответствии с методом ΔΔCt, мРНК gapdh использовали в качестве референсной. Оценка статистической достоверности изменений экспрессии мРНК каспаз проводилась в соответствии с критерием Уилкоксона-Манна-Уитни; n=30 (группа контроля), n=21 (тяжелая дисплазия), n=32 (РШМ ст.0), n=30 (РШМ ст.IA), n=21 (РШМ ст.II), n=14 (РШМ ст.III-IV). Символом «*» маркированы группы, в которых активность каспаз достоверно отличается от контроля (различия полагали достоверными при p<0,05). На диаграммах приведены значения p, полученные при сравнении последовательных стадий РШМ.
На фиг.6 представлено изменение относительной активности каспазы-8 в МНПК пациенток с тяжелой дисплазией и РШМ 0-I стадий до и после лечения. Пунктирными линиями обозначены стандартные отклонения для группы контроля, жирными линиями - медианное значение активности в группе. Оценка статистической достоверности изменений активности каспаз проводилась в соответствии с критерием Уилкоксона-Манна-Уитни. Различия полагали достоверными при p<0,01: * - достоверное отличие от контроля, ** - достоверное отличие от соответствующей группы до лечения, *** - достоверное различие между 1 и 3 месяцами после терапии в группе РШМ IA стадии.
На фиг.7 представлены иммунограммы изменений параметров иммунного статуса больных преинвазивного и микроинвазивного. Изменение относительного содержания CD-позитивных клеток выражены в процентах от нормы. Ly - изменение общей численности лимфоцитов в % от нормы.
На фиг.8 представлена иммунограмма изменений параметров иммунного статуса больных ЦИН 3 до лечения и через 3 месяца после хирургического или комплексного лечения. Изменение относительного содержания CD-позитивных клеток выражены в процентах от нормы (принятой за 100%).
Основой заявляемого способа является иммунокоррегирующее лечение путем стимуляции врожденного иммунитета у больных с преинвазивным и инвазивным РШМ в послеоперационном периоде с помощью лекарственных препаратов (инъекций, мазей, суппозиторией, кремов, гелей) на основе пептида Аллоферон-1.
В частности, предлагается использование инъекций лекарственного средства «Аллокин-альфа» лиофилизата для приготовления раствора для подкожного введения курсом из шести инъекций с интервалом 1 день между инъекциями. При необходимости курс может повторяться. Кроме того, в качестве индуктора могут быть использованы препараты на основе пептида Аллоферон-1 в виде следующих лекарственных форм: мазей, суппозиторией, кремов, гелей.
Для определения эффективности и результативности лечения используется комплексная диагностика, которая включает систему известных диагностических тестов, позволяющих проводить динамический контроль эффективности лечения через определение иммунофенотипирования, уровня генов каспаз, вирусной нагрузки ВПЧ-инфекции, количества онкобелка Е7.
Возможность достижения технической задачи изобретения подтверждается следующим примером.
Материалом для исследования были образцы ткани и периферической крови от 150 пациенток, оперированных в ГБУЗ «Республиканский онкологический диспансер» Республики Карелия в 2010-2012 гг.
Обследовано 75 женщин с преинвазивным РШМ и 45 - со стадией IA1. У всех больных первоначальный диагноз был верифицирован путем гистологического анализа. Непосредственно перед операцией производился забор венозной крови для выделения фракции мононуклеарных клеток периферической крови (МНПК). Также кровь была взята у 45 здоровых женщин, сопоставимых по возрасту, данным анамнеза и не имеющих патологии шейки матки и ВПЧ-инфекции (контрольная группа №1). Повторный забор крови и исследование иммунологических показателей у больных с преинвазивным и инвазивным раком шейки матки осуществлялся через 1 и 3 мес после операции диатермоконизации и лечения препаратом «Аллокин-альфа» в первые две недели послеоперационного периода. Препарат вводился подкожно в дозе 1 мг 6 раз в течение двух недель. Контрольную группу №2 составили пациентки с преинвазивным (n=15) и инвазивным РШМ (n=15), получившие только хирургическое лечение. По анамнезу, данным вирусологического и гистологического исследований рассматриваемые группы не различались.
Также проведено определение ВПЧ-инфицированных пациенток, вирусной нагрузки, онкобелка Е7 в группах здоровых пациентов без патологии шейки матки (n=30), преинвазивного (n=75) и инвазивного (n=45) рака шейки матки до и после лечения. ВПЧ-типирование и выявление вирус-специфических мРНК в исследуемых группах проводилось методом полимеразной цепной реакции. Результаты гипирования представлены в Таблицах 1, 2 и 3.
Результаты, представленные в таблице 1, показывают увеличение количества ВПЧ-инфицированных пациенток.
| Таблица 1 | ||
| Частота определения ВПЧ у больных с преинвазивным и инвазивным РШМ (абс.,%) | ||
| Группа исследования | ВПЧ (+) | ВПЧ (-) |
| Контроль - здоровые без патологии шейки матки (n=30) | 8 (26,7) | 22 (73,3) |
| CIN III (Д3 и Cr in situ)(n=75) | 68 (90,7)* | 7 (9,3) |
| St Ia1 (n=45) | 43 (95,6)* | 2 (4,4) |
| * P<0,05 по отношению к контрольной группе |
В группе здоровых женщин (n=30) ДНК ВПЧ был отмечен у 26,7% (8) пациентов. Средний возраст женщин в контрольной группе составил 33,3±1,7 (n=30). ВПЧ высокого риска в группе здоровых женщин (16 и 18 генотипы) выявлены в 3,3% (1) случаях. При преинвазивном и инвазивном РШМ соответственно выявлено в 100% и 90,7% (Таблица 2) (P<0,05), что соответствует данным литературы (Доорбар Дж., 2006; Доорбар Дж. Молекулярная биология инфекции папилломавируса человека и цервикального рака / Дж. Доормар // Клинические науки. 2006. Т.110. Стр.525-541).
| Таблица 2 | ||||||
| Распределение ВПЧ-генотипов в исследуемых группах пациенток до лечения (абс., %) | ||||||
| Группа пациентов / Типы ВПЧ | ВПЧ 16 | ВПЧ 16, 18, 31, 33 | ВПЧ 18 | ВПЧ 31 | ВПЧ 33 | ВПЧ 6, 11, 74 |
| Контроль (здоровые) (n=30) | 1 (3,3) | - | - | 1 (3,3) | 1 (3,3) | 5 (16,7) |
| CIN 3 (Д3 и Cr in situ) (n=68) | 35 (51,5) | 24 (35,3) | 9 (13,2) | - | - | - |
| РШМ стадии IA (n=43) | 34 (79,1) | - | 5 (11,6) | 3 (7,0) | 1 (2,3) | - |
| CIN 3 + РШМ IA (n=111) (конизация + аллокин) | 69 (62,2) | 24 (21,6) | 14 (12,6) | 3 (2,7) | 1 (0,9) | - |
| CIN 3 + РШМ IA (n=30) (только конизация) | 19 (63,3) | 4 (13,3) | 3 (10,0) | 2 (6,7) | 2 (6,7) | - |
| * P<0,05 по отношению к контрольной группе |
| Таблица 3 | ||||||
| Распределение ВПЧ-генотипов в исследуемых группах пациенток через 3 месяца после лечения (абс., %) | ||||||
| Группы пациентов/генотип | ВПЧ 16 | ВПЧ 18 | ВПЧ 31 | ВПЧ 33 | ВПЧ 6, 11, 74 | Всего |
| CIN 3 РШМ IA (конизация + аллокин) | 1 (0,9) | 1 (0,9) | - | - | - | 2 (1,8) |
| CIN 3 + РШМ IA (только конизация) | 5 (16,7) | 1 (3,3) | 3 (10,0) | 2 (6,7) | - | 11 (36,7) |
В таблице 4 представлены результаты исследования вирусной нагрузки среди ВПЧ-позитивных лиц. Повышенная (>5 lg) и значимая (>3 lg) вирусные нагрузки наблюдаются у 48,5% и 41,2% у больных с преинвазивным РШМ и 53,5% и 37,2% у больных с инвазивным РШМ соответственно. В 10,2% и 9,3% случаев преинвазивного и инвазивного РШМ вирусная нагрузка малозначима (≤2 lg). В группе ВПЧ(+) здоровых пациентов отмечена у 26,7% только малозначимое (≤2 lg) количество вируса.
| Таблица 4 | |||
| Распределение вирусной нагрузки у ВПЧ-инфицированых пациентов (абс., %) | |||
| Группа пациентов | Средний логарифм вирусной нагрузки (lg ДНК ВПЧ/105 клеток) | ||
| Повышенная >5 lg | Значимая >3 lg | Малозначимая >2 lg | |
| Контроль(n=30) | 0 | 0 | 8 (26,7) |
| CIN III (Д3 и Cr in situ) (n=68) | 33 (48,5%)* | 28 (41,2)* | 7 (10,2) |
| St la1 (n=43) | 23 (53,5)* | 16 (37,2)* | 4 (9,3) |
| CIN 3 + РШМ IA (конизация + аллокин) | 0 | 0 | 2 (1,8) |
| CIN 3+РШМ IA (только конизация) | 0 | 8 (26,7)* | 3 (10,0) |
| * P<0,05 по отношению к контрольной группе |
Показано, что частота выявления пациенток с повышенной и значимой вирусной нагрузкой наблюдается у 89,7% и 90,7% больных преинвазивным и инвазивным РШМ, статистически значимо превышая аналогичный показатель для больных с малозначимой вирусной нагрузкой (p<0,05). После комплексного лечения (конизация + «Аллокин-альфа») ВПЧ-позитивных пациентов выявлено 1,7% (2) случаев, при этом определялась незначительная вирусная нагрузка (<3 lg 105) (табл.3 и 4). Напротив, в группе, где было только хирургическое лечение, выявлено 36,7% случаев ВПЧ-положительных пациентов, при этом у 26,7% отмечена значительная вирусная нагрузка (>5 lg 105) и 10% - незначительная вирусная нагрузка (<3 lg 105).
Проведено определение онкобелка Е7 в группах здоровых пациентов, преинвазивного и инвазивного рака шейки матки.
Определение наличия онкобелка Е7 у больных с преинвазивным и инвазивным РШМ является актуальным, так как интеграция ДНК ВПЧ в геном клеток сопровождается нарушением структуры гена Е2, который является репрессором Е7 [Джейшри Р.С. и др., 2009 Джейшри Р.С. Внутренние и внешние факторы клетки в цервикальном канцерогенезе / Р.С. Джейшри, А. Сринивас, М. Тесси и др. // Индиан Дж. Мед. Иссл. 2009. Т.130. Стр.286-295]. При интеграции ДНК-вируса синтез белка Е2 прекращается вследствие нарушения соответствующего гена и активируется синтез белка Е7 [Ванг С.С., Хилдешейм А., 2003; Ванг С.С. Вирусные и клеточные факторы в персистенции и развитии папилломавируса человека / Ванг С.С., А. Хилдешейм // Журнал монографий Национального института рака. 2003. Т.31. Стр.35-40]. Таким образом, происхождение онкобелка Е7 связано с жизненным циклом интегрированной формы ВПЧ-инфекции и может являться маркером преинвазивного и инвазивного РШМ [Джаббар С.Ф., Абраме Л., Глик А., Ламберг П.Ф. Персистенция высокодифференцированной цервикальной дисплазии и цервикальный рак требуют продолжительного выражения папилломавируса человека онкогена типа 16 Е7 // Иссл. рака. 2009. Т.69. №10. Стр.4407-4014]. Кроме того, измерение уровня онкобелка Е7 позволяет уточнить характер вирусной инфекции, а также возможность злокачественной трансформации при интегрированной форме ВПЧ-инфекции.
Онкобелок Е7 определяется в цервикальном материале только при наличии вируса, так как является продуктом вирусного генома (Таблица 5).
| Таблица 5 | |||||
| Частота выявления ВПЧ и белка Е7 у больных преинвазивным и инвазивным РШМ (абс., %) | |||||
| Группы пациентов/наличие ВПЧ и Е7 | Контроль - здоровые без паталогии шейки матки (n=30) | До лечения | После лечения | ||
| CIN III (n=75) | St Ia 1 РШМ (n=45) | ЦИН 3 + РШМ IA (конизация + аллокин) (n=120) | ЦИН 3 + РШМ IA (только конизация) (n=30) | ||
| ВПЧ+ E7+ | 0 | 52 (69,3)* | 30 (66,7)* | 0 | 5 (16,7)* |
| ВПЧ+ Е7(-) | 8 (26,7%) | 16 (21,3) | 13 (28,9) | 2 (1,7)* | 6 (20,0)* |
| ВИЧ(-) Е7+ | 0 | 4 (5,3) | 2 (4,4) | 0 | 0 |
| ВПЧ(-) Е7(-) | 23 (73,3) | 3 (4,0) | 0 | 118 (98,3) | 19 (63,3) |
| Всего | 30 (100,0) | 75 (100,0) | 45 (100,0) | 120 (100,0) | 30 (100,0) |
В контрольной группе из 8 случаев ВПЧ положительных образцов не выявлено наличия онкобелка Е7. В группе больных преинвазивного рака шейки матки (n=75) ВПЧ-позитивных больных выявлено 68 (90,6%) случаев, при этом в сочетании с продукцией онкобелка Е7 в 52 (69,3%) случаях, в 25,3% случаев онкобелка Е7 выявлено не было.
В группе инвазивного РШМ (n=31) ВПЧ-позитивных больных выявлено 96,8%, а сочетании с продукцией онкобелка Е7 67,7% случаях. Таким образом, при преинвазивном и инвазивном РШМ имеется одинаково высокие количества белка Е7, что подтверждает данные литературы [Сопов И., Соренсен Т, Магбагбеолу М. И др. Определение профилей генной экспрессии, связанные с раком, в тяжелой цервикальной неоплазии // Международный журнал о раке. - 2004. - Т.112. - Стр.33-43].
В ходе проведения исследований использовались следующие методы исследования:
1. ВПЧ-типирование. Скрининг на наличие ВПЧ-ДНК и идентификация ВПЧ-генотипа (16-ого, 18-ого, 31-ого и 33-его) проводились методом полимеразной цепной реакции (ПЦР) с использованием наборов «АмплиСенс ВПЧ ВКР скрин-EPh» (ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, Москва).
2. Уровень экспрессии мРНК генов каспаз в ткани шейки матки или МНПК определяли методом полимеразной цепной реакции (ПЦР) в «режиме реального времени» (ПЦР-РВ)
3. Достоверность интерпретации результатов количественного ПЦР-анализа определяли способом нормализации данных. [ПЦР «в реальном времени» / Ребриков Д.В., Саматов Г.А., Трофимов Д.Ю. и др.; под ред. д.б.н. Д.В. Ребрикова. - М.: БИНОМ. Лаборатория знаний, 2009. - 215 с. Бустин С.А., Количественное выражение иРНК с использованием ПЦР (ПЦР-РВ) с обратной фанскрипцией в реальном времени: тенденции и проблемы // Журнал о молекулярной эндокринологии. - 2002. - Т.29. - Стр.23-39].
4. Эффективность амплификации при текущих условиях эксперимента определяли по графику зависимости порогового цикла от концентрации матрицы. Результаты ПЦР нормализовали по массе суммарной фракции РНК.
5. Анализ относительного уровня экспрессии мРНК генов каспаз в МНПК проводили с использованием gapdh в качестве референсного гена по методу ΔΔCt [Ливак К.Дж., Шмиттген Т.Д. Анализ относительных данных генной экспрессии с использованием количественного выражения ПЦР в реальном времени и метода 2(-Дельта Дельта С(Т)) // Методы. 2001. Т.25. №4. Стр.402-408].
6. Определение активности каспаз проводили стандартным методом с использованием специфических субстратов, меченных флуоресцентной меткой (7-амино-4-фифторметилкумарин - AFC) («BioRad», США), детектируемой по изменению флуоресценции или оптической плотности. МНПК (106 клеток).
Результаты исследования.
1. Экспрессия генов каспаз-3, -6 и -9 в ткани преинвазивного и инвазивного РШМ.
Была проведена оценка степени нарушений апонтотической программы при преинвазивном и инвазивном РШМ через определение экспрессии каспаз-3, -6 и -9 на уровне протеолитической активности и содержания соответствующих мРНК. Выявлено в группе преинвазивного рака в значительном количестве случаев увеличение активности эффекторных каспаз-3 и -6 по сравнению с уровнем контроля (фиг.1 и 2).
При РШМ IA стадии наблюдается снижение активности всех исследуемых каспаз (в случае каспаз-3 и -9 - достоверно ниже уровня контроля). В 6 (из 26) образцах РШМ стадии IA (23%) активность каспазы-6 оставалось значительно повышенной. Степень подавления активности каспаз-3 и -9 достоверно коррелировала со стадией заболевания в ряду преинвазивный РШМ→РШМ IA-IV.
2. Экспрессия каспаз в МНПК больных преинвазивным и РШМ
Далее был исследован уровень протеолитической активности рецептор-регулируемой каспазы-8, эффекторных каспаз-3 и -6 и каспазы-9 в МНПК больных с преинвазивным и инвазивным РШМ и группы контроля (фиг.3 и 4).
По мере увеличения стадии РШМ наблюдалось достоверное увеличение активности каспазы-8 в МНПК (r=0,92; R2=0,86; p<0,01), для каспазы-6 (r=0,77; R2=0,59; p<0,01). Активность каспазы-9 при прогрессии РШМ снижается относительно группы контроля; (r=-0,60; R2=0,36; p<0,01). В 26% случаев РШМ IA стадии был зарегистрирован повышенный уровень активности каспазы-9.
При этом отмечено изменение относительного содержания мРНК каспазы-3 (фиг.5) при увеличении стадии РШМ от 0→II стадии в сравнении с 1 руиной контроля.
Для каспазы-6 наблюдалась тенденция к повышению уровня экспрессии мРНК при развитии РШМ (p<0,01). Для относительного уровня мРНК каспазы-9 корреляция со стадией заболевания не была выявлена.
3. Экспрессия каспаз в МНПК больных преинвазивным РШМ и РШМ IA стадии после курса терапии Аллокином-альфа
Изучена экспрессия каспаз в постоперационном периоде на фоне приема Аллокина-альфа, с учетом того факта, что через 1 и 3 месяца выявлена постепенная нормализация количества циркулирующих CD95-позитивных лимфоцитов.
Процесс нормализации активности каспаз после этапа лечения был наиболее выраженным в случае каспазы-8 (фиг.6): в группах РШМ 0 и IA стадий активность достоверно снижалась до уровня контроля. Для каспазы-6 после курса лечения регистрируется существенное повышение уровня активности. Профиль активности каспазы-3 в МНПК больных с преинвазивным РШМ после курса лечения сохраняется таким же, как и в группах до лечения.
Активность каспазы-6 в крови пациенток с РШМ 0-I стадий после лечения в большинстве исследованных случаев соответствует контролю или со