Стабильные композиции с высокими концентрациями белков антител человека против tnf-альфа
Иллюстрации
Показать всеГруппа изобретений относится к медицине и касается жидкой фармацевтической композиции для лечения нарушения, при котором активность TNF-альфа является вредной, причем указанная композиция имеет pH от около 5,0 до 6,4 и включает приблизительно 35-55 мг/мл полиола и приблизительно 40-200 мг/мл антитела человека против TNF-альфа, где композиция не содержит наполнитель NaCl. Группа изобретений также касается способа лечения нарушения, связанного с вредной активностью TNF-альфа, у субъекта, включающего введение субъекту указанной композиции. Группа изобретений обеспечивает препараты с высокой концентрацией антитела, обладающие длительной стабильностью и полезными для подкожного введения характеристиками. 7 н. и 42 з.п. ф-лы, 11 пр., 26 ил., 27 табл.
Реферат
Родственные заявки
Эта заявка испрашивает приоритет предварительной заявки на патент США с № 61/175380, поданной 4 мая 2009, полное содержание которой включено сюда посредством этой ссылки.
Предпосылки создания изобретения
Учитывая многочисленные желаемые свойства, которыми должна обладать композиция, чтобы быть экономически и терапевтически эффективной, например, стабильность, пригодность для введения, концентрацию, составление рецептур терапевтических белков, таких как антитела, часто является сложной задачей. Было известно, что во время производства, хранения и доставки терапевтические белки подвергаются физическим и химическим деградациям. Эти нестабильности могут снизить активность белка и увеличить риск неблагоприятных эффектов у пациентов и, следовательно, оказывать значительное влияние на разрешение регуляторного органа (см., например, Wang, et al. (2007) J. Pharm. Sci. 96: 1). Как таковая, стабильная белковая композиция необходима для эффективности терапевтического белка.
Необходимо введение высоких доз многих терапевтических белков, чтобы они были эффективными, которые предпочтительно составляют в композиции с высокими концентрациями. Композиции с высокими концентрациями белков являются желательными, поскольку они могут оказывать влияние на способ (например, внутривенный в противоположность подкожному) и частоту введения лекарственного средства субъекту.
Несмотря на преимущества композиций с высокими концентрациями белков, составление рецептур терапевтических белков в высоких концентрациях представляет многочисленные проблемы. Например, увеличение концентрации белка часто оказывает отрицательное влияние на агрегацию белка, его растворимость, стабильность и вязкость (см., например, Shire, et al. (2004) J. Pharm. Sci. 93: 1390). Повышенная вязкость, которая является очень часто встречающейся проблемой в случае растворов с высокими концентрациями белков, может иметь отрицательные последствия на введение композиции, например, синдромы ощущаемой боли и жжения и ограничения в производстве, обработке, на последнем этапе - наполнении и в вариантах устройств для доставки лекарственных средств (см., например, Shire, et al. (2004) J. Pharm. Sci. 93: 1390). Даже в случае терапевтических белков, обладающих общими структурными признаками, например, антител, разрешенные композиции до настоящего времени имели изменяющиеся ингредиенты и диапазоны концентраций. Например, антитело против CD20 - Ритуксан составлено для внутривенного введения в концентрации, составляющей 10 мг/мл, тогда как антитело против RSV - Синагис составлено для внутримышечного введения в концентрации, составляющей 100 мг/мл. Таким образом, композиции с высокими концентрациями белков, особенно композиции антител, которые можно использовать с терапевтической целью, остаются проблемой. Соответственно, существует потребность в стабильных композициях с высокими концентрациями белков, которые обеспечивают преимущества дозирования и введения.
Краткое изложение сущности изобретения
Настоящее изобретение основывается, по крайней мере отчасти, на открытии новых композиций с высокими концентрациями антител человека против TNF-α, или их антигенсвязывающих фрагментов, например, адалимумаба. Композиции настоящего изобретения обеспечивают ряд неожиданных характеристик, учитывая высокую концентрацию антитела. Например, композиции настоящего изобретения сохраняют физическую и химическую стабильность в течение удлиненных периодов времени, несмотря на высокую концентрацию белка, и имеют коэффициент вязкости, подходящий для подкожного введения. Композиции настоящего изобретения основываются, по крайней мере отчасти, на неожиданном обнаружении того, что антитело человека против TNF-альфа, или его антигенсвязывающая часть, может оставаться растворимым при высокой концентрации (например, 100 мг/мл) и оставаться не агрегированным при сохранении коэффициента вязкости, подходящего для инъекции (например, подкожного введения). Композиция настоящего изобретения является также неожиданной в том отношении, что при высокой концентрации (например, 100 мг/мл) антитело человека против TNF-альфа, или его антигенсвязывающая часть, может оставаться растворимым и оставаться не агрегированным и химически стабильным (например, без окисления или дезамидирования) в пределах широкого диапазона pH, например, от приблизительно pH 5,2 до приблизительно pH 6,0. Эти полезные характеристики достигаются без необходимости использования NaCl в качестве стабилизатора и с помощью увеличения содержания наполнителя в виде сахароспирта.
В одном аспекте настоящего изобретения обеспечивается жидкая фармацевтическая композиция, включающая более чем 40 мг полиола и по крайней мере приблизительно 100 мг/мл антитела человека против TNF-альфа, или его антигенсвязывающей части.
В другом аспекте настоящего изобретения обеспечивается жидкая фармацевтическая композиция, включающая более чем 20 мг полиола и по крайней мере приблизительно 100 мг/мл антитела человека против TNF-альфа, или его антигенсвязывающей части. В одном варианте осуществления композиции по настоящему изобретению не содержат NaCl.
Особенностью настоящего изобретения также является жидкая фармацевтическая композиция, имеющая pH от приблизительно 5,0 до 6,4 и включающая по крайней мере приблизительно 100 мг/мл антитела человека против TNF-альфа, или его антигенсвязывающей части, причем композиция не содержит NaCl и имеет мутность, составляющую менее 60 NTU (нефелометрических единиц мутности) согласно стандартному исследованию напряжения от перемешивания в течение 24 часов или после 24 месяцев длительного хранения в виде жидкости.
Настоящим изобретением, кроме того, обеспечивается жидкая фармацевтическая композиция, имеющая pH от приблизительно 5,0 до 6,4 и включающая по крайней мере приблизительно 100 мг/мл антитела человека против TNF-альфа, или его антигенсвязывающей части, причем композиция не содержит NaCl и имеет мутность, составляющую менее 100 NTU согласно стандартному исследованию напряжения от перемешивания в течение 48 часов.
Другой аспект настоящего изобретения включает жидкую фармацевтическую композицию, имеющую pH от приблизительно 5,0 до 6,4 и включающую по крайней мере приблизительно 100 мг/мл антитела человека против TNF-альфа, или его антигенсвязывающей части, причем композиция не содержит NaCl и имеет мутность, составляющую менее 40 NTU после хранения в течение 3 месяцев при 5°C, 25°C или 40°C.
Настоящим изобретением также обеспечивается жидкая фармацевтическая композиция, включающая по крайней мере приблизительно 100 мг/мл антитела человека против TNF-альфа, или его антигенсвязывающей части; более чем приблизительно 20 мг/мл полиола; 0,1-2,0 мг/мл поверхностно-активного вещества; приблизительно 1,15-1,45 мг/мл лимонной кислоты * H2O; приблизительно 0,2-0,4 мг/мл дигидрата цитрата натрия; приблизительно 1,35-1,75 мг/мл Na2HPO4 * 2 H2O; приблизительно 0,75-0,95 мг/мл NaH2PO4 * 2 H2O, причем композиция имеет pH от приблизительно 4,7 до 6,5 и не включает NaCl.
Композиция настоящего изобретения подходит для подкожного введения. Как таковое, настоящее изобретение также включает применение композиции настоящего изобретения, включающей антитело человека против TNF-альфа, или его антигенсвязывающую часть, для лечения нарушения, связанного с вредной активностью TNF-альфа, у субъекта.
В одном варианте осуществления композиция настоящего изобретения имеет концентрацию антитела человека против TNF-альфа, или его антигенсвязывающей части, и вязкость, составляющую приблизительно 3,1-3,3 миллипаскаль*секунда.
В одном варианте осуществления композиция настоящего изобретения включает более чем 20 мг полиола. Дополнительные количества полиола, которые могут быть включены в композицию настоящего изобретения, составляют более чем 30 мг полиола. Альтернативно, в композиции настоящего изобретения может использоваться более чем 40 мг полиола, в том числе, но без ограничения, 40-45 мг или приблизительно 42 мг.
В одном варианте осуществления используемым в композиции настоящего изобретения полиолом является сахароспирт, такой как, но без ограничения, маннит или сорбит. В одном варианте осуществления композиция включает приблизительно 40-45 мг/мл либо маннита, либо сорбита.
Различные поверхностно-активные вещества, известные в данной области техники, могут использоваться в композиции настоящего изобретения. В одном варианте осуществления поверхностно-активным веществом является полисорбат 80. В дальнейшем варианте осуществляется в композиции настоящего изобретения используется приблизительно 0,1-2,0 мг/мл полисорбата 80.
В одном варианте осуществления настоящего изобретения композиция включает приблизительно 1,30-1,31 мг/мл лимонной кислоты * H2O.
В другом варианте осуществления настоящего изобретения композиция включает приблизительно 0,30-0,31 мг/мл дигидрата цитрата натрия.
Еще в одном варианте осуществления настоящего изобретения композиция включает приблизительно 1,50-1,56 мг/мл Na2HPO4 * 2 H2O.
В дальнейшем варианте осуществления настоящего изобретения композиция включает приблизительно 0,83-0,89 мг/мл NaH2PO4 * 2 H2O.
В другом варианте осуществления pH композиции настоящего изобретения колеблется от приблизительно 4,8 до приблизительно 6,4. Например, pH композиции настоящего изобретения либо может колебаться от приблизительно 5,0 до приблизительно 5,4 (например, составлять приблизительно 5,2), либо может колебаться от приблизительно 5,8 до приблизительно 6,4 (например, составлять приблизительно 6,0).
Преимущество композиции настоящего изобретения заключается в том, что она обеспечивают высокую концентрацию антитела без увеличения агрегации белка, которая обычно возникает при увеличении концентрации белка. В одном варианте осуществления композиция настоящего изобретения содержит менее чем приблизительно 1% агрегированного белка.
В качестве части настоящего изобретения также предусматриваются описываемые здесь композиции, имеющие концентрацию, составляющую по крайней мере приблизительно 50 мг/мл антитела человека против TNF-альфа, или его антигенсвязывающей части.
В одном варианте осуществления антитело человека, или его антигенсвязывающая часть, включает легкую цепь, включающую CDR3-участок, включающий аминокислотную последовательность, представленную как SEQ ID NO:3, и тяжелую цепь, включающую CDR3-участок, включающий аминокислотную последовательность, представленную как SEQ ID NO:4.
В одном варианте осуществления настоящего изобретения антитело имеет CDR3-участок легкой цепи, включающий аминокислотную последовательность SEQ ID NO:3 или последовательность, являющуюся результатом модификации SEQ ID NO:3 посредством одной замены на аланин в положении 1, 4, 5, 7 или 8 или посредством одной-пяти консервативных аминокислотных замен в положениях 1, 3, 4, 6, 7, 8 и/или 9, и имеет CDR3-участок тяжелой цепи, включающий аминокислотную последовательность SEQ ID NO:4 или последовательность, являющуюся результатом модификации SEQ ID NO:4 посредством одной замены на аланин в положении 2, 3, 4, 5, 6, 8, 9, 10 или 11 или посредством одной - пяти консервативных аминокислотных замен в положениях 2, 3, 4, 5, 6, 8, 9, 10, 11 и/или 12.
Антитело настоящего изобретения может иметь определенные функциональные свойства. Например, антитело человека, или его антигенсвязывающая часть, может подвергаться диссоциации от TNFα человека с Kd, составляющей 1×10-8 M или меньше, подвергаться диссоциации от TNFα человека с константой скорости диссоциации Koff, составляющей 1×10-3 сек-1 или меньше, обе из которых являются определенными с помощью поверхностного плазмонного резонанса, и/или нейтрализовать индуцированную TNFα человека цитотоксичность в стандартном in vitro анализе с использованием клеток L929 с IC50, составляющей 1×10-7 M или меньше.
В одном варианте осуществления антителом человека, или его антигенсвязывающей частью, является IgG1 каппа антитело человека.
В одном варианте осуществления настоящего изобретения легкая цепь антитела человека, или его антигенсвязывающей части, включает, кроме того, CDR2-участок, включающий аминокислотную последовательность, представленную как SEQ ID NO:5, и CDR1-участок, включающий аминокислотную последовательность, представленную как SEQ ID NO:7, и/или тяжелая цепь антитела человека включает CDR2-участок, включающий аминокислотную последовательность, представленную как SEQ ID NO:6, и CDR1-участок, включающий аминокислотную последовательность, представленную как SEQ ID NO:8. В другом варианте осуществления легкая цепь антитела человека, или его антигенсвязывающей части, включает аминокислотную последовательность, представленную как SEQ ID NO:1, а тяжелая цепь антитела человека включает аминокислотную последовательность, представленную как SEQ ID NO:2. В настоящее изобретение также включены антитела человека, или их антигенсвязывающие части, имеющие аминокислотные последовательности, которые идентичны представленным здесь SEQ ID NO на по крайней мере 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99%.
В еще одном варианте осуществления настоящего изобретения антителом человека, или его антигенсвязывающей частью, является адалимумаб.
Краткое описание чертежей
Фиг.1 представляет собой график, на котором отображено присутствие высокомолекулярного (hmw) белкового типа в растворе, содержащем 0,1% Solutol. Согласно MALS (рассеиванию света под множеством углов) (серая линия) молярные массы агрегатов равны приблизительно 109 г/моль, составляя 2,6% общего белка (УФ280, черная линия). Хранение при 40°C в течение 12 недель.
Фиг.2А и 2В представляют собой графики, на которых отображено детектирование на ранней стадии высокомолекулярных (hmw) агрегатов, возникающих во время хранения при 40°C. Тогда как агрегаты невозможно было детектировать через посредство УФ280 (черная кривая), MALS (серая кривая) однозначно свидетельствовало о присутствии hmw типа. Хранение в течение одной недели (A) в сравнение с исходным образцом (B).
Фиг.3 представляет собой график, на котором отображена мутность в зависимости от числа циклов замораживания/оттаивания композиций F1-F6.
Фиг.4 представляет собой график, на котором отображен коэффициент полидисперсности в зависимости от числа циклов замораживания/оттаивания композиций F1-F6.
Фиг.5 представляет собой график, на котором отображены определенные с помощью SEC (гель-фильтрации) уровни агрегатов в зависимости от числа циклов замораживания/оттаивания композиций F1-F6.
Фиг.6 представляет собой график, на котором отображена определенная с помощью DSC (дифференциальной сканирующей калориметрии) Tm в °C композиций F1-F6 в TO.
Фиг.7 представляет собой график, на котором отображены определенные с помощью SEC уровни агрегатов в зависимости от времени перемешивания композиций F1-F6.
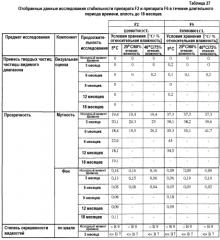
Фиг.8 представляет собой график, на котором отображено сравнение значений коэффициентов мутности, полученных в исследованиях стабильности после хранения в течение 3 месяцев F2, F6 и F7 (3 репрезентативных партий 01032-0134).
Фиг.9 представляет собой график, на котором отображено сравнение значений числа частиц видимого диапазона в соответствии с оценкой DAC, полученных в исследованиях стабильности после хранения в течение 3 месяцев F2, F6 и F7 (3 репрезентативных партий 01032-0134).
Фиг.10 представляет собой график, на котором отображено сравнение значений числа частиц довидимого диапазона (≥10 мкм), полученных в исследованиях стабильности после хранения в течение 3 месяцев F2, F6 и F7 (3 репрезентативных партий 01032-0134).
Фиг.11 представляет собой график, на котором отображено сравнение значений числа частиц довидимого диапазона (≥25 мкм), полученных в исследованиях стабильности после хранения в течение 3 месяцев F2, F6 и F7 (3 репрезентативных партий 01032-0134).
Фиг.12 представляет собой график, на котором отображено сравнение остаточных количеств мономеров, полученных в исследованиях стабильности после хранения в течение 3 месяцев F2, F6 и F7 (3 репрезентативных партий 01032-0134).
Фиг.13 представляет собой график, на котором отображено сравнение сумм вариантов лизина, полученных в исследованиях стабильности после хранения в течение 3 месяцев F2, F6 и F7 (3 репрезентативных партий 01032-0134).
Фиг.14 представляет собой график, на котором отображено основанное на данных по мутности сравнение F2, F6 и F7 по показателю стойкости к напряжению от перемешивания при различных скоростях перемешивания в течение 24 часов.
Фиг.15 представляет собой график, на котором отображено основанное на данных DLS (динамического рассеивания света) (значениях Z-средних размеров) сравнение F2, F6 и F7 по показателю стойкости к напряжению от перемешивания при различных скоростях перемешивания в течение 24 часов.
Фиг.16 представляет собой график, на котором отображено основанное на данных по мутности сравнение F2, F6 и F7 по показателю стабильности до и после нескольких циклов насосной эксплуатации.
Фиг.17 представляет собой график, на котором отображено основанное на данных DLS (Z-средних размерах) сравнение F2, F6 и F7 по показателю стабильности до и после нескольких циклов насосной эксплуатации.
Фиг.18 представляет собой график, на котором отображено основанное на полученных с помощью SEC данных (уровнях агрегатов) сравнение F2, F6 и F7 по показателю стабильности до и после нескольких циклов насосной эксплуатации.
Фиг.19 представляет собой график, на котором отображена визуальная оценка композиций с концентрацией 100 мг/мл после наполнения с использованием перистальтического насоса.
Фиг.20 представляет собой график, на котором отображена визуальная оценка композиций с концентрацией 100 мг/мл после наполнения с использованием поршневого насоса.
Фиг.21 представляет собой график, на котором отображена мутность композиций с концентрацией 100 мг/мл после наполнения с использованием перистальтического насоса.
Фиг.22 представляет собой график, на котором отображена мутность композиций с концентрацией 100 мг/мл после наполнения с использованием поршневого насоса.
Фиг.23 представляет собой график, на котором отображена мутность в TO и после хранения в течение 4 недель при 5°C композиций F8-F11.
Фиг.24 представляет собой график, на котором отображена доля мономеров в TO и после хранения в течение 4 недель при 5°C композиций F8-F11.
Фиг.25 представляет собой график, на котором отображены уровни агрегатов в TO и после хранения в течение 4 недель при 5°C композиций F8-F11.
Фиг.26 представляет собой график, на котором отображено количество частиц довидимого диапазона в TO и после хранения в течение 4 недель при 5°C композиций F8-F11.
Подробное описание изобретения
I. Определения
С тем чтобы настоящее изобретение можно было легче понять, сначала определены некоторые термины. Кроме того, следует обратить внимание, что повсюду, где приводится значение или диапазон значений параметра, предполагается, что частью этого изобретения также являются значения и диапазоны, промежуточные по отношению к приведенным значениям.
Термин «фармацевтическая композиция» относится к композициям, которые находятся в такой форме, что создается возможность для того, чтобы биологическая активность активных ингредиентов была неуклонно эффективной, и которые не содержат дополнительные компоненты, которые являются в значительной степени токсичными для субъектов, которым композиция будет вводиться.
Выражение «фармацевтически приемлемый носитель» принято в данной области техники и включает фармацевтически приемлемый материал, композицию или носитель, подходящий для введения млекопитающим. Носители включают жидкий или твердый наполнитель, разбавитель, формообразующее средство, растворитель или герметизирующий материал, задействованный в перенос или транспортировку рассматриваемого агента из одного органа, или части тела, в другой орган, или часть тела. Каждый носитель должен быть «приемлемым» в том смысле, что он должен быть совместимым с другими ингредиентами композиции и не вредным или не затрагивающим безопасность пациента.
«Фармацевтически приемлемыми наполнителями» (носителями, добавками) являются наполнители, которые можно мотивировано вводить рассматриваемому млекопитающему для обеспечения эффективной дозы используемого активного ингредиента.
Термин «наполнитель» относится к агенту, который может быть добавлен к композиции для обеспечения желаемой консистентности, например, изменения объемных характеристик, для увеличения стабильности и/или для регулирования осмотической концентрации раствора. Примеры широко используемых наполнителей включают, но без ограничения, сахара, полиолы, аминокислоты, поверхностно-активные вещества и полимеры.
Широко используемым наполнителем является полиол. Как здесь используется, «полиол» представляет собой вещество с множеством гидроксильных групп и включает сахара (восстанавливающие и невосстанавливающие сахара), сахароспирты и сахарокислоты. Предпочтительные здесь полиолы имеют молекулярную массу, которая составляет менее чем приблизительно 600 кДа (например, находится в диапазоне от приблизительно 120 до приблизительно 400 кДа). Не ограничивающими примерами полиолов являются фруктоза, манноза, мальтоза, лактоза, арабиноза, ксилоза, рибоза, рамноза, галактоза, глюкоза, сахароза, трегалоза, сорбоза, мелезитоза, раффиноза, маннит, ксилит, эритрит, треит, сорбит, глицерин, соль L-глюконовой кислоты и их соли металлов.
Как здесь используется, «буфер» относится к забуференному раствору, который является устойчивым к изменениям pH благодаря действию кислотно-основных соединенных компонентов. Буферы этого изобретения имеют pH в диапазоне от приблизительно 4 до приблизительно 8; предпочтительно от приблизительно 4,5 до приблизительно 7 и наиболее предпочтительно имеют pH в диапазоне от приблизительно 5,0 до приблизительно 6,5. Примеры буферов, которые будут контролировать pH в этом диапазоне, включают фосфатный, ацетатный (например, натрийацетатный), сукцинатный (например, натрийсукцинатный), глюконатный, глютаматный, гистидиновый, цитратный и включающие другие органические кислоты буферы. В одном варианте осуществления буфером, подходящим для применения в композициях настоящего изобретения, является цитратный и фосфатный буфер.
Термин «поверхностно-активное вещество» обычно включает те агенты, которые защищают белок в композиции от напряжений, вызываемых на границах раздела воздух/раствор и раствор/поверхность. Например, поверхностно-активное вещество может защищать белок от агрегации. Подходящие поверхностно-активные вещества могут включать, например, полисорбаты, полиоксиэтилен-алкиловые эфиры, такие как Brij 35.RTM., или полоксамер, такой как Tween 20, Tween 80 или полоксамер 188. Предпочтительными детергентами являются полоксамеры, например, Полоксамер 188, Полоксамер 407; полиоксиэтилен-алкиловые эфиры, например, Brij 35.RTM., Cremophor A25, Sympatens ALM/230; и полисорбаты/Tween, например, Полисорбат 20, Полисорбат 80, Mirj, и полоксамеры, например, Полоксамер 188 и Tween, например, Tween 20 и Tween 80.
«Стабильной» композицией является композиция, в которой антитело по существу сохраняет свою физическую стабильность и/или химическую стабильность и/или биологическую активность во время процесса производства и/или при хранении. В данной области техники имеются в наличии различные аналитические методы для определения стабильности белка, и их обзоры приведены в Peptide and Protein Drug Delivery, 247-301, Vincent Lee Ed., Marcel Dekker, Inc., New York, N.Y., Pubs. (1991) и Jones, A. (1993) Adv. Drug Delivery Rev. 10: 29-90. Например, в одном варианте осуществления стабильность белка определяют, исходя из процентного содержания мономерного белка в растворе, при низком процентном содержании деградированного (например, фрагментированного) и/или агрегированного белка. Предпочтительно, когда композиция является стабильной при комнатной температуре (приблизительно 30°C) или при 40°C в течение по крайней мере 1 месяца и/или стабильной при приблизительно 2-8° в течение по крайней мере 1 года или в течение по крайней мере 2 лет. Кроме того, композиция предпочтительно является стабильной после замораживания (например, до -70°C) и оттаивания композиции, ниже называемого «циклом замораживания/оттаивания».
Антитело «сохраняет свою физическую стабильность» в фармацевтической композиции, если оно, по существу, не демонстрирует признаки, например, агрегации, преципитации и/или денатурации, определяемые при визуальном исследовании цвета и/или прозрачности или определяемые с помощью рассеивания УФ света или гель-фильтрации. Агрегация является процессом, при котором отдельные молекулы или комплексы связываются ковалентно или нековалентно с образованием агрегатов. Агрегация может развиваться до такой степени, что образуется видимый преципитат.
Стабильность, такую как физическая стабильность композиции, можно определить с помощью хорошо известных в данной области техники способов, включающих измерение видимого поглощения света в образце (абсорбции или оптической плотности). Такое измерение поглощения света имеет отношение к мутности композиции. Мутность композиции является отчасти внутренним свойством белка, растворенного в растворе, и ее обычно определяют с помощью нефелометрии и измеряют в нефелометрических единицах мутности (NTU).
Степень мутности, например, в зависимости от концентрации одного или более компонентов в растворе, например, концентрации белка и/или соли, также называют «опалесценцией» или «опалесцирующим видом» композиции. Степень мутности можно рассчитать на основе стандартной кривой, созданной с использованием суспензий с известной мутностью. Стандартные контрольные образцы для определения степени мутности в случае фармацевтических композиций могут основываться на критериях Европейской Фармакопеи (European Pharmacopoeia, Fourth Ed., Европейский департамент по качеству медицинских препаратов (EDQM), Strasbourg, Франция). В соответствии с критериями Европейской Фармакопеи прозрачный раствор определяют как раствор с мутность, которая меньше или равна таковой контрольной суспензии, мутность которой равна приблизительно 3 в соответствии со стандартами Европейской Фармакопеи. Измерения мутности с помощью нефелометрии могут выявить релеевское рассеяние, которое обычно изменяется линейно в зависимости от концентрации, в отсутствие эффектов ассоциации или отклонения от идеальности. В данной области техники хорошо известны другие способы оценки физической стабильности.
Антитело «сохраняет свою химическую стабильность» в фармацевтической композиции, если химическая стабильность в конкретный момент времени является такой, что антитело, как считается, все еще сохраняет свою биологическую активность, определяемую ниже. Химическую стабильность можно определить посредством, например, детектирования и количественного анализа химически измененных форм антитела. Химическое изменение может включать изменение размера (например, усечение), которое можно оценить, используя гель-фильтрацию, электрофорез в SDS-ПААГ и/или ионизацию лазерной десорбции с использованием матрицы/времяпролетную масс-спектрометрию (MALDI/TOF MS), например. Другие типы химического изменения включают изменение заряда (например, возникающее в результате дезамидирования или окисления), оценку которого можно осуществить с помощью ионообменной хроматографии, например.
Антитело «сохраняет свою биологическую активность» в фармацевтической композиции, если антитело в фармацевтической композиции является биологически активным в случае намеченной для него цели. Например, биологическая активность сохраняется, если биологическая активность антитела в фармацевтической композиции находится в пределах приблизительно 30%, приблизительно 20% или приблизительно 10% (в границах ошибок исследования) биологической активности, продемонстрированной в тот момент времени, когда фармацевтическая композиция была приготовлена (например, определенной в анализе связывания антигена).
В фармакологическом значении, в контексте настоящего изобретения, «терапевтически эффективное количество» или «эффективное количество» антитела относится к количеству, эффективному в предупреждении или лечении, или ослаблении симптома нарушения, для лечения которого антитело является эффективным. «Нарушением» является любое состояние, лечение антителом которого принесет пользу. Оно включает хронические и острые нарушения или заболевания, в том числе те патологические состояния, которые вызывают предрасположенность субъекта к нарушению, о котором идет речь.
«Лечение» относится как к терапевтическому лечению, так и к профилактическим или превентивным мерам. Те, кто нуждается в лечении, включают тех, кто уже имеют нарушение, а также тех, у которых нарушение должно быть предупреждено.
Используемые здесь выражения «парентеральное введение» и «вводимые парентерально» означают способы введения, отличные от энтерального и местного введения, обычно с помощью инъекции, и включают, без ограничения, внутривенную, внутримышечную, внутриартериальную, подоболочечную, внутрикапсулярную, внутриглазничную, внутрисердечную, внутрикожную, внутрибрюшинную, транстрахеальную, подкожную, субкутикулярную, внутрисуставную, подкапсулярную, субарахноидальную, внутричерепную, внутрисуставную, внутрипозвоночную и надчревную инъекцию и инфузию.
Используемые здесь выражения «системное введение», «вводимые системно», «периферическое введение» и «вводимые периферически» означают введение соединения, лекарственного средства или другого материала, отличное от введения непосредственно в центральную нервную систему, так что оно проникает в систему пациента и, таким образом, подвергается метаболизму и другим подобным процессам, например, подкожное введение.
Предполагается, что используемый здесь термин «TNF-альфа человека» (здесь сокращенно hTNF-альфа, TNFα или просто hTNF) относится к цитокину человека, который существует в виде секретируемой формы с М.м. 17 кДа и мембраносвязанной формы с М.м. 26 кДа, биологически активная форма которого состоит из тримера нековалентно связанных молекул с М.м. 17 кДа. Дополнительное описание структуры hTNF-альфа приведено, например, в Pennica, D., et al. (1984) Nature 312: 724-729; Davis, J. M., et al. (1987) Biochem. 26: 1322-1326; и Jones, E. Y., et al. (1989) Nature 338: 225-228. Предполагается, что термин «TNF-альфа человека» включает рекомбинантный TNF-альфа человека (rhTNF-альфа), который можно приготовить с помощью стандартных способов рекомбинантной экспрессии или купить (R & D Systems, каталожный № 210-TA, Minneapolis, Minn.).
Предполагается, что используемый здесь термин «антитело» относится к молекулам иммуноглобулинов, состоящим из четырех полипептидных цепей, двух тяжелых (H) цепей и двух легких (L) цепей, взаимно соединенных дисульфидными связями. В это определение также включены другие встречающиеся в природе антитела с измененной структурой, такие как, например, верблюжьи антитела. Каждая тяжелая цепь состоит из вариабельной области тяжелой цепи (здесь сокращенно HCVR или VH) и константной области тяжелой цепи. Константная область тяжелой цепи состоит из трех доменов, CH1, CH2 и CH3. Каждая легкая цепь состоит из вариабельной области легкой цепи (здесь сокращенно LCVR или VL) и константной области легкой цепи. Константная область легкой цепи состоит из одного домена, CL. VH- и VL-области можно далее подразделить на участки гипервариабельности, называемые определяющими комплементарность участками (CDR), вперемежку с областями, которые являются более консервативными, называемыми каркасными областями (FR). Каждая VH и VL состоит из трех CDR и четырех FR, расположенных от амино-конца к карбоксильному концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. В одном варианте осуществления настоящего изобретения композиция содержит антитело с последовательностями CDR1, CDR2 и CDR3, подобными таковым, описанным в патентах США с № 6090382 и 6258562, каждый из которых включен сюда посредством ссылки.
Используемый здесь термин «CDR» относится к определяющему комплементарность участку в последовательности вариабельной области антитела. В каждой из вариабельных областей тяжелой цепи и легкой цепи существует три CDR, которые названы CDR1, CDR2 и CDR3, в случае каждой из вариабельных областей. Соответственно различным системам точные границы этих CDR были определены по-разному. Система, описанная Kabat (Id.), не только обеспечивает однозначную систему нумерации остатков, применимую к любой вариабельной области антитела, но также дает точные границы остатков, определяющие три CDR. Эти CDR можно назвать CDR по Kabat. Chothia и др. установили, что некоторые субфрагменты внутри CDR по Kabat принимают почти идентичные пептидные базовые конформации, несмотря на наличие огромного отличия на уровне аминокислотной последовательности (Chothia et al. (1987) Mol. Biol. 196: 901-917; Chothia et al. (1989) Nature 342: 877-883). Эти субфрагменты были названы L1, L2 и L3 или H1, H2 и H3, где «L» и «H» обозначает участки легкой цепи тяжелой цепи, соответственно. Эти участки можно назвать CDR по Chothia, которые имеют границы, перекрывающиеся с границами CDR по Kabat. Другие определяющие CDR границы, перекрывающиеся с таковыми CDR по Kabat, были описаны Padlan (1995) FASEB J. 9: 133-139 и MacCallum (1996) J. Mol. Biol. 262(5): 732-745. Кроме того, другие определения границ CDR могут не повторять точно одну из описанных здесь систем, но будут, тем не менее, перекрываться с CDR по Kabat, хотя они могут быть укороченными или удлиненными ввиду предсказания того или экспериментальных данных о том, что конкретные остатки или группы остатков или даже целые CDR не оказывают значительное влияние на связывание с антигеном. В применяемых здесь способах могут использоваться CDR, определенные в соответствии с любой из этих систем, хотя в определенных вариантах осуществления используются CDR, определенные по Kabat или Chothia.
Используемый здесь термин «антигенсвязывающая часть» антитела (или просто «часть антитела») относится к одному или более фрагментам антитела, которые сохраняют способность к специфическому связыванию с антигеном (например, hTNF-альфа). Было установлено, что функцию антитела, относящуюся к связыванию антигена, могут выполнять фрагменты полноразмерного антитела. Примеры связывающих фрагментов, включаемых в термин «антигенсвязывающая часть» антитела, включают (i) Fab-фрагмент, одновалентный фрагмент, состоящий из VL-, VH-, CL- и CH1-доменов; (ii) F(ab')2-фрагмент, двухвалентный фрагмент, включающий два Fab-фрагмента, связанных дисульфидным мостиком в шарнирной области; (iii) Fd-фрагмент, состоящий из VH- и CH1-доменов; (iv) Fv-фрагмент, состоящий из VL- и VH-доменов одного плеча антитела, (v) dAb-фрагмент (Ward et al., (1989) Nature 341: 544-546), который состоит из VH-домена; и (vi) выделенный определяющий комплементарность участок (CDR). Кроме того, хотя два домена Fv-фрагмента, VL и VH, кодируются отдельными генами, их можно соединить, используя рекомбинантные способы, с помощью синтетического линкера, который позволяет создать их в виде одной белковой цепи, в которой VL- и VH-области спарены с образованием одновалентных молекул (известных как одноцепочечный Fv (scFv); см., например, Bird et al. (1988) Science 242: 423-426; и Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85: 5879-5883). Предполагается, что такие одноцепочечные антитела также включены в термин «антигенсвязывающая часть» антитела. Также включены другие формы одноцепочечных антител, такие как диатела. Диатела представляют собой двухвалентные, биспецифические антитела, в которых VH- и VL-домены представлены в одной полипептидной цепи, но используя линкер, который является слишком коротким для того, чтобы сделать возможным спаривание между двумя доменами в одной и той же цепи, вынуждая, тем самым, домены спариваться с комплементарными доменами в другой цепи и создавая два антигенсвязывающих сайта (см., например, Holliger, P., et al. (1993) Proc. Natl. Acad. Sci. USA 90: 6444-6448; Poljak, R. J., et al. (1994) Structure 2: 1121-1123). В одном варианте осуществления настоящего изобретения композиция содержит антигенсвязывающие части, описанные в патентах США с № 6090382 и 6258562, каждый из которых включен сюда посредством ссылки.
Более того, антитело или его антигенсвязывающая часть могут быть частью более больших иммуноадгезивных молекул, образованных благодаря ковалентному или нековалентному соединению антитела или части антитела с одним или несколькими другими белками или пептидами. Примеры таких иммуноадгезивных молекул включают использование центральной области стрептавидина для созд