Способ мониторинга состояния пациента после трансплантации органа
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к трансплантологии, и может быть использовано для мониторинга состояния пациента после трансплантации органа. Для этого, после трансплантации производят мониторинг редокс потенциала (РП) плазмы крови пациента. При этом ежедневно определяют РП плазмы крови пациента с помощью платинового электрода относительно хлорсеребряного электрода. Платиновый электрод предварительно обрабатывают с помощью катодно-анодного сканирования в растворе неорганического восстановителя в циклическом потенциодинамическом режиме. Проводят ежедневный мониторинг величины РП плазмы крови пациента и выявляют изменения величин РП в одном направлении за сутки или несколько суток. При выявлении изменения РП более 25 мВ за сутки или несколько суток судят о наличии дисфункции трансплантата или высоком риске развития криза отторжения трансплантата. При выявлении изменения величины РП менее 25 мВ судят о нормальном состоянии пациента. Изобретение позволяет осуществить прогноз исходов трансплантации и обеспечить своевременную коррекцию лечения пациентов.1 табл., 4 пр., 3 ил.
Реферат
Изобретение относится к области медицины, точнее, к области трансплантологии. Способ может быть использован для своевременного получения диагностической информации о состоянии пациента с трансплантированными органами, что позволит в дальнейшем осуществить прогноз исходов трансплантации и обеспечить своевременную коррекцию лечения.
В настоящее время метод трансплантации широко используется для лечения пациентов с терминальной стадией хронической почечной и печеночной недостаточности, трансплантация сердца, легких и других жизненно важных органов также способна улучшить качество жизни, способствует более полной социальной реабилитации больных, лечение которых другими методами невозможно. Дисфункция трансплантата является весьма опасным осложнением, поскольку она может предшествовать кризу отторжения и гибели трансплантированного органа.
Известные методы диагностики дисфункции и отторжения трансплантата основаны на использовании биопсии и последующего гистологического исследования. Например, с помощью биопсии аллотрансплантата миокарда и иммуногистохимического исследования образцов предлагается диагностировать острое гуморальное отторжение аллотрансплантата сердца [Готье С.В., Куприянова А.Г., Белецкая Л. В. Способ диагностики острого гуморального отторжения аллотрансплантата сердца. Патент РФ №2475190].
Недостатками этого метода являются:
- инвазивность и травматичность для исследуемого органа,
- невозможность проведения тестирования ранее чем через шесть дней после аллотрансплантации.
В последнее время стали известны электрохимические методы определения патологических состояний с помощью измерений редокс потенциалов плазмы крови и тканей.
Известен электрохимический способ измерений редокс потенциала (РП) тела, который использовали для диагностики состояния здоровья человека и животных [Oomoto Y. Health care instrument containing oxidation-reduction potential measuring function. Patent US №6260261 B1 от 31.07.2001, заявка US 08/957,553 от 24.10.1997]. Согласно указанному способу патологические состояния диагностируют, если величина редокс потенциала в ткани пациента смещается в положительную область.
Недостатками метода являются:
1) Использование тканей для диагностики делает метод инвазивным и травматичным для пациента.
2) Для измерений использован водородный электрод сравнения, что весьма опасно ввиду взрывоопасности газообразного водорода.
3) Не предусмотрена предварительная обработка поверхности многоразового платинового электрода, без которой, как известно, невозможно получение воспроизводимых результатов измерений редокс потенциала [Goldin Mark M., Volkov A.G., Khubutiya M.Sh., Kolesnikov V.A., Blanchard G.J., Evseev A.K., Goldin Mikhail M., Teselkin Yu.O., Davydov B.V. Redox Potential Measurement in Aqueous Solutions and Biological Media // ECS Transactions, 2008, 11 (21), P.39-49].
Известен электрохимический способ измерений редокс потенциала биологических сред, отличительным признаком которого является предварительная обработка платинового электрода. Стандартизация состояния поверхности рабочего электрода, позволяет получить точные и воспроизводимые результаты измерений редокс потенциала [Хубутия М.Ш., Ваграмян Т.А., Гольдин М.М., Степанов А.А., Ян-Борисова Л.М., Евсеев А.К. Способ измерения редокс потенциала биологических сред. Заявка 2012102137/28, опубл. 27.07.2013, бюл. 21]. Согласно указанному способу имеется возможность получения диагностической информации о состоянии пациента.
Недостатками способа являются:
1) для проведения диагностики использован лишь качественный параметр - изменение измеренной величины РП в положительную область. Нет количественного признака, отличающего патологическое состояние от нормального;
2) способ не содержит сведений о величинах и знаках величин РП, ограничивающих область значений РП для статистически достоверной группы здоровых людей;
3) использование величины смещения РП исключительно в область положительных потенциалов в качестве единственного отличительного признака патологических состояний сужает область применения, так как имеются данные об обратном направлении эффекта смещения потенциала [Хубутия М.Ш., Евсеев А.К., Колесников В.А., Гольдин М.М., Давыдов А.Д., Волков А.Г., Степанов А.А. Измерения потенциала платинового электрода в крови, плазме и сыворотке крови // Электрохимия, 2010, Т.46, с.569-573].
4) способ невозможно использовать для диагностики пациентов с трансплантированными органами, поскольку в описании способа не содержится сведений об областях потенциалов, соответствующих указанным группам пациентов.
Известен способ измерения и использования окислительного стресса для диагностики патологических состояний [D. Bar-Or, R. Bar-Or, Measurement and uses oxidative stress. Patent US 12/625,072 от 24.09.2009]. Согласно этому способу производят измерения редокс потенциалов в образцах жидких сред организма пациента. Если измеренные величины лежат положительнее диапазона величин РП здоровых людей, диагностируют состояние окислительного стресса. Согласно указанному способу измерения РП могут быть полезными для диагностики, оценки и мониторинга пациентов с острой травмой головы, подозрением или наличием перенесенного инфаркта миокарда, инфекционных заболеваний и пациентов в критических состояниях или с подозрением на наличие критического состояния.
Недостатками способа являются:
1) Методика измерения редокс потенциала платиновым микроэлектродом без предварительной его обработки не позволяет получать воспроизводимые данные (Goldin Mark M., Volkov A.G., Khubutiya M.Sh., Kolesnikov V.A., Blanchard G.J., Evseev A.K., Goldin Mikhail M., Teselkin Yu.O., Davydov B.V. Redox Potential Measurement in Aqueous Solutions and Biological Media // ECS Transactions, 2008, 11 (21), P.39-49. Хубутия М.Ш., Евсеев A.К., Колесников В.А., Гольдин М.М., Давыдов А.Д., Волков А.Г., Степанов А.А. Измерения потенциала платинового электрода в крови, плазме и сыворотке крови // Электрохимия, 2010, Т.46, с.569-573).
2) Время измерений величины редокс потенциала не стандартизовано, что, как показано в работе Goldin Mark M. et al. (ECS Transactions, 2008, 11 (21), P.39-49), является необходимым для получения достоверных данных.
3) Использование для проведения диагностики только одного параметра - измеренной величины РП ограничивает применимость способа.
4) Использование величины смещения РП исключительно в области положительных потенциалов в качестве единственного отличительного признака патологических состояний сужает область применения способа, так как имеются данные об обратном направлении эффекта смещения потенциала [Хубутия М.Ш., Евсеев А.К., Колесников В.А., Гольдин М.М., Давыдов А.Д., Волков А.Г., Степанов А.А. Измерения потенциала платинового электрода в крови, плазме и сыворотке крови // Электрохимия, 2010, Т.46, с.569-573].
5) Способ не содержит диагностических критериев, свидетельствующих о начале заболевания и прогнозе его протекания.
6) Способ невозможно использовать для диагностики пациентов с трансплантированными органами, поскольку в описании способа не содержится сведений об областях потенциалов, соответствующих указанным группам пациентов.
Наиболее близким аналогом предлагаемого способа является способ диагностики отторжения трансплантированной почки [Василенко И.А., Ватазин А.В., Метелин В.Б., Арзуманов С.В., Валов А.Л. Способ диагностики отторжения почечного аллотрансплантата. Патент РФ №2348932], основанный на изучении показателей живых лимфоцитов (высота и диаметр) методом фазово-интерференционной микроскопии, по которым получают значение показателя гетерогенности ядерных структур.
Недостатками метода являются:
- сложность,
- необходимость использования весьма дорогостоящего уникального импортного оборудования,
- высокая квалификация персонала,
- длительность процедуры анализа.
Достигаемый в предлагаемом методе технический результат заключается в использовании диагностических и прогностических критериев, основанных на мониторировании величин РП плазмы крови, для ранней неинвазивной диагностики дисфункции трансплантата и развития криза отторжения, что сократит время анализа, обеспечит возможность принятия своевременных мер для предотвращения отторжения трансплантата и улучшит качество лечения пациента.
Способ осуществляется следующим образом.
Величину РП измеряют с помощью точечного платинового электрода относительно хлорсеребряного электрода, причем перед измерением платиновый электрод предварительно обрабатывают с помощью катодно-анодного сканирования в растворе неорганического восстановителя в циклическом потенциодинамическом режиме согласно методике, описанной в [Хубутия М.Ш., Евсеев А.К., Колесников В.А., Гольдин М.М., Давыдов А.Д., Волков А.Г., Степанов А.А. Измерения потенциала платинового электрода в крови, плазме и сыворотке крови. Электрохимия, 2010, Т.46, С.569-573]. Для того чтобы определить величину РП, измеряют потенциал платинового электрода в течение 15 мин.
Мониторинг РП у пациентов с трансплантированными органами дает возможность ежесуточно сравнивать измеренные величины РП. Изменение величины РП в одном направлении за сутки или несколько суток более 25 мВ сигнализирует о наличии или высоком риске развития дисфункции трансплантата или высоком риске развития криза отторжения трансплантата, при выявлении изменения величины РП менее 25 мВ судят о нормальном состоянии пациента.
Пример 1
Определение области величин РП для группы практически здоровых людей и для групп пациентов с трансплантированными органами было проведено с помощью определения величин РП. Группа здоровых состояла из 63 человек, группа пациентов с трансплантированной печенью - из 64 пациентов, почкой - 59 пациентов и легкими - 6 пациентов. Перед проведением измерения в плазме крови платиновый электрод подвергали катодно-анодной обработке в водном растворе 0,1 М Na2SO3. После этого проводили измерение редокс потенциала плазмы крови пациента, см. таблицу 1. Величины редокс потенциалов плазмы крови практически здоровых людей (n=63) и пациентов после трансплантации печени (n=64), почки (n=59) и легких (n=6).
| N | Величина | Практически здоровые люди | Пациенты после трансплантации печени | Пациенты после трансплантации почки | Пациенты после трансплантации легкого |
| 1 | Пациентов в группе | 63 | 64 | 59 | 6 |
| 2 | Количество анализов | 63 | 615 | 967 | 72 |
| 3 | Пол: | ||||
| мужской | 46 | 40 | 42 | 4 | |
| женский | 17 | 24 | 17 | 2 | |
| 4 | Среднее, мВ | -33,7 | 9,1 | 7,8 | -55,2 |
| 5 | Стандартная ошибка, мВ | 2,8 | 1,0 | 0,8 | 2,6 |
Как видно из таблицы 1, для пациентов с трансплантированными органами характерно смещение величины редокс потенциала в положительную область значений, для пациентов с трансплантированным легким - в отрицательную область значений относительно группы здоровых людей.
Эти данные свидетельствуют о том, что при проведении диагностики осложнений у пациентов с трансплантированными органами необходимо принимать во внимание не только изменения величины РП в положительную область потенциалов, но и в отрицательную.
Пример 2
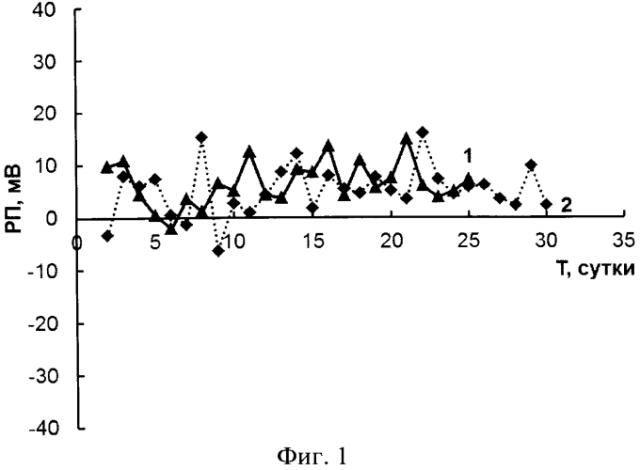
Был проведен ежедневный мониторинг величины редокс потенциала плазмы крови пациента Б. после операции трансплантации почки и пациента К. после операции трансплантации печени. Перед проведением измерения в плазме крови платиновый электрод подвергали катодно-анодной обработке в водном растворе 0,1 М Na2SO3 50-ю циклами катодно-анодных импульсов напряжения со скоростью 500 мВ/с в диапазоне потенциалов от -600 до +600 мВ относительно хлорсеребряного электрода сравнения и платинированным титаном в качестве вспомогательного электрода, после этого платиновый электрод сканировали 10-ю циклами в диапазоне потенциалов от +100 до +200 мВ при скорости развертки 500 мВ/с. После этого проводили измерение редокс потенциала плазмы крови пациента (Фиг.1. Мониторинг РП пациента Б. (1) после трансплантации почки и пациента К. (2) после трансплантации печени).
Как видно из данных, представленных на Фиг.1, при проведении мониторинга редокс потенциалов во время послеоперационного периода пациентов Б. и К. максимальная разница величин РП составила 22 мВ у пациента К. (с 8-х на 9-е сутки), у пациента Б. эта разница составила 14 мВ (за период с 3-х по 6-е сутки). Согласно этим данным имеются основания судить о нормальном состоянии пациента в течение послеоперационного периода при выявлении изменения величины РП менее 25 мВ. Это подтверждено записями в историях болезни пациентов Б. и К., послеоперационный период у обоих пациентов действительно протекал без осложнений.
Пример 3
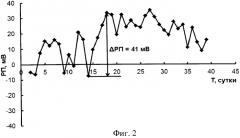
После операции трансплантации почки был проведен ежедневный мониторинг величины редокс потенциала плазмы крови пациента П., результаты которого представлены на Фиг.2 (Фиг. 2 - Мониторинг РП пациента П. после трансплантации почки).
Перед проведением измерения в плазме крови платиновый электрод подвергали катодно-анодной обработке в водном растворе 0,1 М Na2SO3 50-ю циклами катодно-анодных импульсов напряжения со скоростью 500 мВ/с в диапазоне потенциалов от -600 до +600 мВ относительно хлорсеребряного электрода сравнения и платинированным титаном в качестве вспомогательного электрода, после этого платиновый электрод сканировали 10-ю циклами в диапазоне потенциалов от +100 до +200 мВ при скорости развертки 500 мВ/с. После этого проводили измерение редокс потенциала плазмы крови пациента (Фиг.2).
Как видно из данных, представленных на Фиг.2, с 12 по 14 сутки имел место сдвиг величины РП в отрицательную область суммарно на 29 MB, после чего РП начался постоянный сдвиг потенциала в положительную область суммарно на 41 мВ с 15 по 18 сутки. Эти данные позволили поставить предположительный диагноз «дисфункция трансплантата», а учитывая высокие цифры суммарного сдвига с 15 по 18 сутки, вероятно возникновение криза отторжения трансплантированной почки.
Дальнейший контроль величины РП в процессе мониторинга выявил незначительные величины изменения величин РП вплоть до 40 суток мониторинга, что указывает на отсутствие осложнений при дальнейшем лечении пациента П. Отметим также, что величина РП пациента П. при выписке находилась в диапазоне, соответствующем группе пациентов с трансплантированной почкой, послеоперационный период которых протекал без осложнений.
Из истории болезни пациента П. следует, что на 25 сутки действительно имел место криз отторжения почки, подтвержденный гистологически после процедуры биопсии. Подтверждено также отсутствие острой симптоматики и изменений биохимических параметров пациента П. при дальнейшем лечении вплоть до его выписки из стационара, поскольку своевременно было предпринято проведение пациенту П. экстренного лечения состояния криза. Согласно данным в истории болезни была проведена пульстерапия, перфузия аутоплазмы и плазмаферез.
Таким образом, этот пример иллюстрирует диагностические и прогностические возможности предлагаемого способа при мониторинге пациентов с трансплантированной почкой.
Пример 4
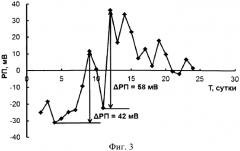
Ежедневный мониторинг величины редокс потенциала плазмы крови пациента Кр. после операции трансплантации печени был проведен. Перед проведением измерения в плазме крови платиновый электрод подвергали катодно-анодной обработке в водном растворе 0,1 М Na2SO3 50-ю циклами катодно-анодных импульсов напряжения со скоростью 500 мВ/с в диапазоне потенциалов от -600 до +600 мВ относительно хлорсеребряного электрода сравнения и платинированным титаном в качестве вспомогательного электрода, после этого платиновый электрод сканировали 10-ю циклами в диапазоне потенциалов от +100 до +200 мВ при скорости развертки 500 мВ/с. Затем измеряли потенциал платинового электрода в водном растворе 0,1 М Na2SO4 относительно хлорсеребряного электрода сравнения, оно составляло 199 мВ. После этого проводили измерение редокс потенциала плазмы крови пациента (Фиг.3 - Мониторинг РП пациента Кр. после трансплантации печени).
Как видно из данных, представленных на Фиг.3, с 7 по 9 сутки зафиксировано изменение величины РП суммарно на 34 мВ, затем обратный сдвиг в отрицательную область потенциалов имел место с 9 по 11 сутки, суммарно сдвиг составил 30 мВ. Наконец, последовало резкое изменение РП 60 мВ с 11 на 12 сутки. Следующий период до выписки пациента К. на 24 сутки резких изменений величины РП не наблюдалось. Эти данные позволили предположить, что с 7 по 9 сутки имела место угроза дисфункции трансплантированной печени, ситуация усугубилась с 11 по 12 сутки. Затем, как видно из данных мониторинга РП, значительных сдвигов величины РП не наблюдалось.
Сопоставление данных мониторинга РП с данными, зафиксированными в истории болезни пациента Кр. У пациента Кр. в послеоперационном периоде с 8 по 14 сутки была диагностирована дисфункция трансплантированной печени, выразившаяся в холестазе. С 9 по 11 сутки пациенту Кр. проведено лечение холестаза, что совпало со сдвигом РП в отрицательную область. Наконец, после 14 суток холестаз был разрешен, что совпало с постепенным смещением величин РП в область отрицательных значений. Важно, что после разрешения холестаза не зафиксировано существенных изменений величин РП вплоть до выписки пациента Кр. из стационара. Отметим также, что величина РП при выписке пациента Кр. находилась в диапазоне потенциалов, соответствующем группе пациентов с трансплантированной печенью, послеоперационный период которых протекал без осложнений.
Таким образом, этот пример иллюстрирует диагностические и прогностические возможности предлагаемого способа при мониторинге пациентов с трансплантированной печенью.
Способ мониторинга состояния пациента после трансплантации органа, заключающийся в том, что после трансплантации производят мониторинг редокс потенциала (РП) плазмы крови пациента, для чего ежедневно определяют РП плазмы крови пациента с помощью платинового электрода относительно хлорсеребряного электрода, при этом платиновый электрод предварительно обрабатывают с помощью катодно-анодного сканирования в растворе неорганического восстановителя в циклическом потенциодинамическом режиме, при проведении ежедневного мониторинга величины РП плазмы крови пациента выявляют изменения величин РП в одном направлении за сутки или несколько суток, при этом при выявлении изменения РП более 25 мВ за сутки или несколько суток судят о наличии дисфункции трансплантата или высоком риске развития криза отторжения трансплантата, при выявлении изменения величины РП менее 25 мВ судят о нормальном состоянии пациента.