Перезаряжаемый электрохимический элемент
Иллюстрации
Показать всеИзобретение относится к области электротехники, в частности к перезаряжаемому электрохимическому элементу аккумуляторной батареи, имеющему корпус, положительный электрод, отрицательный электрод и электролит, содержащий двуокись серы и электропроводящую соль активного металла элемента. Общее количество кислородсодержащих соединений в элементе, способных вступать в реакцию с двуокисью серы и восстанавливать двуокись серы, составляет не более 10 ммолей на ампер-час теоретической зарядной емкости элемента. Повышение циклических характеристик перезаряжаемого элемента является техническим результатом изобретения. 21 з.п. ф-лы, 5 ил., 3 табл.
Реферат
Изобретение относится к перезаряжаемому электрохимическому элементу аккумуляторной батареи, имеющему положительный электрод, отрицательный электрод и электролит, который содержит двуокись серы (SO2) и электропроводящую соль активного металла элемента.
Перенос заряда, необходимый для зарядки и разрядки элемента, основан на подвижности ионов электропроводящей соли в электролите. В частности, электролит может представлять собой жидкость или гель. В содержащих SO2-электролитах (далее - SO2-электролиты) SO2 повышает подвижности ионов электропроводящей соли, которая осуществляет этот перенос заряда. Таким образом, SO2 служит растворителем электропроводящей соли. Электролит может содержать другой растворитель помимо SO2, повышающий подвижность ионов электропроводящей соли. Такими растворителями могут являться неорганические растворители (например, сульфурилхлорид, тионилхлорид), органические растворители и ионные жидкости, которые могут использоваться по отдельности или в смеси. В целях изобретения предпочтительным является раствор электролита, который не только содержит SO2 в низкой концентрации в качестве добавки, но у которого подвижность ионов электропроводящей соли также главным образом, предпочтительно целиком, обеспечивает SO2.
Давно известно, что SO2-электролиты обладают значительными преимуществами (см. "The Handbook of Batteries", автор - David Linden, 1994 г., издательство McGraw Hill). Одним из этих преимуществ является то, что они имеют в 5-10 раз более высокую удельную проводимость, чем у органических электролитов, обычно используемых в ионно-литиевых элементах аккумуляторной батареи. Это обеспечивает более сильный зарядный и разрядный ток, что, в свою очередь, обеспечивает высокую плотность мощности. Высокая удельная проводимость электролита также выгодна с точки зрения зарядной емкости элемента, поскольку при этом можно использовать относительно толстые электроды с высокой зарядной емкостью активного металла элемента.
Элементы различного типа, содержащие SO2-электролит, отличаются друг от друга в основном используемым активным металлом и электропроводящей солью, а также материалами, которые используются в положительном и отрицательном электродах. Настоящее изобретение относится, в частности, к элементам аккумуляторной батареи, обладающим следующими признаками.
а) Активным металлом предпочтительно является щелочной металл, в частности литий или натрий. В этом случае электропроводящей солью предпочтительно является четырехгалоидный алюминат, более предпочтительно тетрахлоралюминат щелочного металла, например LiAlCl4. Во всяком случае в любом анионе электролита содержится, по меньшей мере, 1 моль электропроводящей соли на 22 моля SO2. Предпочтительно верхним пределом молярной концентрации является 1 моль электропроводящей соли на 0,5 моля SO2. В контексте изобретения предпочтительные активные металлы помимо щелочных металлов также включают щелочноземельные металлы и металлы второй подгруппы периодической системы, в частности кальций и цинк. В частности, применимыми электропроводящими солями являются их галогениды, оксалаты, бораты, фосфаты, арсенаты и галлаты.
б) Положительный электрод предпочтительно содержит (для накопления активного металла) окись металла или фосфат металла в виде интеркалированного соединения. Металлом в окиси или фосфате предпочтительно является переходный металл с порядковым номером от 22 до 28, в частности кобальт, марганец, никель или железо. Особое практическое значение также имеют двойные или тройные окиси или фосфаты, содержащие два или три различных переходных металла в структуре основы, такие как литий-никель-кобальтовая окись. Тем не менее изобретение также может применяться в сочетании с другими положительными электродами, например, на основе галоида металла, такого как CuCl2.
в) Отрицательным электродом предпочтительно является вставной электрод. Этим термином обычно обозначаются электроды, активный металл в которых содержится в доступном для обмена с электролитом виде при зарядке и разрядке элемента. В частности, как в целом, так в целях зрения настоящего большое значение имеют содержащие графит отрицательные электроды, активный металл в которых поглощается графитом во время зарядки элемента (ионно-литиевого элемента). При нормальной зарядке элемента на поверхности электрода не осаждается активный металл.
Вместе с тем, изобретение также относится к элементам, активный металл в которых осаждается на отрицательном электроде (литий-металлические элементы). В этом контексте, в частности, предпочтительно, чтобы отрицательный электрод имел пористый осажденный слой, поры которого поглощают активную массу во время зарядки. Такой электрод также называется вставным электродом (в более широком смысле). В таком осажденном слое может использоваться, например, стеклоткань с диаметром пор, по меньшей мере, 6 µм.
г) Необходимая электрическая сепарация положительного и отрицательного электродов может обеспечиваться с помощью разделителя или изолятора.
Разделитель представляет собой структуру, которая препятствует проникновению металлического лития, осаждающегося на отрицательном электроде, на поверхность положительного электрода. В элементах, содержащих SO2-электролит, в частности, применимы керамические материалы с диаметром пор не более 1 µм и инертные полимерные материалы или также смеси двух материалов. Обычно также могут использоваться разделители из полиэтилена (РЕ), полипропилена (РР) или этилентетрафторэтилена (ETFE). Тем не менее зарядные устройства для элементов такого рода должны быть рассчитаны на предотвращение избыточной зарядки во избежание нежелательных реакций.
В этом смысле под изолятором подразумевается структура, которая электрически разделяет положительные и отрицательные электроды, но не препятствует проникновению металлического лития на поверхность положительного электрода. Как указано в WO 2005/031908, возникающие при этом ограниченные местные короткие замыкания необязательно опасны и даже могут оказывать благоприятное воздействие. Изолятор предпочтительно одновременно служит осажденным слоем.
В указанных далее документах содержится более подробная информация об элементах аккумуляторной батареи с SO2-электролитами:
(1) патент US 5213914
(2) WO 00/79631 и патент US 6730441
(3) WO 2005/031908 и US 2007/0065714
(4) WO 2008/058685 US 2010/0062341
(5) WO 2009/077140.
В основу изобретения положена задача создания элементов аккумуляторной батареи с SO2-электролитом, обладающих улучшенными свойствами, в частности, что касается длительной работы с большим числом зарядных и разрядных циклов.
Решение этой задачи обеспечивается посредством перезаряжаемого электрохимического элемента аккумуляторной батареи, имеющего корпус, положительный электрод, отрицательный электрод и электролит, содержащий двуокись серы и электропроводящую соль активного металла элемента, отличающегося тем, что общее количество содержащихся в элементе окисей, способных вступать в реакцию с двуокисью серы и восстанавливать двуокись серы, не превышает 10 ммолей на каждый ампер-час теоретической емкости элемента.
Применительно к настоящему изобретению было установлено, что некоторые кислородосодержащие загрязнители способны серьезно сокращать длительность работы элементов аккумуляторной батареи, которые имеют электролит, содержащий SO2. Ими являются кислородосодержащие соединения, способные вступать в реакцию с двуокисью серы и восстанавливать двуокись серы, иными словами способные вступать в такую реакцию в условиях, которые могут возникать на протяжении эксплуатации батареи. Такого рода кислородосодержащие соединения именуются далее "повреждающими окисями" в качестве неограничивающего обозначения. Поскольку рассматриваемые реакции часто являются чрезвычайно замедленными, они протекают в течение очень длительного времени. Тем не менее с учетом того, что батареи должны сохранять свои функции в течение длительного времени (нескольких лет), их работы все же ухудшают даже такие замедленные реакции.
Это замечание относится как к ионно-литиевым элементам, так и литий-металлическим элементам. Применительно к настоящему изобретению было установлено, что присутствие металлического лития не сказывается на реакциях, в которых участвуют повреждающие окиси. Дело обстоит так безотносительно возможных местных коротких замыканий (изолятор) или эффективного разделения активного металла и положительного электрода (разделитель). В обоих случаях даже небольшое количество повреждающих окисей способно весьма значительно снижать емкость элемента. В частности, как ни удивительно, повреждающие окиси даже в очень низких концентрациях способны существенно ухудшать работу элемента. Например, элемент размера Sub С, который был испытан применительно к настоящему изобретению, имеет теоретическую разрядную емкость 2,3 ампер-часа. Всего 5-10 ммолей повреждающей окиси способно настолько серьезно влиять на работу такого элемента, что во время длительной эксплуатации с большим числом зарядных и разрядных циклов его емкость снижается до нуля.
Теоретическая зарядная емкость элемента зависит от его электродов. Применительно к настоящему изобретению теоретическая емкость положительного электрода принимается равной теоретической емкости элемента. Она представляет собой максимальный теоретический заряд активного металла, который может накапливаться в электроде, т.е. величину электрического заряда, соответствующую максимальному количеству активного металла, которое согласно стехиометрической формуле может содержаться в положительном электроде. Эта величина всегда превышает фактически достижимую максимальную емкость электрода (и, соответственно, также элемента), поскольку на практике заряд, который теоретически может накапливаться, никогда не может быть полностью извлечен из электрода.
Если содержание повреждающих окисей в элементе является меньшим, чем предельные величины, определенные применительно к настоящему изобретению, тем самым значительно увеличивается срок службы элемента. В частности, сохраняется преимущественно стабильная зарядная емкость на протяжении большого числа зарядных и разрядных циклов. Также значительно повышается устойчивость к избыточной зарядке, т.е. даже в случае избыточной зарядки работе элемента не причиняется ущерб.
Как было пояснено выше, изобретение относится в основном к элементам с электролитом, содержание SO2 в котором настолько высоко, что подвижность ионов электропроводящей соли зависит главным образом или даже целиком от присутствия SO2. Минимальное количество SO2 на ампер-час теоретической емкости элемента предпочтительно составляет 1 ммоль, более предпочтительно 5 ммолей, особо предпочтительно 10 ммолей в каждом случае относительно теоретической емкости элемента.
Ознакомившись с изобретением, обеспечиваемый им результат можно объяснить множеством реакций, протекающих обычно с участием нескольких элементов (электродов, электролита). Это будет пояснено далее со ссылкой на электрохимический элемент, имеющий отрицательный электрод на угольной основе и положительный электрод на основе окиси металла.
а) Реакции с участием повреждающих окисей во время зарядки и разрядки
Как полагают авторы изобретения, во время нормальной зарядки и разрядки элемента (без избыточной зарядки) в результате реакции с участием описанных выше повреждающих окисей происходит восстановление двуокиси серы и, в конечном итоге, потеря зарядной емкости.
а1) Прямая реакция с участием повреждающих окисей, присутствующих на активном веществе отрицательного электрода
Типичным кислородосодержащим загрязнителем на активном веществе отрицательного угольного электрода является окись С6О. Она вступает в реакцию с LiC6 электрода и SO2 электролита с участием шести электронов (е") согласно следующей формуле:
( 1 ) 6 L i C 6 + C 6 O + 2 S ( + I V ) O 2 → 7 C 6 + L i 2 S ( + I I ) 2 O 3 + 2 L i 2 O ; потребляемый заряд 6 е-.
Продуктами реакции являются углерод (С6), тиосульфат лития (Li2S2O3) и окись лития (Li2O).
Заключенными в скобки римскими цифрами в надстрочных индексах обозначена степень окисления серы в соответствующем соединении. В ходе реакции степень окисления серы снижается в два раза. Таким образом, двуокись серы восстанавливается с образованием тиосульфата лития.
а2) Косвенная реакция с участием повреждающих окисей, присутствующих на активном веществе отрицательного электрода
Присутствие повреждающей окиси C6O является косвенной причиной следующей последовательности реакции с сопровождающим их восстановлением двуокиси серы и образованием в конечном итоге тиосульфата лития:
( 2 ) 2 L i 2 O + 2 A l C l 3 → 2 A l O C l + 4 L i C l ;
( 3 ) 4 L i 2 S ( + I I I ) 2 O 4 + 2 A l O C l + 2 A l C l 3 + 8 L i C 6 + → 4 L i 2 S ( + I I ) 2 O 3 + 2 A l 2 O 3 + 8 L i C l + 8 C 6 ; потребляемый заряд 8 е-.
Согласно реакции (2) окись лития, образующаяся в ходе реакции (1), вступает в реакцию с хлоридом алюминия (AlCl3), представляющим собой льюисовскую кислоту, которая обычно присутствует в электролите вследствие автодиссоциации электропроводящей соли, в результате чего образуется оксихлорид алюминия (AlOCl) и хлорид лития (LiCl). Тем не менее электропроводящая соль в нейтральной форме (LiAlCl4) также может вызывать растворение Li2O и дальнейшую реакцию с Li2S2O4:
( 2 ' ) 2 L i 2 O + 2 L i A l C l 4 → 2 L i A l O C l 2 + 4 L i C l ;
( 3 a ) 4 L i 2 S ( + I I I ) 2 O 4 + 2 L i A l O C l 2 + 2 L i A l C l 4 + 8 L i C 6 → 4 L i 2 S ( + I I ) 2 O 3 + 2 A l 2 O 3 + 12 L i C l + 8 C 6 ; потребляемый заряд 8 е-.
Что касается последующей реакции (3а), следует отметить, что у элементов этого типа имеется защитный слой дитионита лития (обычно выгодный и, следовательно, желательный для работы элемента). Этот защитный слой формируется согласно формуле
( 4 a ) 8 L i C 6 + 8 S O 2 → 8 C 6 + 4 L i 2 S 2 O 4 ; потребляемый заряд 8 е-
из LiC6-электрода и SO2-электролита с участием восьми электронов. Он состоит из дитионита лития (Li2S2O4). Далее это соединение, образующее защитный слой, вступает в реакцию (3а). В свою очередь, восстанавливается содержащаяся в дитионите лития SO2 (степень окисления серы снижается с +III до +II), и образуется тиосульфат лития.
Присутствие одной молекулы С6О приводит к потреблению в общей сложности 10 молекул SO2 и 22 е- (при этом образуется 5 молекул Li2S2O3). Иначе говоря, это значит, что на каждый ммоль С6О необратимо потребляется 594 миллиампер-час заряда.
В предыдущих расчетах также необходимо учитывать растворимость продуктов реакции тиосульфата лития (Li2S2O3) и окиси лития (Li2O), образующихся в результате реакции (1). Если Li2O не растворяется, реакция (2) не может происходить, и также не происходят последующие реакции (3а) и (4а). Следовательно, потребляемый заряд в результате реакции (1) составляет всего 6е-. Иными словами, в этом случае на каждый ммоль С6О необратимо потребляется 162 миллиампер-час заряда.
Если Li2O растворяется, а Li2S2O3 не растворяется, реакция (4а) не происходит. В этом случае потребляемый заряд снижается до 14е-. Это значит, что на каждый ммоль С6О необратимо потребляется 378 миллиампер-час заряда.
Таким образом, потери емкости, обусловленные повреждающими окисями на активном веществе отрицательного электрода, составляют от 162 до 564 миллиампер-час в зависимости от растворимости упомянутых компонентов (а также в числе прочих факторов от температуры и концентрации SO2).
а3) Реакции, обусловленные повреждающими окисями на активном веществе положительного электрода
Типичным кислородосодержащим загрязнителем на активном веществе положительного электрода является гидроксид, который образуется на его поверхности. В случае электрода на основе окиси металлического лития общей формулы LiMeO2 им может являться, например, LiMeO(OH)2. Он вступает в реакцию с AlCl3 в электролите согласно следующей формуле с образованием оксихлорида алюминия, хлорида металла Me, HCl и LiCl:
( 5 ) L i M e O ( O H ) 2 + 3 A l C l 3 → 3 A l O C l + M e C l 3 + 2 H C l + L i C l .
Гидроксид также может вступать в реакцию с электропроводящей солью в нейтральной форме согласно:
( 5 ' ) L i M e O ( O H ) 2 + 3 L i A l C l 4 → 3 L i A l O C l 2 + M e C l 3 + 2 H C l + L i C l .
Образующийся в результате оксихлорид алюминия дополнительно вступает в реакцию с защитным слоем дитионита лития, как показано в следующих формулах (3b) и (4b). Поскольку эти формулы отличаются от формул (3а) и (4а) только молярной концентрацией, нет необходимости еще раз полностью пояснять их:
( 3 b ) 6 L i 2 S ( + I I I ) 2 O 4 + 3 A l O C l + 3 A l C l 3 + 12 L i C 6 + → 4 L i 2 S ( + I I ) 2 O 3 + 2 A l 2 O 3 + 12 L i C l + 12 C 6 ; потребляемый заряд 12 е-.
Разумеется, что в этом случае также возможен путь протекания реакции через оксихлорид литий-алюминия (LiAlOCl2) по аналогии с реакцией (3а').
( 4 b ) 12 L i C 6 + 12 S O 2 → 12 C 6 + 6 L i 2 S 2 O 4 ; потребляемый заряд 12 е-.
В целом, присутствие одной молекулы LiMeO(OH)2 приводит к потреблению 12 молекул SO2 и 24 е- с образованием 6 молекул Li2S2O3 и 2 молекул HCl (при этом в качестве промежуточного продукта образуются 3 молекулы AlOCl). Потребляемый заряд эквивалентен величине заряда в 702 миллиампер-час на каждый ммоль LiMeO(OH)2. Кроме того, в одной молекуле LiMeO(OH)2 литий больше не доступен в качестве активного металла. Это соответствует дополнительной потере емкости в 27 миллиампер-час на ммоль LiMeO(OH)2. Соответственно, если реакции протекают до завершения, потеря емкости составляет 729 миллиампер-час на ммоль LiMeO(OH)2. Это соответствует 243 миллиампер-час на моль кислорода, поскольку каждый моль повреждающей окиси содержит три моля кислорода.
Как упоминалось ранее, реакции (3b) и (4b) происходят только, когда тиосульфат лития, образующийся согласно реакции (3а), растворен с последующим образованием дитионита лития согласно реакции (4b). Если этого не происходит, потребление заряда снижается до 12 е-. Это эквивалентно необратимой потере емкости в 351 миллиампер-час на каждый ммоль LiMeO(OH)2. И в этом случае к ней следует прибавить потерю емкости в 27 миллиампер-час, обусловленную потреблением активного металла. В этом случае общая потеря емкости составляет 378 миллиампер-час, т.е. 126 миллиампер-час на моль кислорода.
а4) Реакции, обусловленные повреждающими окисями в растворе электролита
Другие кислородосодержащие загрязнители образуются при изготовлении раствора электролита или вследствие реакций раствора электролита с другими компонентами элемента (например, корпусом, разделителем, съемниками тока в электроды и из электродов. Обычно ими являются кислые (AlOCl) или нейтральные (LiAlOCl2) оксихлориды алюминия, вызывающие следующие реакции, при этом реакции (3с) и (4с) и в этом случае эквивалентны реакциям (3а) и (4а) за исключением молярной концентрации.
( 3 c ) 2 L i 2 S ( + I I I ) 2 O 4 + A l O C l + A l C l 3 + 4 L i C 6 → 2 L i 2 S ( + I I ) 2 O 3 + 2 A l 2 O 3 + 4 L i C l + 4 C 6 ; потребляемый заряд 4 е-.
И в этом случае возможен альтернативный путь протекания реакции по аналогии с реакцией (3a').
( 4 c ) 4 L i C 6 + 4 S O 2 → 4 C 6 + 2 L i 2 S 2 O 4 ; потребляемый заряд 4 е-. Присутствие одной молекулы А10С1 приводит к потреблению 4 молекул SO2 и 8 е-, при этом образуются 2 молекулы Li2S2O3. Соответствующий потребляемый заряд составляет 216 миллиампер-час на каждый ммоль AlOCl.
Если тиосульфат лития не растворен, в этом случае потребляемый заряд соответственно также снижается до 4 е-. Это эквивалентно емкости в 108 миллиампер-час.
Съемники тока в электроды и из электродов часто изготавливаются из никеля или никелевого сплава. Поверхность этих компонентов может окисляться, иными словами может содержать окись никеля. Если эта окись никеля (еще) не растворилась в растворе электролита, может происходить прямая реакция по аналогии с реакцией (1) с образованием Li2S2O3 при зарядке элемента.
b) Побочные реакции вследствие распределения окисей во время избыточной зарядки
В случае избыточной зарядки элемента увеличивается зарядное напряжение. При превышении определенного напряжения, которое изменяется в зависимости от типа элемента, это увеличение зарядного напряжения приводит к распаду раствора электролита. Если раствор содержит, например, тетрахлоралюминат в качестве электропроводящей соли, на положительном электроде в качестве продукта избыточной зарядки образуется хлор (Cl2). Это, в свою очередь, вызывает ряд других реакций тиосульфата лития, образующегося в ходе описанных выше реакций, с хлором, диффундировавшим на отрицательный электрод, и с LiC6 отрицательного электрода. В ходе этих реакций происходит перераспределение серы до достижения степени окисления -II в одном конечном продукте и степени окисления +VI в другом конечном продукте. Примерами конечных продуктов со степенью окисления -II являются сульфиды металлов (такие как L i 2 S ( − I I ) или A l 2 S ( − I I ) 3 ). Одним из примеров конечного продукта со степенью окисления +VI является хлорсульфонат лития (LiSO3Cl).
Эта многостадийная реакция может быть представлена следующей окончательной формулой:
( 6 ) 6 L i C 6 + L i 2 S 2 O 3 + 3 C l 2 → 6 C 6 + L i S ( + I V ) O 3 C l + L i S ( − I I ) + 5 L i C l
Для восстановления одной молекулы L i 2 S ( + I I ) 2 O 3 до соединений серы в соответствии с реакцией (6) требуется 6 е-. Иными словами, это значит, что необратимая потеря емкости в ходе реакции одного ммоля тиосульфата лития составляет 162 миллиампер-час.
Таким образом, продемонстрировано, что присутствие повреждающих окисей приводит к образованию кислородного соединения серы при нормальной зарядке и разрядке элемента (без избыточной зарядки), при этом окисление серы в этом соединении может достигать максимальной степени +III. Одним из важных примеров является тиосульфат активного металла (тиосульфат лития в случае литиевого элемента). В ходе последовательности реакций происходит восстановление двуокиси серы в электролите. В случае избыточной зарядки, в результате которой образуются продукты избыточной зарядки, происходят дальнейшие реакции, в ходе которых сера тиосульфата перераспределяется с образованием соединений серы со степенями окисления -II и +VI. Характерным продуктом реакции, который образуется в случае избыточной зарядки элемента в присутствии повреждающих окисей, является хлорсульфонат активного металла. В литиевом элементе им является хлорсульфонат лития. Количество электрического заряда, необходимое для этих реакций, обеспечивается элементом и уже недоступно в качестве полезной емкости батареи.
Подразумевается, что упомянутые выше повреждающие окиси являются примерами повреждающих окисей всех типов (в смысле данного выше определения), которые присутствуют на или в веществах элемента.
Например, положительный электрод может содержать повреждающие окиси в виде различных оксидсодержащих соединений, присутствующих на поверхности вещества электрода. В их число входят гидроксиды (включая воду), оксид-дигидроксиды, карбонаты, бораты и др.
Аналогичным образом, соединение С6О служит упрощенным примером кислорода, связывающего отрицательный угольный электрод. Графитовая поверхность содержит ковалентно связанный кислород, например, в форме кетонов, альдегидов, карбонилов, спиртов, эпоксидов, карбоновых кислот и др. Кислород также может присутствовать в форме адсорбированной воды или адсорбированной гидроокиси металла и т.п.
Тем не менее авторами было установлено, что общим свойством всех повреждающих окисей является их способность вступать в реакцию с двуокисью серы в электролите и восстанавливать двуокись серы. Когда элемент работает нормально (без избыточной зарядки), обычно образуется кислородное соединение серы, в котором сера имеет максимальную степень окисления III, например тиосульфат активного металла. Во время избыточной зарядки обычно образуется кислородное соединение серы, которое также содержит галоген и в котором сера имеет степень окисления +VI. Например, образуется хлорсульфонат активного металла элемента.
В следующей далее таблице приведена зависимость между концентрацией кислорода в повреждающих окисях (О в StO) на отрицательном электроде (NE), положительном электроде (РЕ) и в электролите.
| Таблица 1 | |||||
| Зарядка и разрядка | Избыточная зарядка | Итого | |||
| Место | Потребление SO2 | Образование Li2S2O3 | Потеря емкости, миллиампер-час/ммоль O в StO | Потеря емкости, миллиампер-час/ммоль O в StO | Потеря емкости, миллиампер-час/ммоль O в StO |
| ОЭ | 2-10 ммолей | 1-5 ммолей | 162-594 | 810 | 1404 |
| ПЭ | 0-12 ммолей | 6 ммолей | 126-243 | 324 | 567 |
| Электролит | 0-4 ммолей | 2 ммолей | 108-216 | 324 | 540 |
Поскольку потеря емкости во время зарядки и разрядки (как пояснено) зависит от растворимости компонентов в электролите, в таблице приведены соответствующие интервалы. Это же относится к потреблению SO2, которое также изменяется в соответствии с растворимостью компонентов реакции. В зависимости от начальной концентрации SO2 работа элемента также может ухудшаться или нарушаться вследствие потребления SO2, поскольку перенос заряда в электролит зависит от концентрации SO2.
Согласно наблюдениям авторов во время избыточной зарядки происходят реакции, которые ранее замедлялись из-за низкой растворимости. По этой причине в качестве потери емкости во время избыточной зарядки указано всего одно значение.
Как показано в таблице, повреждающие окиси, содержащиеся в электролите, являются причиной относительно наименьшей потери емкости на ммоль. Показатель около 100 миллиампер-час/ммоль говорит о том, что, когда реакция повреждающей окиси в электролите протекает до завершения (без описанной реакции избыточной зарядки), емкость элемента снижается до нуля, если электролит содержит более около 10 ммолей повреждающей окиси на ампер-час теоретической емкости элемента даже при отсутствии других повреждающих окисей в элементе.
Тем не менее на практике следует учитывать, что в зависимости от области применения батареи могут иметь место условия эксплуатации, в которых повреждающие окиси вступают лишь в частичные реакции. Это, в частности, касается батарей, рассчитанных на применение в условиях низких температур или батарейных установок, в которых соответствующим образом сконструированные зарядные устройства надежно предотвращают избыточную зарядку элемента аккумуляторной батареи. В этих случаях могут быть приемлемы более высокие концентрации повреждающих окисей.
Напротив, при наличии строгих требований долговременной стабильности элемента в неблагоприятных условиях эксплуатации (например, в условиях высоких температур) элемент должен содержать меньшие общие количества повреждающих окисей. Соответственно, в предпочтительных вариантах осуществления элемент содержит не более 5 ммолей, предпочтительно не более 2 ммолей, в особенности не более 1 ммоля, в частности предпочтительно не более 0,5 ммоля, наиболее предпочтительно не более 0,1 ммоля повреждающих окисей на ампер-час теоретической емкости элемента.
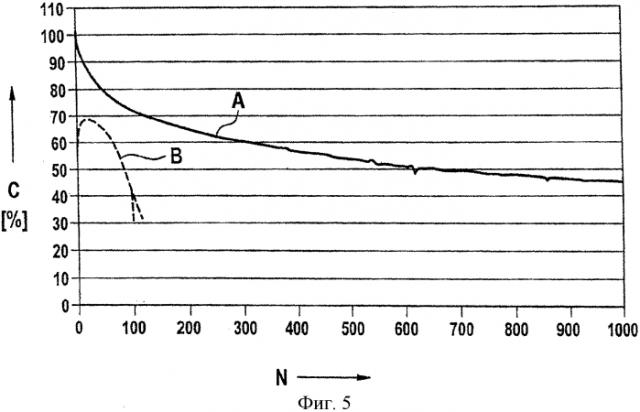
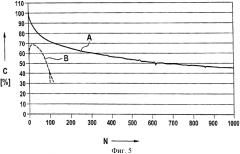
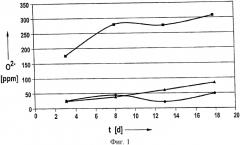
Применительно к настоящему изобретению были проведены эксперименты, в которых типичные вещества положительных и отрицательных электродов, а именно графит и тройную окись металла [Ln(Ni0.77Co0.13Mn0.1)O2] в течение 18 дней выдерживали при температуре 60°С в растворе электролита с составом LiAlCl4×1,5SO2. За это время несколько раз регистрировали число Фишера, являющееся показателем содержания повреждающих окисей в электролит. Результаты представлены на фиг.1. На ней показана определенная методом Фишера концентрация О2- в ч./млн, в зависимости от времени в сутках для трех экспериментов, а именно с использованием чистого электролита (окружности), электролита, содержащего тройную окись металла (квадраты), и электролита, содержащего графит (треугольники).
Из этого могут быть сделаны следующие выводы.
Электролит содержит очень небольшие количества О2-, при этом отклонение кривой находится в пределах погрешности.
В эксперименте с использованием тройной окиси металла наблюдался рост с последующим отсутствием роста, а затем новым ростом. Это указывает на присутствие, по меньшей мере, двух повреждающих окисей с различными скоростями растворения.
В эксперименте с использованием графита наблюдалось очень небольшое увеличение количества О2-. Во всяком случае, оно было менее выраженным, чем в случае тройной окиси металла. Насколько известно авторам, это обусловлено тем, что лишь небольшая доля повреждающих окисей на графите легко растворяется в растворе электролита. По имеющимся у авторов данным это ковалентно не связанные повреждающие окиси. Тем не менее это не значит, что на графите не присутствуют более крупные количества повреждающих окисей. Напротив, дальнейшие экспериментальные исследования показали, что на нормальном графите присутствуют большие количества повреждающих окисей, но они ковалентно связаны и, соответственно, вступают в реакцию только во время зарядки элемента.
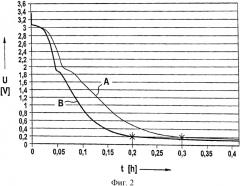
Результаты такого эксперимента проиллюстрированы на фиг.2. На ней показаны электрохимические измерения элемента с тремя электродами. Электрическое напряжение U в вольтах отложено в зависимости от времени t в часах при первой зарядке двух различных отрицательных графитов