Способ получения 2',4,4'-тринитробензанилида из анилина и 4-нитробензойной кислоты
Иллюстрации
Показать всеИзобретение относится к области органической химии, конкретно к способу получения 2′,4,4′-тринитробензанилида, являющегося полупродуктом в синтезе 5(6)-амино-2-(4-аминофенил)бензимидазола - мономера для получения термостойких высокопрочных волокон. Способ включает ацилирование анилина 4-нитробензойной кислотой при нагревании с отгонкой реакционной воды и выделением 4-нитробензанилида с последующим нитрованием его азотной кислотой в среде серной кислоты и выделением целевого продукта. Способ характеризуется тем, что ацилирование ведут под давлением при мольном соотношении анилин:4-нитробензойная кислота, равном (2÷20):1. 4-Нитробензанилид выделяют в виде порошка и после его нитрования полученный 2′,4,4′-тринитробензанилид выделяют из реакционного раствора разбавлением до концентрации серной кислоты 30-85 мас.%. Далее продукт перекристаллизовывают из ароматического растворителя или из смеси амидного растворителя с водой. Предлагаемый способ позволяет сократить продолжительность ацилирования, повысить качество продукта и уменьшить количество отходов. 2 з.п. ф-лы, 2 табл., 8 пр.
Реферат
Предлагаемое изобретение относится к области органической химии и касается способа получения 2′,4,4′-тринитробензанилида (ТНБА), который является полупродуктом синтеза 5(6)-амино-2-(4-аминофенил)бензимидазола - мономера для получения термостойких высокопрочных волокон.
Известен способ получения ТНБА ацилированием 2,4-динитроанилина 4-нитро-бензоилхлоридом (патент RU 2348612 С2, МПК С07С 233/80, опубл. 10.03.2009). Недостатком способа является использование труднодоступных исходных соединений -2,4-динитроанилина и 4-нитробензоилхлорида, необходимость применения для синтеза 4-нитробензоилхлорида высокотоксичных фосгена, тионилхлорида или хлоридов фосфора, высокая коррозионная активность рабочих сред.
Известен способ получения ТНБА ацилированием анилина 4-нитро-бензоилхлоридом с последующим нитрованием образующегося 4-нитробензанилида азотной кислотой в среде 93%-ной серной кислоты (Л.Ф.Мясникова, И.Л.Вайсман, С.С.Глузман, Н.И.Файнгольд, Д.А.Новохатка, С.Г.Панина. Журнал прикладной химии, том 50, №6, с. 1428-1430 (1977)). ТНБА выделяют выливанием раствора ТНБА в смеси серной и остатков азотной кислот в воду. Данные по качеству получаемого этим методом ТНБА - состав и температура плавления в опубликованном описании не приводятся. При воспроизведении этого способа установлено, что образующийся ТНБА имеет низкую температуру плавления 170-180°С (литературное значение 194-195°С, патент RU 2348612), при его восстановлении наблюдалось интенсивное осмоление. Недостаток способа - низкое качество ТНБА, использование труднодоступного 4-нитробензоилхлорида, высокая коррозионная активность рабочих сред.
Известен способ получения ТНБА ацилированием анилина 4-нитро-бензоилхлоридом с последующим нитрованием образующегося 4-нитробензанилида азотной кислотой в среде избытка серной кислоты как растворителе (Л.Г.Матвеев, Г.Ф.Левченко, Э.А.Кудрявцева, И.А.Абрамов. Журнал прикладной химии, том 57, №1, с. 132-134 (1984)). ТНБА выделяют выливанием реакционной массы в воду. Получаемый этим методом ТНБА имел низкую температур плавления - от 170 до 190°С. Методом тонкослойной хроматографии установлено наличие в нем примесей динитробензанилидов и изомерного 2′,4,6′-тринитробензанилида. Недостатком метода является низкое качество ТНБА, использование труднодоступного 4-нитробензоилхлорида, высокая коррозионная активность рабочих сред.
Известен способ получения ТНБА ацилированием анилина 4-нитробензойной кислотой с последующим нитрованием образующегося 4-нитробензанилида азотной кислотой в среде моногидрата - 98,5-100%-ной серной кислоты (патент Германии 70862, НКИ 22, опубл. 1893 г.). Ацилирование ведут при мольном соотношении анилин: 4-нитро-бензойная кислота, равном 1,075:1, т.е. близком стехиометрическому. Смесь нагревают при температуре 220-230°С в течение 8 часов, отгоняя образующуюся в ходе реакции воду. После завершения реакции продукт застывает в твердый плав, который дробят, размалывают, промывают разбавленной соляной кислотой для удаления непрореагировавшего анилина и разбавленным раствором соды для удаления непрореагировавшей 4-нитробензойной кислоты. Получают с хорошим выходом 4-нитро-бензанилид, который растворяют при температуре 15-20°С в пятикратном количестве моногидрата, охлаждают до 5-10°С и нитруют при этой температуре смесью дымящей азотной кислоты и моногидрата. При интенсивном перемешивании нитромассу медленно выливают на лед и промывают водой от кислот до нейтральной реакции. Образующийся 2′,4,4′-тринитробензанилид содержит в качестве примеси мета-изомер (очевидно 2′,4,6′-тринитробензанилид). Показатели качества 2′,4,4′-тринитробензанилида не приведены. Недостатки метода - образование кристаллического плава 4-нитробензанилида, который нужно дробить, неполная конверсия реагентов, обусловливающая необходимость промывок растворами кислоты и щелочного агента, что сопровождается образованием химзагрязненных сточных вод, большая длительность стадии получения 4-нитробензанилида.
Известен способ получения 4-нитробензанилида ацилированием анилина 4-нитробензойной кислотой при мольном соотношении реагентов, равном 1,0:1,0 нагреванием в интервале температур 170-210°С с отгонкой реакционной воды в течение от 3 до 6 часов и последующим нитрованием образующегося 4-нитробензанилида концентрированной азотной кислотой в среде моногидрата (Патент США 4109093, МПК С07С 235/18, опубл. 1978 г.). Нитрование 4-нитробензанилида ведут в моногидрате смесью азотной кислоты плотностью 1,52 г/см3 с моногидратом при постепенном повышении температуры от 0°С до 25°С. Целевой продукт выделяли выливанием реакционного раствора в смесь воды и льда, взятых в весовом соотношении 2:3. Выход 2′,4,4′-тринитробензанилида составляет 90%. Метод, описанный в патенте США 4109093, идентичен методу, предложенному в патенте Германии 70862, и характеризуется теми же недостатками. Стехиометрическое соотношение реагентов на стадии синтеза 4-нитробензанилида приводит к образованию продукта в виде кристаллического плава, загрязненного исходными соединениями из-за неполной конверсии реагентов, - анилином и 4-нитробензойной кислотой. Это, в свою очередь, обусловливает необходимость дробления, измельчения кристаллического плава, промывок 4-нитробензанилида кислотными и щелочными водными растворами. В результате образуется большое количество химзагрязненных стоков. Большое количество химзагрязненных стоков образуется дополнительно и при высаждении 2′,4,4′-три-нтробензанилида из его раствора в серной кислоте выливанием в смесь воды и льда. Недостатками метода также являются большая продолжительность стадии ацилирования анилина 4-нитробензойной кислотой и низкое качество целевого продукта. Методом высокоэффективной жидкостной хроматографии нами установлено, что 2′,4,4′-тринитро-бензанилид, полученный в условиях метода, описанного в патенте США 4109093, содержит лишь 94% 2′,4,4′-тринитробензанилида и в качестве примесей содержит 1% изомерного 2′,4,6′-тринтробензанилида, 0,3% соединения с молекулярной массой 377, отвечающей тетранитробензанилиду, и другие соединения.
Наиболее близким по технической сущности к предлагаемому способу является способ, описанный в патенте США 4109093.
Целью предлагаемого изобретения является усовершенствование процесса получения 2′,4,4′-тринитробензанилида ацилированием анилина 4-нитробензойной кислотой с последующим нитрованием образующегося 4-нитробензанилида, заключающееся в сокращении продолжительности ацилирования, повышении качества 2′,4,4′-тринитробензанилида, исключении необходимости дробления, измельчения и промывок 4-нитробензанилида, уменьшении количества отходов.
Поставленная цель достигается предлагаемым способом получения 2′,4,4′-три-нитробензанилида ацилированием анилина 4-нитробензойной кислотой при нагревании с отгонкой реакционной воды, выделением промежуточного 4-нитробензанилида с последующим нитрованием его азотной кислотой в среде серной кислоты и выделением и очисткой целевого продукта.
Предлагаемый способ отличается тем, что ацилирование ведут под давлением при мольном соотношении анилин: 4-нитробензойная кислота, равном (2÷20):1,4-нитро-бензанилид выделяют в виде порошка и после его нитрования целевой 2′,4,4′-тринитро-бензанилид выделяют из реакционного раствора разбавлением до концентрации серной кислоты 30-85% массовых и далее перекристаллизовывают из ароматического растворителя или смеси амидного растворителя с водой. В качестве ароматического растворителя используют один из ряда: хлорбензол, орто-дихлорбензол, нитробензол или их смеси. В качестве амидного растворителя используют один из ряда: диметилформамид, диметилацетамид, N-метилпирролидон.
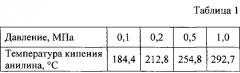
Применение избыточного давления позволяет повысить температуру ацилирования и за счет этого ускорить реакцию, сократить продолжительность процесса. Зависимость температуры кипения анилина от давления приведена ниже (Д.Р.Стэлл. Таблицы давления паров индивидуальных веществ. Изд-во «ИЛ». - М., 1949).
Так при давлении 0,4 МПа можно повысить температуру реакции в конце процесса до 240°С. При этом скорость реакции увеличивается в три раза.
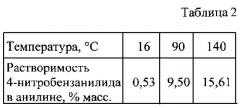
Анилин является эффективным растворителем для 4-нитробензанилида.
Данные по растворимости 4-нитробензанилида, полученные нами, приведены ниже.
Поэтому ацилирование целесообразно вести в избытке анилина как растворителе при мольном соотношении анилин: 4-нитробензойная кислота в интервале (2÷20):1.
Применение достаточного избытка анилина обеспечивает количественное превращение 4-нитробензойной кислоты в целевой 4-нитробензанилид, количественный выход целевого продукта, отсутствие в нем примеси 4-нитробензойной кислоты. При этом образуется раствор 4-нитробензанилида в анилине, из которого целевой продукт можно выделить кристаллизацией с последующей фильтрацией или отгонкой растворителя-анилина в виде азеотропа с водой. Образующийся порошкообразный 4-нитробензанилид характеризуется высоким качеством, имеет температуру плавления 217°С, может быть легко подготовлен для растворения в концентрированной серной кислоте с целью последующего нитрования. Такая подготовка осуществляется путем сушки порошкообразного 4-нитробензанилида от воды.
4-Нитробензанилид выделяется в виде порошка, что обеспечивает возможность его дальнейшей переработки в 2′,4,4′-тринитробензанилид - полупродукт синтеза 5(6)-амино-2-(4-аминофенил)бензимидазола путем нитрования.
Нитрование 4-нитробензанилида проводится в растворе концентрированной серной кислоты при температурах ниже 25°С. Порошкообразная форма 4-нитробензанилида позволяет приготовить его раствор в серной кислоте при низких температурах, что исключает протекание процессов деструкции и сульфирования.
Поскольку обеспечивается количественная конверсия 4-нитробензойной кислоты в 4-нитробензанилид и анилин полностью регенерируется в виде азеотропа, а вода, используемая для отгонки анилина, возвращается в рецикл, стадия ацилирования является малоотходной.
Благодаря высокой скорости ацилирование может быть организовано по непрерывной схеме.
На стадии синтеза 2′,4,4′-тринитробензанилида нитрованием 4-нитробензанилида в среде концентрированной серной кислоты выделение целевого продукта путем разбавления серной кислоты до концентрации в интервале 30-85% массовых решает две задачи. Во-первых, обеспечивается значительное сокращение количества химзагрязненных кислых сточных вод, поскольку серная кислота с концентрацией 30-85% может быть регенерирована и возвращена в процесс. Во-вторых, из-за сильного разбавления при выливании нитромассы в воду все примеси соосаждаются вместе с целевым продуктом, что приводит к 2′,4,4′-тринитробензанилиду, содержащему менее 95% массовых основного вещества. Выделение из 30-85%-ой серной кислоты позволяет повысить содержание 2′,4,4′-тринитробензанилида до 97,5-98,0%.
Дальнейшая перекристаллизация из растворителей ароматического ряда или смеси амидного растворителя и воды позволяет получать 2′,4,4′-тринитробензанилид с содержанием основного вещества 98,5-99,5% массовых. При этом его температура плавления повышается до 196-197°С.
Предлагаемый способ позволяет значительно усовершенствовать процесс получения 2′,4,4′-тринитробензанилида, упростить аппаратурное оформление процесса, уменьшить количество отходов, повысить качество продукта.
Изобретение иллюстрируется примерами, которые не призваны дать исчерпывающее описание метода.
Пример 1. Получение 4-нитробензанилида
В реактор из нержавстали емкостью 0,5 дм3, снабженный мешалкой, гильзой для замера температуры, донным клапаном, системой электрообогрева, системой конденсации для сбора азеотропа анилин-вода, состоящей из конденсатора, приемника и дросселирующего вентиля, загружают 167 г (1,0 г-моль) 4-нитробензойной кислоты и 186 г (2,0 г-моль) свежеперегнанного анилина. Мольное соотношение анилин: 4-нитро-бензойная кислота равно 2:1. Реакционную массу нагревают при перемешивании, одновременно отгоняя воду и повышая температуру до 240°С, поддерживая в системе давление 0,4 МПа. Процесс отгонки воды завершается за 1,5 часа.
Реакционную массу охлаждают до 70°С, вводят 150 см3 воды и отгоняют анилин в виде азеотропа, возвращая водный слой после расслаивания дистиллята. По завершении отгонки анилина добавляют дополнительно воду и фильтруют водную суспензию 4-нитробензанилида.
Осадок высушивают при 100°С в вакууме. Выход 4-нитробензанилида 239,6 г (99% от теоретического). Порошок белого цвета. Температура плавления 217°С.
Пример 2. Получение 4-нитробензанилида
В реактор, описанный в примере 1, загружают 88 г (0,527 г-моль) 4-нитробензойной кислоты и 345 г (3,71 г-моль) анилина. Мольное соотношение анилин: 4-нитробензойная кислота равно 7:1. Смесь нагревают при перемешивании, отгоняя одновременно воду, до температуры 240°С. Процесс завершается за 1,5 часа при давлении 0,4 МПа.
После завершения отгонки воды реакционную массу сливают в кристаллизатор, где охлаждают до 10°С. Суспензию выкристаллизовавшегося 4-нитробензанилида фильтруют. Пасту вносят в 500 см3 воды и отгоняют анилин в виде азеотропа с водой, возвращая водный слой после расслаивания дистиллята. Водную суспензию 4-нитробензанилида фильтруют, осадок высушивают в вакууме при 100°С.
Выход 4-нитробензанилида 124,9 г (98% от теоретического). Белый порошок, температура плавления 217°С.
Маточный раствор от фильтрации анилиновой суспензии 4-нитробензанилида, масса которого составляет 235 г, загружают в реактор, догружают 4-нитробензойную кислоту и анилин в количествах, соответствующих загрузке в начальный синтез. Процесс проводят аналогично описанному выше. После проведения пяти опытов с рециклом анилинового маточника с общей загрузкой 440 г 4-нитробензойной кислоты выход 4-нитробензанилида составил 631 г (99% от теоретического). Кристаллический порошок белого цвета. Температура плавления 217°С.
Пример 3. Получение 4-нитробензанилида
В реактор, описанный в примере 1, загружают 34 г (0,20 г-моль) 4-нитробензойной кислоты и 335 г (3,6 г-моль) анилина. Мольное соотношение анилин: 4-нитробензойная кислота равно 18:1. Процесс ведут в условиях, аналогичных описанным в примере 2. Реакция заканчивается за 1 час при давлении 0,4 МПа. Выделение 4-нитробензанилида и рецикл анилинового маточника ведут, используя те же приемы, что и в примере 2. Выход 4-нитробензанилида составляет 46,3 г (94% от теоретического). Белый кристаллический порошок. Температура плавления 217°С.
Пример 4. Получение 2′,4,4′-тринитробензанилида
10 г 4-нитробензанилида растворяют в 25 см3 моногидрата при температуре (-5)-0°С, постепенно прибавляют смесь 3,8 см3 азотной кислоты с плотностью 1,52 г/см3 с 25 см3 моногидрата. Образовавшийся раствор разбавляют смешением с 65%-ной серной кислотой до концентрации серной кислоты после смешения 82,5% масс. Выпавший осадок отфильтровывают, промывают небольшими количествами 75%-ной серной кислоты и воды и перекристаллизовывают из орто-дихлорбензола. Выход 2′,4,4′-три-нитробензанилида 10,7 г (78% от теоретического). Содержание основного вещества 98,5% (ВЭЖХ). Т пл. 196°С.
Пример 5. Получение 2′,4,4′-тринитробензанилида
Синтез проводят аналогично описанному в примере 4, сернокислотный раствор 2′,4,4′-тринитробензанилида разбавляют до концентрации серной кислоты 30% массовых и перекристаллизацию 2′,4,4′-ТНБА проводят из нитробензола. Получают 11,25 г 2′,4,4′-ТНБА (82% от теоретического). Содержание основного вещества 99,5% (ВЭЖХ), Т пл. 197°С.
Пример 6. Получение 2′,4,4′-тринитробензанилида
Синтез проводят аналогично описанному в примере 4. Сернокислотный раствор 2′,4,4′-тринитробензанилида разбавляют до концентрации серной кислоты 50% массовых. Выпавший 2′,4,4′-ТНБА перекристаллизовывают из хлорбензола. Выход 2′,4,4′-ТНБА 9,88 г (79% от теоретического), содержание основного вещества 98,8% (ВЭЖХ). Т пл. 196°С.
Пример 7. Получение 2′,4,4′-тринитробензанилида
Синтез проводят аналогично описанному в примере 4, сернокислотный раствор 2′,4,4′-тринитробензанилида разбавляют до концентрации серной кислоты 60% массовых и перекристаллизацию 2′,4,4′-ТНБА проводят из смеси нитробензол: хлорбензол 1: 1 по объему. Выход 2′,4,4′-ТНБА 11,05 г (80,5% от теоретического), содержание основного вещества 99,3% (ВЭЖХ). Т пл. 197°С.
Пример 8. Получение 2′,4,4′-тринитробензанилида
Синтез проводят аналогично описанному в примере 4, используя вместо моногидрата 93,4%-ную серную кислоту. Сернокислотный раствор разбавляют с помощью 40%-ной серной кислоты до концентрации серной кислоты 75%. Выделившийся осадок 2′,4,4′-ТНБА перекристаллизовывают из смеси диметилацетамид-вода, содержащей 80% объемных диметилацетамида. Выход 2′,4,4′-ТНБА 9,81 г (74,3% от теоретического). Содержание основного вещества 99,1% (ВЭЖХ). Т пл. 197°С.
1. Способ получения 2′,4,4′-тринитробензанилида ацилированием анилина 4-нитробензойной кислотой при нагревании с отгонкой реакционной воды и выделением 4-нитробензанилида с последующим нитрованием его азотной кислотой в среде серной кислоты и выделением целевого продукта, отличающийся тем, что ацилирование ведут под давлением при мольном соотношении анилин:4-нитробензойная кислота, равном (2÷20):1, 4-нитробензанилид выделяют в виде порошка и после его нитрования полученный 2′,4,4′-тринитробензанилид выделяют из реакционного раствора разбавлением до концентрации серной кислоты 30-85 мас.% и далее перекристаллизовывают из ароматического растворителя или из смеси амидного растворителя с водой.
2. Способ по п.1, отличающийся тем, что в качестве ароматического растворителя используют один из ряда: хлорбензол, орто-дихлорбензол, нитробензол или их смеси.
3. Способ по п.1, отличающийся тем, что в качестве амидного растворителя используют один ряда: диметилформамид, диметилацетамид, N-метилпирролидон.