Устройство введения, способ его эксплуатации и способ введения
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к онкологии, и может быть использована при введении пациенту препарата, ингибирующего деление злокачественной клетки. Для этого предложено устройство введения ингибирующего препарата пациенту, включающее блок введения препарата, блок хранения момента времени введения, блок измерения текущего времени и блок управления, выполненный с возможностью приведения в действие блока введения и управления им таким образом, чтобы вводить ингибирующий препарат пациенту, когда текущее время совпадает с временем введения. При этом время введения препарата установлено на основании предварительно определенной фазы клеточного цикла злокачественной клетки. Фаза, в которой эффект ингибирования клеточного деления препаратом является наибольшим, выбрана как предварительно определенная фаза клеточного цикла. Клеточный цикл разделен на несколько групп предварительно определенной длительности, не большей, чем продолжительность предварительно определенной фазы. Время введения установлено многократно с интервалами, не меньшими чем (T+t), если клеточный цикл определен равным Т, а предварительно определенная длительность определена равной t. Разница соответствующих моментов времени введения для нескольких групп составляет менее чем две продолжительности цикла. Также предложены способ эксплуатации данного устройства и способ введения ингибирующего препарата. Изобретения обеспечивают наиболее эффективное воздействие ингибирующего препарата на злокачественную клетку за счет выбора определенной фазы клеточного цикла и расчета времени введения препарата в эту фазу. 3 н. и 11 з.п. ф-лы, 15 ил.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение в общем относится к устройствам введения, способам их эксплуатации и способам введения. Более конкретно, настоящее изобретение относится к устройству введения, способу его эксплуатации и способу введения для введения пациенту ингибирующего препарата, который ингибирует клеточное деление злокачественной клетки.
УРОВЕНЬ ТЕХНИКИ
Фиг. 1-5 показывают общеизвестные типичные способы введения и уровни эффективности противораковых препаратов. Фиг. 1 представляет собой таблицу, показывающую общеупотребительные способы введения и уровни эффективности метотрексата. Фиг. 2 представляет собой таблицу, показывающую общеизвестные способы введения 5-фторурацила. Фиг. 3 представляет собой таблицу, показывающую результат рандомизированного исследования различных способов лечения, обычно применяемых в Японии, Европе и Соединенных штатах. Фиг. 4 представляет собой таблицу, показывающую общеупотребительные способы введения винкристина. Фиг. 5 представляет собой таблицу, показывающую частоту ремиссии для различных злокачественных опухолей при общеупотребительных способах введения.
Все способы введения, показанные на Фиг. с 1 по 5, представляют собой способы, при которых осуществляют инъекции или капельные инъекции, берут лекарственные каникулы в течение недель, до тех пор пока побочные действия введений не исчезнут, и повторяют введения (см., например, непатентный документ 1 и непатентный документ 2).
При этом, общеизвестные способы введения, показанные на Фиг. с 1 по 5, имеют тот недостаток, что противораковые препараты не способны в достаточной степени проявить свою эффективность из-за того, что растворы препарата вводят в произвольный момент времени, не принимая во внимание клеточный цикл раковой клетки. Этот момент ниже обсуждается подробно со ссылкой на прилагаемые чертежи.
Фиг. 6 представляет собой диаграмму, показывающую пример клеточного цикла. Клеточный цикл представляет собой концепцию рассмотрения процесса, когда клетки делятся, и количество клеток удваивается, в качестве одного цикла. Клеточный цикл образован циклом, состоящим из соответствующих фаз, включая фазу подготовки к синтезу ДНК (т.е. предличинки: фаза G1), фазу синтеза ДНК (фаза S), фазу подготовки к клеточному делению (протонимфы: фаза G2) и фазу клеточного деления (фаза M). В данном случае клетки, которые временно или обратимо останавливают клеточное деление, рассматриваются как находящиеся в стационарной фазе, называемой фазой G0. Отдельная раковая клетка удваивается по окончании клеточного цикла и продолжает удваиваться. "Противораковый препарат" является обобщенным названием медицинского препарата, средства или вещества, которое обладает функцией ингибирования пролиферации раковых клеток, и их грубо подразделяют на два вида, препараты с зависимостью от времени и препараты с зависимостью от концентрации. Препарат с зависимостью от времени демонстрирует свою эффективность в связи с клеточным циклом.
Полагают, что противораковый препарат с зависимостью от времени эффективно действует на фазу G1 клеточного цикла, показанного на Фиг. 6, и демонстрирует эффективность посредством установления препятствия для развития. Рак состоит из множества раковых клеток, и соответствующие раковые клетки находятся в различных фазах клеточного цикла. Следовательно, даже если противораковый препарат вводят в некоторый момент времени, эффективность противоракового препарата может быть получена только в отношении раковых клеток в фазе G1 во время введения, и противораковый препарат не может оказывать воздействие на клетки в других фазах.
В данном случае, если клеточный цикл раковых клеток определяют равным T, и длительность фазы G1, в которой противораковый препарат может оказывать воздействие, определяют равной t, то, когда противораковый препарат впервые вводят в некоторый момент времени, отношение количества клеток, у которых противораковый препарат может предотвратить клеточное деление, ко всем клеткам составляет t/T, и доля количества клеток, которые избегают воздействия, по отношению ко всем клеткам составляет (T-t)/T. Если обычные способы введения повторяют n раз (где n представляет собой целое число), то отношение количества клеток, которые избегают воздействия после n раз, составляет ((T-t)/T)n.
Например, если клеточный цикл T определяют равным 24 ч; фазу G1 t определяют равной 4 ч; и количество введений определяют равным шести, то оказывается, что остается (20/24)6=0,3349=33,5% раковых клеток.
Это означает, что обычные способы введения обладают недостатком, заключающимся в невозможности теоретически исключить раковые клетки, которые избегают ингибирующего воздействия, даже при повышении частоты введения.
Кроме того, поскольку непрерывное время введения является большим, существует проблема физического и умственного напряжения пациента, получающего большую дозу. Более конкретно, поскольку небольшое количество противоракового препарата разбавляют раствором и лечение проводят, осуществляя капельное вливание пациенту непрерывно в течение долгого времени, пациент получает большой объем жидкости. Из-за этого пациент должен часто ходить в туалет, что становится большой нагрузкой для пациента. Более того, поскольку обычные способы введения нагружают почки пациента, существует проблема, заключающаяся в невозможности осуществления введения пациенту, имеющему заболевание почек. Кроме того, когда введение осуществляют при госпитализации, наилучшим моментом времени может оказаться полночь, в зависимости от расписания введения. В данном случае имеет место проблема с введением, являющимся нагрузкой как для медицинского работника, так и для пациента.
[Непатентный документ 1] "Anticancer Report: Fluorouracil and Leucovorin (Colorectal cancer)", опубликован в сети, поиск проведен 11 августа 2010 г., Интернет, <URL:http: //www.mhlw.go.jp/shingi/2004/05/dl/s0521-5o.pdf>
[Непатентный документ 2] "Oncovin", опубликован в сети, поиск проведен 11 августа 2010 г., Интернет <URL:http://www.info.pmda.go.jp/go/pack/4240400Dl030_2_06/>
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Соответственно, варианты осуществления настоящего изобретения могут предложить устройство введения, способ его эксплуатации и способ введения, решающие одну или несколько из проблем, описанных выше.
Более конкретно, варианты осуществления настоящего изобретения могут предложить устройство введения для введения ингибирующего препарата пациенту, для того чтобы ингибировать клеточное деление злокачественной клетки, включающее в себя:
блок введения, выполненный с возможностью ввода ингибирующего препарата пациенту;
блок хранения момента времени введения, выполненный с возможностью сохранения времени введения, в которое следует начинать введение ингибирующего препарата;
блок измерения времени, выполненный с возможностью измерения текущего времени; и
блок управления, выполненный с возможностью приведения в действие блока введения и управления им таким образом, чтобы вводить ингибирующий препарат пациенту, когда текущее время совпадает с временем введения,
причем время введения устанавливают на основании предварительно определенной фазы клеточного цикла злокачественной клетки.
Другому аспекту настоящего изобретения соответствует способ эксплуатации устройства введения, причем данное устройство введения включает в себя:
блок введения, выполненный с возможностью ввода ингибирующего препарата пациенту, для того чтобы ингибировать клеточное деление злокачественной клетки;
блок хранения момента времени введения, выполненный с возможностью сохранения времени введения, в которое следует начинать введение ингибирующего препарата;
блок измерения времени, выполненный с возможностью измерения текущего времени;
блок хранения длительности введения для сохранения длительности введения при введении ингибирующего препарата непрерывно пациенту; и
блок управления, выполненный с возможностью приведения в действие блока введения и управления им таким образом, чтобы вводить ингибирующий препарат пациенту, когда текущее время совпадает с временем введения,
причем данный способ эксплуатации включает в себя этапы, на которых:
устанавливают время введения и длительность введения на основании предварительно определенной фазы клеточного деления злокачественной клетки;
сохраняют установленное время введения в блоке хранения времени введения и установленную длительность введения в блоке хранения длительности введения соответственно; и
вводят ингибирующий препарат пациенту непрерывно в течение времени длительности введения, когда текущее время, измеренное блоком измерения времени, совпадает с временем введения, посредством управления блоком введения с помощью блока управления.
Другому аспекту настоящего изобретения соответствует способ введения для введения ингибирующего препарата пациенту, для того чтобы ингибировать клеточное деление злокачественной клетки, включающий в себя этапы, на которых:
устанавливают время введения, в которое следует начинать введение ингибирующего препарата пациенту на основании предварительно определенной фазы клеточного деления злокачественной клетки;
сохраняют установленное время введения в блоке хранения времени введения; и
вводят ингибирующий препарат пациенту непрерывно, когда текущее время совпадает с временем введения, сохраненным в блоке хранения введения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1 представляет собой таблицу, показывающую общеизвестные способы введения и уровни эффективности метотрексата;
Фиг. 2 представляет собой таблицу, показывающую общеизвестные способы введения для 5-фторурацила;
Фиг. 3 представляет собой таблицу, показывающую результат рандомизированного исследования различных способов лечения, обычно применяемых в Японии, Европе и Соединенных штатах;
Фиг. 4 представляет собой таблицу, показывающую общеизвестные способы введения винкристина;
Фиг. 5 представляет собой таблицу, показывающую частоту ремиссии для различных злокачественных опухолей при общеизвестные способах введения;
Фиг. 6 представляет собой диаграмму, показывающую пример клеточного цикла;
Фиг. 7A представляет собой диаграмму, показывающую пример первого введения способа введения согласно первому варианту осуществления;
Фиг. 7B представляет собой диаграмму, показывающую пример второго введения способа введения согласно первому варианту осуществления;
Фиг. 7C представляет собой диаграмму, показывающую пример третьего введения способа введения согласно первому варианту осуществления;
Фиг. 7D представляет собой диаграмму, показывающую пример шестого введения способа введения согласно первому варианту осуществления;
Фиг. 8 представляет собой диаграмму, показывающую пример конфигурации устройства введения согласно первому варианту осуществления;
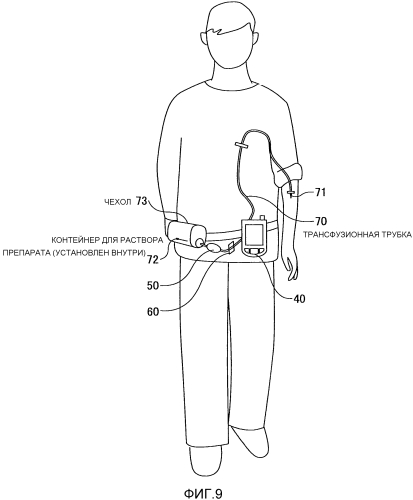
Фиг. 9 представляет собой диаграмму, показывающую пример ношения пациентом устройства введения согласно первому варианту осуществления;
Фиг. 10 представляет собой диаграмму, показывающую внутреннюю конфигурацию примера контроллера устройства введения согласно первому варианту осуществления;
Фиг. 11 представляет собой пример последовательности выполнения этапов способа эксплуатации устройства введения и способа введения с применением устройства введения согласно первому варианту осуществления;
Фиг. 12 представляет собой диаграмму, показывающую пример конфигурации устройства введения согласно второму варианту осуществления;
Фиг. 13 представляет собой диаграмму, показывающую пример конфигурации устройства введения согласно третьему варианту осуществления;
Фиг. 14A представляет собой диаграмму, показывающую пример первого введения согласно способу эксплуатации устройства введения и способу введения согласно четвертому варианту осуществления;
Фиг. 14B представляет собой диаграмму, показывающую пример второго введения согласно способу эксплуатации устройства введения и способу введения согласно четвертому варианту осуществления;
Фиг. 14C представляет собой диаграмму, показывающую пример третьего введения согласно способу введения согласно четвертому варианту осуществления;
Фиг. 14D представляет собой диаграмму, показывающую пример четвертого введения согласно способу эксплуатации устройства введения и способу введения согласно четвертому варианту осуществления;
Фиг. 14E представляет собой диаграмму, показывающую пример шестого введения согласно способу эксплуатации устройства введения и способу введения согласно четвертому варианту осуществления;
Фиг. 15A представляет собой диаграмму, показывающую пример первого введения согласно способу эксплуатации устройства введения и способу введения согласно пятому варианту осуществления;
Фиг. 15B представляет собой диаграмму, показывающую пример второго введения согласно способу эксплуатации устройства введения и способу введения согласно пятому варианту осуществления;
Фиг. 15C представляет собой диаграмму, показывающую пример третьего введения согласно способу эксплуатации устройства введения и способу введения согласно пятому варианту осуществления; и
Фиг. 15D представляет собой диаграмму, показывающую пример шестого введения согласно способу эксплуатации устройства введения и способу введения согласно пятому варианту осуществления.
ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Ниже приводится описание вариантов осуществления настоящего изобретения со ссылкой на прилагаемые чертежи.
Фиг. 6 представляет собой диаграмму, показывающую пример клеточного цикла. Как отмечено выше, клеточный цикл представляет собой концепцию рассмотрения процесса, когда клетки делятся, и количество клеток удваивается, в качестве одного цикла. Клеточный цикл образован циклом, состоящим из соответствующих фаз: фазы подготовки к синтезу ДНК (т.е. предличинки: фаза G1), фазы синтеза ДНК (фаза S), фазы подготовки к клеточному делению (протонимфы: фаза G2) и фазы клеточного деления (фаза M). Раковая клетка становится двумя раковыми клетками посредством однократного прохождения клеточного цикла, количество клеток продолжает удваиваться. "Противораковый препарат" является обобщенным названием медицинского препарата, средства или вещества, которое обладает функцией ингибирования пролиферации раковых клеток, и их грубо подразделяют на два вида препаратов, препараты с зависимостью от времени и препараты с зависимостью от концентрации. Препарат с зависимостью от времени демонстрирует свое воздействие в связи с клеточным циклом. Фазу, которая демонстрирует эффект ингибирования пролиферации раковой клетки, определяют как предварительно определенную фазу.
Полагают, что противораковый препарат с зависимостью от времени эффективно действует на фазу G1 клеточного цикла, показанного на Фиг. 6, и демонстрирует эффективность посредством установления препятствия для развития. Поскольку рак состоит из множества раковых клеток, и соответствующие раковые клетки находятся в различных фазах клеточного цикла, противораковый препарат, который работает в фазе G1, демонстрирует более высокий эффект при продолжительном введении. В качестве типичных противораковых препаратов с зависимостью от времени можно упомянуть, в качестве примеров, 5-фторурацил, метотрексат, винкристин и тому подобные.
В данном случае, препарат с зависимостью от концентрации характеризуется тем, что эффективность клеточной гибели повышается с повышением величины дозировки (зависимость от концентрации), и все равно вводится очень большая доза.
С другой стороны, противораковый препарат обладает функцией ингибирования клеточного деления или нанесения ущерба клеткам непосредственно и естественно вызывает повреждение даже нормальных клеток. Более конкретно, противораковый препарат может вызывать повреждение костного мозга, в котором активна пролиферация клеток (в котором создаются кровяные клетки), слизистой оболочки пищеварительного тракта и печени или почек, которые обладают функцией расщепления препарата и вывода препарата из организма. Чем больше применяют противораковый препарат, тем больше получают побочных действий. Следовательно, необходимо применять противораковый препарат, принимая во внимание соотношение между воздействием и побочным действием противоракового препарата.
В клеточном цикле, показанном на Фиг. 6, если противораковый препарат эффективно воздействует во время фазы G1, то противораковый препарат можно вводить с наибольшей эффективностью, а побочное действие на нормальные клетки можно уменьшить, посредством введения данного противоракового препарата каждой раковой клетке только в фазе G1.
При этом в действительности в организме пациента существует множество раковых клеток, и соответствующие раковые клетки проходят соответствующие клеточные циклы в различные моменты времени. Соответственно, все раковые клетки не входят в фазу G1 вместе в один и тот же момент времени, но соответствующие раковые клетки входят в фазу G1 в различные моменты времени. По этой причине при обычных способах введения противоракового препарата не существует других способов, помимо введения противоракового препарата в произвольный момент времени, игнорируя клеточный цикл, или введения противоракового препарата, разбавленного до низкой концентрации, в организм пациента в течение долгого времени. Из-за этого противораковый препарат не способен производить достаточный эффект ингибирования клеточного деления, и нагрузка на пациента и медицинского работника в случае продолжительного времени непрерывного введения становится большой.
[ПЕРВЫЙ ВАРИАНТ ОСУЩЕСТВЛЕНИЯ]
Фиг. с 7A по 7D представляют собой диаграммы для иллюстрации основного принципа способа введения согласно первому варианту осуществления. Фиг. 7A представляет собой диаграмму, показывающую пример первого введения согласно способу введения в соответствии с первым вариантом осуществления в сравнении с воздействием на нормальные клетки. Аналогично, Фиг. 7B показывает второе введение согласно способу введения в соответствии с первым вариантом осуществления; Фиг. 7C показывает третье введение согласно способу введения в соответствии с первым вариантом осуществления; и Фиг. 7D показывает шестое введение согласно способу введения в соответствии с первым вариантом осуществления в сравнении с воздействием на нормальные клетки соответственно.
На Фиг. с 7A по 7D в качестве примера клеточный цикл раковых клеток определяют равным 24 часам (24 ч), а продолжительность (или длительность) фазы G1, в которой функционирует противораковый препарат, определяют равной четырем часам (4 ч). Кроме того, клеточный цикл нормальных клеток определяют равным 72 часам (72 ч).
В этом случае, как показано на Фиг. 7A, если продолжительность фазы G1 (4 ч) определяют как стандартную, и клеточный цикл (24 ч) делят на продолжительность фазы G1 как основной единицы измерения, то клеточный цикл можно разделить на 24/4=6 групп. Все раковые клетки в шести группах входят в фазу G1 в какой-либо момент времени. В данном случае фаза G1 соответствующих раковых клеток не всегда начинается и заканчивается в те же моменты времени, что и начало и конец шести групп, но распределена во многих случаях по двум группам, что, однако, не приводит к проблемам. Этот момент описан ниже по тексту.
В момент времени первого введения клетки в периоде, когда действует противораковый препарат, существуют с вероятностью 4/24=1/6. Если назвать их первой группой, то противораковый препарат действует на раковую клетку в первой группе. При первом введении противоракового препарата противораковый препарат вводят непрерывно в течение предварительно определенного промежутка времени в пределах четырех часов продолжительности фазы G1 и останавливают введение. Длительность введения изменяется в соответствии с противораковым препаратом. Например, длительность введения может составлять несколько минут или может составлять несколько часов в пределах четырех часов.
Как показано на Фиг. 7B, после первого введения введение останавливают и осуществляют второе введение. В это время, если момент времени второго введения определен через 24 часа после начала первого введения, что совпадает с продолжительностью цикла, то, поскольку противораковый препарат вводят только раковым клеткам в первой группе, и он оказывает ингибирующее рак воздействие только на раковые клетки в первой группе, имеет место только небольшое ингибирующее воздействие на все раковые клетки. Соответственно, второе введение осуществляют, например, через 28 часов после начала первого введения, относительно которого момент времени введения корректируют так, чтобы оказать воздействие на раковые клетки во второй группе. Благодаря таким действиям противораковый препарат может оказывать воздействие на раковые клетки как в первой, так и во второй группах. В это время противораковый препарат вводят раковым клеткам, которые входят в фазу G1 в моменты времени, которые распределены по первой группе и второй группе, так что покрывают всю фазу G1, и противораковый препарат можно ввести раковым клеткам равномерно.
Затем, как показано на Фиг. 7C, при третьем введении противораковый препарат вводят так, что противораковый препарат оказывает воздействие на раковые клетки в третьей группе. Это означает, что введение осуществляют через 28 часов после второго введения. Кроме того, длительность введения может быть такой же, как длительность в первый раз и во второй раз, или может отличаться от длительности в первый раз и во второй раз в соответствии со свойством противоракового препарата и тому подобным.
Хотя это не показано на Фиг. с 7A по 7D, посредством повторения четвертого и пятого введений каждые 28 часов в течение промежутка времени длительностью 4 часа с перерывами аналогично второму и третьему разу, противораковый препарат можно ввести раковым клеткам, которые входят в фазу G1 в четвертой и пятой группах, так, что противораковый препарат может эффективно воздействовать на раковые клетки в четвертой и пятой группах.
Как показано на Фиг. 7D, если шестое введение осуществляют еще через 28 часов после пятого введения, то можно получить эффект ингибирования клеточного деления противоракового препарата для всех раковых клеток. Хотя противораковый препарат также воздействует на нормальные клетки, как показано в правой части Фиг. с 7A по 7D, поскольку клеточный цикл нормальных клеток составляет 72 часа, отдельное введение воздействует только на 4/72=1/18 от всех нормальных клеток, и даже все шесть введений воздействуют только на 24/72=1/3 от всех нормальных клеток.
Таким образом, посредством разделения клеточного цикла на несколько групп на основании предварительно определенного времени (или предварительно определенной длительности), в которое противораковый препарат может эффективно воздействовать на раковые клетки, посредством введения противоракового препарата последовательно нескольким выделенным на основании предварительно определенного времени группам с перерывами, посредством введения противоракового препарата, в конечном счете, всем группам, и посредством предоставления противоракового препарата для всего клеточного цикла, противораковый препарат можно эффективно вводить раковым клеткам, снижая неблагоприятное воздействие на нормальные клетки.
В данном случае в настоящем варианте осуществления клеточный цикл злокачественных клеток разделяют, применяя в качестве основной единицы измерения непрерывную длительность фазы G1, в которой противораковый препарат ингибирует пролиферацию злокачественных клеток, но можно определить в качестве основной единицы измерения для деления более короткий промежуток времени, чем длительность фазы G1. Даже в этом случае посредством производимых с перерывами и всеохватывающих введений противораковый препарат можно ввести всем злокачественным клеткам во время фазы G1, снижая воздействие на нормальные клетки.
При этом, если разделенный промежуток времени короче, чем фаза G1, то возрастает вероятность осуществления перекрывающегося введения тем же самым злокачественным клеткам. Другими словами, когда длительность введения достаточно мала и введение выглядит по времени как точка, как в примере, описанном на Фиг. с 7A по 7D, если основная единица измерения для деления совпадает с фазой G1, то получение злокачественными клетками введения противоракового препарата представляет собой введение только один раз за один цикл для всех злокачественных клеток. Если один цикл злокачественных клеток изображен в виде круга; шесть равномерно распределенных точек на окружности круга изображают моменты времени введения; круг и точки образуют первый круг (который соответствует установлению времени введения согласно настоящему варианту осуществления); дан второй круг, который имеет тот же размер, что и первый круг; 1/6 окружности второго круга показывает фазу G1; второй круг наложен на первый круг; и второй круг вращается по первому кругу (который соответствует различным злокачественным клеткам, проходящим клеточный цикл, в произвольном цикле), то оказывается, что второй круг включает в себя только одно введение из шести введений первого круга. Другими словами, если основную единицу измерения разделенного промежутка времени определяют равной длительности фазы G1, то в одном цикле введения фаза G1 соответствует моменту времени введения только один раз для всех злокачественных клеток. Следовательно, становится возможным вводить ингибирующий препарат в фазу G1 равномерно всем злокачественным клеткам.
С другой стороны, если разделенный промежуток времени соответствующей группы устанавливают меньшим, чем фаза G1, то, поскольку фаза G1 злокачественных клеток может включать в себя два введения в начале и в конце фазы G1, даже при введении в течение одного цикла, некоторые злокачественные клетки получат два введения противоракового препарата, тогда как другие злокачественные клетки получат одно введение противоракового препарата, что не может представлять собой полностью равномерное введение.
Кроме того, если разделенный промежуток времени определяют большим, чем длительность фазы G1, то, поскольку могут существовать злокачественные клетки, фаза G1 которых заключена в интервале между введениями, могут иметь место злокачественные клетки, которым не осуществлено введение в фазе G1.
Кроме того, в способе введения согласно первому варианту осуществления, если длительность введения имеет определенную продолжительность, могут существовать злокачественные клетки, которые получают однократное введение противоракового препарата в фазе G1, и злокачественные клетки, которые получают двойное введение противоракового препарата в фазе G1. При этом, в том случае, когда разделенный промежуток времени совпадает с фазой G1, даже если введение в фазе G1 охватывает две группы, полная продолжительность противоракового введения в цикле равна для всех злокачественных клеток, и противораковый препарат даже в этом случае может водиться всем злокачественным клеткам в одинаковой дозировке.
Следовательно, можно определить основную единицу измерения для деления слегка меньше или больше длительности фазы G1, причем все еще можно ожидать возможности получения более удовлетворительного воздействия, чем при обычных способах введения. При этом, для того чтобы осуществлять более эффективное и равномерное введение противоракового препарата, предпочтительным является разделение клеточного цикла на продолжительность предварительно определенной фазы, в которую противораковый препарат действует наиболее эффективно, в качестве основной единицы измерения и определения нескольких групп.
Как описано выше, в устройстве введения, способе его эксплуатации и способе введения согласно настоящему варианту осуществления определенное устройство введения, способ его эксплуатации и способ введения реализованы на основании подхода к введению противоракового препарата, основанного на предварительно определенной длительности клеточного цикла.
В данном случае, на Фиг. 7 фаза G1 описана как фаза, в которой противораковый препарат действует эффективно. При этом, поскольку другая фаза клеточного цикла может быть фазой, в которой противораковый препарат действует эффективно, в зависимости от комбинации клеток и препарата, в этом случае стандартной может быть другая фаза клеточного цикла.
Ниже по тексту дано более подробное описание определенных примеров конфигурации устройства введения, способа его эксплуатации и способа введения согласно настоящему варианту осуществления. Выше приведен пример подвергаемой некрозу злокачественной клетки, являющейся злокачественной клеткой, и применяемого препарата, являющегося противораковым препаратом. При этом, поскольку устройство введения, способ его эксплуатации и способ введения согласно настоящему изобретению можно применять вообще к злокачественной клетке или опухоли, которая осуществляет клеточное деление, препарат можно обобщить и назвать ингибирующим препаратом или ингибитором.
Фиг. 8 представляет собой диаграмму, показывающую конфигурацию примера устройства введения согласно первому варианту осуществления настоящего изобретения. На Фиг. 8 устройство введения согласно первому варианту осуществления включает в себя контроллер 40, трансфузионный насос 50, механизм 60 блокировки трансфузии, трансфузионную трубку 70, иглу 71 и контейнер 72 для раствора препарата (который можно называть пакетом для раствора препарата). Иглу 71 располагают на конце трансфузионной трубки 70, и трансфузионный насос 50 и механизм 60 блокировки трансфузии располагают посередине трубки раствора препарата 70. Контроллер 40 электрически связан с трансфузионным насосом 50 и механизмом 60 блокировки трансфузии. Например, трансфузионный насос 50, трансфузионная трубка 70, игла 71 и контейнер 72 для раствора препарата могут предлагаться как набор для трансфузии в комплекте для сборки.
Устройство введения согласно настоящему варианту осуществления можно описать как блок введения, который вводит ингибирующий препарат в тело пациента, упомянув в качестве примера блок, который использует трансфузионный насос 50. Если введение пациенту осуществляют с применением трансфузионного насоса 50, то в качестве препарата используют жидкий раствор препарата, и введение осуществляют посредством введения раствора препарата в вену в теле пациента посредством трансфузии. Принцип способа введения согласно первому варианту осуществления, описанный на Фиг. 7, можно применять к общим ингибирующим препаратам, которые ингибируют клеточное деление злокачественных клеток, без ограничения раствора препарата, и можно использовать различные блоки введения, подходящие для вводимого ингибирующего препарата. При этом, для упрощения изложения ниже по тексту дается описание устройства введения с применением трансфузии. Тем не менее устройство введения, способ его эксплуатации и способ введения согласно настоящему изобретению можно применять в различных случаях введения ингибирующего препарата, который ингибирует клеточное деление злокачественных клеток, пациенту, и можно использовать для другого внутримышечного введения, подкожного введения, кожного введения, трансназального введения, парентерального введения, такого как легочное введение, или перорального введения и тому подобного. Следовательно, устройство введения, способ его эксплуатации и способ введения не ограничены использованием трансфузии.
Трансфузионный насос 50 представляет собой трансфузионный блок для того, чтобы перекачивать ингибирующий препарат (т.е. раствор препарата), содержащийся в контейнере 72 для раствора препарата, через трансфузионную трубку 70 в направлении иглы 71 на конце. Пригодны для использования различные трансфузионные насосы 50, при условии, что трансфузионный насос 50 может перекачивать раствор препарата.
Механизм 60 блокировки трансфузии представляет собой блок для того, чтобы блокировать трансфузию, когда раствор препарата не вводится. Механизм 60 блокировки трансфузии может представлять собой, например, механизм, который закрывает канал потока и блокирует трансфузию посредством сжатия трансфузионной трубки 70 и посредством сдавливания трансфузионной трубки 70 снаружи. В этом случае в качестве способа сдавливания трансфузионной трубки 70 могут применяться, например, способ сдавливания трансфузионной трубки 70 непосредственно с помощью подвижного рычага, приводимого в движение двигателем, способ сдавливания поворотом винта и тому подобные в соответствии с предполагаемым назначением.
Контроллер 40 предлагается в виде блока, который управляет приводом трансфузионного насоса 50 и приводом механизма 60 блокировки трансфузии.
Фиг. 9 представляет собой диаграмму, показывающую пример ношения пациентом устройства введения согласно первому варианту осуществления. Контроллер 40 надевают на тело пациента. При этом контейнер 72 для раствора препарата, который не показан на Фиг. 9, устанавливают в чехле 73. Трансфузионный насос 50 располагают около чехла 73 и соединяют с контейнером 72 для раствора препарата посредством трансфузионной трубки 70, и их надевают на тело пациента вместе. Механизм 60 блокировки трансфузии надевают вблизи тела пациента, а также трансфузионного насоса 50. Ингибирующий препарат, перекачиваемый трансфузионным насосом 50, закачивается в тело пациента через трансфузионную трубку 70 и иглу 71.
Фиг. 10 представляет собой диаграмму, показывающую пример внутренней конфигурации контроллера 40 согласно первому варианту осуществления. На Фиг. 10 контроллер 40 согласно первому варианту осуществления включает в себя блок 10 ввода информации о введении лекарственного средства, блок 11 хранения момента времени введения, блок 12 хранения длительности введения, блок 13 хранения скорости введения, блок 14 измерения времени, блок 15 управления, блок 16 привода трансфузионного насоса и блок 17 привода механизма блокировки трансфузии. Кроме того, на Фиг. 10 трансфузионный насос 50 и механизм 60 блокировки трансфузии, соединенные с контроллером 40, показаны как внешние элементы.
Блок 10 ввода информации о введении лекарственного средства представляет собой блок ввода, для того чтобы предоставлять медицинскому работнику возможность устанавливать момент времени введения ингибирующего препарата (например, время начала введения, как, например, в какой момент; т.е. во сколько часов и минут), продолжительность введения и скорость введения (например, измеряемую в мл в час). Другими словами, контроллер 40 сконфигурирован так, что медицинский работник может установить временной промежуток введения и дозу ведения ингибирующего препарата, то есть длительность трансфузии и скорость трансфузии, в зависимости от типа ингибирующего препарата.
В данном случае блок 10 ввода информации о введении лекарственного средства может быть сконфигурирован так, чтобы предоставлять медицинскому работнику возможность вводить другую связанную информацию, такую как тип ингибирующего препарата и дозировка, и вводимая информация может быть определена в зависимости от предполагаемого применения. Блок ввода информации о введении лекарственного средства 10 может быть устроен так, что он представляет собой устройство ввода, основанное на выборе, такое как сенсорная панель, или может быть устроен так, что он представляет собой устройство ввода, в которое непосредственно вводят устанавливаемые значения по одному. Блок 10 ввода информации о введении лекарственного средства может принимать различные конфигурации и способы ввода в зависимости от предполагаемого применения.
Блок 11 хранения момента времени введения представляет собой блок для сохранения времени введения, в которое следует начинать введение, которое вводят и устанавливают в блоке ввода информации о введении лекарственного средства 10. Аналогично, блок 12 хранения длительности введения представляет собой блок для сохранения в