Способ получения продукта для регенерации воздуха
Иллюстрации
Показать всеИзобретение относится к способам получения продуктов для регенерации воздуха, используемых в системах жизнеобеспечения человека при создании локальных дыхательных атмосфер. Способ получения продукта для регенерации воздуха заключается во взаимодействии раствора пероксида водорода и гидроксида калия с последующим нанесением полученного щелочного раствора пероксида водорода на индифферентную пористую волокнистую матрицу и дегидратацию жидкой фазы на матрице. В исходный раствор пероксида водорода перед добавлением гидроксида калия последовательно вводят сульфат магния и галогениды щелочных металлов. Галогениды щелочных металлов, в качестве которых используют фторид калия, хлориды лития, натрия, калия или их смеси, вводят в жидкую фазу через 5÷10 минут после добавления сульфата магния. Способ получения продукта для регенерации воздуха обеспечивает снижение на единицу конечной продукции исходного сырья (пероксида водорода) и энергии, необходимой для испарения воды на стадии дегидратации. 8 пр., 2 табл.
Реферат
Изобретение относится к способам получения продуктов для регенерации воздуха, используемых в системах жизнеобеспечения человека (СЖО) при создании локальных дыхательных атмосфер.
Известен способ получения продукта для регенерации воздуха (патент РФ №2225241, МПК A62D 9/00, 2004), по которому продукт получают путем взаимодействия растворов пероксида водорода (H2O2) и гидроксида калия (KOH), нанесения полученного щелочного раствора пероксида водорода на индифферентную пористую волокнистую матрицу и последующей дегидратацией жидкой фазы на матрице. При этом используется раствор пероксида водорода концентрацией от 50 до 85% и раствор гидроксида калия с концентрацией 50-60% или твердый KOH. Мольное соотношение H2O2/KOH=1,5÷2,0. Смешение компонентов производят таким образом, чтобы температура в зоне синтеза не превышала 45°C (предпочтительно не выше 10°C). Дегидратацию жидкой фазы на матрице осуществляют либо сушкой в вакууме при 30-150°C или в потоке осушенного декарбонизированного воздуха либо инертного газа при атмосферном давлении при температуре 60-200°C.
Однако данный способ получения продукта для регенерации воздуха имеет существенный недостаток - высокие нормы расхода исходного сырья (H2O2) на единицу конечной продукции при его реализации в промышленном масштабе. Это происходит за счет того, что при длительном использовании в реальном производственном цикле (не менее 8 часов) щелочной раствор пероксида водорода, полученный смешением H2O2 и KOH, меняет свой химический состав из-за гетерогенного разложения H2O2 на стенках реакционных емкостей, трубопроводах, матрице и т.д., контактирующих с жидкой фазой, и гомогенного разложения пероксида водорода, катализируемого присутствующими в растворе ионами (прежде всего OH-) [У. Шамб, Ч. Сеттерфилд, Р. Вентворс. Перекись водорода, - М.: Иностранная литература. 1958. 578 с. ].
Каталитический распад H2O2 приводит к снижению содержания основного компонента (надпероксида калия) в получаемом продукте для регенерации воздуха, что в свою очередь негативно сказывается на его основных эксплуатационных характеристиках. С целью получения продукта для регенерации воздуха с максимальным содержанием основного компонента необходимо при снижении концентрации пероксида водорода в исходном щелочном растворе ниже предельно допустимого значения (индивидуального для каждой системы, но не меньше стехиометрического соотношения реагирующих компонентов - KOH и H2O2) довести его концентрацию до первоначального значения. Необходимость данной технологической операции ведет не только к дополнительному расходу исходного сырья (H2O2), но и повышает энергозатраты процесса в целом вследствие необходимости удалять на стадии дегидратации большее количество воды (которая вводится в систему как при добавлении раствора H2O2, так и образуется при его разложении).
Следует также отметить, что при распаде пероксида водорода выделяется атомарный кислород - один из наиболее сильных окислителей, что при разложении существенных количеств H2O2 создает дополнительную угрозу возникновения «кислородного» пожара, устранить который практически невозможно. Кроме того, продукт для регенерации воздуха, полученный известным способом, характеризуется недостаточно эффективным использованием ресурса при его эксплуатации в системах жизнеобеспечения человека.
Это обусловлено следующими факторами. Во-первых, при получении продукта для регенерации воздуха из-за высокой вязкости концентрированного щелочного раствора пероксида водорода достаточно сложно равномерно нанести его на волокнистую матрицу, что приводит к неоднородному распределению активных центров продукта для регенерации воздуха (надпероксид и гидроксид калия) по поверхности матрицы. Это, в свою очередь, приводит к неравномерной отработке продукта при его эксплуатации в системах жизнеобеспечения, что негативно сказывается на такие важные эксплуатационные характеристики, как время защитного действия, степень отработки по диоксилу углерода и кинетике его поглощения. Последний недостаток особенно отчетливо проявляется при эксплуатации систем жизнеобеспечения человека, снаряженных указанным продуктом для регенерации воздуха, в режиме высоких нагрузок, требующих быстрого удаления из газовой фазы значительного количества диоксида углерода. Низкие скорости поглощения диоксида углерода приводят к его накоплению в регенерируемом газе, что может негативно сказаться не только на физическом состоянии пользователя системами СЖО, но и представлять серьезную опасность для его жизни.
Задачей изобретения является повышение экономичности и безопасности процесса получения продукта для регенерации воздуха, обладающего улучшенными эксплуатационными характеристиками.
Технический результат изобретения заключается в снижении расхода исходного сырья (H2O2), снижении энергозатрат процесса в целом и эффективном использовании ресурса продукта для регенерации воздуха при его эксплуатации в системах жизнеобеспечения человека
Задача решается изобретением, согласно которому в способе получения продукта для регенерации воздуха, включающем взаимодействие пероксида водорода и гидроксида калия, нанесение полученного щелочного раствора пероксида водорода на индифферентную пористую волокнистую матрицу и последующую дегидратацию жидкой фазы на матрице, в исходный раствор пероксида водорода перед добавлением гидроксида калия дополнительно последовательно вводят сульфат магния (MgSO4) при мольном соотношении пероксид водорода/сульфат магния равном 480÷655 и галогениды щелочных металлов (MeHal) при мольном соотношении гидроксид калия/галогенид щелочного металла (KOH/MeHal), равном 13÷110, а смешение пероксида водорода и гидроксида калия осуществляют при мольном соотношении пероксид водорода/гидроксид калия равном 1,55÷1,85. При этом предпочтительно галогениды щелочных металлов в жидкую фазу вводят через 5÷10 минут после добавления сульфата магния. В качестве галогенидов щелочных металлов предпочтительно использовать фторид калия, хлориды лития, натрия, калия или их смеси. Гидроксид калия добавляют в жидкую фазу не менее чем через 20 минут после добавления галогенидов щелочных металлов.
Последовательное ведение в раствор пероксида водорода сульфата магния и галогенидов щелочных металлов перед добавлением гидроксида калия обеспечивает практическое постоянство химического состава получаемого щелочного раствора пероксида водорода на протяжении до 21 часа и дает возможность использовать в качестве исходных компонентов концентрированные растворы H2O2 и твердый KOH. Это позволяет не только снизить расход пероксида водорода на получение единицы целевого продукта и повысить в нем содержание основного вещества (надпероксида калия), но и снизить расход энергии, необходимой для перевода воды из жидкой фазы в газообразную при дегидратации жидкой фазы на матрице.
Из практики работы с различными растворами пероксида водорода известно [Г.А. Серышев. Химия и технология перекиси водорода, - Л.: Химия, 1984. С. 182.], что механизм снижения кинетики распада пероксида водорода в различных растворах не известен. Поэтому сложно однозначно оценить влияние того или иного иона или их ассоциатов (а также их концентрационное влияние), содержащихся в многокомпонентном растворе, на поведение системы в целом. Поиск необходимой композиции веществ для снижения кинетики распада пероксида водорода каждой конкретной системы - задача, которая решается только эмпирическим путем. Причем здесь важную роль играет не только качественный и количественный состав присутствующих в системе ионов, но и порядок их введения в раствор. На основании проведенных экспериментов было отмечено, что для снижения кинетики распада H2O2, содержащегося в щелочном растворе пероксида водорода при получении продукта для регенерации воздуха указанным способом должен соблюдаться следующий порядок введения компонентов. Вначале к исходному раствору пероксида водорода добавляется в необходимом количестве сульфат магния, после его полного растворения через 5-10 минут добавляют галогениды щелочных металлов. Гидроксид калия вводят в систему примерно через 20 минут после добавления галогенидов щелочных металлов, т.е. когда введенные в жидкую фазу ионы, обеспечивающие снижение кинетики распада пероксида водорода, достаточно равномерно распределятся по всему объему раствора. Добавление всех указанных компонентов проводят при интенсивном механическом перемешивании жидкой фазы.
Заявляемое изобретение позволяет улучшить эксплуатационные характеристики продукта для регенерации воздуха при его эксплуатации в системах жизнеобеспечения человека при создании локальных дыхательных атмосфер по следующим обстоятельствам.
Присутствие в щелочном растворе пероксида водорода галогенид-анионов снижает его вязкость, что позволяет более равномерно нанести его на матрицу, т.е. приводит к более однородному распределению активных центров продукта для регенерации воздуха по поверхности матрицы. Это, в свою очередь, приводит к более равномерной отработке продукта для регенерации воздуха при его эксплуатации в системах жизнеобеспечения, т.е. улучшает его эксплуатационные характеристики (прежде всего время защитного действия).
Кроме того, продукт для регенерации воздуха, полученный по изобретению, имеет более высокую динамическую емкостью по диоксиду углерода на единицу массы и лучшие кинетические параметры процесса хемосорбции CO2 нежели прототип. Специалистам, работающим в данной области техники, хорошо известно, что процессы хемосорбции различных газов твердыми веществами протекают в жидкой фазе, образующейся на поверхности гранул хемосорбентов (продуктов для регенерации воздуха). Присутствие галогенидов щелочных металлов, снижающих вязкость поверхностной пленки водного раствора, образующейся на поверхности гранул продукта, приводит к усилению диффузионных процессов в жидкой фазе и повышению растворимости и ионизации реагирующих веществ (гидроксида калия и диоксида углерода) в водном растворе поверхностной пленки. За счет этого имеет место интенсификация массообменных процессов на границах раздела газ - жидкость и жидкость - твердая фаза при эксплуатации продукта для регенерации воздуха в системах жизнеобеспечения человека.
Затуханию процесса регенерации воздуха способствует дегидратация жидкой фазы за счет уноса воды потоком очищаемого газа и выделяющегося кислорода. Этому явлению препятствует наличие в жидкой фазе галогенидов щелочных металлов, обладающих гигроскопичными свойствами.
Способ получения продукта для регенерации воздуха осуществляют следующим образом. Готовят исходный щелочной раствор пероксида водорода, для чего в раствор пероксида водорода с концентрацией от 50 до 85% массовых при интенсивном перемешивании последовательно вводят сульфат магния, галогениды щелочных металлов (фторид калия, хлориды лития, натрия, калия или их смеси) и гидроксид калия. Причем галогениды щелочных металлов вводят в жидкую фазу через 5-10 минут после сульфата магния, а гидроксид калия вводят в систему не менее чем через 20 минут после введения галогенидов щелочных металлов. Мольное соотношение исходных компонентов должно составлять следующие величины: пероксид водорода/сульфат магния (H2O2/MgSO4)=480-655; гидроксид калия/галогенид щелочного металла (KOH/MeHal)=13÷110, пероксид водорода/гидроксид калия (H2O2/KOH)=1,55-1,85. Для снижения кинетики процесса распада пероксида водорода добавление гидроксида калия проводят таким образом, чтобы температура жидкой фазы не превышала 50°C. Полученный щелочной раствор пероксида водорода на протяжении всего технологического цикла (8 часов) хранят в темном месте при температуре не выше 25°C и через определенные интервалы времени проводят анализы по определению химического состава жидкой фазы. При снижении мольного соотношения H2O2/KOH менее 1,5 (стехиометрическое соотношение компонентов протекающей реакции) за счет распада H2O2 в щелочной раствор дополнительно вводят пероксид водорода в количестве, необходимом для достижения первоначального значения.
По мере технологической надобности на протяжении всего производственного цикла щелочной раствор пероксида водорода равномерно наносят на индифферентную пористую волокнистую матрицу необходимых геометрических размеров любым известным способом (например, пропитка, аэрозольное напыление и др.) и проводят дегидратацию. Дегидратацию пропитанной исходным раствором пористой волокнистой матрицы осуществляют либо сушкой в вакууме при 30-150°C или в потоке осушенного декарбонизированного воздуха либо инертного газа, выступающих в качестве сушильного агента, при атмосферном давлении при температуре 60-220°C.
Декарбонизация сушильного агента проводится с помощью любого поглотителя диоксида углерода. Обезвоживание сушильного агента можно осуществлять, пропуская его через регенерируемые поглотители воды типа цеолита, силикагеля и др. По окончании дегидратации готовый продукт для регенерации воздуха помещают в специальный контейнер.
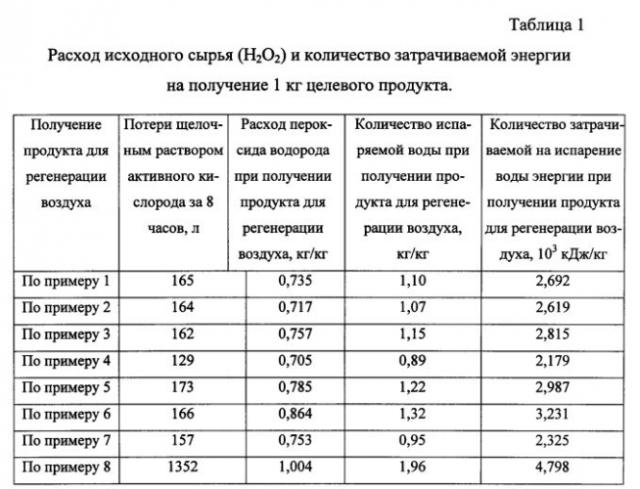
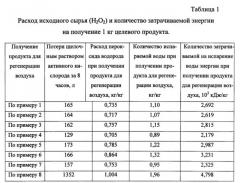
В примерах 1-7 и в Таблице 1 приведены данные о получении заявляемым способом продукта для регенерации воздуха в течение 8 часов, т.е. в течение производственной смены. Пример 8 описывает получение продукта для регенерации по патенту РФ №2225241, МПК A62D 9/00, 2004 г. в тождественных производственных условиях.
Пример 1.
К 24,73 л водного 50% раствора пероксида водорода при непрерывном перемешивании добавляют 108,8 г сульфата магния (H2O2/MgSO4=480) и через 10 минут добавляют 817,3 г хлорида лития (KOH/MeHal=13). Примерно через 20 минут после равномерного распределения всех введенных компонентов по объему жидкой фазы добавляют 15,56 кг твердого 90% гидроксида калия (H2O2/KOH=1,74). Добавление KOH производят таким образом, чтобы температура жидкой фазы не превышала 50°C. Далее полученный щелочной раствор пероксида водорода по мере технологической надобности на протяжении производственной смены (8 часов) равномерно наносят на индифферентную пористую волокнистую матрицу необходимых геометрических размеров аэрозольным напылением и проводят дегидратацию. Дегидратацию жидкой фазы на матрице осуществляют сушкой в вакууме при 30-90°C и остаточном 0,96 атм. давлении. Получают 20,1 кг продукта, содержащего 69,6% KO2, 17,1% KOH, 5,2% H2O, 0,5% MgSO4,4,8% LiCl и 2,8% матрицы. При этом в процессе синтеза было испарено 22,1 кг воды, на что потребовалось затратить 5,410·104 кДж энергии. Потеря щелочным раствором пероксида водорода активного кислорода за 8 часов составила 165 л.
Пример 2.
К 23,87 л водного 50% раствора пероксида водорода при непрерывном перемешивании добавляют 101 г сульфата магния (H2O2/MgSO4=525) и через 8 минут добавляют 585 г хлорида натрия (KOH/MeHal=25). Примерно через 25 минут после равномерного распределения всех введенных компонентов по объему жидкой фазы добавляют 15,56 кг твердого 90% гидроксида калия (H2O2/KOH=1,68). Добавление KOH производят таким образом, чтобы температура жидкой фазы не превышала 50°C. Далее полученный щелочной раствор пероксида водорода по мере технологической надобности на протяжении производственной смены (8 часов) равномерно наносят пропиткой на индифферентную пористую волокнистую матрицу необходимых геометрических размеров и проводят дегидратацию. Дегидратацию жидкой фазы на матрице осуществляют сушкой в вакууме при 30-90°C и остаточном давлении 0,95 атм. Получают 19,9 кг продукта, содержащего 69,2% KO2, 18,1% KOH, 5,5% H2O, 0,5% MgSO4, 3,7% NaCl и 3,0% матрицы. При этом в процессе синтеза было испарено 21,2 кг воды, на что потребовалось затратить 5,19·104 кДж энергии. Потеря щелочным раствором пероксида водорода активного кислорода за 8 часов составила 164 л.
Пример 3.
К 24,43 л водного 50% раствора пероксида водорода при непрерывном перемешивании добавляют 94 г сульфата магния (H2O2/MgSO4=551) и через 7 минут добавляют 548 г хлорида калия (KOH/MeHal=34). Примерно через 30 минут после равномерного распределения всех введенных компонентов по объему жидкой фазы добавляют 15,56 кг твердого 90% гидроксида калия (H2O2/KOH=1,72). Добавление KOH производят таким образом, чтобы температура жидкой фазы не превышала 50°C. Далее полученный щелочной раствор пероксида водорода по мере технологической надобности на протяжении производственной смены (8 часов) равномерно наносят на индифферентную пористую волокнистую матрицу необходимых геометрических размеров аэрозольным напылением и проводят дегидратацию. Дегидратацию жидкой фазы на матрице осуществляют сушкой в потоке осушенного и декарбонизованного воздуха при температуре 200°C. Получают 19,3 кг продукта, содержащего 68,6% KO2, 18,6% KOH, 5,1% H2O, 0,5% MgSO4, 3,8% KCl и 3,4% матрицы. При этом в процессе синтеза было испарено 22,21 кг воды, на что потребовалось затратить 5,437·104 кДж энергии. Потеря щелочным раствором пероксида водорода активного кислорода за 8 часов составила 162 л.
Пример 4.
К 11,35 л водного 85% раствора пероксида водорода при непрерывном перемешивании добавляют 76,2 г сульфата магния (H2O2/MgSO4=610) и через 5 минут добавляют 290 г фторида калия (KOH/MeHal=50). Примерно через 27 минут после равномерного распределения всех введенных компонентов по объему жидкой фазы добавляют 15,56 кг твердого 90% гидроксида калия (H2O2/KOH=1,55). Добавление KOH производят таким образом, чтобы температура жидкой фазы не превышала 50°C. Далее полученный щелочной раствор пероксида водорода по мере технологической надобности на протяжении производственной смены (8 часов) равномерно наносят на индифферентную пористую волокнистую матрицу необходимых геометрических размеров аэрозольным напылением и проводят дегидратацию. Дегидратацию жидкой фазы на матрице осуществляют сушкой в потоке осушенного и декарбонизованного воздуха при температуре 150°C.Получают 18,7 кг продукта, содержащего 75,9% KO2, 13,6% KOH, 4,4% H2O, 0,5% MgSO4, 2,3% KF и 3,3% матрицы. При этом в процессе синтеза было испарено 16,63 кг воды, на что потребовалось затратить 4,067·104 кДж энергии. Потеря щелочным раствором пероксида водорода активного кислорода за 8 часов составила 129 л.
Пример 5.
К 24,16 л водного 50% раствора пероксида водорода при непрерывном перемешивании добавляют 77,9 г сульфата магния (H2O2/MgSO4=655) и через 8 минут добавляют 158,3 хлорида калия и 58 г фторида калия (KOH/MeHal=80). Примерно через 30 минут после равномерного распределения всех введенных компонентов по объему жидкой фазы добавляют 15,56 кг твердого 90% гидроксида калия (H2O2/KOH=1,7). Добавление KOH производят таким образом, чтобы температура жидкой фазы не превышала 50°C. Далее полученный щелочной раствор пероксида водорода по мере технологической надобности на протяжении производственной смены (8 часов) равномерно наносят пропиткой на индифферентную пористую волокнистую матрицу необходимых геометрических размеров и проводят дегидратацию. Дегидратацию жидкой фазы на матрице осуществляют сушкой в вакууме при 30-50°C и остаточном давлении 0,95 атм. Получают 18,4 кг продукта, содержащего 70,2% KO2, 19,1% KOH, 5,1% H2O, 0,4% MgSO4, 2,4% KCl, 0,4% KF и 2,8% матрицы. При этом в процессе синтеза было испарено 22,4 кг воды, на что потребовалось затратить 5,481·104 кДж энергии. Потеря щелочным раствором пероксида водорода активного кислорода за 8 часов составила 173 л.
Пример 6.
К 26,3 л водного 50% раствора пероксида водорода при непрерывном перемешивании добавляют 101 г сульфата магния (H2O2/MgSO4=550) и через 10 минут добавляют 8,5 хлорида лития, 134,1 хлорида калия и 15,7 г фторида калия (KOH/MeHal=110). Примерно через 20 минут после равномерного распределения всех введенных компонентов по объему жидкой фазы добавляют 15,56 кг твердого 90% гидроксида калия (H2O2/KOH=1,85). Добавление KOH производят таким образом, чтобы температура жидкой фазы не превышала 50°C. Далее полученный щелочной раствор пероксида водорода по мере технологической надобности на протяжении производственной смены (8 часов) равномерно наносят на индифферентную пористую волокнистую матрицу необходимых геометрических размеров аэрозольным напылением и проводят дегидратацию. Дегидратацию жидкой фазы на матрице осуществляют сушкой в потоке осушенного и декарбонизованного воздуха при температуре 220°C. Получают 18,2 кг продукта, содержащего 62,5% KO2, 16,4% KOH, 9,2% Na2O2, 2,4% NaOH, 6,2% H2O, 0,4% MgSO4 и 2,9% матрицы. При этом в процессе синтеза было испарено 24,02 кг воды, на что потребовалось затратить 5,868·104 кДж энергии. Потеря щелочным раствором пероксида водорода активного кислорода за 8 часов составила 166 л.
Пример 7.
К 12,0 л водного 85% раствора пероксида водорода при непрерывном перемешивании добавляют 96,5 г сульфата магния (H2O2/MgSO4=510) и через 7 минут добавляют 193,7 г хлорида калия и 63,8 г хлорида лития (KOH/MeHal=61). Примерно через 25 минут после равномерного распределения всех введенных компонентов по объему жидкой фазы добавляют 15,56 кг твердого 90% гидроксида калия (H2O2/KOH=1,64). Добавление KOH производят таким образом, чтобы температура жидкой фазы не превышала 50°C. Далее полученный щелочной раствор пероксида водорода по мере технологической надобности на протяжении производственной смены (8 часов) равномерно наносят на индифферентную пористую волокнистую матрицу необходимых геометрических размеров аэрозольным напылением и проводят дегидратацию. Дегидратацию жидкой фазы на матрице осуществляют сушкой в потоке осушенного и декарбонизованного воздуха при температуре 150°C. Получают 18,5 кг продукта, содержащего 74,4% KO2, 15,6% KOH, 4,4% H2O, 0,6% MgSO4, 0,3% LiCl, 1,5% KCl и 3,2% матрицы. При этом в процессе синтеза было испарено 17,59 кг воды, на что потребовалось затратить 4,30·104 кДж энергии. Потеря щелочным раствором пероксида водорода активного кислорода за 8 часов составила 157 л.
Пример 8 (сравнительный).
Исходный щелочной раствор пероксида водорода для последующей дегидратации готовят, соблюдая технологические операции и мольное соотношение исходных компонентов, изложенные в примере 1 патента РФ 2225241, МПК A62D 9/00, 2004 г. Щелочной раствор пероксида водорода готовят в количестве, необходимом для непрерывной реализации технологического процесса, в течение производственной смены (8 часов).
К 23,52 л 50% пероксида водорода добавляют 11,25 л 50% раствора гидроксида калия (мольное соотношение H2O2/KOH=2,0). Приготовление щелочного раствора пероксида водорода производят таким образом, чтобы температура в зоне реакции не превышала 50°C. Далее полученный щелочной раствор пероксида водорода по мере технологической надобности на протяжении производственной смены (8 часов) равномерно наносят на индифферентную пористую волокнистую матрицу необходимых геометрических размеров аэрозольным напылением и проводят дегидратацию. Дегидратацию жидкой фазы на матрице осуществляют сушкой в потоке осушенного и декарбонизованного воздуха при температуре 220°C.
Через 3 часа после приготовления щелочного раствора пероксида водорода мольное отношение H2O2/KOH составило 1,48, т.е. меньше стехиометрического соотношения равного 1,5. Поэтому для достижения начального соотношения исходных компонентов H2O2/KOH=2,0 в оставшийся щелочной раствор пероксида водорода было добавлено 3,7 л 50% пероксида водорода. Через 3 часа по аналогичной причине операция была повторена и в жидкую фазу ввели еще 1,65 л 50% пероксида водорода. Получают 17,2 кг продукта, содержащего 72,6% KO2. 17,9% KOH, 6,4% H2O и 3,1% пористой матрицы.
При этом в процессе синтеза было испарено 33,65 кг воды, на что потребовалось затратить 8,234·104 кДж энергии. Потеря щелочным раствором пероксида водорода активного кислорода за 8 часов составила 1352 л.
Нормы расхода H2O2 и затрачиваемой энергии при получении 1 кг готового продукта, а так же количество выделившегося активного кислорода за 8 часов непрерывного синтеза по примерам 1-8 приведены в таблице 1.
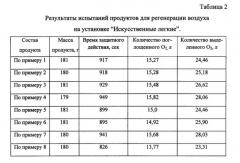
Продукт для регенерации воздуха, полученный по заявляемому способу, испытан в патроне изолирующего дыхательного аппарата на установке "Искусственные легкие" (ИЛ) при следующих условиях:
| - легочная вентиляция | 30,0±1 л/мин |
| - объемная подача диоксида углерода | 1,0±0,03 л/мин |
| - влажность газовоздушной смеси, % | 96-98 |
| - потребление кислорода (отсос из установки) | 1,14±0,05 л/мин |
| - частота дыхания | 20±0,5 мин-1 |
| - температура окружающей среды | 20-25°C |
Объемы кислорода и диоксида углерода указаны при 10°C и 101,3 кПа, легочная вентиляция - при 37°C и 101,3 кПа. Для сравнения с регенеративными продуктами, полученными заявляемым способом (примеры 1-7), в тех же условиях был испытан регенеративный продукт, изготовленный по методике, описанной в примере 1 патента РФ №2225241 (пример 8). Все регенеративные продукты имели форму пластин одинакового размера и плотности. Время защитного действия определяли как время от начала работы регенеративного продукта до того момента, когда концентрация CO2 в потоке газо-воздушной смеси на линии "вдоха" установки "ИЛ" достигала 3%. Результаты испытаний представлены в таблице 2.
Как видно из представленных в таблицах 1-2 данных, предложенный способ получения продукта для регенерации воздуха обеспечивает снижение на единицу конечной продукции исходного сырья (пероксида водорода) и энергии, необходимой для испарения воды на стадии дегидратации при его реализации в производственном цикле в течение 8 часов. При этом более чем в 7 раз уменьшается выделение одного из сильнейших окислителей - атомарного кислорода, что существенно повышает безопасность производства.
Как видно из представленных в таблице 2 данных, продукт для регенерации воздуха, полученный по изобретению, обеспечивает за счет интенсификации массообменных процессов на границах раздела газ - жидкость и жидкость - твердая фаза более высокую динамическую емкостью по диоксиду углерода на единицу массы и лучшие кинетические параметры процесса хемосорбции CO2, т.е. при его эксплуатации в системах жизнеобеспечения человека увеличивается время защитного действия при одинаковых массогабаритных характеристиках изделия.
Способ получения продукта для регенерации воздуха, включающий взаимодействие пероксида водорода и гидроксида калия, нанесение полученного щелочного раствора пероксида водорода на индифферентную пористую волокнистую матрицу и последующую дегидратацию жидкой фазы на матрице, отличающийся тем, что в исходный раствор пероксида водорода перед добавлением гидроксида калия последовательно вводят сульфат магния (MgSO4) при мольном соотношении пероксид водорода/сульфат магния равном 480÷655 и галогениды щелочных металлов (MeHal) при мольном соотношении гидроксид калия/галогенид щелочного металла (KOH/MeHal) равном 13÷110, смешение пероксида водорода и гидроксида калия осуществляют при мольном соотношении пероксид водорода/гидроксид калия равном 1,55÷1,85, при этом галогениды щелочных металлов, в качестве которых используют фторид калия, хлориды лития, натрия, калия или их смеси, вводят в жидкую фазу через 5÷10 минут после добавления сульфата магния, а гидроксид калия вводят в раствор не мене чем через 20 минут после введения галогенидов щелочных металлов.