Способ получения препарата для повышения мясной и молочной продуктивности сельскохозяйственных животных (варианты) и препарат, полученный на его основе
Иллюстрации
Показать всеГруппа изобретений относится к препарату для повышения мясной и молочной продуктивности сельскохозяйственных животных и вариантам способа его получения. Способ предусматривает выращивание рекомбинантного штамма Escherichia coli ВКПМ В-6519 на среде, содержащей источник аминного азота, источник витаминов, солевые компоненты и глюкозу, с перемешиванием и аэрацией. Осуществляют контроль либо уровня pH и оптической плотности, либо уровня растворенного кислорода и оптической плотности путем поэтапной подпитки глюкозой из расчета 2-3 г/дм3 культуральной жидкости и 10-12% раствором дрожжевого экстракта из расчета 3-4 г/дм3 культуральной жидкости. При достижении оптической плотности от 3 до 3,5 единицы вводят спиртовой раствор изопропил-бета-D-тиогалактозида в концентрации от 8 до 12 мг/дм3. Осуществляют выделение, очистку, сушку раствора белка и приготовление масляной суспензии препарата. Полученный препарат дополнительно содержит пчелиный воск, витамины А и Е и обладает стимулирующим действием на молочную и мясную продуктивность сельскохозяйственных животных. 3 н. и 8 з.п. ф-лы, 9 табл., 3 пр., 3 ил.
Реферат
Изобретение относится к биотехнологии и сельскохозяйственной микробиологии и заключается в интенсификации процесса биосинтеза клетками рекомбинантного штамма Escherichia coli соматостатинсодержащего белка, который регулирует образование и концентрацию соматотропного гормона у сельскохозяйственных животных.
В середине 90-х годов XX века российские исследователи предложили оригинальное решение повышения интенсивности роста животных, основывающееся на возможности регуляции уровней биологически активных пептидов и активности ферментов желудочно-кишечного тракта млекопитающих. Внимание привлек соматостатин - биологически активный полипептид, вырабатывающийся в гипоталамусе и желудочно-кишечном тракте животных. Соматостатин, оказывая сильное ингибирующее действие на ряд гормонов (соматотропин, ТТГ, инсулин, глюкагон и др.), инициирует угнетение секреции желудочных ферментов, поджелудочной железы, тонкого отдела кишечника, замедление моторики желудочно-кишечного тракта и эвакуации его содержимого. Вследствие этого, снижение концентрации соматостатина в организме инициирует увеличение содержания эндогенного соматотропного гормона, что приводит к интенсификации анаболических процессов.
Перспективным подходом для получения соматотропина в промышленных условиях является использование микроорганизмов в качестве продуцентов этого препарата [1, 2].
Известен способ получения соматотропина, включающий его экспрессию в клетках Escherichia coli, заключающийся в достаточно быстром биосинтезе микробными клетками рекомбинантного соматотропина в виде нерастворимых "телец включения" [3].
В патенте РФ №2233879 авторами описана конструкция плазмидной ДНК pES1-6, обеспечивающая синтез рекомбинантного соматотропина в клетках Escherichia coli [4].
Известен штамм Escherichia coli - продуцент свиного соматотропина (Патент РФ №2072393) [5].
В патенте РФ №2031121 авторами предложен способ получения рекомбинантного соматостатинсодержащего белка, используемого в качестве субстанции ветеринарного лекарственного средства для повышения мясной и молочной продуктивности сельскохозяйственных животных. Лекарственная форма соматостатинсодержащего белка, применяемая для повышения продуктивности сельскохозяйственных животных, содержит белок-носитель в виде ферментативно неактивной хлорамфеникол-ацетилтрансферазы без 10 С-терминальных аминокислот, иммуногенно-активную часть соматостатина и масляный адъювант [6].
Однако выход целевого белка, производимого по указанным способам, невысок и составляет около 0,2 г с 1 л культуральной жидкости продуцента.
При интенсификации способов производства биопрепаратов оптимизацию условий биосинтеза, как правило, проводят по следующей схеме: поиск оптимальных значений физико-химических параметров культивирования (рН, температурные показатели и др.), а также подбор состава питательной среды. Также интенсификация процесса биосинтеза достигается дозированным внесением дополнительных источников углеродного и азотного питания.
В ряде случаев интенсификация процессов биосинтеза может быть достигнута за счет изменений концентраций субстратов и/или физико-химических факторов. Образование заданных целевых пептидов происходит в начале стационарной фазы роста микробных клеток при исчерпании определенных специфических субстратов, в частности, при снятии ингибирования некоторых ферментов.
Подобная индукция регуляции факторов транскрипции генов была изучена при непрерывном культивировании дрожжей Saccharomyces cerevisiae в хемостате. На находящуюся в состоянии лимитированного галактозой сбалансированного роста (steady-state) культуру производилось импульсное воздействие различными концентрациями глюкозы. Было показано включение двух различных систем транскрипции на возмущающие переходные состояния [6].
В патенте РФ №2451070 описан способ ферментации с подпиткой для получения высокого выхода рекомбинантного белка. Он включает в себя непрерывное добавление источника углерода в питательную среду с культурой рекомбинантных бактериальных клеток и последующее постоянное непрерывное добавление индуктора в питательную среду после того, как в культуре достигнуто пороговое значение одного из параметров [7].
Технической задачей настоящего изобретения является разработка способа интенсификации процесса биосинтеза соматостатинсодержащего белка при глубинном культивировании клеток штамма-продуцента Escherichia coli, основанного на применении нового алгоритма внесения в культуральную среду источников углеродного питания. Следующей задачей настоящего изобретения является увеличение биологической активности соматостатинсодержащего белка при его применении у сельскохозяйственных животных путем добавления в состав лекарственной формы препарата новых ингредиентов, потенциирующих действие химерного белка.
Один из аспектов изобретения состоит в том, что для интенсификации процесса биосинтеза рекомбинантного соматостатинсодержащего белка клетки штамма-продуцента Escherichia coli, выращивают на среде, содержащей источники аминного азота, витаминов, солевые компоненты и глюкозу с перемешиванием и аэрацией, а в качестве индуктора используют изопропил-бета-D-тиогалактозид. При этом контролируют динамику процесса биосинтеза по значению pH среды. При резком повышении уровня pH на 0,2-0,4 единицы осуществляют подпитку среды источниками углерода, при первой подпитке в качестве источника углерода используют глюкозу в количестве 2-3 г/дм3 культуральной жидкости, вторую подпитку проводят 10-12% раствором дрожжевого экстракта из расчета 3-4 г/дм3 культуральной жидкости, а третью подпитку осуществляют введением глюкозы в количестве 2-3 г/дм3 культуральной жидкости.
Другой аспект изобретения состоит в том, что для интенсификации процесса биосинтеза рекомбинантного соматостатин содержащего белка клетки штамма-продуцента Escherichia coli, выращивают на среде, содержащей источники аминного азота, витаминов, солевые компоненты и глюкозу с перемешиванием и аэрацией, а в качестве индуктора используют изопропил-бета-D-тиогалактозид. При этом контролируют динамику процесса биосинтеза по уровню растворенного кислорода.
При повышении уровня растворенного кислорода на 20-40% от исходных показателей осуществляют подпитки среды культивированияисточниками углерода. При первой подпитке в качестве источника углерода используют глюкозу в количестве 2-3 г/дм3 культуральной жидкости. При вторичном повышении уровня растворенного кислорода вносят вторую подпитку в виде 10-12% раствора дрожжевого экстракта из расчета 3-4 г/дм3 культуральной жидкости. При следующем увеличении уровня растворенного кислорода на 20-40% вводят глюкозу в количестве 2-3 г/дм3 культуральной жидкости, при этом аэрацию увеличивают до 1 об/об/мин.
Следующий аспект изобретения состоит в том, что индуктор вводят при достижении плотности суспензии от 3 до 3,5 единиц, а в качестве индуктора используют спиртовой раствор изопропил-бета-D-тиогалактозида в концентрации от 8 до 12 мг/дм3, предпочтительно в концентрации 10,5 мг/дм3.
Другой аспект изобретения состоит в том, что ветеринарный лекарственный препарат для повышения мясной и молочной продуктивности сельскохозяйственных животных состоит из соматостатинсодержащащего белка, полученного при глубинном выращивании клеток рекомбинантного штамма - продуцента Escherichia coli ВКПМ В-6519, адъюванта на основе рафинированных растительных масел и дополнительно содержит пчелиный воск, а также лекарственные соединения (витамины А и Е), потенциирующие действие химерного белка. При этом основные компоненты препарата на 100 мл масляной суспензии содержат 0,9 г пчелиного воска, 250 мг химерного белка, 300000 ME витамина А и 200 мг витамина Е.
Перечень фигур
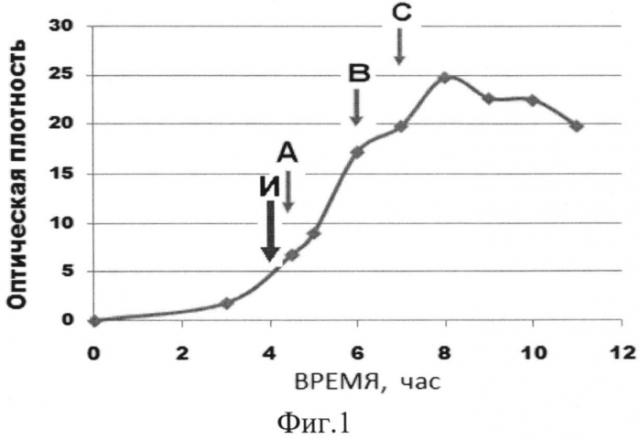
Фиг. 1 Контроль культивирования по оптической плотности, где И - момент внесения индуктора ИПТГ, а А, В. С - периоды введения дополнительных источников углерода при контроле pH.
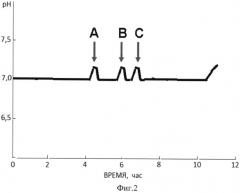
Фиг. 2 Динамика изменения рН в процессе биосинтеза рекомбинантного соматостатинсодержащего белка.
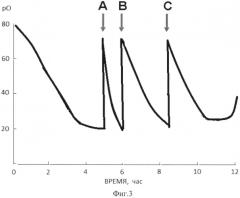
Фиг. 3 Динамика изменения концентрации растворенного кислорода в процессе биосинтеза рекомбинантного соматостатинсодержащего белка.
В процессе разработки способа интенсификации биосинтеза соматостатинсодержащего белка с помощью нового алгоритма подпитки углеродными субстратами при глубинном культивировании клеток Escherichia coli было обнаружено, что сочетание различных источников углерода на этапах культивирования позволяет повысить эффективность процесса синтеза микробными клетками рекомбинантного соматостатинсодержащего белка. Так импульсное введение на втором этапе глубинного культивирования клеток штамма-продуцента дрожжевого экстракта, содержащего несколько типов источников углерода, позволяет повысить выход целевого продукта.
Биосинтез целевого белка проводят в условиях глубинного культивирования клеток продуцента Escherichia coli (штамм ВКПМ В-6519) на питательной среде на основе триптона, дрожжевого экстракта, а также источников азота, фосфора, минеральных солей и содержащей в качестве источника углерода и энергии глюкозу. В качестве индуктора используют изопропил-бета-D-тиогалактозид (ИПТГ) из расчета 10,5 мг/дм3 питательной среды.
Клетки штамма ВКПМ В-6519 представляют собой грамотрицательные, малоподвижные палочки, при неблагоприятных условиях образующие филаменты. Клетки штамма хорошо растут в температурном интервале (30-42)°С на богатых средах типа LB, а также на синтетических средах с добавками, компенсирующими ауксотрофные мутации. На богатых средах клетки штамма образуют гладкие, с ровными краями колонии, которые со временем ослизняются, что объясняется lon-мутацией. При температуре инкубации 40-42°С ослизнения колоний не происходит. При росте на синтетических питательных средах с добавками клеточные колонии этого штамма всегда слизистые.
Клетки штамма Escherichia coli ВКПМ В-6519 (штамм депонирован во Всероссийской коллекции промышленных микроорганизмов) имеют следующие генетические маркеры: F-, lacY, supE, gal 6, xyl4, mal A1, arcH, his′, lon-, apr24, rpl. Клетки штамма устойчивы к стрептомицину, не сбраживают лактозу, галактозу, ксилозу и мальтозу. Клетки штамма растут на синтетической среде с добавками глюкозы, аргинина и гистидина. Клетки штамма ВКПМ В-6519, вследствие наличия плазмиды pC(Sp)nS, приобретают устойчивость к ампициллину. Культуру для рабочего банка клеток выращивают на полусинтетической жидкой питательной среде следующего состава (г/дм3):
| Глюкоза | 10,0 |
| Триптон | 15,0 |
| Дрожжевой экстракт | 7,5 |
| K2HPO4 | 1,0 |
| KH2PO4 | 0,5 |
| NaCl | 10,0 |
| Ампициллина натриевая соль | 0,05 |
| Вода дистиллированная | до 1 л |
| рН- | 7,0-7,1 |
Признак устойчивости клеток штамма к стрептомицину обеспечивает простую селекцию штамма, а отсутствие lon-протеазы обусловливает высокий уровень синтеза рекомбинантных белков.
Культуру для рабочего банка клеток выращивают на полусинтетической жидкой питательной среде приведенного выше состава.
Выращивание проводят в качалочных колбах объемом 750 см3 со 100 см3 питательной среды. Колбы засевают суспензией клеток, выращенных на поверхности агаризованной среды в чашках Петри, и инкубируют на качалке при температуре (37±1)°С и скорости перемешивания 200 об/мин в течение 7-10 часов.
Микробную культуру продуцента рекомбинантного соматостатинсодержащего белка в производственном ферментере выращивают на полусинтетической жидкой питательной среде приведенного выше состава.
Выдерживают следующие значения технологических параметров процесса культивирования:
| температура - | (37±1)°С; |
| значение рН (начальное) - | 7,0±0,1; |
| скорость перемешивания - | 350 об/мин; |
| аэрация - | 0,5 об/об/мин; |
| продолжительность выращивания - | 8-12 часов. |
Контроль процесса культивирования проводят по показаниям оптической плотности среды. Пробы для определения оптической плотности отбирают каждый час. При достижении плотности, равной 3-3,5 единиц (середина экспоненциальной фазы роста), в ферментер вносят спиртовый раствор индуктора изопропил-бета-D-тиогалактозида (ИПТГ) из расчета 10,5 мг/дм3.
В процессе биосинтеза с использованием в качестве продуцента клеток Escherichia coli и применением в качестве основного источника углерода глюкозы образуются «кислые» продукты метаболизма, снижающие значения рН среды. В процессе биосинтеза оптимальное значение рН среды (около 7,0) поддерживают с помощью контроллера, который автоматически добавляет в ферментер дозу щелочи для поддержания заданной величины pH. Скорость подачи щелочи в процессе биосинтеза целевого бежа коррелирует со скоростью потребления углеродного субстрата. В момент полной утилизации дозы субстрата величина pH резко увеличивается, что является очень информативным показателем для подачи очередной дозы углеродного субстрата.
При увеличении значения pH выше 7,2 вносят первую подпитку субстрата глюкозой из расчета 2-3 г/дм3 культуральной жидкости, аэрацию увеличивают до 1 об/об/мин. При повторном увеличении значения pH выше 7,1-7,2 вносят вторую подпитку субстрата в виде 10-12% раствора дрожжевого экстракта из расчета 3-4 г/дм3 культуральной жидкости Далее при прекращении снижения pH и увеличении его значения выше 7,1-7,2 вносят третью подпитку углеродного субстрата глюкозой из расчета 2-3г/дм3 культуральной жидкости.
Процесс культивирования продолжают еще в течение 3-5 часов до прекращения снижения уровня pH и его повышения до значений, равных 7,3-7,5.
Согласно другому варианту реализации настоящего изобретения контролируют уровень растворенного кислорода для контроля уровня потребления углеродного субстрата. При исчерпании субстрата резко снижается скорость потребления кислорода клетками продуцента и возрастает уровень растворенного кислорода. Для коррекции уровня углеродного субстрата проводят подпитки субстрата при повышении уровня растворенного кислорода на 20-40% от исходных показателей. При первой подпитке в качестве источника углерода используют глюкозу в количестве 2-3 г/дм3 культуральной жидкости. При вторичном повышении уровня растворенного кислорода на 20-40% вносят 10-12% раствор дрожжевого экстракта из расчета 3-4 г/дм3 культуральной жидкости. При следующем увеличении уровня растворенного кислорода на 20-40% вводяттретью подпитку источником углерода - глюкозой в количестве 2-3 г/дм3 культуральной жидкости, при этом аэрацию увеличивают до 1 об/об/мин.
После окончания процесса синтеза культуральную жидкость охлаждают до температуры 10-12°С и передают на концентрирование.
В ферментере сжатым воздухом устанавливают избыточное давление 0,05 мПа и подают культуральную жидкость по стерильной линии на штуцер проточной центрифуги Сера Z-61 при скорости вращения ротора 17000 об/мин. Скорость сепарирования бактерий составляет 15-20 дм3ч-1. Микробную пасту ресуспендируют в лизирующем буферном растворе и подают на вход гомогенизатора фирмы Braun&Luebbe, модель SHL 05. Микробную суспензию гомогенизируют однократно при скорости подачи 40-50 дм3ч-1.
Очистка целевого рекомбинантного белка состоит в процедуре денатурации телец-включений в растворе гуанидинхлорида и последующей процедуре ренатурации нативной конформации соматостатина в составе химерного белка.
Нерастворимые компоненты препарата удаляют на проточной центрифуге при скорости вращения 17000 об/мин.
Отфильтрованный супернатант переносят в диализные мешки и герметизируют. Ренатурацию проводят с помощью ступенчатого 3-5 центрифуге при скорости вращения 17000 об/мин.
Отфильтрованный супернатант переносят в диализные мешки и высушивают в сушильных аппаратах марки КС-30 или аналогичных моделях. По достижении рабочего вакуума, не превышающего 100 микрон, препарат должен быть охлажден до минус (30±35)°С и выдержан при указанной температуре в течение 45-60 минут.
При высушивании препарата регулируют температуру на полках таким образом, чтобы достигнуть 0°С в препарате к 16-18 часу сушки, затем,повышая постепенно температуру, достигнуть +(27-30)°С в материале, при этой температуре выдерживают препарат в течение 8-10 часов. Длительность процесса высушивания составляет 24-28 часов.
Лекарственную форму препарата готовят по схеме с использованием в качестве адъюванта растительных масел, входящих в группу из рафинированного подсолнечного, кукурузного, хлопкового и рапсового масел и их комбинаций, с добавлением 0,9% по массе очищенного пчелиного воска. Физиологическое воздействие соматостатинсодержащего белка на организм сельскохозяйственных животных можно усилить, имея в виду следующее.
Действие соматотропного гормона на организм млекопитающих осуществляется непрямым путем, а именно посредством образования в гепатоцитах соматомедина С (инсулиноподобного фактора роста-1). Исходя из этого, дополнительное применение препаратов, усиливающих синтез соматомединов, помимо соматотропного гормона, приведет к суммации конечного эффекта. Одним из таких соединений является витамин А. Применение в составе препарата масляного раствора витамина А позволит усилить синтез в организме животных соматомединов A1, A2, В и С, а также образование ферментов, необходимых для активирования фосфоаденозинфосфосульфата (ФАФС), участвующего в синтезе мукополисахаридов: хондроитинсерной кислоты и сульфогликанов-компонентов соединительной ткани, хрящей, костей сельскохозяйственных животных [8].
В практике используют витамин А совместно с витамином Е. Синергизм их действия настолько высок, что витамин А в отсутствие токоферола теряет свои свойства и быстро разрушается [9]. Витамин Е, кроме того, улучшает использование белка клетками организма, влияет на функцию половых и эндокринных желез [10]. С этой точки зрения, оправданно дополнительное введение в готовую форму препарата витамина Е в виде масляного раствора. Таким образом, при приготовлении новой лекарственной формы препарата на основе соматостатинсодержащего белка в ее состав входят масляные растворы витамина А в концентрации 3000 МЕ/мл адъюванта и витамина Е в концентрации 2 мг/мл адъюванта. Использование такой прописи лекарственного препарата позволяет достичь более выраженных клинических эффектов при применении ветеринарного препарата на основе соматостатинсодержащего белка у сельскохозяйственных животных.
Пример 1. Процесс биосинтеза соматостатинсодержащего белка осуществляли следующим образом. В качестве продуцента использовали штамм ВКПМ В-6519.
Штамм Escherichia coli ВКПМ В-6519 хранили в криопробирках при минус 40°С.
Посевной материал для засева ферментера выращивали в колбах на полусинтетической жидкой питательной среде следующего состава (г/дм3):
| Глюкоза | 10,0 |
| Триптон | 15,0 |
| Дрожжевой экстракт | 7,5 |
| K2HPO4 | 1,0 |
| KH2PO4 | 0,5 |
| NaCl | 10,0 |
| Ампициллина натриевая соль | 0,05 |
| Вода дистиллированная | до 1 л |
| рН | 7,0-7,1 |
В колбу с 100 см3 среды с соблюдением правил асептики переносили содержимое из криопробирки. Колбу помещали на качалку и инкубировали при (180-200) об/мин при (37±1)°С в течение 8 часов.
Процесс биосинтеза рекомбинантного соматостатинсодержащего белка проводили в производственном ферментере БИОР-025 (ОКБ ТБМ, г.Кириши) объемом 250 дм3 на питательной среде приведенного выше состава.
Поддерживали следующие значения технологических параметров процесса культивирования:
| температура - | (37±1)°С; |
| значение pH (начальное) - | 7,0±0,1; |
| скорость перемешивания - | 350 об/мин; |
| аэрация - | 0-4 часа роста 0,5 об/об/мин, далее |
| 1 об/об/мин. |
В течение процесса культивирования с интервалом 60 минут отбирали пробы культуральной жидкости для определения оптической плотности. Где И - момент внесения индуктора ИПТГ, А, В, С - временные периоды введения дополнительных источников углерода. При достижении оптической плотности, равной 3,5 единицы (4 часа роста), в ферментер добавляли спиртовый раствор индуктора изопропил-бета-D-тиогалактозида (ИПТГ) из расчета 10,5 мг/дм3.
Далее при прекращении снижения pH и повышении его значений до 7,2-7,4 (4,5 часа роста) вносили первую подпитку глюкозой из расчета 2 г/дм3 культуральной жидкости, аэрацию увеличили до 1 об/об/мин.
При повторном повышении значений pH до 7,2 (6 часов роста) вносили вторую подпитку 10% раствором дрожжевого экстракта из расчета 4 г/дм3 культуральной жидкости.
Далее при прекращении снижения значения pH и повышении его до 7,2 (7 часов роста) вносили третью подпитку глюкозой из расчета 3 г/дм3 культуральной жидкости.
Процесс культивирования продолжали еще в течение 3 часов до прекращения снижения уровня pH и его повышения до 7,3-7,5, затем культуральную жидкость охладили до температуры 10-12°С и передали на концентрирование.
На фиг. 2 приведена диаграмма, характеризующая динамику изменения значений pH в процессе биосинтеза соматостатинсодержащего белка и моменты внесения добавок.
Культуральную жидкость из ферментера сжатым воздухом подавали по стерильной линии на штуцер проточной центрифуги Сера Z-61 при скорости вращения ротора 17000 об/мин. Скорость сепарирования бактерий составляла 15-20 дм3ч-1. Получено 2,7 кг микробной пасты.
Микробную пасту ресуспендировали в лизирующем буферном растворе и клетки разрушали с помощью гомогенизатора фирмы Braun&Luebbe, модель SHL 05. Микробную суспензию гомогенизировали однократно при скорости подачи 40-50 дм3ч-1. После разрушения нерастворимые компоненты препарата отделяли на проточной центрифуге Сера Z-61. Было получено 1,15 кг отмытых телец включения.
Дальнейшая очистка полученного химерного белка заключалась в денатурации телец-включений в растворе гуанидинхлорида.
Процедуру ренатурации нативной конформации соматостатина в составе химерного белка осуществляли путем диализа.
Растворенный полупродукт перенесли в диализные мешки и герметизировали. Ренатурацию провели с помощью ступенчатого 3-5-кратного диализа (соотношение диализат: буфер приблизительно 1:10).
Сушку раствора белка проводили в сублимационной сушилке КС-30. Температура досушивания достигала+(27-30)°С. Длительность процесса высушивания составляла около 24 часов.
Было получено 193 г сухого соматостатинсодержащего белка молекулярной массой 29,5 кДа.
Пример 2. Процесс биосинтеза соматостатинсодержащего белка осуществляли следующим образом. В качестве продуцента использовали штамм Escherichia coli ВКПМ В-6519.
Штамм ВКПМ В-6519 хранили в криопробирках при минус 40°С.
Посевной материал для засева ферментера выращивали в колбах на полусинтетической жидкой питательной среде следующего состава (г/дм3):
| Глюкоза | 10,0 |
| Триптон | 15,0 |
| Дрожжевой экстракт | 7,5 |
K2HPO4 1,0
| KH2PO4 | 0,5 |
| NaCl | 10,0 |
| Ампициллина натриевая соль | 0,05 |
| Вода дистиллированная | до 1 л |
| рН | 7,0-7,1 |
В колбу с 100 см3 среды с соблюдением правил асептики переносили содержимое из криопробирки. Колбу помещали на качалку и инкубировали при (180-200) об/мин при (37±1)°С в течение 8 часов.
Процесс биосинтеза рекомбинантного соматостатинсодержащего белка проводили в производственном ферментере БИОР-025 (ОКБ ТБМ, г.Кириши) объемом 250 дм3 на питательной среде приведенного выше состава.
Поддерживали следующие значения технологических параметров процесса культивирования:
| температура - | (37±1)°С; |
| значение pH (начальное) - | 7,0±0,1; |
| скорость перемешивания - | 350 об/мин; |
| аэрация - | 0-4 часа роста 0,5 об/об/мин, далее |
| 1 об/об/мин. |
В течение процесса культивирования с интервалом 60 минут отбирали пробы культуральной жидкости для определения оптической плотности. При достижении оптической плотности, равной 3,8 единицы (4 часа роста), в ферментер вносили спиртовый раствор индуктора изопропил-бета-D-тиогалактозида (ИПТГ) из расчета 10,5 мг/дм3.
Подпитку углеродными субстратами проводили по контролю уровня растворенного кислорода. При повышении уровня растворенного кислорода на 25-30% (5 часов роста) внесли первую подпитку глюкозой из расчета 2 г/дм3 культуральной жидкости, аэрацию увеличили до 1 об/об/мин.
При повторном повышении уровня растворенного кислорода на 25-30% (6,5 часов роста) внесли вторую подпитку 10% раствором дрожжевого экстракта из расчета 4 г/дм3 культуральной жидкости.
Далее при повышении уровня растворенного кислорода на 25-30% (8,5 часов роста) внесли третью подпитку глюкозой из расчета 3 г/дм3 культуральной жидкости.
На фиг. 3 приведена диаграмма, характеризующая динамику изменения концентрации растворенного кислорода в процессе биосинтеза соматостатинсодержащего белка и моменты внесения добавок.
Процесс культивирования продолжали еще в течение 3 часов до прекращения снижения уровня рН и его повышения до 7,3-7,5, затем культуральную жидкость охладили до температуры 10-12°С.
Культуральную жидкость сепарировали на проточной центрифуге Сера Z-61 при скорости вращения ротора 17000об/мин. Скорость сепарирования бактерий составляла 15-20 дм3ч-1. Получено 3,0 кг микробной пасты.
Микробную пасту ресуспендировали в лизирующем буферном растворе и клетки разрушали с помощью гомогенизатора фирмы Braun&Luebbe, модель SHL 05. Микробную суспензию гомогенизировали однократно при скорости подачи 40-50 дм3ч-1. После разрушения нерастворимые компоненты препарата отделяли на проточной центрифуге Сера Z-61. Было получено 1,0 кг отмытых телец включения.
Дальнейшая очистка полученного химерного белка заключалась в денатурации телец-включений в растворе гуанидинхлорида.
Процедуру ренатурации нативной конформации соматостатина в составе химерного белка осуществляли путем диализа.
Растворенный полупродукт перенесли в диализные мешки и герметизировали. Ренатурацию провели с помощью ступенчатого 3-5-кратного диализа (соотношение диализат: буфер приблизительно 1:10).
Сушку раствора белка проводили в сублимационной сушилке КС-30. Температура досушивания достигала +(27-30)°С. Длительность процесса высушивания составляла 24 часа.
Было получено 245 г сухого соматостатинсодержащего белка.
Как следует из результатов, приведенных в примерах 1 и 2, выход целевого белка с 1 л культуральной жидкости в 3,5-5 раз превышает показатели, известные ранее [6].
Возможность осуществления изобретения подтверждается примерами практического использования препарата для повышения мясной и молочной продуктивности сельскохозяйственных животных.
Для приготовления готовой формы препарата использовали рафинированное растительное масло и пчелиный воск. В рафинированное растительное масло добавляют пчелиный воск из расчета 0,9% по массе, витамины А и Е в виде масляного раствора в концентрациях 3000 МЕ/мл адъюванта витамина А и 2 мг/мл адъюванта витамина Е. Масло нагревают до температуры 45-50С°, перемешивая, достигают полного растворения воска. Затем масло с воском охлаждают до температуры 35-37С° и добавляют навеску сухого белка из расчета 250 мг на 100 мл адъюванта. Суспензию гомогенизируют в течение 1-2 минут и передают на разливочное оборудование. Готовую эмульсию препарата расфасовывают в тару (флаконы стеклянные и шприцы одноразовые). При иной концентрации компонентов препарат приготавливают аналогично. Предпочтительными являются следующие содержания компонентов: на 100 мл рафинированного растительного масла: 250 мг химерного белка, 0,9 г пчелиного воска; витамин А - 300000 ME, витамин Е - 200 мг.
Пример 3. В условиях промышленного свиноводческого комплекса поросятам крупной белой породы в возрасте 18-21 сутки и массой тела 5,5-6,2 кг были введены препараты из расчета 50-200 мкг рекомбинантного белка на 1 кг живой массы тела по следующей схеме: первые две инъекции-с интервалом 14 суток, следующие две инъекции препарата - с интервалом 60 суток между инъекциями. В качестве положительного контроля использовали лекарственную форму препарата без добавления в адъювант витаминов А и Е. Показатели мясной продуктивности животных при применении препаратов в дозе 50 мкг на 1 кг живой массы тела приведены в таблице 1.
| Таблица 1 | |||
| Показатели мясной продуктивности животных при применении препаратов в дозе 50 мкг на 1 кг живой массы тела. | |||
| Показатели | Группы животных | ||
| Животные без обработки препаратом (контроль) | Животные, обработанные препаратом, полученным по старой технологии (первая опытная группа) | Животные, обработанные препаратом, полученным по новой технологии (вторая опытная группа) | |
| Масса тела животных при первой инъекции, кг | 6,2±0,3 | 5,9±0,2 | 6,0±0,3 |
| Масса тела животных при второй инъекции, кг | 10,7±0,2 | 10,9±0,2 | 11,2±0,1 |
| Масса тела животных при третьей инъекции, кг | 34,7±0,4 | 35,5±0,4 | 37,1±0,2 |
| Масса тела животных при четвертой инъекции, кг | 71,8±0,3 | 75,4±0,2 | 81,4±0,2 |
Как следует из представленных в таблице 1 данных, лекарственная форма препарата с добавлением витаминов А и Е оказала более стимулирующее действие на мясную продуктивность животных. Так после второй инъекции препарата живая масса животных во второй опытной группе превышала аналогичный показатель в первой опытной группе на 4,50%, а к окончанию эксперимента этот показатель был выше на 7,95%.
Показатели мясной продуктивности животных при применении препаратов в дозе 100 мкг на 1 кг живой массы тела приведены в таблице 2.
| Таблица 2 | |||
| Показатели мясной продуктивности животных при применении препаратов в дозе 100 мкг на 1 кг живой массы тела. | |||
| Показатели | Группы животных | ||
| Животные без обработки препаратом (контроль) | Животные, обработанные препаратом, полученным по старой технологии (первая опытная группа) | Животные, обработанные препаратом, полученным по новой технологии (вторая опытная группа) | |
| Масса тела животных при первой инъекции, кг | 6,2±0,3 | 6,0,±0,2 | 6,1±0,4 |
| Масса тела животных при второй инъекции, кг | 10,7±0,2 | 10,8±0,1 | 11,1±0,2 |
| Масса тела животных при третьей инъекции, кг | 34,7±0,4 | 35,2±0,3 | 36,9±0,2 |
| Масса тела животных при четвертой инъекции, кг | 71,8±0,3 | 74,9±0,2 | 81,2±0,3 |
Как следует из представленных в таблице 2 данных, лекарственная форма препарата с добавлением витаминов А и Е оказала более активное стимулирующее действие на мясную продуктивность животных. Так после второй инъекции препарата живая масса животных во второй опытной группе превышала аналогичный показатель в первой опытной группе на 4,82%, а к окончанию эксперимента этот показатель был выше на 8,41%.
Показатели мясной продуктивности животных при применении препаратов в дозе 200 мкг на 1 кг живой массы тела приведены в таблице 3.
| Таблица 3 | |||
| Показатели мясной продуктивности животных при применении препаратов в дозе 200 мкг на 1 кг живой массы тела. | |||
| Показатели | Группы животных | ||
| Животные без обработки препаратом (контроль) | Животные, обработанные препаратом, полученным по старой технологии (первая опытная группа) | Животные, обработанные препаратом, полученным по новой технологии (вторая опытная группа) | |
| Масса тела животных при первой инъекции, кг | 6,2±0,3 | 5,7±0,1 | 5,9±0,2 |
| Масса тела животных при второй инъекции, кг | 10,7±0,2 | 10,7±0,2 | 11,0±0,3 |
| Масса тела животных при третьей инъекции, кг | 34,7±0,4 | 35,0±0,3 | 36,3±0,2 |
| Масса тела животных при четвертой инъекции, кг | 71,8±0,3 | 74,1±0,2 | 80,2±0,2 |
Как следует из представленных в таблице 3 результатов, лекарственная форма препарата с добавлением витаминов А и Е оказала более активное стимулирующее действие на мясную продуктивность животных. Так после второй инъекции препарата живая масса животных во второй опытной группе превышала аналогичный показатель в первой опытной группе на 3,71%, а к окончанию эксперимента этот показатель был выше на 8,23%.
Изучение влияния препарата на мясную продуктивность быков при откорме проводили в животноводческих откормочных организациях.
Масляную суспензию препаратов животным вводили подкожно в дозе 50-200 мкг белка на 1 кг массы тела двукратно с интервалом 14 суток между инъекциями. Третью и четвертую инъекции препаратов осуществляли с интервалом два месяца между инъекциями. В качестве положительного контроля использовали лекарственную форму препарата без добавления в адъювант масляных растворов витаминов А и Е. Показатели мясной продуктивности животных при применении препаратов в дозе 50 мкг рекомбинантного белка на 1 кг живой массы тела приведены в таблице 4.
| Таблица 4 | |||
| Показатели мясной продуктивности животных при применении препаратов в дозе 50 мкг рекомбинантного белка на 1 кг живой массы тела | |||
| Показатели | Группы животных | ||
| Животные без обработки препаратом | Животные, обработанные препаратом, полученным | Животные, обработанные препаратом, полученным | |
| (контроль) | по старой технологии (первая опытная группа) | по новой технологии (вторая опытная группа) | |
| Масса тела животных при первой инъекции, кг | 147,2±3,3 | 148,3±3,4 | 147,1±3,0 |
| Масса тела животных при второй инъекции, кг | 158,7±3,9 | 161,8±4,9 | 164,1±4,2 |
| Масса тела животных при третьей инъекции, кг | 206,1±4,4 | 221,2±3,8 | 227,9±4,0 |
| Масса тела животных при четвертой инъекции, кг | 271,8±5,3 | 281,9±3,1 | 295,2±3,3 |
Как следует из представленных в таблице 4 результатов, лекарственная форма препарата с добавлением витаминов А и Е оказала более активное стимулирующее действие на мясную продуктивность животных. После второй инъекции препарата живая масса животных во второй опытной группе превышала аналогичный показатель в первой опытной группе на 3,03%, а к окончанию эксперимента этот показатель был выше на 4,71%.
Показатели мясной продуктивности животных при применении препаратов в дозе 100 мкг рекомбинантного белка на 1 кг живой массы тела приведены в таблице 5.
| Таблица 5 | |||
| Показатели мясной продуктивности животных при применении препаратов в дозе 100 мкг рекомбинантного белка на 1 кг живой массы тела. | |||
| Показатели | Группы животных | ||
| Животные без обработки препаратом (контроль) | Животные, обработанные препаратом, полученным по старой технологии (первая опытная группа) | Животные, обработанные препаратом, полученным по новой технологии (вторая опытная группа) | |
| Масса тела животных при первой инъекции, кг | 146,2±3,3 | 147,3±3,4 | 147,1±3,1 |
| Масса тела животных при второй инъекции, кг | 157,7±3,7 | 162,4±4,6 | 164,9±4,0 |
| Масса тела | 207,2±4,6 | 223,4±3,6 | 229,6±3,0 |
| животных при третьей инъекции, кг | |||
| Масса тела животных при четвертой инъекции, кг | 273,5±5,1 | 283,6±2,9 | 297,4±3,6 |
Как следует из представленных в таблице 5 результатов, лекарственная форма препарата с добавлением витаминов А и Е оказала более активное стимулирующее действие на мясную продуктивность животных. Так после второй инъекции препарата живая масса животных во второй опытной группе превышала аналогичный показатель в первой опытной группе на 2,77%, а к окончанию эксперимента этот показатель был выше на 4,87%.
Показатели мясной продуктивности животных при применении препаратов в дозе 200 мкг рекомбинантного белка на 1 кг живой массы тела приведены в таблице 6.
| Таблица 6 |
| Показатели мясной |