Антиретровирусные препараты на основе производных азидотимидина
Иллюстрации
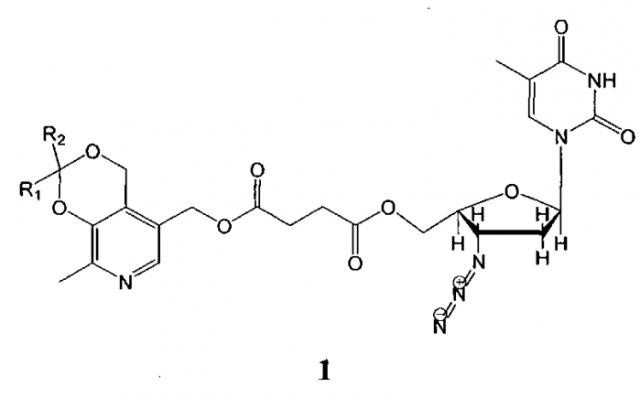
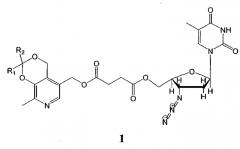
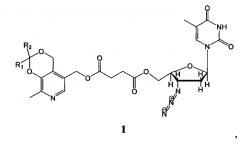
Показать всеИзобретение относится к антиретровирусным производным азидотимидина формулы 1 и может быть использовано в качестве лекарственного средства.
, где:
R1+R2=-CH2(CH2)2CH2-
R1+R2=-CH2(CH2)3CH2-
R1=Н, R2=СН3
R1=H, R2=CH2CH2CH3
R1=H, R2=C(CH3)3
R1=H, R2=CH2(CH2)6CH3
Предложены новые эффективные средства с низкой токсичностью против ретровирусных инфекций. 16 пр., 2 табл.
Реферат
Изобретение относится к области удовлетворения жизненных потребностей человека и может быть использовано в медицине и биологии в качестве лекарственных средств. Препараты являются синтетическими биологически активными веществами гетероциклического ряда, обладают высокой антиретровирусной активностью, и представляют собой сложные эфиры янтарной кислоты, содержащие фрагменты пиридоксина и азидотимидина общей формулы 1:
, где:
R1+R2=-CH2(CH2)2CH2-
R1+R2=-CH2(CH2)3CH2-
R1=Н, R2=CH3
R1=H, R2=CH2CH2CH3
R1=H, R2=C(CH3)3
R1=H, R2=CH2(CH2)6CH3
Соединения формулы 1 обладают высокой антиретровирусной активностью на фоне низкой токсичности и могут найти применение в медицине.
Лечение больных, инфицированных вирусом иммунодефицита человека (ВИЧ) - одна из самых актуальных проблем современной фармакологии и медицины. Антиретровирусные препараты, существующие на сегодняшний день, обладают высокой терапевтической активностью в отношении ВИЧ, но при этом имеют целый ряд побочных эффектов, таких как анемия, нейтропения, расстройства желудочно-кишечного тракта и др. Кроме того, пролонгированные положительные эффекты комбинированной антиретровирусной терапии часто осложняются возникновением лекарственной устойчивости. В связи с этим крайне актуальной является разработка новых высокоэффективных и безопасных лекарственных препаратов.
Известно пять классов препаратов, которые применяются в лечении ВИЧ-инфекции: ингибиторы обратной транскриптазы, ингибиторы интегразы, ингибиторы протеазы, ингибиторы рецепторов, ингибиторы слияния. Стандарт лечения ВИЧ инфекции предполагает использование комбинации препаратов, по меньшей мере, трех антиретровирусных препаратов, относящихся к разным классам. (Panel on Antiretroviral Guidelines for Adults and Adolescents (2013) Guidelines for the Use of Antiretroviral Agents in HIV-1-Infected Adults and Adolescents, 12 February 2013. Washington DC: Department of Health and Human Services; Available at http://aidsinfo.nih.gov/guidelines/html/1/adult-and-adolescent-treatment-guidelines/0(accessed 24 January 2014).
Зидовудин (азидотимидин) [US 5,077,280 Treatment of viral infections/Brown University Research Foundation - Опубл. - 31.12.1991] применяется для лечения ВИЧ-инфекции у взрослых и детей как в виде монотерапии, так и в комбинации с другими антиретровирусными препаратами. Кроме того, его применяют для профилактики заражения плода от ВИЧ-инфицированной матери и постэкспозиционной профилактики у медицинских работников. С 1987 г., когда зидовудин впервые стали применять для лечения ВИЧ-инфекции, его эффективность была доказана многочисленными клиническими испытаниями. Показано, что лечение зидовудином в течение года снижает развитие инфекции, но выживаемость при этом не увеличивается [Margaret A. Fischl, MD; Douglas D. Richman, MD; Nellie Hansen, MPH; Ann C. Collier, MD; John T. Carey, MD; Michael F. Para, MD; W. David Hardy, MD; Raphael Dolin, MD; William G. Powderly, MD; J. Davis Allan, MD; Brian Wong, MD; Thomas C. Merigan, MD; Vincent J. McAuliffe, MD; Newton E. Hyslop, MD; Frank S. Rhame, MD; Henry H. Balfour Jr., MD; Stephen A. Spector, MD; Paul Volberding, MD; Carla Pettinelli, MD, PhD; James Anderson, PhD, AIDS Clinical Trials Group The safety and efficacy of zidovudine (AZT) in the treatment of subjects with mildly symptomatic human immunodeficiency virus type 1 (HIV) infection a double-blind, placebo-controlled trial//Annals of Internal Medicine - 1990. - V 112, №10 - P. 727-737].
Сущность предполагаемого изобретения состоит в том, что применение заявляемых веществ общей формулы 1, относящихся к аналогам ингибиторов обратной транскриптазы, применяемых при терапии ВИЧ-инфекции, может значительно увеличить терапевтическую эффективность ввиду наличия в своем составе веществ с более низкой токсичностью, что способствует снижению побочных эффектов в процессе лечения пациентов. Эти положительные эффекты связаны с наличием в составе заявленной формулы 1 элемента группы витаминов B, а именно пиридоксина, который выделяется вследствие гидролиза сложноэфирных связей в организме.
В настоящее время в литературе известны различные способы получения производных азидотимидина в качестве противовирусных агентов. В работе [L. Ait Mohamed, М. Taourirte, A. Rochdi, Н.В. Lazrek, J.J. Vasseur, J.W. Engels, C. Pannecouque, and E.De Clercq Synthesis of New Homo and Heterodimers of 2′,3′-Dideoxyinosine (ddI) Using Ester Linkage // NUCLEOSIDES, NUCLEOTIDES & NUCLEIC ACIDS - 2003. - V. 22, N. 5-8. - P. 829-831] было получено производное азидотимидина, состоящее из фрагментов ряда противовирусных агентов, в том числе азидотимидина, и сшивающего агента. В работе [Patrick Vlieghe, Frederic Bihel, Thierry Clerc, Christophe Pannecouque, Myriam Witvrouw, Erik De Clercq, Jean-Pierre Salles, Jean-Claude Chermann, § and Jean-Louis Kraus New 3′-Azido-3′-deoxythymidin-5′-yl O-(ω-Hydroxyalkyl) Carbonate Prodrugs: Synthesis and Anti-HIVEvaluation // J. Med. Chem. - 2001. - V. 44. - P. 777-786] также были исследованы на противовирусную активность сложные эфиры азидотимидина и различных карбоновых кислот. Установлено, что для некоторых соединений наблюдается увеличение противовирусной активности, но при этом возрастает их токсичность.
Следует отметить, что описанные в литературе соединения, по мнению заявителя, не могут рассматриваться в качестве аналогов к заявленному техническому решению вследствие того, что они не совпадают с заявляемыми соединениями по химической структуре. При этом указанные соединения являются аналогами по достигаемому(ым) техническому (им) результату(ам), т.к. характеризуются (обладают) указанными выше недостатками. Заявителем не выявлены источники, содержащие информацию о технических решениях, идентичных настоящему изобретению, что позволяет сделать вывод о его соответствии критерию «новизна».
Целью заявленного технического решения является создание низкотоксичных биологически активных соединений с высокой антиретровирусной активностью в отношении вируса иммунодефицита человека (ВИЧ).
Поставленная задача решается путем синтеза антиретровирусных веществ общей формулы 1:
где:
R1+R2=-CH2(CH2)2CH2-
R1+R2=-CH2(CH2)3CH2-
R1=Н, R2=CH3
R1=H, R2=CH2CH2CH3
R1=H, R2=C(CH3)3
R1=H, R2=CH2(CH2)6CH3
Заявляемые вещества на фоне низкой токсичности проявили высокую антиретровирусную активность в отношении ВИЧ и могут найти применение в медицине.
В результате проведенного заявителем анализа уровня техники в области современной медицины не выявлено использование антиретровирусных препаратов аналогичной структуры.
Заявителем не выявлены источники, в которых содержались бы сведения о влиянии отличительных признаков изобретения на достигаемый технический результат. Указанное новое свойство объекта обусловливает, по мнению заявителя, соответствие изобретения критерию «изобретательский уровень».
Предлагаемые в данном изобретении соединения формулы 1 получали согласно нижеприведенной схеме:
где:
Характеристики новых соединений приведены в примерах конкретного выполнения. Структуры полученных соединений подтверждены методами масс-спектрометрии, 1Н и 13С ЯМР-спектроскопии.
Спектры ЯМР 1Н зарегистрированы на приборе «Bruker» AVANCE 400 (400 МГц). Химический сдвиг определялся относительно сигналов остаточных протонов дейтерированного растворителя.
HRMS-эксперимент был проведен с использованием масс-спектрометра TripleTOF 5600, АВ Sciex (Германия) из раствора в метаноле методом ионизации - турбоионный спрей (TIS) - при энергии столкновения с молекулами азота 10 еВ.
Температура плавления веществ определялась на приборе OptiMelt МРА100 (Stanford Research Systems). Угол оптического вращения определяли с помощью поляриметра автоматического ADP440+ (B&S), Англия. Контроль за ходом реакций проводили методом ТСХ на пластинах Sorbfil ПТСХ-АФ-А-УФ. Препаративную хроматографию соединений проводили на силикагеле КСКГ фр. 0.10-0.16 (Экофарм).
Примеры конкретного выполнения заявленного технического решения
Общая методика получения ацеталей и кеталей пиридоксина 2 (а-е)
В круглодонной колбе, снабженной насадкой Дина-Старка, готовили суспензию гидрохлорида пиридоксина эквивалент далее (экв) 1 экв, моногидрата и-толуолсульфокислоты (2.1 экв) и карбонил содержащего соединения (альдегид или кетон) (2.1 экв) в 100 мл бензола. Реакционную массу кипятили 8 ч, затем растворитель отгоняли в вакууме. Остаток нейтрализовали до рН=7 водным раствором гидрокарбоната натрия. Выпавший осадок отфильтровывали и промывали петролейным эфиром.
Соединение 2б было описано в патенте [1,030,400. Sulfur-Containing Derivatives of Vitamin B6 and process for their preparation / Merck. Actiengesellschaft. - Опубл. - 20.01.1965].
Соединение 2в было описано в статье [Arustamova, I.S.; Kul′nevich, V.G. Some transformations of 5-hydroxymethyl-8-methyl-1,3-dioxinopyridines // Journal of Organic Chemistry USSR (English Translation) - 1985. - T. 21, №11 - p. 2225-2230.]
Пример 1. Синтез (8′-метил-4′Н-спиро[циклопентан-1,2′-[1,3]диоксино[4,5-с]пиридин]-5′-ил)метанола (2а)
Продукт получали по вышеописанной методике, использовали пиридоксина гидрохлорид (7 г, 34.4 ммоль), циклогексанон (72.1 ммоль) и моногидрат n-толуолсульфокислоты (72.1 ммоль). Выход 60%; Белые кристаллы, т.пл. 108-109°C. ЯМР 1Н (400 МГц, ДМСО-d6), δ м.д.: 1.68-1.96 м (8Н, 4CH2), 2.28 с (3Н, CH3), 4.40 д (2Н, 3J=4.2 Гц, CH2), 4.91 с (2Н, CH2), 5.15 уш т (1Н, ОН), 7.92 с (1Н, СН); ЯМР 13С (100 МГц, ДМСО-d6) δ м.д.: 18.16, 23.05, 35.60, 58.20, 59.24, 110.48, 125.84, 130.68, 138.63, 145.52, 145.60; HRMS (TIS): найдено [М+Н]+: 236.1287, рассчитано для C13H18NO3 [М+Н]+: 236.1287.
Пример 2. Синтез (8-метил-2-пропил-4Н-[1,3]диоксино[4,5-с]пиридин-5-ил)метанола (2г)
Продукт получали по вышеописанной методике, использовали пиридоксина гидрохлорид (34.4 ммоль), масляный альдегид (72.1 ммоль) и моногидрат n-толуолсульфокислоты (72.1 ммоль). Выход 73%; Белые кристаллы, т.пл. 101°C. ЯМР 1H (400 МГц, CDCl3), δ м.д.: 0.99 т (3Н, 3J=7.4 Гц, CH3), 1.52-1.58 м (2Н, CH2), 1.80-1.87 м (2Н, CH2), 2.34 с (3H, CH3), 4.25 уш с (1Н, ОН), 4.48 с (2Н, CH2), 4.96 с (2Н, CH2), 4.97 т (1Н, 2J=4.8 Гц, СН), 7.75 с (1Н, СН); ЯМР 13С (100 МГц, CDCl3) δ м.д.: 14.01, 17.08, 18.17, 36.41, 60.04, 64.27, 99.97, 127.76, 130.11, 139.17, 147.31, 147.99; HRMS (TIS): найдено [М+Н]+: 224.1287, рассчитано для C12H18NO3 [М+Н]+: 224.1287.
Пример 3. Синтез (2-(трет-бутил)-8-метил-4Н-[1,3]диоксино[4,5-с]пиридин-5-ил)метанола (2д)
Продукт получали по вышеописанной методике, использовали пиридоксина гидрохлорид (34.4 ммоль), пивальдегид (72.1 ммоль) и моногидрат n-толуолсульфокислоты (72.1 ммоль). Выход 65%; Белые кристаллы, т.пл.158-159°C.ЯМР 1Н (400 МГц, CDCl3), 1.01 с (9Н, CH3), 2.30 с (3H, CH3), 4.76 с (1Н, СН), 4.38 д (2Н, 3J=3.6 Гц, CH2), 4.74 с (1Н, СН), 4.94 и 4.98 (2Н, АВ, 2J=-16.0 Гц, CH2), 5.16 уш т (1Н, ОН), 7.92 с (1Н, СН); ЯМР 13С (100 МГц, CDCl3) δ м.д.: 17.90, 24.09, 34.58, 58.17, 63.84, 103.98, 126.67, 130.85, 138.77, 145.07, 147.07; HRMS (TIS): найдено [М+Н]+: 238.1443, рассчитано для C13H20NO3 [М+Н]+: 238.1443.
Пример 4. Синтез (8-метил-2-октил-4Н-[1,3]диоксино[4,5-с]пиридин-5-ил)метанола (2е)
Продукт получали по вышеописанной методике, использовали пиридоксина гидрохлорид (34.4 ммоль), нониловый альдегид (34.4 ммоль) и моногидрат n-толуолсульфокислоты (72.1 ммоль). Выход 82%; Белые кристаллы, т.пл. 175°C. ЯМР 1Н (400 МГц, CDCl3), δ м.д.: 0.88 т (3H, 3J=6.6 Гц, CH3), 1.28-1.38 м (10Н, 5CH2), 1.49-1.57 м (2Н, CH2), 1.80-1.94 м (2Н, CH2), 2.39 с (3H, CH3), 3.30 уш с (1H, ОН), 4.53 с (2Н, CH2), 4.99 с (2Н, CH2), 5.00 к (1H, 2J=5.2 Гц, СН), 7.83 с (1H, СН); ЯМР 13С (100 МГц, CDCl3) δ м.д.: 14.25, 18.33, 22.80, 23.71, 29.35, 29.51, 29.60, 31.99, 34.42, 60.38, 64.32, 100.21, 127.79, 129.81, 139.31, 147.59, 148.05; HRMS (TIS): найдено [М+Н]+: 294.2069, рассчитано для C17H28NO3 [М+Н]+: 294.2069.
Общая методика получения моноэфиров янтарной кислоты 3 (а-е):
Ацеталь или кеталь пиридоксина 1 (а-е) (1 экв), янтарный ангидрид (1 экв) и 4-диметиламинопиридин (1 экв) растворяли в 15 мл хлороформа. Реакционную смесь перемешивали при комнатной температуре 24 часа. После завершения реакции растворитель отгоняли при пониженном давлении, и продукт очищали с помощью колоночной хроматографии на силикагеле [элюент - смесь этилацетат - ацетон (1:1)].
Пример 5. Синтез 4-((8′-метил-4,Н-спиро[циклопентан-1,2′-[1,3]диоксино[4,5-с]пиридин]-5′-ил)метокси)-4-оксобутановой кислоты (3а)
Продукт получали по вышеописанной методике, использовали соединение 2а (2.70 ммоль), янтарный ангидрид (2.70 ммоль) и 4-диметиламинопиридин (2.70 ммоль). Выход 64%; Маслообразное вещество коричневого цвета; ЯМР 1Н (400 МГц, CDCl3), δ м. д.: 1.73-2.05 м (8Н, 4CH2), 2.40 с (3H, CH3), 2.66 м (4Н, 2CH2), 4.89 с (2Н, CH2), 5.02 с (2Н, CH2), 8.06 с (1Н, СН), 10.16-10.75 уш с (1Н, СООН); ЯМР 13С (100 МГц, CDCl3), δ м. д.: 17.52, 23.65, 29.33, 29.41, 36.26, 59.87, 61.04, 111.59, 125.16, 127.60, 139.34, 146.87, 148.13, 172.10, 175.38; HRMS (TIS): найдено [М+Н]+: 336.1447, рассчитано для C17H22NO6 [М+Н]+: 336.1447.
Пример 6. Синтез 4-((8′-метил-4,Н-спиро[циклогексан-1,2′-[1,3]диоксино[4,5-с]пиридин]-5′-ил)метокси)-4-оксобутановой кислоты (3б)
Продукт получали по вышеописанной методике, использовали соединение 26 (4.25 ммоль), янтарный ангидрид (4.25 ммоль) и 4-диметиламинопиридин (4.25 ммоль). Выход 96%; Маслообразное вещество коричневого цвета; ЯМР 1Н (400 МГц, ацетон-d6), δ м. д.: 1.39-1.57 м (2Н, CH2), 1.58-1.68 м (4Н, 2CH2), 1.70-1.92 м (4Н, 2CH2), 2.36 с (3H, CH3), 2.63 м (4Н, 2CH2), 4.95 с (2Н, CH2), 5.07 с (2Н, CH2), 8.02 с (1H, СН); ЯМР 13С (100 МГц, ацетон-d6), δ м. д.: 18.40, 23.20, 25.86, 29.14, 29.53, 36.06, 58.22, 61.70, 100.86, 126.10, 127.75, 140.87, 146.37, 148.38, 172.60, 173.74, 206.21; HRMS (TIS): найдено [М+Н]+: 350.1604, рассчитано для C18H24NO6 [М+Н]+: 350.1604.
Пример 7. Синтез 4-((2,8-диметил-4Н-[1,3]диоксино[4,5-с]пиридин-5-ил)метокси)-4-оксобутановой кислоты (3в)
Продукт получали по вышеописанной методике, использовали соединение 2в (2.67 ммоль), янтарный ангидрид (2.67 ммоль) и 4-диметиламинопиридин (2.67 ммоль). Выход 89%; Маслообразное вещество коричневого цвета; ЯМР 1Н (400 МГц, метанол-d4), δ м. д.: 1.55 д (3H, 3J=5.1 Гц, CH3), 2.38 с (3H, CH3), 2.56-2.64 м (4Н, 2CH2), 4.99-5.08 м (4Н, CH2), 5.27 кв (1H, СН), 7. 96 с (1H, СН); ЯМР 13С (100 МГц, CDCl3), δ м. д.: 16.05, 19.36, 29.53, 29.88, 63.25, 64.12, 102.45, 130.64, 135.64, 140.68, 143.34, 151.54, 172.98, 177.15; HRMS (TIS): найдено [М+Н]+: 296.1134, рассчитано для C14H18NO6 [М+Н]+: 296.1134.
Пример 8. Синтез 4-((8-метил-2-пропил-4Н-[1,3]диоксино[4,5-с]пиридин-5-ил)метокси)-4-оксобутановой кислоты (3г)
Продукт получали по вышеописанной методике, использовали соединение 2 г (2.24 ммоль), янтарный ангидрид (2.24 ммоль) и 4-диметиламинопиридин (2.24 ммоль). Выход 57%; Бесцветные кристаллы, т.пл. 164°C; ЯМР 1Н (400 МГц, ДМСО-а6), δ м. д.: 0.96 т (3H, 3J=7.4 Гц, CH3), 1.44 - 1.58 м (2Н, CH2),1.71 - 1.84 м (2Н, CH2), 2.31 с (3H, CH3), 2.45 -2.58 м (4Н, 2CH2), 4.96 с (2Н, CH2), 5.01 с (2Н, CH2), 5.15 т (1Н, 3J=5.1 Гц, СН), 7.99 с (1Н, СН), 12.27 уш с (1Н, СООН); ЯМР 13С (100 МГц, ДМСО-d6), δ м. д.: 13.74, 16.53, 18.19, 28.61, 28.65, 35.73, 60.86, 63.23, 99.27, 125.24, 127.78, 140.45, 146.59, 147.04, 171.87, 173.40; HRMS (TIS): найдено [M+H]+: 324.1447, рассчитано для C16H22NO6 [М+Н]+: 324.1447.
Пример 9. Синтез 4-((2-(трет-бутил)-8-метил-4Н-[1,3]диоксино[4,5-с]пиридин-5-ил)метокси)-4-оксобутановой кислоты (3д)
Продукт получали по вышеописанной методике, использовали соединение 2д (1.06 ммоль), янтарный ангидрид (1.06 ммоль) и 4-диметиламинопиридин (1.06 ммоль). Выход 63%; Бесцветные кристаллы, т.пл. 151°C; ЯМР 1H (400 МГц, ДМСО-d6), δ м. д.: 1.00 с (9Н, CH3), 2.30 с (3H, CH3), 2.42-2.56 м (4Н, 2CH2), 4.76 с (1Н, СН), 4.96 кв (1Н, 2J=-16.0 Гц, CH2), 4.99 с (2Н, CH2), 7.97 с (1Н, СН), 12.25 уш с (1Н, СООН); ЯМР 13С (100 МГц, ДМСО-d6), δ м. д.: 18.02, 24.09, 28.59, 28.66, 34.60, 60.90, 63.70, 104.11, 125.20, 127.64, 146.64, 147.21, 171.89, 173.41; HRMS (TIS): найдено [М+Н]+: 338.1604, рассчитано для C17H24NO6 [М+Н]+: 338.1604.
Пример 10. Синтез 4-((8-Метил-2-октил-4Н-[1,3]диоксино[4,5-с]пиридин-5-ил)метокси)-4-оксобутановой кислоты (3е)
Продукт получали по вышеописанной методике, использовали соединение 2е (1.70 ммоль), янтарный ангидрид (1.70 ммоль) и 4-диметиламинопиридин (1.70 ммоль). Выход 52%; Бесцветные кристаллы, т.пл. 146°C; ЯМР 1Н (400 МГц, ДМСО-d6), δ м. д.: 0.86 уш т (3H, 3J=6.0 Гц, CH3), 1.13-1.40 м (9Н, CH2), 1.47 м (2Н, CH2),1.78 м (2Н, CH2), 2.31 с (3H, CH3), 2.47-2.54 м (4Н, 2CH2), 4.95 с (2Н, CH2), 5.00 с (2Н, CH2), 5.13 уш т (1Н, 3J=4.5 Гц, СН), 7.99 с (1Н, СН), 12.26 уш с (1Н, СООН); ЯМР 13С (100 МГц, ДМСО-d6), δ м. д.: 13.94, 18.17, 22.11, 23.07, 28.61, 28.73, 28.90, 31.26, 33.68, 60.85, 63.23, 99.43, 125.22, 127.76, 140.44, 146.55, 147.02, 171.85, 173.38; HRMS (TIS): найдено [М+Н]+: 394.2230, рассчитано для C21H32NO6 [М+Н]+: 394.2230.
Общая методика получения бис-эфиров янтарной кислоты 1 (а-е):
Моноэфир янтарной кислоты 3 (а-е) (1 экв), азидотимидин (АЗТ) (1 экв) и 4-диметиламинопиридин (1 экв) растворяли в 15 мл хлористого метилена. В раствор добавляли дициклогексилкарбодиимид (1 экв). Реакционную смесь перемешивали при комнатной температуре на протяжении 24 часов. После завершения реакции растворитель отгоняли при пониженном давлении, и продукт очищали с помощью колоночной хроматографии на силикагеле [элюент - этилацетат].
Пример 11. Синтез (3-азидо-5-(5-метил-2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)тетрагидрофуран-2-ил)метил((8′-метил-4′Н-спиро[циклопентан-1,2′-[1,3]диоксино[4,5-с]пиридин]-5′-ил)метил)сукцината (1а)
Продукт получали по вышеописанной методике, использовали соединение 3а (1.49 ммоль), АЗТ (1.49 ммоль), 4-диметиламинопиридин (1.49 ммоль) и дициклогексилкарбодиимид (1.49 ммоль). Выход 60%; бесцветные кристаллы, т.пл. 81-82°C; , с=4.7; ЯМР 1Н (400 МГц, CDCl3), δ м. д.: 1.67-1.82 м (4Н, 2CH2), 1.86 с (3H, CH3), 1.99-1.83 м (4Н, 2CH2), 2.30-2.48 м (2Н, CH2), 2.38 с (3H, CH3), 2.54-2.74 м (4Н, 2CH2), 3.94-4.01 м (1Н, СН), 4.14-4.22 м (1Н, СН), 4.24 (1Н, АВХ, 2JAB=-12.2 Гц, 3JAX=3.7 Гц, CH2), 4.41 (1Н, АВХ, 3JBX=4.3 Гц, CH2), 4.83 с (2Н, CH2), 4.96 с (2Н, CH2), 6.08 т (1H, J=6.3 Гц, СН), 7.21 уш кв (1Н, 4J=-1.2 Гц, СН), 8.00 с (1H, СН), 10.32 уш с (1Н, NH); ЯМР 13С (100 МГц, CDCl3), δ м. д.: 12.55, 18.27, 23.48, 28.77, 36.06, 37.35, 59.63, 60.25, 61.43, 63.30, 77.36, 81.65, 85.35, 111.23, 111.25, 124.11, 126.55, 135.43, 140.30, 146.42, 148.88, 150.43, 164.09, 171.82; HRMS (TIS): найдено [М+Н]+: 585.2309, рассчитано для С27Н33N6O9 [М+Н]+: 585.2309.
Пример 12. Синтез (3-азидо-5-(5-метил-2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)тетрагидрофуран-2-ил)метил((8′-метил-4′Н-спиро[циклогексан-1,2,-[1,3]диоксино[4,5-с]пиридин]-5′-ил)метил)сукцината (1б)
Продукт получали по вышеописанной методике, использовали соединение 3б (1.56 ммоль), АЗТ (1.56 ммоль), 4-диметиламинопиридин (1.56 ммоль) и дициклогексилкарбодиимид (1.56 ммоль). Выход 36%; бесцветные кристаллы, т.пл. 78-79°C; , с=3.2; ЯМР 1Н (400 МГц, DMSO-d6), δ м. д.: 1.41-2.11 м (10Н, 5CH2), 1.77 с (3H, CH3), 2.27-2.48 м (2Н, CH2), 2.30 с (3H, CH3), 2.57-2.69 м (4Н, 2CH2), 3.94 кв (1Н, 3J=9.7 Гц, 3J=4.8 Гц, СН), 4.23 (1H, АВХ, 2JAB=-12.4 Гц, 3JAX=4.1 Гц, CH2), 4.26 (1Н, AВХ, 3JBX=5.2 Гц, CH2), 4.43 кв (1Н, 3J=13.2 Гц, 3J=6.0 Гц, СН), 4.83-4.94 м (2Н, CH2), 4.97-5.06 м (2Н, CH2), 6.12 т (1H, J=6.5 Гц, СН), 7.45 с (1Н, СН), 7.93-8.00 м (1Н, СН), 11.37 уш с (1Н, NH); ЯМР 13С (100 МГц, DMSO-d6): δ 12.10, 18.28, 22.14, 23.04, 24.65, 28.47, 28.50, 32.89, 35.59, 56.99, 59.04, 59.98, 60.91, 63.45, 80.55, 83.54, 99.74, 109.96, 110.75, 114.70, 124.93, 126.65, 135.98, 139.93, 140.14, 144.89, 145.66, 147.01, 147.19, 150.38, 163.67, 171.69, 171.83; HRMS (TIS): найдено [M+H]+: 599.2466, рассчитано для C28H35N6O9 [M+H]+: 599.2466.
Пример 13. Синтез (3-азидо-5-(5-метил-2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)тетрагидрофуран-2-ил)метил((2,8-диметил-4Н-[1,3]диоксино[4,5-с]пиридин-5-ил)метил)сукцината (1в)
Продукт получали по вышеописанной методике, использовали соединение 3в (1.50 ммоль), АЗТ (1.50 ммоль), 4-диметиламинопиридин (1.50 ммоль) и дициклогексилкарбодиимид (1.50 ммоль). Выход 48%; Маслообразное вещество коричневого цвета; ЯМР 1Н (400 МГц, CDCl3), δ м. д.: 1.57 д (3H, 3J=5.1 Гц, CH3), 1.89 д (3H, 3J=3.4 Гц, CH3), 2.42 с (3H, CH3), 2.34-2.48 м (2Н, CH2), 2.57-2.75 м (4Н, 2CH2), 3.99 кв (1Н, 3J=9.2 Гц, 3J=4.1 Гц, СН), 4.27 м (1Н, J=12.2 Гц, J=3.6 Гц, CH2), 4.45 м (1Н, J=4.2 Гц, CH2), 4.88 и 4.92 (2Н, АВ, 2JAB=-16.0 Гц, CH2), 4.97 с (2Н, CH2), 5.15 кв (1Н, СН), 6.09 т (1Н, J=6.3 Гц, СН), 7.22 с (1Н, СН), 8.03 с (1Н, СН(Pyr)), 9.82 уш с (1Н, NH); ЯМР 13С (100 МГц, CDCl3), δ м. д.: 12.67, 18.48, 20.63, 28.84, 28.87, 37.50, 60.31, 61.60, 63.34, 63.85, 81.79, 85.55, 97.27, 111.38, 124.34, 127.28, 135.28, 140.98, 141.01, 147.76, 148.63, 150.37, 163.97, 171.90; HRMS (TIS): найдено [М+Н]+: 545.1996, рассчитано для C24H29N6O9 [М+Н]+: 545.1996.
Пример 14. Синтез (3-азидо-5-(5-метил-2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)тетрагидрофуран-2-ил)метил((8-метил-2-пропил-4Н-[1,3]диоксино[4,5-с]пиридин-5-ил)метил)сукцината (1г)
Продукт получали по вышеописанной методике, использовали соединение 3г (1.12 ммоль), АЗТ (1.12 ммоль), 4-диметиламинопиридин (1.12 ммоль) и дициклогексилкарбодиимид (1.12 ммоль). Выход 21%; Маслообразное вещество коричневого цвета; ЯМР 1Н (400 МГц, CDCl3), δ м. д.: 0.97 т (3H, J=7.5 Гц, CH3), 1.46-1.60 м (2Н, CH2), 1.75-1.90 м (2Н, CH2), 1.90 д (3H, J=2.9 Гц, CH3), 2.32-2.48 м (2Н, CH2), 2.41 с (3H, CH3), 2.55-2.77 м (4Н, 2CH2), 3.98 кв (1Н, J=8.9 Гц, J=4.1 Гц, СН), 4.14-4.23 м (1Н, CH2), 4.26 м (1Н, J=12.2 Гц, J=3.7 Гц, CH2), 4.44 м (1Н, J=3.9 Гц, СН), 4.88 и 4.90 (2Н, АВ, 2JAB=-16.0 Гц, CH2), 4.96 с (2Н, CH2), 4.99 т (1Н, J=5.2 Гц, СН), 6.08 т (1Н, J=6.3 Гц, СН), 7.22 уш с (1H, СН), 8.02 с (1H, СН), 10.05 уш с (1Н, NH); ЯМР 13С (100 МГц, CDCl3), δ м. д.: 12.63, 13.93, 16.97, 18.31, 28.79, 28.83, 36.25, 37.45, 60.28, 61.56, 63.33, 63.89, 81.75, 85.46, 85.49, 99.94, 111.33, 124.39, 127.58, 135.55, 136.54, 140.78, 147.83, 148.57, 150.42, 164.09, 171.87, 171.89; HRMS (TIS): найдено [М+Н]+: 573.2309, рассчитано для C26H33N6O9 [М+Н]+: 573.2309.
Пример 15. Синтез (3-азидо-5-(5-метил-2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)тетрагидрофуран-2-ил)метил((8-метил-2-(трет-бутил)-4Н-[1,3]диоксино[4,5-с]пиридин-5-ил)метил)сукцината (1д)
Продукт получали по вышеописанной методике, использовали соединение 3д (0.56 ммоль), АЗТ (0.56 ммоль), 4-диметиламинопиридин (0.56 ммоль) и дициклогексилкарбодиимид (0.56 ммоль). Выход 54%; Маслообразное вещество коричневого цвета; ЯМР 1Н (400 МГц, CDCl3), δ м. д.: 0.98 с (9Н, 3CH3), 1.83 д (3H, J=2.2 Гц, CH3), 2.28-2.46 м (2Н, CH2), 2.37 с (3H, CH3), 2.52-2.73 м (4Н, 2CH2), 3.95 уш кв (1H, J=4.4 Гц, СН), 4.10-4.28 м (2Н, СН, CH2), 4.35-4.46 уш м (1Н, CH2), 4.55 с (1H, СН), 4.86 с (2Н, CH2), 4.92 с (2Н, CH2), 6.06 т (1Н, J=6.0 Гц, СН), 7.20 с (1Н, СН), 7.97 с (1Н, СН), 10.48 с (1Н, NH); ЯМР 13С (100 МГц, CDCl3), δ м. д.: 12.49, 18.07, 24.14, 28.66, 28.69, 33.76, 34.85, 37.26, 60.17, 61.48, 63.23, 64.14, 81.58, 85.22, 85.25, 104.91, 111.16, 124.23, 127.43, 135.41, 140.48, 147.92, 148.45, 150.44, 164.14, 171.76, 171.80; HRMS (TIS): найдено [М+Н]+: 587.2466, рассчитано для C27H35N6O9 [М+Н]+: 587.2466.
Пример 16. Синтез (3-азидо-5-(5-метил-2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)тетрагидрофуран-2-ил)метил((8-метил-2-октил-4Н-[1,3]диоксино[4,5-с]пиридин-5-ил)метил)сукцината (1е)
Продукт получали по вышеописанной методике, использовали соединение 3е (0.63 ммоль), АЗТ (0.63 ммоль), 4-диметиламинопиридин (0.63 ммоль) и дициклогексилкарбодиимид (0.63 ммоль). Выход 56%; Маслообразное вещество коричневого цвета; ЯМР 1Н (400 МГц, CDCl3), δ м. д.: 0.83 т (3H, J=6.7 Гц, CH3), 1.17-1.38 м (10Н, 5CH2), 1.43-1.53 м (2Н, CH2), 1.75-1.90 м (5Н, CH2, CH3), 2.30-2.48 м (5Н, CH3, CH2), 2.54-2.74 м (4Н, 2CH2), 3.97 кв (1Н, J=8.2 Гц, J=3.7 Гц, СН), 4.12-4.29 м (2Н, J=3.5 Гц, СН, CH2), 4.42 м (1Н, J=12.0 Гц, J=3.8 Гц, CH2), 4.86 и 4.88 (2Н, АВ, 2JAB=-16.4 Гц, CH2), 4.95 с (2Н, CH2), 4.96 кв (1Н, J=5.1 Гц, СН), 6.08 т (1Н, J=6.2 Гц, СН), 7.21 с (1Н, СН), 8.00 с (1Н, СН), 10.25 уш с (1Н, NH); ЯМР 13С (100 МГц, CDCl3), δ м. д.: 12.58, 14.09, 18.29, 22.63, 23.51, 28.74, 28.77, 29.16, 29.31, 29.42, 31.81, 34.18, 37.37, 60.24, 61.53, 63.29, 63.84, 81.68, 85.34, 85.37, 100.07, 111.26, 124.31, 127.48, 135.47, 140.76, 147.75, 148.53, 150.43, 164.09, 171.82, 171.84; HRMS (TIS): найдено [М+Н]+: 643.3092, рассчитано для C31H43N6O9 [М+Н]+: 643.3092.
Методика изучения антиретровирусной активности
Первый этап. Культивирование клеток HeLa.
Все работы с культурой клеток проводили в стерильном ламинарном боксе согласно общепринятым правилам работы в лаборатории 2-го класса биобезопасности.
Клетки из раковой опухоли шейки матки человека HeLa (АТСС) культивировали в среде DMEM с добавлением 10% эмбриональной телячьей сыворотки FBS и пенстрепа (фирма-производитель - Sigma, Великобритания). Клетки инкубировали при 37°C, во влажной атмосфере, содержащей 5% углекислого газа (СO2). Пересев клеток проводили при плотности клеточного монослоя 90% с применением 0,25% раствора трипсина-ЭДТА (фирма-производитель - БиоЛот, Санкт Петербург).
Таким путем завершали получение клеточной культуры HeLa и приступали ко второму этапу.
Второй этап. Определение цитотоксичности потенциальных антиретровирусных веществ.
Точные навески исследуемых веществ растворяли в рассчитанном объеме стерильного раствора диметилсульфоксида (фирма-производитель - БиоЛот, Санкт Петербург) или стерильном растворе DPBS (фирма-производитель - БиоЛот, Санкт Петербург) в 1,5-миллилитровой стерильной пробирке, до полного растворения вещества. Препарат разводили в различных концентрациях от 1 кратного до 1000 кратного раствора.
Таким образом, после получения необходимых растворов, вещество наносили на клетки HeLa в 96 луночном планшете и инкубировали во влажной атмосфере, при содержании 5% CO2, 24 часа. По истечении 24 часов, после воздействия препаратов, в каждую лунку планшета добавляли по 10 мкл смеси растворов MTS/PMS (Promega, Sigma, США), в соотношении 1:20). Через 1 час выполняли измерение оптической плотности раствора на планшетном фотометре Tecan (Thermo Scientific, США) при длине волны 490 нм в соответствии с инструкциями фирмы производителя (Promega, США).
Результаты получали в единицах оптической плотности с помощью программного обеспечения Skanlt Software 3.0 for Multiskan FC (Thermo Scientific, CШA). Статистический анализ результатов проводили в программном обеспечении Excel 2010 (Microsoft, США). После определения оптимальной нетоксичной концентрации по сравнению с исходным препаратом азидотимидином приступали к третьему этапу.
Третий этап. Определение антиретровирусной активности веществ.
Определение антиретровирусной активности вещества проводили в соответствии с ранее описанным методом (Биобезопасная модель ВИЧ-инфекции для оценки антиретровирусной активности лекарственных препаратов / Е.В. Головин, И.Г. Мустафин, Е.В. Мартынова, О.Р. Галеев, В.А. Анохин, А.А. Ризванов // Современные технологии в медицине. - 2012. - Т. 1. - С. 55-60). Рекомбинантный лентивирус, экспрессирующий белок GFP, получали с помощью котрансфекции культуры клеток НЕК293 плазмидами, кодирующими разные компоненты рекомбинантного вируса, например, плазмидами, полученными из некоммерческой организации AddGene (www.addgene.org): pCMV-VSV-G (плазмида №8454), psPAX2 (плазмида №12260) и pWPT-GFP (плазмида №12255). Сбор вирусного супернатанта проводили 3 раза, через каждые 12 часов. Супернатанты объединяли и хранили при 4°C. По завершению сбора супернатанты центрифугировали в течение 5 минут, при 1500 об/мин и фильтровали через фильтр 0,22 мкм. Очищенные супернатанты хранили в аликвотах при -80°C. Полученный лентивирус добавляли в культуру клеток, предварительно проинкубированные с исследуемыми веществами. Культивирование и инфицирование клеток проводили в 24-луночном культуральном планшете. В планшете с клетками HeLa после двух дней культивирования наблюдали нормальный рост клеток, примерно 30000 клеток в каждой лунке.
Далее культуральную среду удаляли и добавляли свежую среду в объеме 250 мкл в каждую лунку. В лунки добавляли исходные растворы исследуемых веществ до конечных нетоксичных концентраций в культуральной среде для каждого препарата. Клетки инкубировали в течении 30 минут при 37°C во влажной атмосфере, содержащей 5% СO2. Среду удаляли, в лунки добавляли по 250 мкл раствора лентивируса в питательной среде, содержащей соответствующее исследуемое вещество в конечной концентрации. Клетки инкубировали в течении 3 часов при 37°C во влажной атмосфере, содержащей 5% CO2. Среду удаляли и добавляли по 500 мкл свежей среды. Инфицированные клетки инкубировали в течении двух суток при 37°C во влажной атмосфере, содержащей 5% CO2.
Инфицирование клеток определяли по экспрессии GFP с помощью метода проточной цитометрии.
Эффективность антиретровирусной активности исследуемого вещества определяли по экспрессии репотерного гена, например, GFP. Ген GFP входит в состав генома рекомбинантного лентивируса и, таким образом, ведет себя как типичный вирусный ген. Для экспрессии лентивирусных генов необходимо, чтобы провирус встроился (интегрировался) в геном клетки хозяина. После встраивания в геном клетки хозяина начинается экспрессия вирусных генов - транскрипция мРНК и трансляция белка. Если исследуемое вещество подавляет вирусную инфекцию на стадии проникновения вируса в клетку, обратной транскрипции, транспорта в ядро и/или интеграции, то не происходит экспрессии вирусных генов. Следовательно, не происходит экспрессии репотерного гена. В описываемом нами примере, специфическая активность репотерного белка - зеленая флуоресценция при облучении светом с длиной волны 450 нанометров. Таким образом, наличие зеленой флуоресценции клеток свидетельствует об успешной интеграции вируса в геном клетки хозяина и, следовательно, низкой антиретровирусной активности исследуемого вещества.
Из представленных в таблице 1 данных следует, что заявленные вещества обладают антиретровирусным действием, при этом соединения 1 (г-е) ингибируют инфекцию на уровне азидотимидина - одного из наиболее эффективных и часто используемых антиретровирусных препаратов.
Из представленных в таблице 2 данных следует, что исследуемые вещества менее токсичны азидотимидина (в 1,5-2,5 раза). Таким образом, синтезированные соединения представляют интерес при разработке новых антиретровирусных веществ, используемых для борьбы с ретровирусами, например, с ВИЧ-инфекциями.
Антиретровирусные препараты на основе производных азидотимидина общей формулы 1: , гдеR1+R2=-CH2(CH2)2CH2-R1+R2=-CH2(CH2)3CH2-R1=Н, R2=СН3 R1=H, R2=CH2CH2CH3 R1=H, R2=C(CH3)3 R1=H, R2=CH2(CH2)6CH3