Фармацевтическая композиция для лечения болезни печени
Иллюстрации
Показать всеИзобретение относится к фармацевтической промышленности, а именно к композиции для стимуляции регенерации поврежденной печени в результате гепатэктомии. Фармацевтическая композиция для стимуляции регенерации поврежденной печени в результате гепатэктомии, содержащая: проантоцианидин в эффективном количестве, при этом мономерные звенья проантоцианидина имеют следующую формулу:
в которой в случае, когда R1 представляет собой ОСН3, R2 представляет собой ОН и R3 представляет собой Н, когда R1 представляет собой ОН, R2 представляет собой Н и R3 представляет собой Н, когда R1 представляет собой ОН, R2 представляет собой ОН и R3 представляет собой Н, или когда R1 представляет собой ОН, R2 представляет собой ОН и R3 представляет собой ОН, и R4 представляет собой 3-(α)-ОН, 3-(β)-ОН, 3-(α)-О-сахар или 3-(β)-O-сахар; и фармацевтически приемлемый носитель или соль, где фармацевтически приемлемая соль выбрана из группы, состоящей из неорганических солей натрия, калия, амина, магния, кальция, цинка, алюминия или циркония, и органических солей дициклогексиламина, метил-d-глюкамина, аргинина, лизина, гистидина или глутамина. Вышеописанная композиция эффективна для стимуляции регенерации поврежденной печени в результате гепатэктомии. 9 з.п. ф-лы, 17 ил., 3 табл., 15 пр.
Реферат
Область техники
Изобретение относится к фармацевтической композиции и, в частности, к фармацевтической композиции для замедления прогрессирования рака печени, улучшения функций печени, уменьшения фиброза печени, цирроза печени и воспаления печени, и способствования регенерации поврежденной печени.
Сведения о предшествующем уровне техники
Гепатоцеллюлярная карцинома (HCC, рак печени) занимает пятое место среди причин смерти от рака в мире у мужчин, восьмое в женщин. HCC с трудом поддается выявлению на ранней стадии. Таким образом, задержка своевременного лечения встречается постоянно. С клинической точки зрения, гепатэктомия или пересадка печени являются лучшими способами лечения HCC. Однако, так как большая часть пациентов с HCC диагностируются на поздней стадии, по этой причине только 15% пациентов могут проходить лечение путем гепатэктомии, при этом степеь восстановления составляет меньше чем 5%. Дополнительно могут применяться другие способы лечения, включая транскатетерную артериальную химиоэмболизацию (TACE), радиочастотную катетерную абляцию (RFA) и радиационную терапию, однако, частота рецидивов HCC составляет более 80%. Когда у пациентов с клиническими проявлениями диагностируется HCC, средняя продолжительность их жизни составляет только около 6 месяцев, поэтому не только коэффициент смертности от HCC является высоким, но также и их прогноз является очень слабым. В настоящее время эффективность стандартных химиотерапевтических лекарственных средств, применяющихся для лечения HCC, например, фторурацила, пирарубицина, оксалиплатина, цисплатина и т.п., является ограниченной. Новый лекарственный препарат таргетной терапии Nexavar® (Сорафениб) в качестве ингибитора многочисленных киназ был одобрен для поздней стадии HCC или первичной HCC. Нексавар улучшает выживаемость при HCC. В 2008 году мировой рынок противоопухолевых средств составил 53.1 биллионов долларов (Nature Review in Cancer) и рынок лекарственных препаратов против рака печени составил примерно 2.5 биллиона долларов. Таким образом, разработка новых лекарственных средств, предназначенных для лечения HCC, является нереализованной потребностью в области медицины.
Краткое изложение сущности изобретения
В одном варианте осуществления изобретения предложена фармацевтическая композиция для замедления прогрессирования HCC, улучшения функции печени, уменьшения фиброза печени, цирроза печени и воспаления печени, способствования регенерации поврежденной печени и/или обратному развитию фиброза печени, содержащая: проантоцианидин в эффективном количестве; и фармацевтически приемлемый носитель или соль, при этом мономерные звенья проантоцианидина имеют следующую формулу:
В формуле в случае, когда R1 представляет собой OCH3, R2 представляет собой OH и R3 представляет собой H, когда R1 представляет собой OH, R2 представляет собой H и R3 представляет собой H, когда R1 представляет собой OH, R2 представляет собой OH и R3 представляет собой H, или когда R1 представляет собой OH, R2 представляет собой OH и R3 представляет собой OH, и R4 представляет собой 3-(α)-OH, 3-(β)-OH, 3-(α)-O-сахар или 3-(β)-O-сахар.
В изобретении после экспериментальных испытаний было обнаружено, что фармацевтическая композиция (BEL-X) может применяться для лечения различных заболеваний печени, включая (1) рак печени, вызванный хроническим вирусным гепатитом B или инфекционным вирусным гепатитом C. Фармацевтическая композиция (BEL-X) может применяться отдельно или в качестве вспомогательного средства для других различных способов лечения, которые могут улучшать функцию печени пациентов с HCC, уменьшать прогрессирование HCC, увеличивать показатель операбельности и показатель успешности хирургической операции у пациентов с HCC, уменьшать послеоперационную частоту рецидивов, увеличивать показатель выживаемости и продлевать выживаемость пациентов с HCC, кроме того, улучшать качество жизни пациентов с HCC. (2) Фармацевтическая композиция (BEL-X) может применяться отдельно или в комбинации с другими клиническими лекарственными средствами для лечения пациентов с фиброзом печени. (3) Фармацевтическая композиция (BEL-X) может применяться отдельно или в комбинации с другими клиническими лекарственными средствами для лечения пациентов с жировой инфильтрацией печени, а также для улучшения функций печени для предотвращения цирроза печени и HCC.
Таким образом, изобретение представлено далее следующими пунктами.
1. Фармацевтическая композиция для замедления прогрессирования HCC, содержащая: проантоцианидин в эффективном количестве, при этом мономерное звено проантоцианидина имеет следующую формулу:
в которой, в случае, когда R1 представляет собой OCH3, R2 представляет собой OH и R3 представляет собой H, когда R1 представляет собой OH, R2 представляет собой H и R3 представляет собой H, когда R1 представляет собой OH, R2 представляет собой OH и R3 представляет собой H, или когда R1 представляет собой OH, R2 представляет собой OH и R3 представляет собой OH, и R4 представляет собой 3-(α)-OH, 3-(β)-OH, 3-(β)-O-сахар или 3-(β)-O-сахар; и фармацевтически приемлемый носитель или соль.
2. Фармацевтическая композиция для замедления прогрессирования HCC, как описано в пункте 1, в которой мономерные звенья проантоцианидина связаны друг с другом посредством C4-C8 связи, C4-C6 связи или C2-O7 связи.
3. Фармацевтическая композиция для замедления прогрессирования HCC, как описано в пункте 1, в которой проантоцианидин имеет степень полимеризации, изменяющуюся от 2 до 30.
4. Фармацевтическая композиция для замедления прогрессирования HCC, как описано в пункте 1, в которой мономерные звенья проантоцианидина содержат R или S оптические изомеры при C2, C3 или C4.
5. Фармацевтическая композиция для замедления прогрессирования HCC, как описано в пункте 1, в которой мономерные звенья проантоцинидина включают флавоноидные соединения.
6. Фармацевтическая композиция для замедления прогрессирования HCC, как описано в пункте 5, в которой флавоноидные соединения включают катехин, эпикатехин, эпиафзетехин, галлокатехин, галлоэпикатехин, эпигаллокатехин, галлаты, флавонолы, флавандиолы, лейкоцианидины или процинидины.
7. Фармацевтическая композиция для замедления прогрессирования HCC, как описано в пункте 1, в которой мономерное звено проантоцианидина включает флаван-3-ол.
8. Фармацевтическая композиция для замедления прогрессирования HCC, как описано в пункте 1, в которой проантоцианидин экстрагирован из растения.
9. Фармацевтическая композиция для замедления прогрессирования HCC, как описано в пункте 8, в которой растение включает семейство вересковые (Ericaceae), семейство розовые (Rosaceae), семейство сосновые (Pinaceae), виноградовые (Vitaceae) или семейство крапивные (Urticaceae).
10. Фармацевтическая композиция для замедления прогрессирования HCC, как описано в пункте 9, в которой растение семейства крапивные (Urticaceae) включает бомерию белоснежную Boehmeria nivea L. Gaud.
11. Фармацевтическая композиция для улучшения функций печени, содержащая: проантоцианидин в эффективном количестве, при этом мономерное звено проантоцианидина имеет следующую формулу:
в которой в случае, когда R1 представляет собой OCH3, R2 представляет собой OH и R3 представляет собой H, когда R1 представляет собой OH, R2 представляет собой H и R3 представляет собой H, когда R1 представляет собой OH, R2 представляет собой OH и R3 представляет собой H, или когда R1 представляет собой OH, R2 представляет собой OH и R3 представляет собой ОН, и R4 представляет собой 3-(α)-OH, 3-(β)-OH, 3-(α)-O-сахар или 3-(β)-O-сахар; и фармацевтически приемлемый носитель или соль.
12. Фармацевтическая композиция для улучшения функций печени, как описано в пункте 11, в которой мономерные звенья проантоцианидина связаны друг с другом посредством C4-C8 связи, C4-С6 связи или С2-O7 связи.
13. Фармацевтическая композиция для улучшения функций печени, как описано в пункте 11, в которой проантоцианидин имеет степень полимеризации, изменяющуюся от 2 до 30.
14. Фармацевтическая композиция для улучшения функций печени, как описано в пункте 11, в которой мономерные звенья проантоцианидина содержат R или S оптические изомеры при С2, C3 или C4.
15. Фармацевтическая композиция для улучшения функций печени, как описано в пункте 11, в которой мономерные звенья проантоцианидина включают флавоноидные соединения.
16. Фармацевтическая композиция для улучшения функций печени, как описано в пункте 11, в которой флавоноидные соединения включают катехин, эпикатехин, эпиафзетехин, галлокатехин, галоэпикатехин, эпигаллокатехин, галлаты, флавонолы, флавандиолы, лейкоцианидины или процинидины.
17. Фармацевтическая композиция для улучшения функций печени, как описано в пункте 11, в которой мономерное звено проантоцианидина включает флаван-3-ол.
18. Фармацевтическая композиция для улучшения функций печени, как описано в пункте 11, в которой проантоцианидин экстрагирован из растения.
19. Фармацевтическая композиция для улучшения функций печени, как описано в пункте 18, в которой растение включает семейство вересковые (Ericaceae), семейство розовые (Rosaceae), семейство сосновые (Pinaceae), виноградовые (Vitaceae) или семейство крапивные (Urticaceae).
20. Фармацевтическая композиция для улучшения функций печени, как описано в пункте 19, в которой растение семейства крапивные (Urticaceae) включает бомерию белоснежную Boehmeria nivea L. Gaud.
21. Фармацевтическая композиция для уменьшения фиброза печени, содержащая: проантоцианидин в эффективном количестве, при этом мономерное звено проантоцианидина имеет следующую формулу:
в которой в случае, когда R1 представляет собой OCH3, R2 представляет собой OH и R3 представляет собой H, когда R1 представляет собой OH, R2 представляет собой H и R3 представляет собой H, когда R1 представляет собой OH, R2 представляет собой OH и R3 представляет собой H, или когда R1 представляет собой OH, R2 представляет собой OH и R3 представляет собой OH, и R4 представляет собой 3-(α)-OH, 3-(β)-OH, 3-(α)-O-сахар или 3-(β)-O-сахар; и фармацевтически приемлемый носитель или соль.
22. Фармацевтическая композиция для уменьшения фиброза печени, как описано в пункте 21, в которой мономерные звенья проантоцианидина связаны друг с другом посредством C4-C8 связи, C4-C6 связи или C2-O7 связи.
23. Фармацевтическая композиция для уменьшения фиброза печени, как описано в пункте 21, в которой проантоцианидин имеет степень полимеризации, изменяющуюся от 2 до 30.
24. Фармацевтическая композиция для уменьшения фиброза печени, как описано в пункте 21, в которой мономерные звенья проантоцианидина содержат R или S оптические изомеры при C2, C3 или C4.
25. Фармацевтическая композиция для уменьшения фиброза печени, как описано в пункте 21, в которой мономерные звенья проантоцианидина включают флавоноидные соединения.
26. Фармацевтическая композиция для уменьшения фиброза печени, как описано в пункте 25, в которой флавоноидные соединения включают катехин, эпикатехин, эпиафзетехин, галлокатехин, галлоэпикатехин, эпигаллокатехин, галлаты, флавонолы, флавандиолы, лейкоцианидины или процинидины.
27. Фармацевтическая композиция для уменьшения фиброза печени, как описано в пункте 21, в которой мономерное звено проантоцианидина включает флаван-3-ол.
28. Фармацевтическая композиция для уменьшения фиброза печени, как описано в пункте 21, в которой проантоцианидин экстрагирован из растения.
29. Фармацевтическая композиция для уменьшения фиброза печени, как описано в пункте 28, в которой растение включает семейство вересковые (Ericaceae), семейство розовые (Rosaceae), семейство сосновые (Pinaceae), виноградовые (Vitaceae) или семейство крапивные (Urticaceae).
30. Фармацевтическая композиция для уменьшения фиброза печени, как описано в пункте 29, в которой растение семейства крапивные (Urticaceae) включает бомерию белоснежную Boehmeria nivea L. Gaud.
31. Фармацевтическая композиция для уменьшения цирроза печени, содержащая: проантоцианидин в эффективном количестве, при этом мономерное звено проантоцианидина имеет следующую формулу:
в которой в случае, когда R1 представляет собой OCH3, R2 представляет собой OH и R3 представляет собой H, когда R1 представляет собой OH, R2 представляет собой H и R3 представляет собой H, когда R1 представляет собой OH, R2 представляет собой OH и R3 представляет собой H, или когда R1 представляет собой OH, R2 представляет собой OH и R3 представляет собой OH, и R4 представляет собой 3-(α)-OH, 3-(β)-OH, 3-(α)-O-сахар или 3-(β)-O-сахар; и фармацевтически приемлемый носитель или соль.
32. Фармацевтическая композиция для уменьшения цирроза печени, как описано в пункте 31, в которой мономерные звенья проантоцианидина связаны друг с другом посредством C4-C8 связи, C4-C6 связи или C2-O7 связи.
33. Фармацевтическая композиция для уменьшения цирроза печени, как описано в пункте 31, в которой проантоцианидин имеет степень полимеризации, изменяющуюся от 2 до 30.
34. Фармацевтическая композиция для уменьшения цирроза печени, как описано в пункте 31, в которой мономерные звенья проантоцианидина содержат R или S оптические изомеры при C2, C3 или C4.
35. Фармацевтическая композиция для уменьшения цирроза печени, как описано в пункте 31, в которой мономерные звенья проантоцианидина включают флавоноидные соединения.
36. Фармацевтическая композиция для уменьшения цирроза печени, как описано в пункте 35, в которой флаваноидные соединения включают катехин, эпикатехин, эпиафзетехин, галлокатехин, галлоэпикатехин, эпигаллокатехин, галлаты, флавонолы, флавандиолы, лейкоцианидины или процинидины.
37. Фармацевтическая композиция для уменьшения цирроза печени, как описано в пункте 31, в которой мономерное звено проантоцианидина включает флаван-3-ол.
38. Фармацевтическая композиция для уменьшения цирроза печени, как описано в пункте 31, в которой проантоцианидин экстрагирован из растения.
39. Фармацевтическая композиция для уменьшения цирроза печени, как описано в пункте 38, в которой растение включает семейство вересковые (Ericaceae), семейство розовые (Rosaceae), семейство сосновые (Pinaceae), виноградовые (Vitaceae) или семейство крапивные (Urticaceae).
40. Фармацевтическая композиция для уменьшения цирроза печени, как описано в пункте 39, в которой растение семейства крапивные (Urticaceae) включает бомерию белоснежную Boehmeria nivea L. Gaud.
41. Фармацевтическая композиция для уменьшения воспаления печени, содержащая: проантоцианидин в эффективном количестве, при этом мономерное звено проантоцианидина имеет следующую формулу:
в которой, в случае, когда R1 представляет собой OCH3, R2 представляет собой OH и R3 представляет собой H, когда R1 представляет собой OH, R2 представляет собой H и R3 представляет собой H, когда R1 представляет собой OH, R2 представляет собой OH и R3 представляет собой H, или когда R1 представляет собой OH, R2 представляет собой OH и R3 представляет собой OH, и R4 представляет собой 3-(α)-OH, 3-(β)-OH, 3-(α)-O-сахар или 3-(β)-O-сахар; и фармацевтически приемлемый носитель или соль.
42. Фармацевтическая композиция для уменьшения воспаления печени, как описано в пункте 41, в которой мономерные звенья проантоцианидина связаны друг с другом посредством C4-C8 связи, C4-C6 связи или C2-O7 связи.
43. Фармацевтическая композиция для уменьшения воспаления печени, как описано в пункте 41, в которой проантоцианидин имеет степень полимеризации, изменяющуюся от 2 до 30.
44. Фармацевтическая композиция для уменьшения воспаления печени, как описано в пункте 41, в которой мономерные звенья проантоцианидина содержат R или S оптические изомеры при C2, C3 или C4.
45. Фармацевтическая композиция для уменьшения воспаления печени, как описано в пункте 41, в которой мономерные звенья проантоцианидина включают флавоноидные соединения.
46. Фармацевтическая композиция для уменьшения воспаления печени, как описано в пункте 45, в которой флаваноидные соединения включают катехин, эпикатехин, эпиафзетехин, галлокатехин, галлоэпикатехин, эпигаллокатехин, галлаты, флавонолы, флавандиолы, лейкоцианидины или процинидины.
47. Фармацевтическая композиция для уменьшения воспаления печени, как описано в пункте 41, в которой мономерное звено проантоцианидина включает флаван-3-ол.
48. Фармацевтическая композиция для уменьшения воспаления печени, как описано в пункте 41, в которой проантоцианидин экстрагирован из растения.
49. Фармацевтическая композиция для уменьшения воспаления печени, как описано в пункте 48, в которой растение включает семейство вересковые (Ericaceae), семейство розовые (Rosaceae), семейство сосновые (Pinaceae), виноградовые (Vitaceae) или семейство крапивные (Urticaceae).
50. Фармацевтическая композиция для уменьшения воспаления печени, как описано в пункте 49, в которой растение семейства крапивные (Urticaceae) включает бомерию белоснежную Boehmeria nivea L. Gaud.
51. Фармацевтическая композиция для способствования регенерации поврежденной печени, содержащая: проантоцианидин в эффективном количестве, при этом мономерное звено проантоцианидина имеет следующую формулу:
в которой в случае, когда R1 представляет собой OCH3, R2 представляет собой OH и R3 представляет собой H, когда R1 представляет собой OH, R2 представляет собой H и R3 представляет собой H, когда R1 представляет собой OH, R2 представляет собой OH и R3 представляет собой H, или когда R1 представляет собой OH, R2 представляет собой OH и R3 представляет собой OH, и R4 представляет собой 3-(α)-OH, 3-(β)-OH, 3-(α)-O-сахар или 3-(β)-O-сахар; и фармацевтически приемлемый носитель или соль.
52. Фармацевтическая композиция для способствования регенерации поврежденной печени, как описано в пункте 51, в которой мономерные звенья проантоцианидина связаны друг с другом посредством C4-C8 связи, C4-C6 связи или C2-O7 связи.
53. Фармацевтическая композиция для способствования регенерации поврежденной печени, как описано в пункте 51, в которой проантоцианидин имеет степень полимеризации, изменяющуюся от 2 до 30.
54. Фармацевтическая композиция для способствования регенерации поврежденной печени, как описано в пункте 51, в которой мономерные звенья проантоцианидина содержат R или S оптические изомеры при C2, C3 или C4.
55. Фармацевтическая композиция для способствования регенерации поврежденной печени, как описано в пункте 51, в которой мономерные звенья проантоцианидина включают флавоноидные соединения.
56. Фармацевтическая композиция для способствования регенерации поврежденной печени, как описано в пункте 55, в которой флаваноидные соединения включают катехин, эпикатехин, эпиафзетехин, галлокатехин, галлоэпикатехин, эпигаллокатехин, галлаты, флавонолы, флавандиолы, лейкоцианидины или процинидины.
57. Фармацевтическая композиция для способствования регенерации поврежденной печени, как описано в пункте 51, в которой мономерное звено проантоцианидина включает флаван-3-ол.
58. Фармацевтическая композиция для способствования регенерации поврежденной печени, как описано в пункте 51, в которой проантоцианидин экстрагирован из растения.
59. Фармацевтическая композиция для способствования регенерации поврежденной печени, как описано в пункте 58, в которой растение включает семейство вересковые (Ericaceae), семейство розовые (Rosaceae), семейство сосновые (Pinaceae), виноградовые (Vitaceae) или семейство крапивные (Urticaceae).
60. Фармацевтическая композиция для способствования регенерации поврежденной печени, как описано в пункте 59, в которой растение семейства крапивные (Urticaceae) включает бомерию белоснежную Boehmeria nivea L. Gaud.
61. Фармацевтическая композиция для способствования обратному развитию фиброза печени, содержащая: проантоцианидин в эффективном количестве, при этом мономерное звено проантоцианидина имеет следующую формулу:
в которой в случае, когда R1 представляет собой OCH3, R2 представляет собой OH и R3 представляет собой H, когда R1 представляет собой OH, R2 представляет собой H и R3 представляет собой H, когда R1 представляет собой OH, R2 представляет собой OH и R3 представляет собой H, или когда R1 представляет собой OH, R2 представляет собой OH и R3 представляет собой OH, и R4 представляет собой 3-(α)-OH, 3-(β)-OH, 3-(α)-O-сахар или 3-(β)-O-сахар; и фармацевтически приемлемый носитель или соль.
62. Фармацевтическая композиция для способствования обратному развитию фиброза печени, как описано в пункте 61, в которой мономерные звенья проантоцианидина связаны друг с другом посредством C4-C8 связи, C4-C6 связи или C2-O7 связи.
63. Фармацевтическая композиция для способствования обратному развитию фиброза печени, как описано в пункте 61, в которой проантоцианидин имеет степень полимеризации, изменяющуюся от 2 до 30.
64. Фармацевтическая композиция для способствования обратному развитию фиброза печени, как описано в пункте 61, в которой мономерные звенья проантоцианидина содержат R или S оптические изомеры при C2, C3 или C4.
65. Фармацевтическая композиция для способствования обратному развитию фиброза печени, как описано в пункте 61, в которой мономерные звенья проантоцианидина включают флавоноидные соединения.
66. Фармацевтическая композиция для способствования обратному развитию фиброза печени, как описано в пункте 65, в которой флаваноидные соединения включают катехин, эпикатехин, эпиафзетехин, галлокатехин, галлоэпикатехин, эпигаллокатехин, галлаты, флавонолы, флавандиолы, лейкоцианидины или процинидины.
67. Фармацевтическая композиция для способствования обратному развитию фиброза печени, как описано в пункте 61, в которой мономерное звено проантоцианидина включает флаван-3-ол.
68. Фармацевтическая композиция для способствования обратному развитию фиброза печени, как описано в пункте 61, в которой проантоцианидин экстрагирован из растения.
69. Фармацевтическая композиция для способствования обратному развитию фиброза печени, как описано в пункте 68, в которой растение включает семейство вересковые (Ericaceae), семейство розовые (Rosaceae), семейство сосновые (Pinaceae), виноградовые (Vitaceae) или семейство крапивные (Urticaceae).
70. Фармацевтическая композиция для способствования обратному развитию фиброза печени, как описано в пункте 69, в которой растение семейства крапивные (Urticaceae) включает бомерию белоснежную Boehmeria nivea L. Gaud.
71. Применение фармацевтической композиции для замедления прогрессирования рака печени, улучшения функции печени, уменьшения фиброза печени, цирроза печени и воспаления печени, способствования регенерации поврежденной печени и/или обратному развитию фиброза печени, как описано по любому пункту 1-70.
72. Фармацевтическая композиция для замедления прогрессирования рака печени, улучшения функции печени, уменьшения фиброза печени, цирроза печени и воспаления печени, способствования регенерации поврежденной печени и/или обратному развитию фиброза печени, как описано по любому пункту 1-70.
Подробное описание представлено в следующих вариантах осуществления с обращением на сопровождающие чертежи.
Краткое описание чертежей
Изобретение может быть полностью понятно при прочтении нижеследующего подробного описания и примеров со ссылками, сделанными на сопровождающие чертежи, на которых:
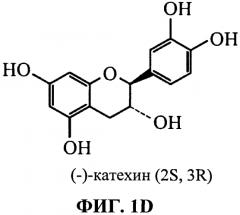
На ФИГ.1a-1f представлен 3-флаванол, 3,4-флаванол, катехин и эпикатехин;
На ФИГ.2a-2e представлены масс-спектры, полученные методом пиролитической газовой хроматографии - масс-спектрометрии, проантоцианидина после повторной очистки 95% этанольного проантоцианидин-содержащего экстракта бомерии белоснежной Boehmeria nivea L. Gaud.;
На ФИГ.3 представлен инфракрасный спектр поглощения проантоцианидина после повторной очистки 95% этанольного экстракта бомерии белоснежной Boehmeria nivea L. Gaud.;
На ФИГ.4a-4b представлены масс-спектры, полученные методом высокоэффективной жидкостной хроматографии (+/-), проантоцианидина после повторной очистки 95% этанольного экстракта бомерии белоснежной Boehmeria nivea L. Gaud.;
На ФИГ.5a-5c представлены спектры 13C ЯМР и 1H ЯМР проантоцианидина после повторной очистки 95% этанольного экстракта бомерии белоснежной Boehmeria nivea L. Gaud.;
На ФИГ.6a-6b, соответственно, показано связывание посредством C4-C8 связи и C4-C6 связи в соответствии с детектированными спектрами 1H ЯМР и 13C ЯМР, в изобретении мономерные звенья очищенного проантоцианидинового полимера связаны друг с другом, главным образом, посредством C4-C8 связи;
На ФИГ.7a-7c представлены масс-спектры, полученные методом времяпролетной масс-спектрометрии с лазерной ионизацией и десорбцией из жидкой матрицы (MALDI-TOF), проантоцианидина после повторной очистки 95% этанольного экстракта бомерии белоснежной Boehmeria nivea L. Gaud.;
На ФИГ.8 показан эффект фармацевтических композиций (BEL-X) на показатель выживаемости, в изобретении, трансгенных мышей с HCC, индуцированной геном X вируса гепатита B;
На ФИГ.9 показан эффект фармацевтических композиций (BEL-X) на HCC у трансгенных мышей с HCC, индуцированной геном X вируса гепатита B, в изобретении оцененный по соотношению масса печени/масса тела;
На ФИГ.10 показан эффект фармацевтических композиций (BEL-X) на функцию печени у трансгенных мышей с HCC, индуцированной геном X вируса гепатита B, в изобретении оцененный по показателю функции печени - аланинаминотрансферазы (ALT);
На ФИГ.11 показан эффект фармацевтических композиций (BEL-X) на функцию печени у трансгенных мышей с HCC, индуцированной геном X вируса гепатита B, в изобретении оцененный по показателю функции печени - аспартатаминотрансферазы (AST);
На ФИГ.12 показан эффект фармацевтических композиций (BEL-X) на фиброз печени, индуцированный химическим веществом DEN у крыс, в изобретении оцененный по содержанию гидроксипролина;
На ФИГ.13 показан эффект фармацевтических композиций (BEL-X) на фиброз печени, индуцированный химическим веществом DEN у крыс, в изобретении оцененный по области окрашивания α-SMA;
На ФИГ.14 показан эффект фармацевтических композиций (BEL-X) на фиброз печени, индуцированный химическим веществом DEN у крыс, в изобретении оцененный по содержанию гидроксипролина;
На ФИГ.15-16 показан эффект фармацевтических композиций (BEL-X) на показатель выживаемости у крыс с фиброзом печени/раком печени, в изобретении индуцированным химическим веществом DEN; и
На ФИГ.17 показан эффект фармацевтических композиций (BEL-X) на регенерацию печени у крыс с фиброзом печени, индуцированным химическим веществом DEN, в изобретении оцененный по коэффициенту регенерации объема печени.
Подробное описание изобретения
В последующем подробном описании, для целей пояснения, многочисленные конкретные детали изложены для того, чтобы предоставить исчерпывающее понимание раскрытых вариантов осуществления изобретения. Однако, может быть очевидно, что один или несколько вариантов могут быть осуществлены на практике без этих конкретных деталей. В других случаях широко известные структуры и устройства показаны схематически для того, чтобы облегчить описание чертежей.
Изобретение рассматривает проантоцианидин в качестве активного ингредиента фармацевтической композиции (BEL-X) с целью достижения замедления прогрессирования HCC, улучшения функций печени, уменьшения фиброза печени, цирроза печени и воспаления печени, и способствования регенерации поврежденной печени.
В изобретении проантоцианидин, обладающий эффектом по замедлению прогрессирования HCC, улучшению функций печени, уменьшению фиброза печени, цирроза печени и воспаления печени, и способствованию регенерации поврежденной печени, может быть экстрагирован из растения. В одном варианте используемое растение может включать семейство вересковые (Ericaceae), розовые (Rosaceae), сосновые (Pinaceae), виноградовые (Vitaceae) или крапивные (Urticaceae), предпочтительно бомерию белоснежную семейства крапивные (Urticaceae Boehmeria nivea L. Gaud.). Подлежащие экстрагированию части растения могут включать корни, стебли, листья и/или фрукты.
В изобретении экстрагирование из растения может быть проведено с использованием известных стандартных способов. В одном варианте высушенные корни, стебли, листья и/или фрукты растения режут или измельчают. Затем растение экстрагируют с использованием экстрагирующего раствора. В одном варианте для экстрагирования выбраны корни и/или стебли бомерии белоснежной Boehmeria nivea L. Gaud.
Экстрагирующий раствор может быть выбран из воды или раствора, состоящего из смеси воды и растворителей с полярностями, отличающимися от воды. К растворителям с отличающимися от воды полярностями относятся спирт, ацетон, метанол или этилацетат. Растворители могут использоваться отдельно, в смеси друг с другом или в смеси с водой. Соотношение экстрагирующего раствора и растения не имеет конкретного ограничения. В одном варианте соотношение экстрагирующего раствора и растения составляет 1:10 (масса/масса).
Во время экстракции температура экстракции может незначительно изменяться в зависимости от выбранного экстрагирующего раствора. В одном варианте растение может быть погружено в экстрагирующий раствор при комнатной температуре. В другом варианте экстрагирующий раствор может быть нагрет до его температуры кипения (60-100°C). Время экстракции составляет примерно от 2 часов до семи дней в зависимости от температуры экстракции. К тому же, в процессе экстракции в экстрагирующий раствор при необходимости может быть добавлен, например, хлорид натрия, разбавленная неорганическая кислота (например, разбавленная соляная кислота) или органическая кислота (например, витамин С или винная кислота) для регулирования величины pH экстрагирующего раствора.
Затем, экстракт, содержащий активный ингредиент проантоцианидин, концентрируют и сушат, или, в случае необходимости, проводят частичную или полную очистку экстракта. В одном варианте, в случае способа частичной очистки, высушенный экстракт повторно растворяют в 95% спирте и/или водном растворе метанола. Затем полученный раствор экстрагируют с использованием различных по полярности растворителей для частичного удаления примесей, например, с использованием аполярного растворителя (например, н-гексана) для удаления липидов и аполярных веществ, и затем с использованием трихлорметана и/или этилацетата для удаления низкомолекулярных фенольных соединений. Затем экстрагированную растворителем жидкую фазу концентрируют и сушат с получением частично очищенного проантоцианидина.
Способ полной очистки может включать следующие стадии. Частично очищенный экстракт растворяют в спирте или водном растворе метанола и помещают в колонку с молекулярными ситами. Затем выполняют элюирование с использованием различных растворов и/или смесей растворов для очистки и отделения проантоцианидина. В одном варианте порядок элюирования различными растворами является следующим: 95% спирт, 95% спирт/метанол (1:1, об/об), 50% метанол и 50% водный раствор ацетона. Растворы, которые были элюированы посредством каждого элюента, собирали в партии. Затем очищенный проантоцианидин в элюированном растворе детектировали с использованием жидкостной хроматографии (280 нм). Растворы проантоцианидина с различными молекулярно-массовыми распределениями могут быть получены путем сбора растворов, элюированных посредством различных элюентов. Затем элюированный раствор концентрировали при температуре ниже 40°C и сушили вымораживанием с получением очищенного проантоцианидина. В одном варианте колонка с молекулярными ситами, используемая для элюирования, представляет собой колонку Sephadex LH-20 (приобретенную у компании German Amersham Corporation).
В изобретении, мономерные звенья очищенного проантоцианидина имеют следующую формулу.
В одном варианте, когда R1 представляет собой OCH3, R2 представляет собой OH и R3 представляет собой H. В другом варианте, когда R1 представляет собой OH, R2 представляет собой H и R3 представляет собой H. В другом варианте, когда R1 представляет собой OH, R2 представляет собой ОН и R3 представляет собой H. В другом варианте, когда R1 представляет собой OH, R2 представляет собой OH и R3 представляет собой OH. В формуле R4 может представлять собой 3-(α)-OH, 3-(β)-OH, 3-(α)-O-сахар или 3-(β)-O-сахар.
Мономерные звенья проантоцианидина могут содержать R или S оптические изомеры при C2, C3 или C4.
Структура мономерных звеньев проантоцианидина может содержать флавоноидные соединения, например, катехин, эпикатехин, эпиафзетихин, галлокатехин, галлоэпикатехин, эпигаллокатехин, галлаты, флавонолы, флавандиолы, лейкоцианидины или процинидины. В одном варианте мономерные звенья проантоцианидина могут содержать флаван-3-ол или производные флавана.
В изобретении проантоцианидин имеет степень полимеризации, изменяющуюся от 2 до 30, предпочтительно от 3 до 20. Мономерные звенья проантоцианидина могут быть связаны друг с другом посредством C4-C8 связи, C4-С6 связи или C2-O7 связи. Проантоцианидин имеет среднюю молекулярную массу, изменяющуюся от 600 до 10000.
В одном варианте очищенный проантоцианидин может включать проантоцианидин с одной степенью полимеризации. В другом варианте очищенный проантоцианидин может включать смесь проантоцианидина с различными степенями полимеризации.
В изобретении экстрагированный проантоцианидин может быть приготовлен в форме фармацевтической композиции, предназначенной для замедления прогрессирования рака печени, улучшения функции печени, уменьшения фиброза печени, цирроза печени и воспаления печени, и способствования регенерации поврежденной печени, которая содержит проантоцианидин и фармацевтически приемлемый носитель или соль.
Фармацевтически приемлемый носитель может включать, но без ограничения, растворитель, дисперсионную среду, покрытие, антибактериальное средство, противогрибковое средство, изотонический агент, замедляющий поглощение агент, или фармацевтический компатибилизатор. Для различных способов введения фармацевтическая композиция может быть изготовлена в форме различных пригодных лекарственных форм с использованием известных способов.
Фармацевтически приемлемая соль может включать, но без ограничения, неорганические соли или органические соли. Неорганические соли могут включать, например, соли щелочных металлов, такие как соли натрия, соли калия или соли амина, соли щелочноземельных металлов, такие как соли магния или соли кальция, или соли двухвалентных или четырехвалентных катионов, такие как соли цинка, соли алюминия или соли циркония. Органические соли могут включать соли дициклогексиламина, соли метил-в-глюкамина или соли аминокислот, такие как соли аргинина, соли лизина, соли гистидина или соли глутамина.
В изобретении способы введения фармацевтической композиции (BEL-X) могут включать пероральное, непероральное введение, введение посредством ингаляции-распыления или посредством имплантированного резервуара. Непероральные способы включают подкожные, внутрикожные, внутривенные, внутримышечные, интраартикулярные, внутриартериальные, интрасиновиальные, интрастернальные, интратекальные или интралезиональные инъекции или методы перфузии.
Лекарственные формы для перорального введения могут включать, но без ограничения, таблетки, капсулы, эмульсии, водные суспензии, дисперсии или растворы.
В изобретении, после проведения экспериментальных испытаний было обнаружено, что фармацевтическая композиция (BEL-X) может применяться для лечения различных болезней печени, включая (1) рак печени, ассоциированный с хронической инфекцией, вызванной вирусом гепатита В или виру