Рекомбинантная псевдоаденовирусная частица, продуцирующая модифицированные наноантитела, узнающие микоплазму m.hominis, фармацевтическая композиция на ее основе и способ ее использования для терапии микоплазмозов
Иллюстрации
Показать всеНастоящее изобретение относится к области молекулярной иммунологии, биотехнологии и медицины. Создана рекомбинантная псевдоаденовирусная частица, на основе генома аденовируса человека 5 серотипа, содержащая экспрессирующую кассету со вставкой гена модифицированного химерного наноантитела, связывающегося с микоплазмой M. hominis, нуклеотидная последовательность которого предварительно модифицирована путем присоединения эффекторного Fc-фрагмента иммуноглобулина G. При этом предварительно модифицированной последовательностью гена наноантитела является нуклеотидная последовательность SEQ ID 1. Созданная рекомбинантная псевдоаденовирусная частица активирует систему комплемента иммунной системы млекопитающих. Фармацевтическая композиция представляет собой рекомбинантные псевдоаденовирусные частицы по заявленному изобретению и фармацевтически приемлемый носитель, причем при введении в организм млекопитающего она активирует систему комплемента и подавляет микоплазму M. hominis. Способ терапии микоплазмы M. hominis реализуют путем введения нуждающемуся в этом млекопитающему терапевтически эффективного количества созданной фармацевтической композиции. При этом фармацевтическую композицию вводят путем внутривенных инъекции. 3 н. и 2 з.п. ф-лы, 6 ил., 2 табл., 6 пр.
Реферат
Область техники настоящего изобретения
Настоящее изобретение относится к области молекулярной иммунологии, биотехнологии и медицины.
Предшествующий уровень техники настоящего изобретения
Микоплазмы являются факультативными мембранными паразитами. Они представляют собой одни из самых маленьких бактерий, лишенных ригидной клеточной стенки и окруженные одной трехслойной липопротеиновой мембраной. Человек является естественным хозяином, по крайней мере, 12 видов микоплазм (Тимаков В.Д., Каган Г.Я., 1973; Прозоровский С.В., Раковская И.В., Вульфович Ю.В., 1995). Многие из микоплазм человека считаются непатогенными и являются комменсалами (M. orale, M. facium, M. salivarium). Другие виды микоплазм: M. pneumoniae, M. fermentans, M. incognitus, M. penetrans - в полном соответствии с постулатами Коха патогенны для человека. Три вида из семейства Mycoplasmataceae способны колонизировать урогенитальный тракт: Mycoplasma hominis, Mycoplasma genitalium и Ureaplasma urealyticum. Состояние иммунной системы, физиологическое состояние, гормональный фон человека, а особенно наличие других сопутствующих инфекций может провоцировать развитие клинически выраженного патологического процесса, вызванного микоплазмами.
Урогенитальные микоплазмы относятся к условно-патогенным микроорганизмам, они участвуют во всех типах влагалищных микробиоценозов: нормальные представители микрофлоры урогенитального тракта, ассоцианты бактериального вагиноза, а при определенных условиях могут вызывать острые и хронические заболевания. Наиболее распространенным видом генитальных микоплазм человека является Mycoplasma hominis. Инфекция Mycoplasma hominis вызывает эндометриты, сальпингиты, послеабортную и послеродовую лихорадки, внутриутробную инфекцию, участвует в формировании бесплодия (Lee et al, Concordance of Ureaplasma urealyticum and Mycoplasma hominis in Infertile Couples: Impact on Semen Parameters. Urology, 2013 Jun; 81(6):1219-24. doi: 10.1016/j.urology.2013.02.044. Epub 2013Apr 18). Mycoplasma hominis может передаваться от матери к плоду и вызывать нарушения развития, выкидыши или недостаточный вес новорожденных. Кроме того, была показана ассоциация M. hominis с возникновением рака простаты у мужчин (Barykova et al, Association of Mycoplasma hominis infection with prostate cancer. Oncotarget. 2011 Apr; 2(4):271-3. PMID: 21508438).
Способность микоплазм паразитировать на мембране эукариотической клеток во много определяет патогенез вызываемых ими инфекций, который включает формирование местных воспалительных и генерализованных аутоиммунных заболеваний. Микоплазмы проникают в организм, мигрируя через слизистые оболочки, и прикрепляются к эпителию сначала посредством неспецифического, а затем лигандрецепторного взаимодействия через сиалогликопротеиновые рецепторы, а также связывания поверхностных белков с различными рецепторами. Микробы не проявляют выраженного цитопатогенного действия, но вызывают значительные нарушения функциональных свойств клеток с развитием местных воспалительных реакций. Взаимодействие с рецепторным аппаратом клеток может приводить к нарушению их антигенной структуры и запуску аутоиммунных процессов (Медицинская микробиология, вирусология и иммунология // Учебник под ред. Академика РАМН А.А. Воробьева - М.: МИА. - 2008. - 702 с.).
Развитие иммунного ответа направленного на элиминацию микоплазменной инфекции не сопровождается формированием специфической резистентности, поэтому для микоплазмы характерны случаи повторного заражения. При отсутствии специфических антител макрофаги не способны фагоцитировать микоплазму, что обусловлено наличием поверхностных антигенов, перекрестно реагирующих с антигенами некоторых тканей организма человека. Микоплазмы чувствительны к действию системы комплемента, дефицит компонентов которой или их дефекты создают условия для персистенции микоплазмы (Медицинская микробиология, вирусология и иммунология // Учебник под ред. Академика РАМН А.А. Воробьева - М.: МИА. - 2008. - 702 с.). Микоплазмы также обладают высокой антигенной изменчивостью и низкой иммуногенностью для человека, что позволяет им уходить от механизмов иммунной защиты организма, основанных на формировании специфических антител и последующих антител-опосредованных эффекторных механизмов, таких как:
1) непосредственная нейтрализация патогена, его токсинов и факторов вирулентности за счет опсонизации антителами таргетных антигенов;
2) антител-опосредованный фагоцитоз;
3) активация системы комплемента;
4) индукция специфических механизмов адаптивного иммунитета.
Лечение микоплазмозов, вызванных M. Hominis, проводят антибиотиками. Поскольку микоплазмы лишены клеточной стенки, то это ограничивает их восприимчивость к антимикробным агентам, вмешивающимся в синтез клеточной стенки бактерий (например, антибиотики пенициллинового ряда и цефалоспорины). Для лечения микоплазмоза назначают антибиотики из групп тетрациклинов, макролидов, фторхинолонов, линкозаминов и аминогликозидов.
Среди тетрациклинов препаратом выбора является антибиотик доксициклин. В отличие от тетрациклина он имеет лучшие фармакокинетические свойства и большую безопасность. К недостаткам антибиотика доксициклина следует отнести ограниченность его назначения: он не показан детям до 8 лет и беременным женщинам, так как обладает тератогенным действием.
Из макролидов препаратами выбора являются следующие антибиотики: джозамицин, мидекамицин, кларитромицин, азитромицин и эритромицин. Для джозамицина и мидекамицина характерны хорошая переносимость и отсутствие побочных эффектов. Кларитромицин и азитромицин, в отличие от эритромицина, устойчивы в кислой среде желудка, обладают высокой способностью к проникновению внутрь клеток. Макролиды I поколения (джозамицин, мидекамицин и эритомицин) могут быть назначены беременным женщинам даже в I триместре беременности. Макролиды II поколения (азитромицин, кларитромицин, рокситромицин) противопоказаны беременным.
Все виды микоплазм высокочувствительны к антибиотикам из группы фторхинолонов. Предпочтение отдается офлоксацину из-за его высокой бактерицидной активности и хорошим фармакокинетическим характеристикам. Как и в случае тетрациклинов, препараты этой группы антибиотиков нежелательны для лечения беременных.
В последние годы увеличивается процент штаммов микоплазм, резистентных к различным группам антибиотиков. Внутри различных групп антибиотиков резистентность к различным препаратам также различается (информационные данные отдела новых технологий ФБУН НИИ эпидемиологии и микробиологии имени Пастера). Эти данные свидетельствуют о снижении эффективности антибиотикотерапии микоплазмозов. Таким образом, существует потребность в создании и разработке новых подходов к лечению инфекций, вызванных M. hominis.
Одним из наиболее перспективных подходов лечения инфекционных заболеваний, наряду с антибиотикотерапией является пассивная иммунизация. Этот подход заключается во введении в организм специфических к антигенам патогена антител, которые способны индуцировать антител-опосредованные эффекторные механизмы иммунной защиты организма. Данный подход для лечения M. hominis реализован в препарате «Микоплазма-Иммун», выпускаемом ЧАО «БИОФАРМА» и используемым на территории Украины. Действующей основой препарата являются антитела, специфические к Mycoplasma hominis. Препарат содержит иммунологически активную белковую фракцию, выделенную из сыворотки или плазмы крови человека. Лечение проводят курсом внутримышечных инъекций, причем первая инъекция проводится в условиях лечебного стационара. Беременность не является противопоказанием для применения этого препарата, но он запрещен для введения лицам, страдающим аллергическими заболеваниями. Как и в случае с другими подобными препаратами основным недостатком является высокий риск аллергизации, в некоторых случаях наблюдается анафилактический шок. Кроме этого, помимо специфической активной субстанции, препарат содержит антитела иной специфичности.
В определенной степени преодолеть указанные недостатки существующих препаратов позволило бы использование очищенных препаратов рекомбинантных антител, полученных генно-инженерными подходами. В недавних научных исследованиях было показано, что такие модифицированные различными путями антитела имеют потенциал для терапии различных бактериальных инфекций, вызванных Bacillus anthracis (Ζ. Chen, M. Moayeri, R. Purcell, Toxins 3 (2011) 1004-1019), Clostridium botulinum (A. Nowakowski, C. Wang, D.B. Powers, P. Amersdorfer, T.J. Smith, V.A. Montgomery, R. Sheridan, R. Blake, L.A. Smith, J.D. Marks, Proc. Natl. Acad. Sci. USA 99 (2002) 11346-11350), C. Difficile (I. Lowy, D.C. Molrine, B.A. Leav, B.M. Blair, R. Baxter, D.N. Gerding, G. Nichol, W.D. Thomas Jr., M. Leney, S. Sloan, C.A. Hay, D.M. Ambrosino, N. Engl, J. Med. 362 (2010) 197-205), S. Aureus (G.P. Rigg, R.C. Matthews, M.S. Donohoe, C.M. Illidge, S.J. Hodgetts, P. Williamson, J.P. Burnie, Interscience Conference on Antimicrobial Agents and Chemotherapy, San Diego, Calif. (2002). Некоторые из этих антител сейчас проходят различные стадии клинических испытаний.
Особенно перспективным представляется получение и использование рекомбинантных однодоменных миниантител (далее наноантитела), полученных на основе антител животных семейства верблюдовых. Эти антитела представляют собой димер одной укороченной тяжелой цепи иммуноглобулина. Специфическое узнавание и связывание с антигеном обеспечивается одним вариабельных доменом таких антител. По сравнению с другими типами рекомбинантных антител и каноническими антителами, наноантитела обладают рядом преимуществ:
1) Наличие высокоэффективного способа генерирования и селекции наноантител.
2) Малый размер 13-15 кДа.
3) Структурные особенности, позволяющие связывать скрытые эпитопы антигенов.
4) Высокая растворимость и стабильность при хранении.
5) Простота генно-инженерных манипуляций.
6) Возможность высокоэффективного получения в различных про- и эукариотической системах экспрессии.
7) Низкая иммуногенность.
8) Высокая стабильность при введении в организм.
9) Высокая проницаемость в различные ткани организма.
Наноантитела и их производные могут использоваться как классические антитела во всех их приложениях, включающих, в том числе детекцию антигенов (в исследовательских и диагностических целях), а также для пассивной иммунизации и индукции разнообразных реакций за счет конъюгирования наноантител с различными эффекторными молекулами.
Так, было показано, что наноантитела, полученные против мембран-ассоциированного антигена M. hominis, способны в экспериментах in vivo (пассивная иммунизация мышей, больных микоплазмозом) снижать титр микоплазмы в вагинальных смывах (патент РФ №2484095; Логунов Д.Ю., Тиллиб С.В. НАНОАНТИТЕЛА aMh1, aMh2, СВЯЗЫВАЮЩИЕ АНТИГЕН MYCOPLASMA HOMINIS, СПОСОБ ИХ ПОЛУЧЕНИЯ, СПОСОБ ЛЕЧЕНИЯ ИНФЕКЦИИ, ВЫЗВАННОЙ MYCOPLASMA HOMINIS). Данное техническое решение, как наиболее близкое к заявляемому по составу действующего вещества, выбрано авторами настоящего изобретения за прототип.
Недостатками прототипа являются следующие:
- Наноантитела, используемые для достижения заявленного эффекта, не несут в своей структуре никаких эффекторных доменов, способных индуцировать специфические антимикробные защитные реакции организма. Подавление микоплазмы данными наноантителами основано на опсонизации патогена, в то время как собственные ресурсы иммунной системы организма не задействуются в элиминации микоплазмы.
- Наноантитела представляют собой белковую молекулу, которая под действием протеаз быстро деградирует в организме человека. Период полураспада чужеродного белка в организме в среднем составляет 2-3 часа. Это приводит к необходимости многократного введения препарата для достижения терапевтического эффекта.
- Для достижения заявленного эффекта используется метод введения - спринцевание раствором наноантител. С одной стороны, данный способ введения характеризуется низкой проницаемостью слизистой урогенитального тракта для антител, что влечет за собой необходимость использования высококонцентрированных препаратов, а, с другой стороны, нет данных о влиянии гормонального фона и прочих факторов на проницаемость слизистой в различные фазы менструального цикла и во время беременности. Также данный способ введения ограничивает терапевтический потенциал наноантител локализацией очага инфекции и не распространяет возможный терапевтический эффект на случаи генерализованного инфекционного процесса.
В настоящее время нет терапевтических препаратов против M. hominis, сочетающих в себе технологичность, универсальность, эффективность и безопасность. Актуальность и социальная значимость лечения бесплодия и урогенитальных инфекций, вызванных M. hominis, в том числе у беременных женщин, подтверждают высокую потребность в подобных препаратах.
Таким образом, в уровне техники существует острая потребность в разработке эффективной и универсальной фармацевтической композиции, служащей для терапии инфекций, вызванных M.hominis, что и явилось задачей настоящего изобретения.
Раскрытие настоящего изобретения
Техническая задача настоящего изобретения заключается в том, чтобы создать рекомбинантную псевдоаденовирусную частицу, продуцирующую модифицированные наноантитела, узнающие микоплазму M. hominis и активирующие систему комплемента, с обеспечением эффективной адресной доставки действующего вещества на слизистую оболочку генитального тракта и пролонгированного действия действующего вещества, а также фармацевтическую композицию на его основе и способ ее использования для терапии генитальных микоплазмозов путем внутривенного введения РПАН.
Указанная техническая задача решена за счет того, что создана рекомбинантная псевдоаденовирусная частица, на основе генома аденовируса человека 5 серотипа, содержащая экспрессирующую кассету со вставкой гена модифицированного химерного наноантитела, связывающегося с микоплазмой M. hominis, нуклеотидная последовательность которого предварительно модифицирована путем присоединения эффекторного Fc-фрагмента иммуноглобулина G. При этом предварительно модифицированной последовательностью гена наноантитела является нуклеотидная последовательность SEQ ID 1. Созданная рекомбинантная псевдоаденовирусная частица активирует систему комплемента иммунной системы млекопитающих. Фармацевтическая композиция представляет собой рекомбинантные псевдоаденовирусные частицы по заявленному изобретению и фармацевтически приемлемый носитель, причем при введении в организм млекопитающего она активирует систему комплемента и подавляет микоплазму М. hominis. Способ терапии микоплазмы М. hominis реализуют путем введения нуждающемуся в этом млекопитающему терапевтически эффективного количества созданной фармацевтической композиции. При этом фармацевтическую композицию вводят путем внутривенных инъекции.
С целью повышения терапевтического потенциала действующего вещества в рамках указанной выше задачи настоящего изобретения по приданию ему иммуностимулирующих функций, наноантитело модифицируют путем присоединения к нему эффекторного Fc-фрагмента иммуноглобулина G, который способен индуцировать эндогенные специфические механизмы иммунной защиты от патогена - систему комплемента, таким образом получается химерное наноантитело. Указанная выше задача настоящего изобретения по достижению длительного присутствия в организме действующего вещества решается за счет того, что разработку препарата проводили с использованием в качестве носителя для действующего вещества (химерного наноантитела) рекомбинантной псевдоаденовирусной наночастицы (РПАН), продуцирующей химерное наноантитело. Также, для решения указанной выше задачи эффективной доставки действующего вещества на слизистую оболочку урогенитального тракта, было использовано свойство Fc-фрагмента иммуноглобулина G обеспечивать направленный транспорт этих молекул на слизистую оболочку генитального тракта.
Именно Fc-фрагмент иммуноглобулина G обеспечивает поступление химерных наноантител из системного кровотока в очаг урогенитальной инфекции M. hominis, что открывает возможность системного (внутривенного) введения РПАН для лечения микоплазмозов, тогда как наноантитела, в частности наноантитела, взятые в качестве прототипа настоящего изобретения, могут использоваться только путем местного введения в очаг инфекции, то есть путем внутривагинального спринцевания.
Таким образом, в заявленном изобретении использована РПАН, созданная на основе аденовируса пятого серотипа, экспрессирующего химерный ген наноантитела (SEQ ID1), состоящий из собственно наноантитела (SEQ ID1 nb) и Fc-фрагмента иммуноглобулина G (SEQ ID1 Fc), находящихся в одной рамке считывания. Ген химерного наноантитела имеет нуклеотидную последовательность SEQ ID1, состоящую из двух нуклеотидных последовательностей, находящихся в одной рамке считывания: SEQ ID1 nb и SEQ ID1 Fc. Эти нуклеотидные последовательности кодируют две функциональные части химерного наноантитела: наноантитело и Fc-фрагмент иммуноглобулина G соответственно. Получающийся в результате экспрессии этого гена полипептид имеет аминокислотную последовательность SEQ ID2, состоящую из двух функциональных частей: наноантитело и Fc-фрагмент иммуноглобулина G, аминокислотные последовательности которых соответственно SEQ ID2 nb и SEQ ID2 Fc.
Пролонгированная продукция в организме химерных наноантител достигается за счет использования РПАН, вводимых внутривенно. Совокупность использованных подходов обеспечивает эффективное лечение урогенитальных микоплазмозов, вызванных M. hominis, с использованием данного изобретения.
Таким образом действующее вещество данного изобретения, то есть химерное наноантитело, представляет собой химерный белок, обладающий свойствами как специфического наноантитела, так и иммуностимулирующими свойствами Fc-фрагмента канонических антител. Как специфическое наноантитело действующее вещество связывается с микоплазмой M. hominis, а за счет свойств Fc-фрагмента действующее вещество активирует систему иммунологического комплемента, за счет которой происходит убийство микоплазмы. Более того, Fc-фрагмент обеспечивает направленный транспорт химерных наноантител на слизистую оболочку генитального тракта. Для того чтобы обеспечить длительное присутствие действующего вещества в организме, в качестве вектора-носителя используют РПАН.
Реализация изобретения осуществляется следующим образом.
1) Конструирование химерного гена наноантитела, состоящего из собственно наноантитела и Fc-фрагмента иммуноглобулина G, находящихся в одной рамке считывания.
Предлагаемое техническое решение предусматривает повышение терапевтического потенциала за счет модификации наноантитела путем присоединения к нему Fc-фрагмента иммуноглобулина G, таким образом, чтобы они находились в одной рамке считывания (единая рамка считывания обеспечивает продукцию единого белкового продукта, кодируемого заданными нуклеотидными последовательностями). При связывании наноантитела с поверхностью патогенного микроорганизма - микоплазмы M. hominis, Fc-фрагмент служит сигналом для запуска активации системы комплемента. Fc-фрагмент иммуноглобулина G обладает способностью активировать систему комплемента по так называемому классическому пути, что приводит к иммуностимуляции организма и элиминации патогена с участием собственных иммунных механизмов хозяина.
Комплемент представляет собой порядка 16 белков, составляющих около 10% всех белков сыворотки крови. Помимо сыворотки крови белки системы комплемента представлены в различных тканевых жидкостях организма и мукозальных слизях. Система комплемента представляет собой один из важнейших факторов иммунной защиты организма и осуществляет:
- запуск и усиление воспалительных реакций,
- привлечение фагоцитов путем хемотаксиса,
- выведение иммунных комплексов,
- клеточную активацию,
- прямой киллинг (убийство) микроорганизмов,
- участие в продукции антител.
Классический путь активации комплемента инициируется антителами, связанными с поверхностью клеток-мишеней. Активация комплемента приводит к каскаду ряда протеолитических реакций, в результате которых в мембране клетки мишени собирается мембраноатакующий комплекс (МАК), происходит неферментативный разрыв мембраны и гибель клетки-мишени. Помимо этого в процессе сборки МАК происходит выделение хемотаксических и провоспалительных молекул, которые стимулируют механизмы врожденной иммунной защиты организма. Необходимым условием для запуска описанных механизмов является наличие в составе антитела Fc-домена. Наноантитела обладают способностью связываться со специфическими антигенами, но в их структуре отсутствует эффекторный Fc-фрагмент, который запускает процесс активации комплемента. Таким образом, действующее вещество, взятое за прототип данного изобретения, не обладает иммуностимулирующими свойствами, а механизм анти-микоплазменного действия может объясняться только общей опсонизацией патогена, без направленного антибактериального действия.
Возможности придания иммуностимулирующих свойств различным белкам, путем присоединения к ним Fc-фрагментов иммуноглобулинов, сейчас активно исследуются в соответствующих областях медицины и биотехнологии (Daniel M Czajkowsky, Jun Hu, Zhifeng Shao, and Richard J Pleass. Fc-fusion proteins: new developments and future perspectives. EMBO Mol Med. 2012 October; 4(10): 1015-1028).
Из описанного выше следует, что связывание наноантител, взятых за прототип настоящего изобретения, с поверхностными структурами микоплазмы не активирует комплемент-зависимый киллинг патогена и не активирует врожденный иммунитет хозяина, так как в их составе отсутствует Fc-фрагмент иммуноглобулина.
Для решения задачи по достижению увеличения терапевтического потенциала действующего вещества данного изобретения методами генной инженерии было сконструировано химерное наноантитело, состоящее из собственно наноантитела, связывающегося с микоплазмой M. hominis, и Fc-фрагмента иммуноглобулина G. Последовательность специфического к микоплазме наноантитела была получена с использованием тех же процедур, что были использованы для получения прототипа настоящего изобретения, а последовательность Fc-фрагмента иммуноглобулина G была получена путем биоинформатического поиска в соответствующих базах данных. Эти две последовательности были использованы для конструирования химерного наноантитела, обладающего свойствами наноантитела и распознаваемое как иммуноглобулин класса G, что описано в примере 1.
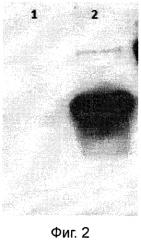
Таким образом, действующее вещество настоящего изобретения представляет собой химерный белок, состоящий из собственно специфического наноантитела, которое связывается с микоплазмой M. hominis, и Fc-фрагмента иммуноглобулина G, за счет которого такое химерное наноантитело приобретает эффекторные функции, обусловленные Fc-зависимой активацией системы комплемента. Успешность данного технического решения поставленной задачи активации системы комплимента продемонстрирована в примере 2.
2) Для достижения длительного присутствия в организме действующего вещества предлагаемое техническое решение предусматривает использование в качестве носителя для действующего вещества рекомбинантной псевдоаденовирусной наночастицы (далее РПАН). РПАН - это природная, биосовместимая наноструктура, созданная на основе аденовируса. Геном РПАН представлен двуцепочечной ДНК, в которой присутствуют все гены, необходимые для сборки вирусоподобной частицы, ее проникновения в клетку хозяина и экспрессии генов, однако отсутствуют гены, детерминирующие репликацию вирусных частиц и последующие инфекционные механизмы. Таким образом, РПАН представляют собой репликативно-дефектные вирусные частицы, которые способны к инвазии в организм хозяина, однако не обладают инфекционными свойствами. РПАН широко используют в качестве вектора-носителя в генной терапии различных заболеваний. При этом в состав ДНК РПАН осуществляют вставку чужеродного гена (трансгена), который в настоящем изобретении представляет собой ген химерного наноантитела против M. hominis с нуклеотидной последовательностью SEQ ID1 (см. фиг. №5). Успешное создание таких РПАН продемонстрировано в примере 1. При введении в организм, за счет вирусных механизмов инвазии, РПАН проникают в различные типы клеток различных тканей, где осуществляют экспрессию (продукцию) генов, в том числе и введенного в геном РПАН трансгена, то есть в настоящем изобретении РПАН обеспечивает продукцию химерного наноантитела, имеющего аминокислотную последовательность SEQ ID2 (см. фиг. №6).
В отличие от белковых препаратов наноантител, период выведения которых из организма составляет обычно от нескольких десятков минут до нескольких часов, РПАН обеспечивают транзиторную продукцию в течение нескольких дней и даже недель. Присутствие продуцируемого РПАН, значительного количества химерных наноантител в сыворотке крови через 2 дня после введения препарата РПАН продемонстрировано в примере 3.
Наряду с вышеперечисленным, РПАН отличаются высокой эффективностью экспрессии целевого гена в различных типах клеток и безопасностью для человека и животных, подтвержденной в многочисленных клинических испытаниях. В качестве носителя используют РПАН, полученные на основе рекомбинантного аденовируса человека 5-го серотипа. Такие РПАН получили наибольшее распространение в качестве векторов для генной терапии, поскольку аденовирус 5-го серотипа признан наиболее безопасным среди более чем 50 известных серотипов аденовирусов. В настоящее время на основе РПАН разрабатываются генно-инженерные препараты против различных бактериальных (туляремия, туберкулез, бруцеллез и др.) и вирусных (вирус иммунодефицита человека, папилломавирус человека, вирус бешенства, вирус Эбола и др.) патогенов человека (Wang J., Thorson L., Stokes R.W., Santosuosso M., Huygen K., Zganiacz Α., Hitt M., Xing Z. Single mucosal, but not parenteral, immunization with recombinant adenoviral-based vaccine provides potent protection from pulmonary tuberculosis. J. Immunol. 2004 Nov 15; 173(10):6357-65; Richardson J.S., Yao M.K., Tran K.N., Croyle M.A., Strong J.E., Feldmann H., KobingerG.P. Enhanced protection against Ebola virus mediated by an improved adenoviras-based vaccine. PLoS One. 2009; 4(4):e5308. Epub 2009 Apr 23; Li W.H., Zhang Y., Wang S.H., Liu L., Yang F. Recombinant replicationdefective adenovirus based rabies vaccine. Zhongguo Yi Xue Ke Xue Yuan Xue Bao. 2003 Dec; 25(6):650-4; Lees C.Y., Briggs D.J., Wu X., Davis R.D., Moore S.M., Gordon C, Xiang Z., Ertl H.C., Tang D.C., Fu Z.F. Induction of protective immunity by topic application of a recombinant adenovirus expressing rabies virus glycoprotein. Vet Microbiol. 2002 Apr 2; 85(4):295-303).
Таким образом, использование РПАН в качестве носителя для действующего вещества заявляемой композиции позволяет доставлять в организм ген химерного наноантитела и осуществлять эффективную продукцию белка, кодируемого этим геном, что, в свою очередь, обеспечивает продление периода циркуляции значительного количества химерных наноантител в организме до нескольких дней и недель, в отличие от использования белковых препаратов наноантител. Успешность данного технического решения для обеспечения длительного присутствия химерных наноантител в организме продемонстрирована в примере 3.
РПАН эффективны и безопасны в качестве носителей для доставки гена наноантитела в различные типы клеток и тканей, что открывает возможности для различных способов формуляции препаратов и путей их введения в организм. РПАН относительно стабильны и могут быть представлены в виде лиофилизованых препаратов, могут храниться при 4°С длительное время без потери активности. Технологии получения рекомбинантных РПАН в промышленных масштабах являются экономически оправданными и позволяют получать препараты РПАН с высоким титром (R. Harrop, et al., Advanced Drug Delivery Reviews, V.58, 1.8, 2006, P.931-947). Исходя из вышесказанного РПАН, продуцирующие химерные наноантитела, помимо свойств, направленных на решение задач настоящего изобретения, потенциально обладают рядом уникальных свойств.
Создание фармацевтической композиции, пригодной для внутривенного введения лабораторным животным, на основе вышеописанных РПАН представлено в примере 4.
3) Для обеспечения доставки действующего вещества на слизистую оболочку урогенитального тракта предлагаемое техническое решение предусматривает модификацию наноантитела путем присоединения к нему Fc-фрагмента иммуноглобулина G. Действующее вещество заявляемой фармацевтической композиции, то есть химерное наноантитело специфичное к поверхностному антигену M. hominis, направлено преимущественно на терапию урогенитальных микоплазмозов, вызванных M. hominis. Основным местом локализации инфекции M. hominis является слизистая оболочка урогенитального тракта. Показано, что для данного типа слизистой характерно присутствие в тканевой жидкости и слизи иммуноглобулинов класса G (в отличие от слизистой дыхательных путей, где преобладают иммуноглобулины класса А).
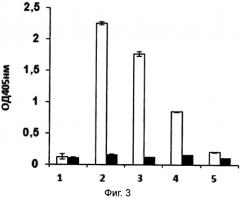
Иммуноглобулины поступают на слизистую генитального тракта из системной циркуляции за счет рецептор-опосредованного направленного транспорта через многослойный эпителий. Доказано, что именно Fc-фрагмент иммуноглобулина G обуславливает этот механизм транспорта (Li Ζ, Palaniyandi S, Zeng R, Tuo W, Roopenian DC, Zhu X. Transfer of IgG in the female genital tract by МНС class l-related neonatal Fc receptor (FcRn) confers protective immunity to vaginal infection. Proc Natl Acad Sci USA. 2011 Mar 15; 108(11):4388-93. doi: 10.1073/pnas.1012861108. Epub 2011 Feb 28). Таким образом, присоединение к наноантителу Fc-фрагмента иммуноглобулина G обеспечивает адресную доставку действующего терапевтического вещества (химерного наноантитела специфичного к поверхностному антигену M. hominis) на слизистую оболочку генитального тракта из системного кровотока, то есть к месту локализации микоплазменной инфекции. Данное техническое решение позволяет за счет адресной доставки к месту локализации инфекции вводить РПАН, продуцирующие химерные наноантитела в системную циркуляцию, в частности внутривенно. Успешность данного технического решения в рамках поставленной задачи адресной доставки действующего вещества на слизистую оболочку генитального тракта демонстрируется в примере 5.
Успешность технических решений в рамках поставленных задач и применимость данного изобретения для лечения урогенитальной инфекции, вызванной M. hominis, продемонстрирована в примере 6.
Настоящее изобретение объединяет в себе преимущества различных упомянутых подходов и относится к области молекулярной иммунологии, биотехнологии и медицины.
Таким образом, действующее вещество данного изобретения, то есть химерное наноантитело, представляет собой химерный белок, обладающий свойствами как специфического наноантитела, так и иммуностимулирующими свойствами Fc-фрагмента канонических антител. Как специфическое наноантитело действующее вещество связывается с микоплазмой M. hominis, а за счет свойств Fc-фрагмента действующее вещество активирует систему иммунологического комплемента, за счет которой происходит убийство микоплазмы. Более того, Fc-фрагмент обеспечивает направленный транспорт химерных наноантител на слизистую оболочку генитального тракта. Для того чтобы обеспечить длительное присутствие действующего вещества в организме, в качестве вектора-носителя используют РПАН. Заявляемая фармацевтическая композиция представляет собой рекомбинантную псевдоаденовирусную наночастицу (РПАН), несущую в геноме химерный ген наноантитела, состоящий из нуклеотидной последовательности, кодирующей собственно наноантитело, специфичное к поверхностному антигену M. hominis, и нуклеотидной последовательности, кодирующей Fc-фрагмент иммуноглобулина G. Обе нуклеотидные последовательности расположены в одной рамке считывания, что обеспечивает такими РПАН продукцию химерных наноантител, которые и являются действующим веществом заявляемой фармацевтической композиции. Помимо РПАН в состав фармацевтической композиции входит фармацевтически приемлемый носитель, состоящий, например, из фосфатно-солевого буферного раствора по рецепту Дульбекко и 100 мкМ ЭДТА.
Настоящее изобретение относится к фармацевтической композиции для терапии микоплазмозов и представляет собой суспензию, состоящую из описанных выше РПАН в фармацевтически приемлемом растворителе или наполнителе. В соответствии с одним из предпочтительных вариантов осуществления данного изобретения заявленную фармацевтическую композицию вводят внутривенно в терапевтически эффективном количестве.
Термин «фармацевтически приемлемый» для целей настоящего изобретения означает, что растворитель или наполнитель не оказывает каких-либо неблагоприятных действий на пациентов, которым его вводят. Такие растворители и наполнители хорошо известны из предшествующего уровня техники (U.S Department of Health and Human Services Food and Drug Administration Center for Drug Evaluation and Research Office of Compliance, Immediate Office Electronic Drug Registration and Listing Team. National Drug Code Directory; Approved Drug Products with Therapeutic Equivalence Evaluations, 25th edition, FDA, 2005).
Применение такой фармацевтической композиции позволяет добиться транзиторной экспрессии у пациента химерных наноантител, которые за счет своих уникальных свойств, подробно описанных выше, способны обеспечивать элиминацию патогенной микоплазмы из организма. Среднему специалисту в данной области техники будет понятно, что применение такой фармацевтической композиции эффективно для лечения инфекционных заболеваний, вызванных M. hominis.
Термин «лечение» для целей настоящего изобретения использован для обозначения нанесения на участок тела пациента или введение в его организм лекарственного средства по любым показаниям. Термин «терапевтически эффективное количество» означает такое количество РПАН, которое обеспечивает необходимый терапевтический эффект, то есть проявление анти-микоплазменной активности. В термин «терапевтически эффективное количество» входит понятие о единичной дозе лекарственного средства, использованного в ходе лечения в течение времени, требуемого для достижения терапевтического эффекта.
Авторы настоящего изобретения исходят из того, что, как известно среднему специалисту в данной области техники, первичные, исходно получаемые последовательности наноантител могут быть затем адаптированы или «форматированы» различным образом для последующего практического использования. Таким образом, авторы настоящего изобретения понимают под термином "химерные наноантитела" как первичные, исходно получаемые, "минимальные" аминокислотные последовательности наноантител с Fc-фрагментом иммуноглобулина G, так и их модификации, полученные в результате адаптаций или «форматирования» и их варианты.
Термин «вариант химерного наноантитела» для целей настоящего изобретения означает полипептид, который содержит изменения в аминокислотной последовательности, а именно делеции, вставки, добавления или замены аминокислот, при условии, что при этом сохраняется необходимый уровень активности белка, например, как минимум 10% от активности исходного химерного наноантитела. Ряд изменений в варианте белка зависит от положения или от типа аминокислотного остатка в трехмерной структуре белка. Количество изменений может составлять, например, от 1 до 30, более предпочтительно, от 1 до 15, и наиболее предпочтительно, от 1 до 5 изменений в последовательности исходного наноантитела с Fc-фрагментом иммуноглобулина G. Эти изменения могут иметь место в областях полипептида, которые не являются критичными для его функции. Это становится возможным благодаря тому, что некоторые аминокислоты обладают высокой гомологией друг с другом, и поэтому третичная структура или активность белка не нарушаются при таком изменении. Поэтому в качестве варианта белка может выступать белок, который характеризуется гомологией не менее 70%, предпочтительно, не менее 80%, более предпочтительно, не менее 90%, и наиболее предпочтительно, не менее 95% по отношению к аминокислотной последовательности исходного наноантитела с Fc-фрагментом иммуноглобулина G при условии сохранения активности полипептида. Гомология между аминокислотными последовательностями может быть установлена с использованием хорошо известных методов, например с помощью сравнения последовательностей в компьютерной программе BLAST.
Замена, делеция, вставка, добавление или замена одного или нескольких аминокислотных остатков будут представлять собой консервативную мутацию или консервативные мутации при условии, что активность белка при этом сохраняется. Примером консервативной мутации(ий) является консервативная замена(ы). "Консервативная аминокислотная замена" представляет собой замену, при которой аминокислотный остаток заменяется аминокислотным остатком, имеющим сходную боковую цепь. В данной области техники определены семейства аминокислот, имеющих сходные боковые цепи. Эти с