Штамм культивируемых клеток cho-il7/13 - продуцент интерлейкина-7 человека
Иллюстрации
Показать всеИзобретение относится к биотехнологии и касается штамма клеток CHO-IL7/13. Охарактеризованный штамм получен трансфекцией клеток CHOdhfr плазмидой pIPvES-DHFR/IL7, содержащей ген интерлейкина-7 человека. Плазмида pIPvES-DHFR/IL7 была синтезирована амплифицированием кДНК интерлейкина-7 человека с помощью праймеров: ecoIL CCTGAATTCCACCATGTTCCATGTTTCTTTTAG, содержащего сайт рестрикции EcoRI и последовательность Козак, и bamIL CCAGGATCCTCAGTGTTCTTTAGTGCCCATC, содержащего сайт рестрикции BamHI, с последующим клонированием по данным сайтам рестрикции в вектор pIRES-DHFR. Предложенный штамм обладает более высокой продуцирующей способностью рекомбинантного интерлейкина-7 человека и может быть использован для лечения ряда патологических состояний, связанных с низким содержанием В- и Т-лимфоцитов. 4 ил., 3 пр.
Реферат
Изобретение относится к биотехнологии, в частности к технологии получения рекомбинантного интерлейкина-7 человека.
Интерлейкин-7 (ИЛ-7) представляет собой цитокин, стимулирующий пролиферацию В- и Т-лимфоцитов и их предшественников. Утрата организмом гена ИЛ-7 (нокаут) вызывает опустошение тимуса, тотальную лимфопению, тяжелый иммунодефицит, снижение интенсивности (в 7-10 раз) ответа иммунокомпетентных клеток на действие стимуляторов. При этом полностью блокируется процесс формирования гамма/дельта Т-лимфоцитов, ослабляется процесс образования альфа/бета Т-клеток. При избытке ИЛ-7 уровень В- и Т-лимфоцитов в крови повышен.
Предполагается, что ИЛ-7 можно будет успешно использовать для лечения ряда патологических состояний, связанных с низким содержанием В- и Т-лимфоцитов, в частности:
- для восстановления содержания Т-клеток, главным образом CD4+, в сочетании с высокоактивной антиретровирусной терапией ВИЧ-инфицированных;
- для лечения лимфопении, связанной с применением цитостатиков и радиационной терапии при лечении онкологических заболеваний;
- для терапии онкологических заболеваний в сочетании с локальной гипертермией;
- для регенерации Т-клеток после пересадки гематопоэтических стволовых клеток.
Молекула интерлейкина-7 представляет собой гликозилированную полипептидную цепь длиной 152 аминокислотных остатка. В молекуле присутствуют 6 остатков цистеина, образующих три дисульфидных мостика, а также три сайта N-гликозилирования и один сайт O-гликозилирования. Секрецию синтезированного белка направляет сигнальная последовательность, содержащая 25 аминокислотных остатков [ru.wikipedia.org/wiki/Интерлейкин_7; Кетлинский С.А., Симбирцев А.С. Цитокины. С.-Пб., 2008].
Для получения ИЛ-7 используются рекомбинантные клетки бактерий, дрожжей, высших эукариот, трансформированные соответствующими векторами, экспрессирующими ИЛ-7 человека. Однако в клетках бактерий синтезируется негликозилированная форма ИЛ-7, отличающаяся нестабильностью при введении in vivo по сравнению с нативной (гликозилированной) формой. ИЛ-7, синтезированный в клетках дрожжей, содержит углеводные цепи, отличающиеся от углеводных цепей нативного белка, что приводит к изменению его антигенных свойств.
Наиболее перспективными продуцентами ИЛ-7 человека для использования в качестве лекарственного средства могут служить рекомбинантные культивируемые клетки высших эукариот, в частности клетки BHK, COS, CHO, РУЛ-293, в которых обеспечиваются синтез, гликозилирование, фолдирование, отщепление сигнальной последовательности и секреция в среду культивирования белков, идентичных нативным белкам человека. В частности, описан синтез ИЛ-7 человека в ряде культивируемых клеток млекопитающих (WO 2004018681, WO 8903884). В результате были получены клетки HEK-293, COS-7, BHK, синтезировавшие ИЛ-7 человека при культивировании в течение 10 дней. Идентичность полученных продуктов интерлейкину-7 человека была установлена, однако не приведены какие-либо данные о продуктивности полученных клеток-продуцентов.
Наиболее близким по технической сущности к заявляемому изобретению является технология, описанная в патенте WO 2004018681, где описывается получение ИЛ-7 продуцированном клеток яичников китайского хомячка (CHO), HEK-293. Недостатком данной технологии является относительно невысокий выход ИЛ-7.
Задачей, стоявшей перед авторами, являлось расширение диапазона штаммов-продуцентов с целью создания более высокопроизводительных клеточных линий -продуцентов ИЛ-7 человека.
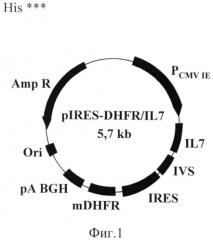
Данная задача решена тем, что предложен штамм культивируемых клеток овариев китайского хомячка CHO-IL 7/13, стабильно экспрессирующий высокоактивный рекомбинантный интерлейкин-7 (ИЛ-7) человека, полученный трансфекцией клеток CHOdhfr плазмидой pIRES-DHFR/IL7, содержащей ген ИЛ-7 человека, схема которой приведена на фиг. 1. Штамм характеризуется следующими свойствами.
Морфологические признаки: Клетки правильной округлой формы, одиночные или сгруппированные в кластеры.
Культуральные признаки: Тип роста - суспензионный.
Устойчивость к селективным факторам: Растет на среде с 500 нг/мл метатрексата.
Криоконсервация. Среда для криоконсервации - 90% фетальной сыворотки и 10% диметилсульфоксида. Температура хранения -196°C (жидкий азот).
Контаминация. Клетки штамма CHO-IL7/13 свободны от микоплазмы.
Родословная штамма: Родительская клеточная линия CHOdhfr-. Трансфекция плазмидой pIRES-DHFP/IL7, отбор стабильного высокопродуктивного клона на среде без гипоксантина/тимидина с увеличением концентрации метотрексата.
Стандартные условия выращивания: Среда PF-CHO LS без гипоксантина/тимидина с 4 нМ глутамина, 500 нМ метатрексата, 37°C, 5% CO2.
Культуральные свойства: Суспензионное культивирование в пробирках, колбах или 6-луночных платах на орбитальном шейкере с частотой вращения 150-180 об/мин. Посевная доза 0,3-0,5×106/мл, пересев каждые 3-4 суток. Время удвоения 22-24 часа.
Данные по видовой принадлежности: Cricetulus griseus (ПЦР-анализ с видоспецифичными праймерами).
Характеристики полезного вещества, продуцируемого штаммом: рекомбинантный интерлейкин-7 человека (оценка с помощью твердофазного иммуно-ферментного анализа, вестерн-блота, биологического теста).
Характеристика биосинтеза полезных продуктов (выход продукта в среду, уровень активности и способ ее определения): Рекомбинантный интерлейкин-7 человека секретируется в культуральную среду в концентрации не менее 10 мкг/мл за 4 суток. Стабильность культивирования - 15 пассажей. Метод определения активности - Conlon P.J. et al. Murine thymocytes proliferate in direct response to interleukin-7 // Blood. - 1989. - V.74(4). - P.1368-73.
Способ криоконсервирования: фетальная сыворотка с 10% DMSO, заморозка до -70°C со скоростью 1°C/мин, далее помещение в жидкий азот, жизнеспособность после размораживания и отмывки от криоконсерванта 85% (с трипановым синим).
Другие особенности штамма: Возможно культивирование клеток в среде DMEM/F12 с 10% фетальной сыворотки (адгезионный тип роста) без дополнительной адаптации.
Сущность изобретения иллюстрируется следующими рисунками. Фиг.1 - Карта экспрессионной плазмиды pIRES-DHFR/IL
Кольцевая схема плазмиды pIRES-DHFR/IL7, где используются следующие обозначения: Amp R - ген бета-лактамазы: Р CMV IE - промотор предранних белков цитомегаловируса; IL7 - ген интерлейкина-7 человека; IVS - синтетический интрон; mDHFR - модифицированный ген дигидрофолятредуктазы; pA BGH - сигнал полиаденилирования и терминации транскрипции гена гормона роста быка; Ori - бактериальный репликатор.
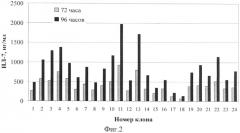
Фиг 2. Результаты скрининга продукции 24 кандидатных клонов CHO-L7 через 72 и 96 часов после начала культивирования.
Фиг.3 - Связывание белков среды культивирования клеток pIRES-DHFR/IL7 с антителом к интерлейкину-7 человека в иммуноблоте.
1 - Среда культивирования клеток клона 11, 10 мкл
2 - Среда культивирования клеток клона 13, 10 мкл
3 - Образец экспрессированного в клетках E.coli (негликозилированного) ИЛ-7 человека (R&D Systems, кат. №207-IL-005/CF) - 1 мкл
4 - Маркеры молекулярного веса.
Фиг.4. Определение биологической активности ИЛ-7, секретируемого клетками клона 7/13.
Список последовательностей Seq ID No 1 - ДНК, кодирующая интерлейкин-7 человека (Приложение)
Изобретение поясняется следующими примерами:
Пример 1. Выделение кДНК интерлейкина-7 человека и получение экспрессионной плазмиды. Для получения кДНК ИЛ-7 человека использовали препарат кДНК на матрице РНК из аденокарциномы матки человека. Далее кДНК ИЛ-7 человека амплифицировали с помощью праймеров
IL7-for (5′-TGCTCCAGTTGCGGTCATCATGACTA-3′) и
IL7-rev (5′-CTGCATAAGCAGATAGATTCTTGGAGGATGC-3′),
параметры амплификации: 95°C × 5 мин; 35 циклов: 95°C × 15 сек, 55°C × 15 сек, 72°C × 20 сек и дополнительный цикл достройки 2 мин × 72°C. Продукт амплификации длиной 649 пар нуклеотидов очищали электрофорезом в 2% агарозном геле и клонировали в вектор pCD2.1 (Invitrogen). Плазмидные ДНК из нескольких клонов были выделены и просеквенированы в двух направлениях с помощью вышеприведенных праймеров. Сравнение последовательности вставки, содержащейся в одной из полученных плазмид, pCR2.1-IL7-5, с референсной последовательностью варианта 1 кДНК ИЛ-7 человека, аннотированной в GenBank (NM_000880.3), показало их полную идентичность (Seq ID No 1.).
Для создания экспрессионной плазмиды последовательность кДНК ИЛ-7 амплифицировали с помощью праймеров ecoIL (CCTGAATTCCACCATGTTCCATGTTTCTTTTAG), содержащего сайт рестрикции EcoRI и последовательность Козак, и bamIL (CCAGGATCCTCAGTGTTCTTTAGTGCCCATC), содержащего сайт рестрикции BamHI, и клонировали по данным сайтам рестрикции в вектор pIRES-DHFR с получением экспрессионной плазмиды pIRES-DHFR/IL7. Схема плазмиды pIRES-DHFR/IL7 представлена на Фиг.1.
Пример 2. Получение штамма культивируемых клеток-продуцента ИЛ-7 человека. Экспрессионную плазмиду pIRES-DHFR/IL7 переводили в линейную форму обработкой рестриктазой PvuI. Клетки CHOdhfr-, адаптированные к суспензионному росту, культивировали в среде PF-CHO LS (HyClone) с 4 мМ глутамина, 50 Ед/мл пенициллина, 50 мкг/мл стрептомицина, 0,1 мМ гипоксантина и 0,016 мМ тимидина (Sigma) (полная среда). Клетки выращивали в 50-миллилитровых центрифужных пробирках на шейкере, при температуре 37°C и скорости вращения платформы 180 об/мин. Постоянную трансфекцию суспензионных клеток CHOdhfr- проводили в 24-луночных платах в бессывороточной среде с помощью липосомального реагента FreeStyle™ MAX Reagent (Invitrogen) по инструкции изготовителя. Через 1 сутки после трансфекции среду заменяли на полную, а еще через сутки переводили в селективные условия и культивировали далее в среде без гипоксантина и тимидина и с 20 нМ метотрексата (МТХ, Sigma), заменяя среду каждые 3 суток.
Концентрацию ИЛ-7 определяли с помощью иммуноферментного анализа. Пулы стабильно трансфецированных клеток высевали на среде PF-CHO LS без гипоксантина/тимидина с 1% сыворотки и 20 нМ метатрексата с плотностью 1,5 клетки на лунку в 96-луночные плоскодонные платы в объеме 200 мкл на лунку. На 7 и 11 сутки заменяли половину среды, добавляя свежую среду без сыворотки. Перед первой заменой среды все платы просматривали визуально и отмечали лунки, содержащие единичные клоны. На 14 сутки проводили скрининг, определяя концентрацию специфического белка в супернатантах лунок с единичными клонами. Затем отобранные клоны переносили вначале в 24-луночные платы (600 мкл среды на лунку), затем в 6-луночные платы (3 мл среды на лунку), а далее - в 50-мл центрифужные пробирки. Культивирование клеток проводили на шейкере при скорости вращения платформы 180 об/мин. В результате скрининга 24 клонов, культивируемых в среде с последовательно повышающимися концентрациями метотрексата (20-50-100-250-500 нМ), был получен штамм клеток овариев китайского хомячка CHO-IL7/13 с удельной продуктивностью (qP), равной 6,5 пг ИЛ-7/кл/сутки (Фиг 2). Максимальная концентрация ИЛ-7 человека при культивировании клеток данного клона составила 10850 нг/мл. Криоконсервированные клетки клона CHO-IL7/13 помещены в коллекцию.
Пример 3. Анализ белка, продуцируемого клетками штамма CHO-IL 7/13.
Клетки штамма CHO-IL 7/13 культивировали в среде с 20 нМ метотрексата, как описано в примере 2, в течение 72 часов. Клетки осаждали центрифугированием и образцы культуральной среды подвергали электрофорезу в полиакридамидном геле с ДДС-Na. Разделенные белки переносили на нитроцеллюлозную мембрану, которую инкубировали с известными моноклональными антителами против интерлейкина-7 человека (Human IL-7 DuoSet, производства R&D Systems, USA). Результат, полученный после обработки вторыми антителами и проявления, представленный на Фиг.3, показывает наличие белковой полосы с молекулярным весом 29 килодальтон, связывающейся с антителами к ИЛ-7 человека и отсутствующей в среде культивирования контрольных клеток. Данный молекулярный вес соответствует гликозилированной форме интерлейкина-7 человека. Продуктивность штамма CHO-IL7/13 оценивали с помощью иммуноферментного анализа с антителами Human IL-7 DuoSet. Результаты измерений приведены на Фиг.4.
Определение биологической активности рекомбинантного ИЛ-7 человека выполняли на первичной культуре спленоцитов мыши, по способности данного цитокина стимулировать пролиферацию различных клеток лимфоцитарного ряда [2-4]. Спленоциты выделяли из селезенок мышей-гибридов F1 (C57BL/6×CBA) следующим образом. В асептических условиях селезенки измельчали, гомогенизировали многократным пропусканием через иглу шприца (d=1.2 мм). Клеточную суспензию в стерильном забуференном физиологическом растворе (PBS) фильтровали через двойной слой марли и центрифугировали. Затем лизировали эритроциты 0,86% раствором NH4Cl, далее клетки дважды отмывали в PBS и ресуспендировали в среде RPMI-1640 (Sigma) с 2,0 мМ L-глутамина, 50 мкМ 2-меркаптоэтанола и 80 мг/л гентамицина (полная среда). Полученные клетки (5×105 клеток на лунку) инкубировали в 4-х параллелях в присутствии различных концентраций стандартного образца белка ИЛ-7 (R&D Systems, кат. №207-IL-005) или различных разведении супернатантов среды культивирования клеток-штамма ИЛ-7/13, в которых концентрацию ИЛ-7 предварительно определяли с помощью иммуноферментного анализа (R&D Systems). Далее образцы супернатантов разводили таким образом, чтобы в полученных разведениях содержалось 100, 10 или 1 нг/мл рекомбинантного белка. Инкубацию клеток с образцами проводили в полной среде с добавлением 10% телячьей эмбриональной сыворотки (ТЭС) (Sigma) в 96-луночных плоскодонных культуральных платах (Costar) в течение 72 часов в CO2-инкубаторе при 37°C в условиях абсолютной влажности. За 20 часов до окончания инкубации к клеткам добавляли 3H-тимидин («Изотоп», С-Петербург) в конечной концентрации 5 µCi/мл. Далее клетки переносили на стекловолоконные фильтры с помощью харвестера Fil-terMate 96 (Perkin Elmer) и определяли интенсивность включения тимидина на β-счетчике MicroBeta TriLux 1450 (Perkin-Elmer), которую выражали в импульсах в минуту. Усредненный результат четырех параллельных опытов представлен на фиг.4, из которого следует, что эффективность стимуляции пролиферации спленоцитов супернатантом клеток клона ИЛ-7/13 практически совпадает с эффективностью стандартного образца ИЛ-7 в соответствующих дозах, что указывает на наличие у рекомбинантного ИЛ-7 адекватной биологической активности.
Штамм культивируемых клеток CHO-IL7/13- продуцент интерлейкина-7 человека, полученный трансфекцией клеток CHOdhfr плазмидой pIPvES-DHFR/IL7, содержащей ген интерлейкина-7 человека, общая схема которой приведена на фиг. 1, которая была синтезирована амплифицированием кДНК интерлейкина-7 человека с помощью праймеров: ecoIL CCTGAATTCCACCATGTTCCATGTTTCTTTTAG, содержащего сайт рестрикции EcoRI и последовательность Козак, и bamIL CCAGGATCCTCAGTGTTCTTTAGTGCCCATC, содержащего сайт рестрикции BamHI, с последующим клонированием по данным сайтам рестрикции в вектор pIRES-DHFR.