Рацемический 2,17β-дисульфамоилокси-3-метокси-8α-эстра-1,3,5(10)-триен в качестве ингибитора пролиферации опухолевых клеток mcf-7
Иллюстрации
Показать всеИзобретение относится к рацемическому 2,17β-дисульфамоилокси-3-метокси-8α-эстра-1,3,5(10)-триену, ингибирующему пролиферацию опухолевых клеток рака молочной железы MCF-7. 1 пр.
Реферат
Изобретение относится к синтезу рацемического 2,17β-дисульфамоилокси-3-метокси-8α-эстра-1,3,5(10)-триена, ингибирующего пролиферацию опухолевых клеток MCF-7. Это предполагает возможность его применения в медицине.
Рак молочной железы (РМЖ) у женщин является «ведущим» онкологическим заболеванием [1]. 60-70% Опухолей этой локализации эстрогенозависимы [1], т.е. скорость пролиферации опухолевых клеток значительно возрастает в присутствии этой группы гормонов.
Хотя наиболее распространенные методы лечения эстрогенозависимых опухолевых заболеваний включают использование антиэстрогенов и селективных модуляторов рецепторов эстрогенов [2-4], разрабатывается и новая стратегическая линия, состоящая в применении сульфаматов стероидных эстрогенов [5]. Так, запатентован метод получения и использования многих сульфаматов стероидных эстрогенов природного ряда [6], в частности соединение (I) (прототип).
Целью изобретения является расширение группы веществ, блокирующих рост клеток рака молочной железы MCF-7. Поставленная цель достигается синтезом рацемического 2,17β-дисульфамоилокси-3-метокси-8α-эстра-1,3,5(10)-триена (II). Особенностями структуры этого соединения является цис-сочленение колец B и C, а также наличие сульфамоильной группы в положении 2, что принципиально отличает его от всех известных ингибиторов с такими свойствами.
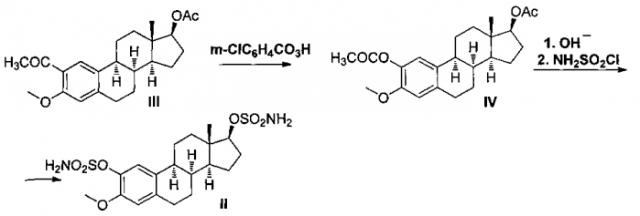
Схема синтеза 2,17β-дисульфамоилокси-3-метокси-8α-эстра-1,3,5(10)-триена (II) представлена ниже.
Пример.
К раствору 2.05 г стероида (III) [7] в 40 мл хлористого метилена добавляют 1.2 г Na2HPO4 и 1.6 г м-хлорнадбензойной кислоты в 40 мл хлористого метилена. Реакционную смесь перемешивают 20 ч при комнатной температуре, а затем выливают в 700 мл диэтилового эфира. Органическую фазу отделяют, промывают равным объемом насыщенного раствора бикарбоната натрия, а затем водой до нейтральной реакции. Растворители удаляют в вакууме, продукт реакции выделяют флэш-хроматографией на силикагеле, элюируя смесью петролейный эфир-этилацетат 10:1, 5:1. После кристаллизации из гексана выход 1.69 г (79%), т.пл. 164-165°C. Спектр ЯМР 1H соединения (IV), δ, м.д.: 6.79 (C1-H), 6.64 (C4-H), 2.63 (C6-Hα), 2.78 (C6-Hβ), 1.81 (C7-Hα), 1.66 (C7-Hβ), 2.01 (C8-Hα), 2.59 (C9-Hα), 1.70 (C11-Hα), 1.61 (C11-Hβ), 1.32 (C12-Hα), 1.72 (C12-Hβ), 1.66 (C14-Hα), 1.51 (C15-Hα), 1.78 (C15-Hβ), 2.21 (C16-Hα), 1.51 (C16-Hβ), 4.62 (C17-Hα), 0.90 (C18H3), 3.78 (CH3O), 2.04 (CH3CO), 2.29 (C2-OCOCH3).
Спектр ЯМР 13C, δ, м.д.: 122.9 (C1), 137.5 (C2), 134.9 (C3), 112.2 (C4), 137.5 (C5), 31.1 (C6), 20.7 (C7), 37.3 (C8), 41.1 (C9), 133.7 (C10), 28.4 (C11), 37.3 (C12), 41.6 (C13), 47.1 (C14), 22.1 (C15), 26.8 (C16), 82.4 (C17), 13.3 (C18), 55.7 (CH3O), 21.0 и 170.9 (ацетильная группа при C17), 20.5 и 169.2 (ацетильная группа при C2). Масс-спектр, m/z (%): 386 (12), 344 (100), 202 (10), 189 (8), 187 (7), 176 (15), 137 (8).
Найдено, %: C 71.45; H 8.08. C23H30O5. Вычислено, %: C 71.48; H 7.82.
К раствору 200 мг 2,17β-диацетокси-3-метокси-8α-эстра-1,3,5(10)-триена (IV) в смеси 5 мл бензола и 3 мл метанола добавляют 150 мг NaOH, перемешивают 2 часа при 50°C. Реакционную смесь выливают в 10 мл 1 н. соляной кислоты, продукты реакции экстрагируют тремя порциями этилацетата по 10 мл. Органические слои последовательно промывают двумя порциями воды по 5 мл, 15 мл насыщенного раствора NaCl, сушат над Na2SO4. Растворители удаляют на роторном испарителе. После кристаллизации остатка из метанола получают 150 мг (96%) соединения (V), т.пл. 211-213°C.
Спектр ЯМР 1H (DMSO, δ, м.д.): 8.52 с (1H), 6.53 с (1H), 6.50 с (1H), 4.48 д (1H, J 4.5 Гц), 3.69 с (3H), 3.43 д (1H, J 4.5 Гц) 2.63 д (1H, J 16.1 Гц), 2.42 д (1H, J 12.2 Гц), 1.87 дд (2H, J 9.9 Гц, J 14.8 Гц), 1.73-1.45 м (7H) 1.33 т (2H, J 8.7 Гц), 1.11 т (1H, J 11.0 Гц) 0.74 с (3H). Спектр ЯМР 13C (DMSO, δ, м.д.): 146.5, 145.1, 134.5, 127.3, 116.6, 113.0, 81.1, 56.4, 48.0, 42.4, 42.1, 38.4, 38.1, 31.1, 30.3, 22.7, 21.6, 13.3.
Найдено, %: C 75.33, H 8.80. C19H26O3. Вычислено, %: C 75.46; H 8.67.
К раствору 100 мг 2,17β-дигидрокси-3-метокси-8α-эстра-1,3,5(10)-триена (V) в 2 мл сухого диметилацетамида при комнатной температуре добавляют 150 мг сульфамоилхлорида, реакционную смесь перемешивают 8 ч при комнатной температуре в атмосфере аргона. Реакционную смесь выливают в насыщенный раствор хлористого натрия (10 мл), продукты реакции экстрагируют этилацетатом (3×5 мл). Объединенную органическую фазу промывают водой (2x5 мл), 15 мл насыщенного раствора NaCl, сушат над Na2SO4. Растворитель удаляют на ротационном испарителе, остаток кристаллизуют из метанола. Получают 114 мг (75%) целевого продукта (II), т.пл. 215-217°C.
Спектр ЯМР 1H (DMSO, δ, м.д.): 7.80 с (2H), 7.39 с (2H), 7.07 с (1H), 6.80 с (1H), 4.27 д (1H J=8.1 Гц), 3.74 с (3H), 3.44-3.32 м (1H) 2.86-2.72 м (1H), 2.65-2.55 м (2H), 2.28-2.14 м (1H), 2.02-1.90 м (2H), 1.77-1.39 м (7H), 1.18-1.05 м (1H), 0.85 с (3H). Спектр ЯМР 13C (DMSO, δ, м.д.): 150.2, 137.8, 137.0, 134.0, 124.3, 113.9, 88.2, 56.6, 47.1, 42.2, 41.5, 37.9, 37.3, 31.4, 29.0, 27.9, 22.4,21.1, 13.8.
Найдено, %: C 49.51, H 7.31 N 5.88. C19H28N2O7S2. Вычислено, %: C 49.55; H 6.13 N 6.08.
Исследовали влияние стероида (II) на рост перевиваемой культуры клеток человека MCF-7 (аденокарцинома молочной железы). В качестве отрицательного контроля использовали нормальные кожные фибробласты человека (КФЧ) ранних пассажей. Клетки культивировали во флаконах Карреля в среде DMEM/F12 (Биолот) с добавлением 1% эмбриональной сыворотки крупного рогатого скота (Биолот), без антибиотиков, в 5% CO2 атмосфере, при 37°C. Клетки высаживались на флаконы Карреля по 50×104 клеток на флакон. Для изучения пролиферативной активности клеток через 24 часа после посева в культуральную среду ее заменяли на среду, содержащую ингибитор сульфатазы, до конечной концентрации 50 мкг/мл, после чего инкубировали данные опухолевые клеточные линии в течение различных промежутков времени (от 24 до 72 ч). Конечная концентрация ДМСО в культуральной среде не превышала 0.5%. Для исключения цитотоксического действия ДМСО проводили опыты с добавлением ДМСО без ингибитора сульфатазы. Для исключения неспецифического губительного действия веществ использовались нормальные кожные фибробласты человека. Далее клетки снимали раствором версена-трипсина (Биолот), рассеивали на флаконы Карреля, содержащие новую полную культуральную среду. Подсчет клеток проводили в момент достижения необработанными контрольными клетками максимальной плотности клеток на единицу площади поверхности культурального флакона (монослой), при этом их количество определялось как 100%. Оказалось, что при концентрации стероида (II) 20 мкг/мл рост опухолевых клеток тормозится примерно в той же степени, что и под действием применяемого в клинической практике тамоксифена. При этом стероид (II) не тормозил рост нормальных кожных фибробластов человека. Этот результат весьма важен, так как механизмы действия стероида (II) и тамоксифена различны.
Список использованной литературы
[1] Gururaj А.Е., Rayala S.K., Vadlamudi R.K., Kumar R. Novel mechanisms of resistance to endocrine therapy: genomic and nongenomic considerations // Clin. Cancer Res. 2006. Vol. 12. P. 1001s - 1007s.
[2] Chetrite G.S., Pasqualini J.R. The selective estrogen enzyme modulator (SEEM) in breast cancer // J. Steroid Biochem. Mol. Biol. 2001. Vol. 76. P. 95-104.
[3] Fabian C.J., Kimler B.F. Selective estrogen-receptor modulators for primary prevention of breast cancer // J. Clin. Oncol. 2005. Vol. 23. N 8. P. 1644-1655.
[4] Jordan V.C. Antiestrogens and Selective Estrogen Receptor Modulators as Multifunctional Medicines. 2. Clinical Considerations and New Agents // J. Med. Chem. 2003. Vol. 46. N 7. P. 1081-1111.
[5] Maltais R., Poirier D. Steroid sulfatase inhibitors: A review covering the promising 2000-2010 decade // Steroids. Vol. 76. N 10/11. P. 929-948 (2011).
[6] Leese M., Purohit Α., Reed M.J., Newman S.P., Chander R.K., Jourdan F., Potter B.V.L. Oestrogen derivatives as inhibitors of steroid sulfatase // United States Patent Application Publication US 2006/0094698 A1.
[7] Шавва А.Г., Власова К.B., Цогоева С.Б., Егоров М.С., Якуцени П.П. Изучение связывания эстрадиола и 8-изоэстрадиола с α-рецептором эстрогенов методом молекулярного моделирования // Биоорган. химия. 2002. Т. 28. №3. С. 236-241.
Рацемический 2,17β-дисульфамоилокси-3-метокси-8α-эстра-1,3,5(10)-триен формулы в качестве ингибитора пролиферации опухолевых клеток рака молочной железы MCF-7.