Спин-меченое производное кинуренина и способ его получения
Иллюстрации
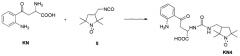
Показать всеИзобретение относится к спин-меченому производному кинуренина с удлиненным линкером между кинурениновой и радикальной частями молекулы, обладающему высокой фотостабильностью и имеющему следующую структурную формулу I, а также к способу его получения, характеризующемуся тем, что к суспензии кинуренина в сухом эфире добавляют триэтиламин и хлортриметилсилан (СН3)3SiCl, образующийся осадок удаляют, растворитель отгоняют, остаток растворяют в сухом хлороформе CHCl3, добавляют изоцианат формулы II, затем воду, создают щелочную среду и экстрагируют хлороформом, экстракт отбрасывают, водную фазу доводят до кислой рН и снова экстрагируют хлороформом, экстракт сушат. Технический результат - новый спин-меченый кинуренин является фотохимически гораздо более стабильным, чем синтезированные ранее соединения этого класса. 2 н. и 7 з.п. ф-лы, 2 ил., 1 пр.
I II
Реферат
Изобретение относится к производным кинуренина, ковалентно связанным с нитроксильными радикалами, которые могут быть использованы для создания новых типов активных компонентов солнцезащитных препаратов.
Для защиты кожных покровов от избыточной солнечной радиации современные фармакология и косметология предлагают широкий выбор солнцезащитных кремов и лосьонов. Основным действующим компонентом этих составов являются хромофорные органические молекулы, эффективно поглощающие УФ-излучение в диапазоне от 300 до 400 нм. Основные требования, предъявляемые к этим соединениям, - это высокое поглощение в областях УФ-А и УФ-В облучения, высокая фотостабильность, а также низкая токсичность и фототоксичность. Наиболее известным УФ-фильтром, используемым в косметологии, является этилгексил метоксициннамат (ОМС). Недавние исследования показали, что присутствие в солнцезащитных препаратах радикальных ловушек может дать заметный положительный эффект как с точки зрения замедления старения кожи, так и для уменьшения фотоповреждений кожных покровов, вызванных продолжительным солнечным облучением [1-4]. Таким образом, наиболее эффективным компонентом солнцезащитного препарата являлся бы УФ-фильтр, обладающий антиоксидантной активностью. В работах [5, 6] с этой целью был предложен синтез хромофора - ОМС, ковалентно связанного с нитроксильными радикалами. Было показано, что полученные соединения обладают высокой фотостабильностью, а также обладают антиоксидантными свойствами, обусловленными способностью нитроксидов захватывать свободные радикалы.
В наших предыдущих работах [7, 8] было показано, что нитроксиды способны не только захватывать свободные радикалы, но также тушить триплетные состояния фотовозбужденных молекул. При этом в качестве хромофора использовался кинуренин (KN) - природная аминокислота, являющаяся продуктом метаболических превращений триптофана и содержащаяся в хрусталике глаз ряда млекопитающих, включая человека. В хрусталике кинуренин и его производные выполняют функцию молекулярных УФ-фильтров, защищая сетчатку от УФ-повреждений. На основании полученных ранее результатов была предпринята попытка синтеза производных кинуренина, ковалентно связанных с нитроксидами, и исследования фотохимических свойств этих соединений.
Нами были синтезированы производные кинуренина KN1-KN3, ковалентно связанные с нитроксидами, и исследованы фотохимические свойства этих соединений [8]. Полученные результаты показали, что синтез спин-меченых производных кинуренина имеет значительный потенциал для создания более совершенных солнцезащитных средств, а также ряда других применений в фармакологии и косметологии. Однако фотостабильность таких солнцезащитных антиоксидантов оказалась недостаточной, что связано, в частности, с реакцией внутримолекулярного переноса электрона, происходящей между фотовозбужденной кинурениновой частью молекулы и нитроксильным радикалом. Поэтому для синтеза новых производных кинуренина предполагается использовать более устойчивые нитроксильные радикалы с удлиненным линкером между кинурениновой частью молекулы и нитроксильным радикалом, ожидая уменьшение скорости реакции переноса электрона и, как следствие, увеличение фотостабильности.
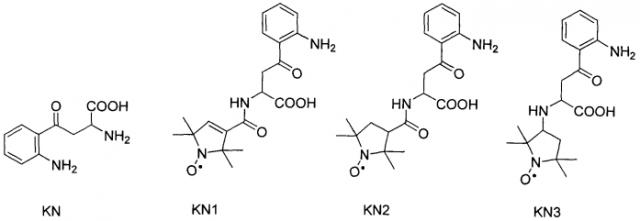
Прототипом предлагаемых соединений являются спин-меченые кинуренины KN1-KN3, синтез и фотохимические свойства которых были описаны в работе [8].
Структурные формулы этих соединений приведены ниже:
Было установлено, что вследствие спинового обмена между кинурениновой и нитроксильной частью молекулы время жизни триплетного состояния конъюгата заметно меньше по сравнению с молекулой KN, однако квантовый выход триплета значительно выше. Основным фактором, определяющим квантовый выход фоторазложения конъюгатов KN1-KN3, является внутримолекулярный перенос электрона от фотовозбужденной кинурениновой части к нитроксильной. Как следствие, KN1-KN3 конъюгаты в водных растворах фотохимически менее стабильны по сравнению с исходной молекулой KN.
Основным недостатком прототипа является его относительно низкая фотостабильность: если для природного кинуренина квантовый выход фоторазложения в водном анаэробном растворе составляет 2×10-5, то для спин-меченых кинуренинов KN2 и KN3 это значение на 2-3 порядка выше (см. таблицу). Основным каналом фоторазложения этих соединений является реакция внутримолекулярного переноса электрона, происходящая между фотовозбужденной кинурениновой частью молекулы и нитроксильным радикалом.
Изобретение решает задачу увеличения фотостабильности спин-меченых кинуренинов.
Задача решается за счет увеличения длины линкера, связывающего кинурениновую и нитроксильную части молекулы.
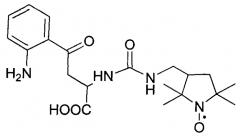
Спин-меченое производное кинуренина, обладающее высокой фотостабильностью и имеющее следующую структурную формулу:
готовят следующим образом: к суспензии кинуренина в сухом эфире добавляют триэтиламин и хлортриметилсилан (СН3)3SiCl, образующийся осадок удаляют, растворитель отгоняют, остаток растворяют в сухом хлороформе CHCl3, добавляют изоцианат формулы:
затем воду, создают щелочную среду и экстрагируют хлороформом, экстракт отбрасывают, водную фазу доводят до кислой рН и снова экстрагируют хлороформом, экстракт сушат.
Суспензию кинуренина в сухом эфире после добавления триэтиламина и хлортриметилсилана (СН3)3SiCl перемешивают при комнатной температуре.
После добавления триэтиламина и хлортриметилсилана (СН3)3SiCl к суспензии кинуренина в сухом эфире получившийся осадок отфильтровывают.
После удаления осадка растворитель отгоняют при пониженном давлении.
После растворения остатка в сухом хлороформе CHCl3 и добавления изоцианата получившийся раствор выдерживают, преимущественно оставляют на сутки.
После добавления воды производят перемешивание.
После добавления воды создают щелочную среду добавлением щелочи, преимущественно до рН=8-10
После однократной процедуры экстракции хлороформом водную фазу доводят до кислой рН=3-4.
Синтез спин-меченого D,L-кинуренина с модифицированной структурой
Синтез спиновых меток
Для синтеза спиновых меток в качестве основы нами были выбраны нитроксильные радикалы пирролидинового ряда как наиболее устойчивые к восстановлению [9].
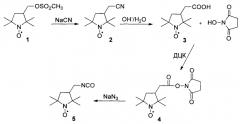
Синтез нитроксильного радикала с удлиненным линкером проводили по следующей схеме:
Исходная карбоновая кислота 3, удлиненная на СН2-фрагмент, была получена гидролизом нитрила 2, который синтезировали путем замещения мезильного фрагмента в нитроксильном радикале 1, получение которого описано в работе [10]. Радикал-изоцианат 5 синтезировали из сукцинимидного производного 4, которое получали из карбоновой кислоты 3.
Синтез спин-меченого производного D,L-кинуренина
Использование изоцианатов в качестве спиновых меток для аминокислот предполагает введение защитной группы по одной из функций. Достижение максимального сходства в структуре с полученными ранее спин-мечеными кинуренинами означает введение метки по аминогруппе кинуренина. Для защиты карбоксильной функции использовалась триметилсилильная защитная группа. Ниже приведена схема синтеза спин-меченого производного кинуренина KN4.
Общая методика замещения мезильного фрагмента цианидом
Мезильное производное 1 (1 экв.) растворяют в безводном ДМСО (10 мл) и добавляют NaCN (1.2 экв.), нагревают на масляной бане (Т=60°C) 7 дней. За протеканием реакции наблюдают методом ТСХ (SiO2, элюент - эфир). После окончания реакции смесь разбавляют водой (20 мл) и экстрагируют хлороформом (7 мл × 3), хлороформный экстракт промывают насыщенным соленым раствором (10 мл × 7), сушат над Na2SO4. Осушитель отфильтровывают, растворитель отгоняют при пониженном давлении, остаток хроматографируют (SiO2, элюент - эфир). Перекристаллизовывают из смеси (гексан/эфир). Получают нитрил в виде ярко-желтого порошка.
Общая методика гидролиза нитрилов до карбоновых кислот
Нитрил 2 (1 экв.) растворяют в 25 мл смеси (10% КОН/ЕtOН, 1:1) и кипятят на масляной бане. Окончание реакции наблюдают методом ТСХ (SiO2, элюент - эфир). Через сутки нитрил полностью гидролизуется до амида. Полный гидролиз наблюдается через 5 дней. Спирт отгоняют при пониженном давлении, оставшийся щелочной раствор экстрагируют хлороформом, экстракт отбрасывают. Подкисляют щелочной раствор 3% HCl до рН=3 и экстрагируют хлороформом (10 мл × 5), сушат над Na2SO4. Осушитель отфильтровывают, растворитель отгоняют при пониженном давлении, остаток кристаллизуют из смеси (гексан/EtOAc, 1:1). Получают карбоновую кислоту в виде бледно-желтого порошка.
Общая методика получения сукцинимидных производных
Карбоновую кислоту 3 (1 экв.) и N-(гидрокси)сукцинимид (1 экв.) суспендируют в EtOAc и охлаждают в бане со льдом. Затем при перемешивании добавляют дициклогексилкарбодиимид (ДЦК) (1.5 экв.). Через 15 мин реакционную смесь вынимают из бани и продолжают перемешивание при комнатной температуре еще 2 ч. Затем образовавшийся осадок отфильтровывают и промывают на фильтре EtOAc. Осадок отбрасывают, растворитель отгоняют при пониженном давлении, при этом получается твердое, но слегка маслянистое желтое вещество, которое хроматографируют на колонке (SiO2, элюент - CHCl3). Фракции собирают, растворитель отгоняют при пониженном давлении, получают сукцинимидное производное в виде бледно-желтого порошка.
Общая методика получения изоцианатов
Сукцинимидное производное 4 (1 экв.) растворяют в смеси ацетон/вода (2:1) и охлаждают в бане со льдом. Затем добавляют при перемешивании по каплям водный раствор NaN3 и продолжают перемешивать еще 3 ч. Отгоняют ацетон при пониженном давлении без нагрева. Полученный в результате реакции ацил-азид экстрагируют EtOAc и осушают при помощи MgSO4 при интенсивном перемешивании около 30 мин. Затем осушитель отфильтровывают, растворитель отгоняют при пониженном давлении. Остаток кипятят в сухом гексане в течение 1 ч, растворитель отгоняют. Полученный изоцианат используют в дальнейшем без очистки.
Общая методика получения спин-меченого производного кинуренина введением нитроксильного радикала с удлиненным линкером, имеющего следующую структурную формулу:
характеризуется тем, что к суспензии кинуренина в сухом эфире добавляют триэтиламин и хлортриметилсилан (СН3)3SiCl, перемешивают при комнатной температуре, осадок отфильтровывают, растворитель отгоняют при пониженном давлении, остаток растворяют в сухом хлороформе СНCl3, добавляют изоцианат формулы:
выдерживают, затем добавляют воду, перемешивают, доводят до рН=8-10 добавлением щелочи и экстрагируют хлороформом, экстракт отбрасывают, водную фазу доводят до рН=3-4 и снова экстрагируют хлороформом, полученный экстракт сушат.
Более подробно способ осуществляют следующим образом: к суспензии кинуренина в сухом эфире добавляют избыток триэтиламина и хлортриметилсилана (СН3)3SiCl, перемешивают при комнатной температуре не менее 6 ч. Образовавшийся осадок отфильтровывают и отбрасывают, растворитель отгоняют при пониженном давлении. Остаток растворяют в сухом хлороформе СНСl3 и добавляют избыток изоцианата 5, оставляют на сутки. Затем добавляют воду, перемешивают 5-10 мин, доводят до рН=8-10 добавлением NaOH и экстрагируют CHCl3, экстракт отбрасывают. Водную фазу доводят до рН=3-4 и снова экстрагируют CHCl3. Экстракт сушат над Na2SO4.
Сущность изобретения иллюстрируется следующим примером.
Пример 1
К суспензии 1 экв. кинуренина в сухом эфире добавляют 2.5 экв. триэтиламина и 2.5 экв. (CH3)3SiCl, перемешивают при комнатной температуре 24 ч. Образовавшийся осадок отфильтровывают и отбрасывают, растворитель отгоняют при пониженном давлении. Остаток растворяют в сухом СНСl3 и добавляют 1.5 экв. изоцианата 5, оставляют на сутки. Затем добавляют воду, перемешивают 10 мин, доводят до рН=8-9 добавлением NaOH и экстрагируют CHCl3, экстракт отбрасывают. Водную фазу доводят до рН=4 и снова экстрагируют CHCl3. Экстракт сушат над Na2SO4. Полученные соединения имеют кинурениновый УФ-спектр, по данным ВЭЖХ представляют собой диастереомерную смесь и по масс-спектрам высокого разрешения соответствуют спин-меченым кинуренинам.
Исследование фотохимических свойств спин-меченого кинуренина
Фотовозбуждение кинурениновой части конъюгата KN-RNO. приводит к образованию синглетного возбужденного S1 состояния. Основными путями гибели этого состояния являются внутренняя конверсия в основное состояние, флуоресценция, интеркомбинационная конверсия в триплетное состояние, а также реакция внутримолекулярного переноса электрона между кинурениновой и нитроксильной частями молекулы [8]. Реакция переноса электрона может также происходить и из триплетного состояния.
Заметим, что внутренняя конверсия и флуоресценция приводят к восстановлению основного состояния исходного соединения, в то время как в результате интеркомбинационной конверсии и реакции переноса электрона образуются активные короткоживущие частицы - триплетное состояние и радикал +.KN-RNOH. Образование этих частиц приводит к фоторазложению исходного соединения, а также может приводить к повреждению окружающих молекул. Таким образом, квантовые выходы фоторазложения, образования триплетных состояний и образования радикалов +.KN-RNOH являются принципиально важными параметрами, характеризующими эффективность потенциального солнцезащитного антиоксиданта. Проведено измерение этих параметров для вновь синтезированного спин-меченого кинуренина KN4 и сопоставление их с данными для KN1-KN3.
Измерение фотостабильности спин-меченого кинуренина
Растворы для фоторазложения исследуемых соединений были приготовлены в фосфатном буфере (рН 7.2) с концентрациями около 1 мМ. Образцы объемом 1 мл были помещены в кварцевую ЯМР-ампулу (5 мм диаметром) и облучались при помощи ртутной лампы (ДРШ-1000). Инфракрасная часть спектра облучения была обрезана при помощи водного фильтра, набор ультрафиолетовых стеклянных фильтров сужал спектр облучения до диапазона 300-400 нм. Образцы продувались аргоном или кислородом в течение 15 мин до облучения и в процессе облучения. В ходе облучения через равные промежутки времени забирали аликвоты (объем 15 мкл). Далее эти образцы разводили в 185 мкл воды и до хроматографического анализа хранили при температуре 4°C в термостате хроматографа. Для контроля измерения аналогично был облучен 1 мМ раствор кинуренина, чей квантовый выход фоторазложения хорошо известен [11]. Концентрацию исходных веществ и их продуктов в облученных образцах определяли методом ВЭЖХ с оптическим детектированием. Актинометрия проводилась с использованием водного раствора ферриоксалата калия. Рассчитанная из полученных данных интенсивность излучения в регионе 300-400 нм составляла 1.0±0.2×1018 квантов в секунду.
На Фиг. 1 представлена зависимость концентрации KN4 в растворе от времени облучения в аэробных (квадраты) и анаэробных (кружки) условиях. На начальном участке кинетической кривой наблюдается линейная зависимость концентраций от времени, затем скорость разложения уменьшается. Для расчета квантового выхода фоторазложения использовали только начальные участки кинетических кривых (прямые линии на Фиг. 1).
Квантовый выход фоторазложения рассчитывали как отношение числа разложившихся за единицу времени молекул исходного вещества к числу квантов света, поглощенных образцом за это же время. Результаты измерений представлены в таблице.
Измерение фотоактивности спин-меченого кинуренина.
В данном случае под фотоактивностью мы будем понимать величины квантовых выходов триплетного состояния и радикалов +.KN-RNOH, образующихся под УФ-облучением. Для измерения этих величин использовалась установка лазерного импульсного фотолиза, описанная в работе [11]. В зависимости от необходимой длины волны источником возбуждения может быть эксимерный XeCl лазер (Lambda Physik EMG 101, λ=308 нм, энергия импульса до 120 мДж; длительность импульса 15 нc) или твердотельный Nd3+:YAG лазер (Quanta-Ray LAB-130-10, λ=266, 355 и 532 нм; энергия импульса до 70, 150 и 300 мДж для каждой длины волны, соответственно, длительность импульса 8 нс). На пути лазерного луча располагается кварцевая пластинка и отражает часть луча на фотодиод, запускающий осциллограф и пропускающий излучение на измеритель мощности (Model 1918-С). Сигнал с измерителя мощности, поступающий в компьютер, позволяет непрерывно отслеживать реальную энергию лазера во время проведения эксперимента. Источником зондирующего излучения является ксеноновая лампа ДКсШ-150 (длительность импульса 2 мс). Возбуждающее и зондирующее излучения пересекаются под прямым углом. Система из сферических линз позволяет сконцентрировать луч лазера (поперечный размер 3×8 мм2) и лампы (поперечный размер 1×3 мм2) на поверхность кварцевой кюветы. Таким образом, во всех экспериментах длина пути оптического возбуждения составляла 1 мм, а регистрирующего излучения - 8 мм. После прохождения через образец зондирующее излучение попадает на монохроматор (30-1000 нм, 1 нм/дел.) и измеряется с помощью ФЭУ (Electron Tubes Ltd. 9794 В), сигнал от которого оцифровывается 11-битным АЦП двухканального цифрового осциллографа LeCroy 104MXi (1 ГГц). Установка полностью управляется персональным компьютером.
На Фиг. 2 представлены кинетические зависимости промежуточного поглощения, полученные на длине волны 430 нм (максимум поглощения триплетного состояния кинуренина) при фотолизе растворов KN и KN4 в анаэробных условиях в водном растворе. Возбуждение производилось с использованием Nd3+:YAG лазера (355 нм), оптическая плотность всех растворов на этой длине волны была одинаковой (0.96 на 1 см). При фотолизе KN основным промежуточным соединением является кинуренин в триплетном состоянии TKN, гибель которого происходит по механизму триплетной аннигиляции. В микросекундной временной шкале спад сигнала малозаметен (Фиг. 2). При фотолизе спин-меченого кинуренина наблюдается формирование двух короткоживущих интермедиатов: триплетное состояние, образующееся сразу после лазерного импульса и быстро гибнущее в микросекундном временном диапазоне, и радикал +.KN-RNOH, сигнал которого на Фиг. 2 выглядит как остаточное поглощение после гибели TKN.
При расчете квантовых выходов кинуренина в триплетном состоянии и радикалов были сделаны следующие предположения: а) триплетное состояние KN4 на длине волны 430 нм имеет такой же коэффициент поглощения, что и TKN (3.7×103 М-1 см-1 [12, 13]); б) радикал +.KN4 на длине волны 430 нм имеет такой же коэффициент поглощения, что и +.KN (2.6×103 M-1 см-1 [13]).
Результаты измерений представлены в таблице совместно с ранее полученными данными для KN и спин-меченых кинуренинов KN1-KN3.
а3начение взято из [11]
б3начение взято из [8] и пересчитано с учетом уточненного в [11] значения квантового выхода триплета для KN.
Из таблицы видно, что квантовый выход триплетов конъюгата кинуренина с нитроксильным радикалом с удлиненным линкером между хромофорным и радикальным центрами KN4 несущественно отличается от значений, полученных для ранее синтезированных и изученных спин-меченых кинуренинов KN1-KN3. Это неудивительно, поскольку квантовый выход триплетного состояния определяется в первую очередь скоростью основного канала дезактивации синглетного возбужденного состояния S1 кинурениновой части молекулы, и структура нитроксильного фрагмента вряд ли может оказать на нее заметное влияние.
В то же время для водных растворов KN4 наблюдается существенное (в 2-3 раза) уменьшение квантового выхода радикалов +.KN-RNOH по сравнению с KN1-KN3. Очевидно, это явление следует отнести к изменению структуры нитроксильного фрагмента: увеличение расстояния между кинурениновой и радикальной частями молекулы приводят к уменьшению скорости реакции переноса электрона. Как результат, новый спин-меченый кинуренин является заметно более стабильным: если для ранее изученных конъюгатов квантовый выход фоторазложения в водном растворе в анаэробных условиях составлял величины от 2.9×10-3 до 2.5×10-2, то для нового соединения эта величина не превосходит 6×10-4, то есть наблюдается по меньшей мере четырехкратное увеличение фотостабильности. Аналогичным образом увеличивается фотостабильность нового соединения и при облучении в аэробных условиях.
Таким образом, осуществлен синтез конъюгата кинуренина с удлиненным линкером между кинурениновой и радикальной частями молекулы и исследованы фотохимические свойства этого соединения. Установлено, что новый спин-меченый кинуренин является фотохимически гораздо более стабильным, чем синтезированные ранее соединения этого класса. Это открывает хорошие перспективы для разработки нового поколения солнцезащитных препаратов.
Источники информации
1. Keller, K.L.; Fenske, N.A. J. Am. Acad. Dermatol. 39 (1998) 611-625.
2. Katiyar, S.K.; Elmets, C.A. Int. J. Oncol. 18 (2001) 1307-1313.
3. Lin, J.Y.; Selim, M.A.; Shea, S.R.; Grichnik, J.M.; Omar, M.M.; Monteiro-Riviere, N.A.; Pinnell, S.R. J. Am. Acad. Dermatol. 48 (2003) 866-874.
4. Pinnell, S.R. Am. Acad. Dermatol. 48 (2003) 1-19.
5. Damiani, E.; Astolfi, P.; Cionna, L.; Ippoliti, F.; Greci, L. Free Radic. Res. 40 (2006) 485-494.
6. E. Venditti, T. Spadoni, L. Tiano, P. Astolfi, L. Greci, G.P. Littarru and E. Damiani, Free Radic. Biol. Med. 45 (2008) 345-354.
7. В.В. Яньшоле, И.А. Кирилюк, И.А. Григорьев, С.В. Морозов, Ю.П. Центалович, Изв. Ак. Наук. Сер. Хим. 2010, №1, 67-75.
8. Yuri P. Tsentalovich, Vadim V. Yanshole, Yuliya F. Polienko, Sergey V. Morozov, Igor A. Grigor′ev, Photochem. Photobiol. 87 (2011) 22-31 - прототип
9. A.A. Bobko, I.A. Kirilyuk, I.A. Grigor′ev, J.L. Zweier, V.V. Khramtsov. FRBM 42(2007)404-412.
10. Balint, J; Egri, G.; Fogassy, E.; Kiss, V.; Balog, M.; Hideg, K.; Kalai, Т.; Demeter, A. Tetrahedron Asymmetry, 15 (2004) 671-679.
11. Yuri P. Tsentalovich, Peter S. Sherin, Lyudmila V. Kopylova, Ivan V. Cherepanov, Jakob Grilj, Eric Vauthey, Invest. Ophthalmol. Vis. Sci. 52 (2011) 7687-7696.
12. Yu. P. Tsentalovich, O.A. Snytnikova, P.S. Sherin, M.D.E. Forbes, J. Phys. Chem. A 109 (2005) 3565-3568.
13. O.A. Snytnikova, P.S. Sherin, Yu. P. Tsentalovich, J. Photochem. Photobiol. A: Chem. 186 (2007) 364-368.
1. Спин-меченое производное кинуренина, обладающее высокой фотостабильностью и имеющее следующую структурную формулу:
2. Способ получения спин-меченого производного кинуренина, имеющего следующую структурную формулу: характеризующийся тем, что его осуществляют следующим образом: к суспензии кинуренина в сухом эфире добавляют триэтиламин и хлортриметилсилан (СН3)3SiCl, образующийся осадок удаляют, растворитель отгоняют, остаток растворяют в сухом хлороформе CHCl3, добавляют изоцианат формулы: затем воду, создают щелочную среду и экстрагируют хлороформом, экстракт отбрасывают, водную фазу доводят до кислой рН и снова экстрагируют хлороформом, экстракт сушат.
3. Способ по п. 2, отличающийся тем, что суспензию кинуренина в сухом эфире после добавления триэтиламина и хлортриметилсилана (СН3)3SiCl перемешивают при комнатной температуре.
4. Способ по п. 2, отличающийся тем, что после добавления триэтиламина и хлортриметилсилана (CH3)3SiCl к суспензии кинуренина в сухом эфире получившийся осадок отфильтровывают.
5. Способ по п. 2, отличающийся тем, что после удаления осадка растворитель отгоняют при пониженном давлении.
6. Способ по п. 2, отличающийся тем, что после растворения остатка в сухом хлороформе СНСI3 и добавления изоцианата получившийся раствор выдерживают, преимущественно оставляют на сутки.
7. Способ по п. 2, отличающийся тем, что после добавления воды производят перемешивание.
8. Способ по п. 2, отличающийся тем, что после добавления воды создают щелочную среду добавлением щелочи, преимущественно до рН=8-10.
9. Способ по п. 2, отличающийся тем, что после однократной процедуры экстракции хлороформом водную фазу доводят до кислой рН=3-4.