Способ коррекции кишечного микробиоценоза
Иллюстрации
Показать всеИзобретение относится к фармацевтической промышленности и представляет собой способ коррекции кишечного микробиоценоза с использованием микробных культур Е. coli М-17, В. subtilis ТПИ 13, В. licheniformis ТПИ 11, В. Bifidum 1, L. plantarum 8Р-А3, В. cereus IP5832, В. subtilis 534, характеризующийся тем, что суточные дозы указанных микробных культур перед применением смешиваются с эмульсией перфтордекалина на физиологическом растворе, а затем вводятся мелким лабораторным животным в объеме 0,5 см3, крупным домашним, сельскохозяйственным и лабораторным животным в объеме 20,0 см3, для приема человеком в объеме 10,0 см3. Изобретение обеспечивает увеличение антагонистической активности микробных препаратов в 1,2-1,5 раза и в 1,2-1,9 раза увеличение выживаемости пробиотических культур в желудочно-кишечном тракте. 2 пр., 3 табл.
Реферат
I. Область техники, к которой относится изобретение
Изобретение относится к микробиологии, медицине, ветеринарии и может быть использовано для коррекции кишечного микробиоценоза в комплексе мероприятий по профилактике и лечению желудочно-кишечных расстройств и нарушений иммунного статуса, вызванных дисбактериозами и их последствиями.
II. Уровень техники
Известны способы коррекции кишечного микробиоценоза путем использования пробиотиков на основе культур бифидо- и лактобактерий, бацилл, энтерококков и др. (Сателлитный симпозиум. Коррекция и профилактика дисбактериоза. Новые подходы к терапии заболеваний желудочно-кишечной системы. Под ред. Н.А. Токаревой. Эффект, фармакотерапия. Гастроэнтерология. 2011, №3. - С. 77-84; Панин А.Н., Малик Н.И., Илаев О.С. Пробиотики в животноводстве - состояние и перспективы / Ветеринария. 2012, №3. - С. 3-8; Кишечная микрофлора: взгляд изнутри. Сборник научных статей. 2012, вып. №1. - С. 3-99.)
Результаты других исследований (Бакулин В.М., Бакулин М.К., Овсянников Ю.С., Тихонов И.В. Использование перфторуглеродов в технологии пробиотических микробных культур / Биозащита и биобезопасность. 2013, №4. - С. 49-52.) показали при исследовании перфторуглеродных соединений - перфтордекалина (ПФД) и карбогала (КГ), что внесение 5 об. % ПФД в жидкую среду культивирования, при сохранении всех остальных условий роста, позволило увеличить выход культур Escherichia coli М-17 (пробиотический штамм препарата Колибактерин), Bacillus subtilis ТПИ 13, Bacillus licheniformis ТПИ 11 (пробиотические штаммы препарата Биод-5) и Saccharomyces boulardii (пробиотический штамм препарата Энтерол) в 1,55-1,67 раза, синхронно с увеличением биомассы исследуемых культур увеличилась и их антибактериальная активность (в 1,6-1,75 раз); КГ по степени активации процессов роста уступал ПФД и позволял повысить выходы биомассы в 1,26-1,46 раза и увеличить антибактериальную активность получаемых культур в 1,2-1,4 раза. В другой работе (Кузин А.В. Перфторуглеродные соединения в комплексном лечении резистентных форм гастродуоденальных язв: дис. на соиск. уч. степ. канд. мед. наук / М.: 2004. - 138 с.) показано, что использование орошения перфтораном (действующим компонентом которого является перфтордекалин) гастродуоденальных язв, приводило к их скорейшему заживлению.
Недостатком используемых способов коррекции кишечного микробиоценоза является то, что они оказывают замедленный и ослабленный корригирующий эффект из-за низкой приживляемости микроорганизмов в биопленке и пониженный стимулирующий эффект для восстановления нормальной резидентной микрофлоры, что можно объяснить на основе одного из основных экологических законов - закона обеднения разнородного вещества в островных его сгущениях Г.Ф. Хильми (Хильми Г.Ф. Основы биофизики биосферы. Л.: Гидрометиоиздат, 1966. - 272 с.). В соответствии с этим законом индивидуальная система, существующая в среде с иным уровнем организации, постепенно теряет свою структуру, как бы растворяется в окружающей среде. Закон Г.Ф. Хильми связан с другим законом - оптимальности (Реймерс Н.Ф. Экология. Теории, законы, правила, принципы и гипотезы. - М.: 1994. - 367 с.) и в значительной степени отражает термодинамику малой системы, находящейся в чуждой среде. Наиболее полно закон обеднения разнородного вещества в островных его сгущениях Г.Ф. Хильми проявляется при пероральном поступлении, т.е. своеобразной интродукции пробиотиков в желудочно-кишечный тракт больного с выраженными дисбиотическими изменениями кишечной микрофлоры и низкой устойчивостью вводимых препаратов к стрессорным химическим, физическим и биологическим факторам внутренней среды желудочно-кишечного тракта (Погорельский И.П., Чичерин И.Ю., Лундовских И.А. Экологическая и функциональная маргинальность пробиотических микроорганизмов. Общество, наука, инновации: ежегод. открыт. верос. науч.-техн. конф. 16-27 апреля 2012 г.: сб. материалов Вят. Гос. ун-т; отв. ред. С.Г. Литвинец. Киров. 1 электрон. опт. Диск (CD-ROM). Секция «Микробиология»).
Общим существенными признаками с заявляемым способом указанных работ является применение пробиотиков, используемых для коррекции и регуляции кишечного биоценоза, и перфторуглеродных соединений, используемых для глубинного культивирования пробиотических культур и терапии гастродуоденальных язв путем их орошения.
III. Сущность изобретения заключается в следующем.
Была поставлена задача - разработать способ коррекции кишечного микробиоценоза путем использования пробиотиков в комплексе с перфторуглеродными соединениями.
Поставленная задача решается путем перорального приема комплексов, создаваемых из коммерческих медицинских или ветеринарных пробиотиков с эмульгированным перфтордекалином, с использованием в качестве эмульгатора пищевого лецитина.
Препараты пробиотиков, смешанные с перфтордекалином, приготовленным в соответствии с ТУ 95.1233-92 с изм. 1, 2, эмульгированным в физиологическом растворе хлористого натрия с использованием в качестве эмульгатора пищевого лецитина, при пероральном введении оказывают более эффективное корригирующее действие на кишечный микробиоценоз в комплексе мероприятий по профилактике и лечению желудочно-кишечных расстройств и нарушений иммунного статуса, вызванными дисбактериозами и их последствиями.
Сущность технического решения, способ коррекции кишечного микробиоценоза поясняется следующим. Попадание микробных препаратов в желудочно-кишечный тракт является мощным стрессовым фактором для автохтонного и аллохтонного компонентов корригируемого биоценоза, поэтому в состав препарата вводится в качестве мощного антистрессового компонента эмульгированный перфтордекалин, обеспечивающий улучшение условий коррекции микробного биоценоза в данной экологической нише, повышение эффективности действия пробиотиков (С.В. Дармова Перфторорганические соединения, стрессы и выживаемость микроорагнизмов / С.В. Дармова, М.К. Бакулин и др. Сборник «Наука - Производство - Технологии - Экология». - 2009. - С. 137-139).
При данном способе коррекции кишечного микробиоценоза путем приема внутрь комплексов, в которых используются только сертифицированные препараты, предназначенные для медицинского, ветеринарного или пищевого применения, прошедшие соответствующую аттестацию, и чья безопасность и полезность для человека и животных показана в результате многолетнего практического употребления.
Перфторорганическим соединением, предназначенным для реализации данного способа является перфторуглерод перфтордекалин, наиболее изученный из перфторуглеродов с точки зрения безвредности и полезности для человека при разработке медицинского препарата «Перфторана» и пробиотических микроорганизмов при разработке метода их глубинного культивирования. Перфтордекалин (ПФД, химическая формула - C10F18), ТУ 95.1233-92 бесцветная прозрачная негорючая жидкость без запаха, с вязкостью 2,74 мм2×сСт-1 при 25°С, плотностью 1,945 г/см3 и температурой кипения 155°С. ПФД не служит питательным веществом, не утилизируется микроорганизмами и является лучшим из перфторорганических соединений для использования в биотехнологических процессах в качестве мощного антистрессового фактора и одновременно активатора роста микробной культуры и продукции ими биологически активных веществ (Иваницкий Г.Р. Биофизика на пороге нового тысячелетия: перфторуглеродные среды и газотранспортные кровезаменители / Г.Р. Иваницкий // Биофизика. - 2001. - №1. - С. 5-33; Иваницкий Г.Р. Наноконтейнеры на основе перфторуглеродов с функцией переноса оксида азота / Г.Р. Иваницкий // Биофизика. - 2008. - №2. - С. 367-377; Бакулин М.К. Теория и практика использования перфторуглеродов «голубой крови» при глубинном культивировании биодеструкторов / М.К. Бакулин и др. Теоретическая и прикладная экология. - 2010. - №4. - С. 4-8).
Для человека и животных с большим запасом безопасности допустимая доза коммерческого препарата перфторана установлена в 30,0 см3/кг или 3,0 см3/кг перфтороруглеродов (2,1 см3/кг перфтордекалина и 0,9 см3/кг перфторметилциклогексилпиперидина), являющихся действующим компонентом перфторана. При этой дозе, как показали многочисленные эксперименты на различных животных и наблюдения в клинике, препарат не вызывает гемолитических эффектов, анафилактоидных реакций, не пирогенен, не ингибирует гемопоэз, не тератогенен и не эмбриотоксичен, не канцерогенен и не приводит к патологическим изменениям органов и не более токсичен, чем медицинская глюкоза (Медико-биологические аспекты применения эмульсий перфторуглеродов / Под ред. Белоярцева Ф.Ф. - Пущино, 1983. - 186 с.; Иваницкий Г.Р. Биофизические основы создания перфторуглеродных сред и газотранспортных кровезаменителей (обзор) / Иваницкий Г.Р. // Перфторорганические соединения в биологии и медицине. - Пущино, 2001. - С. 448).
При предлагаемом способе коррекции вначале, с использованием перемешивающих устройств (миксеры, гомогенизаторы и др.) или простым интенсивным встряхиванием рукой во флаконе в течение 2-3 минут, готовится эмульсия перфтордекалина, содержащая в 100 см3:
10,0 грамм перфтордекалина;
0,9 грамм NaCl;
0,1 грамм пищевого лецитина.
Затем в полученную эмульсию вводится используемый для коррекции один из препаратов пробиотиков из расчета содержания 1 дозы рекомендуемой инструкцией по применению препарата в объеме, предназначенном для перорального введения в организм: 0,5 см3 для мелких лабораторных животных (мыши, хомячки, морские свинки), которым препарат вводится с помощью иглы с оливой; 20,0 см3 для крупных домашних, сельскохозяйственных и лабораторных животных, которым препарат вводится с кормом; 10,0 см3 для приема человеком в соответствии с рекомендациями по основному микробному препарату. Перед использованием эмульсия перфтордекалина с введенным корригирующим микробным препаратом интенсивно встряхивается рукой во флаконе в течение 10-20 секунд.
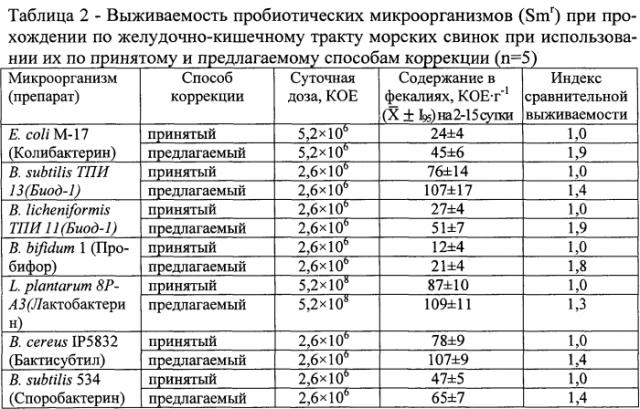
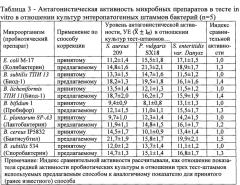
В результате использования предлагаемого способа в 1,2-1,5 раз возрастает антагонистическая активность микробных препаратов, что показано в экспериментах in vitro в отношении энтеропатогенных культур тест-штаммов Staphylococcus aureus 209, Proteus vulgaris SX18 и Salmonella enteritidis var. Danysz и в 1,2-1,9 раза увеличивается выживаемость пробиотических культур в желудочно-кишечном тракте экспериментальных животных (белые мыши и морские свинки), что показано на примере культур штаммов, выделенных из пробиотиков: Колибактерин (Escherichia coli М-17) Биод-5 (Bacillus subtilis ТПИ 13 и В. licheniformis ТПИ 11); Пробифор (В. bifidum 1); Лактобактерин (Lactobacillus plantarum 8Р-А3) Бактисубтил (В. cereus IP 5832) и Споробактерин (В. subtilis 534).
Выращивание пробиотических микроорганизмов проводили на плотных питательных средах рекомендованного состава, выживаемость микроорганизмов пробиотиков в желудочно-кишечном тракте экспериментальных животных оценивали в соответствии с рекомендуемой методикой (Иванов В.П., Совершенствование методов диагностики дисбактериоза толстого кишечника: информационное письмо / В.П. Иванов, А.Г. Бойцов, А.Д. Коваленко и др. - СПб.: Центр Госсанэпиднадзора, 2002. - 31 с.; Лихачева А.Ю., Бондаренко В.М., Соколова К.Я. Современное состояние вопроса таксономии бактерий рода Lactobacillus / А.Ю. Лихачева, В.М. Бондаренко, К.Я. Соколова // Журн. микробиол. - 1992. - №9-10. - С. 74-78; Методические рекомендации «Оценка безопасности наноматериалов». Утв. Приказом Роспотребнадзора от 12.10.2007 г. №280. - М.: Роспотребнадзор, 2001; Дармов И.В. Выживаемость микроорганизмов пробиотиков в желудочно-кишечном тракте экспериментальных животных / И.В. Дармов, И.Ю. Чичерин, И.П. Погорельский и др. Журнал инфектологии. - 2012. - Т.4. - №1. - С. 68-74).
При выращивании пробиотических микроорганизмов в микроаэрофильных условиях использовали систему для анаэробного культивирования Anaerobic system Mark III - LE003 (Hi Media Laboratories Pvt. Ltd, Мумбаи, Индия) с пакетами газогенераторными Hi Anaero Gas Facet.
Для изучения выживаемости пробиотических микроорганизмов в желудочно-кишечном тракте экспериментальных животных проводили маркирование пробиотических штаммов устойчивостью к 500 мкг/см3 стрептомицина, что позволяло дифференцировать их в фекалиях от культур бактерий собственной индигенной микрофлоры кишечника. Суть методики получения маркированных производных пробиотических культур микроорганизмов состоит в использовании 2-4 пересевов их на плотных питательных средах с повышающимися концентрациями стрептомицина и отборе спонтанных мутантов, сохраняющих видовые признаки.
Отобранные мутанты пробиотических культур, устойчивые к стрептомицину (Smr-мутанты), стабильно сохраняли признак антибиотико-резистентности. Изучение популяционного состава мутантных бактерий по признаку антибиотико-резистентности на плотных питательных средах, содержащих стрептомицин в концентрациях 150 мкг/см3, свидетельствовало о сохранении всеми популяциями исследуемых бактерий наследственно закрепленного признака устойчивости к стрептомицину (Smr-признака).
Мутантные бактерии сохраняли все свои исходные контролируемые культурально-морфологические, тинкториальные, антагонистические и биохимические признаки. Маркерный признак помогает выявить и идентифицировать бактерии маркированных пробиотических культур в фекалиях при высеве проб на селективные плотные питательные среды, на которой микроорганизмы индигенной микрофлоры не растут. Таким условиям удовлетворяют плотные питательные среды, содержащие 100 мкг/см3 стрептомицина, на котором способны расти R+ - (устойчивые к этому препарату) микроорганизмы.
Антагонистическую активность определяли на плотной среде путем нанесения 50 мкл выросшей пробиотической культуры полоской по диаметру чашки и подсева через 24 часа по 50 мкл взвеси суточной агаровой культуры тест-штаммов в концентрации 1·107 КОЕ·см-3 штрихом перпендикулярно к диаметральной полоске с последующим подращиванием культуры в течение 2 сут. Усредненный размер зон ингибирования роста в штрихах тест-культур в сравнении с контролем использовали в качестве условных единиц (УЕ) антибактериальной активности культуры.
Пример 1. Определение выживаемости пробиотических микроорганизмов (Smr) при прохождении по желудочно-кишечному тракту белых мышей и морских свинок при применении пробиотических культур по принятому (ранее известному) и предлагаемому способам коррекции (таблицы 1 и 2).
Пример 2. Определение антагонистической активности микробных препаратов в тесте in vitro в отношении культур энтеропатогенных штаммов бактерий Staphylococcus aureus 209, Proteus vulgaris SX18 и Salmonella enteritidis var. Danysz (таблица 3).
Способ коррекции кишечного микробиоценоза с использованием микробных культур Е. coli М-17, В. subtilis ТПИ 13, В. licheniformis ТПИ 11, В. Bifidum 1, L. plantarum 8Р-А3, В. cereus IP5832, В. subtilis 534, входящих в состав препаратов пробиотиков Колибактерин, Биод-5, Пробифор, Лактобактерин, Бактисубтил, Споробактерин, отличающийся тем, что суточные дозы указанных микробных культур перед применением смешиваются с эмульсией перфтордекалина на физиологическом растворе, содержащим в 100 см3:10,0 грамм перфтордекалина;0,9 грамм NaCl;0,1 грамм пищевого лецитина,а затем вводятся мелким лабораторным животным в объеме 0,5 см3, крупным домашним, сельскохозяйственным и лабораторным животным - в объеме 20,0 см3, для приема человеком - в объеме 10,0 см3.