Спиро-аминосоединения, пригодные для лечения нарушений сна и лекарственного привыкания
Иллюстрации
Показать всеИзобретение имеет отношение к спиро-аминосоединению формулы (VI), где m представляет собой 1 или 2 или 3, n представляет собой 1 или 2, R выбирают из 6-членного ароматического кольца и 5-членного гетероароматического кольца, содержащего от 1 до 2 гетероатомов, выбранных из S и N, причем такое кольцо является замещенным одним или двумя заместителями, выбранными из группы, состоящей из (С1-С3)алкила, атома галогена, (С3-С5)циклоалкилоксигруппы, фенила, необязательно замещенного одним или более атомами галогена, 5- или 6- членного гетероцикла, содержащего, по меньшей мере, один атом азота, выбираемого из 1,2,3-триазола, пиримидина, пиридина и пиразина; Р представляет собой заместитель Q, где Q выбирают из группы, состоящей из фенила, пиридила, пиримидила, при этом Q необязательно замещен одним или более заместителями, выбранными из группы, состоящей из (С1-С3)алкила, галогена, трифторметила, метилкарбоксигруппы. Изобретение также относится к спиро-аминосоединению формулы (VI), где m представляет собой 1 или 3, n представляет собой 1 или 2, R представляет собой фенил, замещенный заместителем циклопропил (С1-С3)алкокси, Р представляет собой заместитель Q, где Q выбирают из группы, состоящей из фенила, пиридила, пиримидила, при этом Q необязательно замещен одним или более заместителями, выбранными из группы, состоящей из (С1-С3)алкила, галогена, трифторметила, метилкарбоксигруппы. Соединения формулы IV предназначены для производства медикамента для лечения патологий, при которых необходимо применение антагониста орексинового рецептора 1. Технический результат - спиро-аминосоединения, обладающие антагонистической активностью к орексиновому рецептору. 3 н. и 16 з.п. ф-лы, 99 пр.
Реферат
Область техники, к которой относится изобретение
Изобретение имеет отношение к новым спиро-аминосоединениям, обладающим антагонистической активностью к орексиновому рецептору 1.
Изобретение также имеет отношение к способу получения таких соединений, фармацевтическим композициям, содержащим одно или более соединений формулы (VI), и их применению в качестве антагонистов орексинового рецептора 1.
Уровень техники
Орексины являются нейропептидами, открытыми в 1998 двумя группами исследователей. Орексин А представляет собой пептид, состоящий из 33 аминокислот, а орексин В - пептид, состоящий из 28 аминокислот. Орексины секретируются отдельной группой нейронов в боковой части гипоталамуса и связываются с сопряженными с G-белком рецепторами, а именно OX1 и OX2. Орексиновый рецептор 1 (OX1) селективно связывает орексин А, а орексиновый рецептор 2 (OX2) способен связывать и орексин А и орексин В.
Известно, что орексины стимулируют потребление корма крысами, таким образом, подтверждая свою модулирующую роль в механизмах, связанных с потреблением пищи.
Кроме того, было показано, что орексины регулируют структуру сна и тем самым создают возможность потенциально новых терапевтических способов лечения нарколепсии, а также инсомнии и других нарушений сна. Недавно было показано, что орексины участвуют в механизмах привыкания, таким образом, применение их в качестве модуляторов может предоставить возможность лечения компульсивных нарушений и привыкания к наркотическим средствам. Орексиновые рецепторы располагаются в мозге млекопитающих и принимают участие в некоторых патологических процессах.
В международной патентной заявке WO 2009/016560 ряд производных транс-3-аза-бицикло[3.1.0]гексана раскрываются как орексиновые антагонисты.
Новые производные пирролидина и пиперидина были раскрыты в WO 2009/040730, производные N-ароил-циклических аминов были раскрыты в международной патентной заявке WO 02/090355, а пиперазиновые соединения в WO 03/051873, все они являются новыми структурами, предложенными в качестве антагонистов орексиновых рецепторов,
Ряд производных N-ароил-циклических аминов раскрывается в международной патентной заявке WO 2004/026866 как непептидные антагонисты орексиновых рецепторов человека. В частности, 43 пиперидиновых соединения, в которых бета положение при атоме азота было замещено водородом или метальными группами, были проверены на активность по отношению к рецепторам OХ1 и OХ2.
В этих документах описываются соединения, обладающие активностью по отношению к двум типам рецепторов.
Целью настоящего изобретения является предоставление соединений, обладающих селективной антагонистической активностью к орексиновому рецептору 1.
Раскрытие изобретения
Цель настоящего изобретения достигается посредством спиро-аминосоединения формулы (VI):
где
m представляет собой 1 или 2 или 3
n представляет собой 1 или 2,
R выбирают из 5- или 6-членного ароматического кольца и 5- или 6-членного гетероароматического кольца, содержащего от 1 до 3 гетероатомов, выбранных из S, О и N, причем такое кольцо является замещенным одним или двумя заместителями, выбранными из группы, состоящей из (С1-С3)алкила, галогена, (С3-С5)циклоалкилоксигруппы, (С1-С3)алкилкарбонила, фенила, необязательно замещенного одним или более атомами галогена, 5- или 6-членного гетероцикла, содержащего, по меньшей мере, один атом азота;
P представляет собой заместитель Q или COQ, где Q представляет собой группу, выбранную из фенила, пиридила, пиримидила, хинолила, изохинолила, хиноксалила, бензофуранила, имидазотриазолила, при этом Q необязательно замещен одним или более заместителями, выбранными из группы, состоящей из (С1-С3)алкила, галогена, трифторметила, карбамидной группы, метилкарбамидной группы, карбоксигруппы; метилкарбоксигруппы,
или его фармацевтически приемлемой соли.
В этом изобретении соединения формулы (VI) могут существовать в виде R и S энантиомеров и в виде рацемической смеси. Это изобретение включает в объем правовой охраны все возможные изомеры и рацемические смеси. Где бы ни находились дополнительные центры симметрии, это изобретение включает все возможные диастереоизомеры, а также соответствующие смеси.
В первом варианте осуществления в спиро-аминосоединении формулы (VI) Р представляет собой Q. Это соединение имеет формулу (VIa):
Во втором варианте осуществления в спиро-аминосоединении формулы (VI) Р представляет собой COQ. Это соединение имеет формулу (VIb):
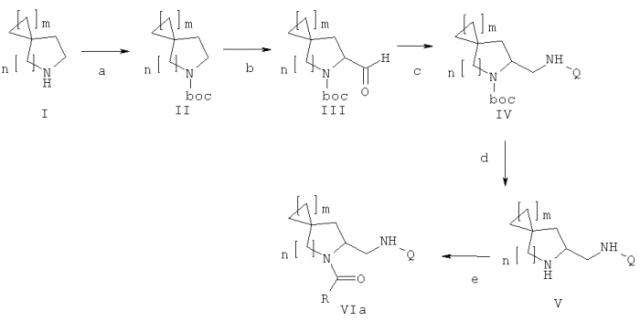
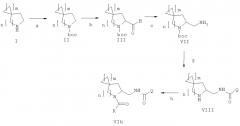
Дополнительный аспект данного изобретения касается способа получения соединения формулы (VIa), включающего следующие стадии, представленные на схеме:
a) защита соединения формулы (I) защитной группой ВОС для получения соединения формулы (II);
b) взаимодействие соединения формулы (II) с сильными основаниями и диметилформамидом, что дает соединение формулы (III);
c) добавление амина формулы Q-NH2, где Q выбирают из группы, состоящей из фенила, пиридила, пиримидила, хинолила, изохинолила, хиноксалила, бензофуранила, имидазотриазолила, такой Q необязательно замещен одним или более заместителями, выбранными из группы, состоящей из (C1-C3)алкила, галогена, трифторметила, карбамидной группы, метилкарбамидной группы, карбоксигруппы, метилкарбоксигруппы, в присутствии восстановителя для получения соединения формулы (IV);
d) отщепление BOC-группы от соединения формулы (IV) для получения соединения формулы (V);
e) взаимодействие соединения формулы (V) с RCOOH в присутствии агентов сочетания или с соответствующими хлорангидридами RCOCl в присутствии основания, где R выбирают из 5- или 6-членного ароматического кольца и 5- или 6-членного гетероароматического кольца, содержащего от 1 до 3 гетероатомов, выбранных из S, О и N, причем такое кольцо является замещенным одним или двумя заместителями, выбранными из группы, состоящей из (С1-С3)алкила, галогена, (С3-С5)циклоалкоксигруппы, (С1-С3)алкилкарбонила, фенила, необязательно замещенного одним или более атомами галогена, 5- или 6-членного гетероцикла, содержащего, по меньшей мере, один атом азота.
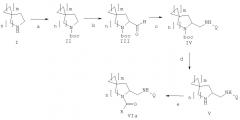
В дополнительном аспекте данное изобретение касается способа получения соединения формулы (VIb), включающего следующие стадии, представленные на схеме ниже:
a) защита соединения формулы (I) защитной группой ВОС с получением соединения формулы (II);
b) взаимодействие соединения формулы (II) с сильными основаниями и диметилформамидом, что дает соединение формулы (III);
f) проведение восстановительного аминирования соединения формулы (III) с получением амина формулы (VII);
g) взаимодействие соединения формулы (VII) с QCOOH в присутствии агентов сочетания или с соответствующими хлорангидридами QCOCl в присутствии основания с получением амида формулы (VIII), где Q является группой, выбранной из фенила, пиридила, пиримидила, хинолила, изохинолила, хиноксалила, бензофуранила, имидазотриазолила, такой Q необязательно замещен одним или более заместителями, выбранными из группы, состоящей из (C1-C3)алкила, галогена, трифторметила, карбамидной группы, метилкарбамидной группы, карбоксигруппы, метилкарбоксигруппы;
h) отщепление BOC-группы от соединения формулы (VIII) и взаимодействие с RCOOH в присутствии агентов сочетания или с соответствующими хлорангидридами RCOCl в присутствии основания с получением соединения формулы VIb, где R выбирают из 5- или 6-членного ароматического кольца и 5- или 6-членного гетероароматического кольца, содержащего от 1 до 3 гетероатомов, выбранных из S, О и N, причем такое кольцо является замещенным одним или более заместителями, выбранными из группы, состоящей из (С1-С3)алкила, галогена, (С3-С5)циклоалкилоксигруппы, (С1-С3)алкилкарбонила, фенила, необязательно замещенного одним или более атомами галогена, 5- или 6-членного гетероцикла, содержащего, по меньшей мере, один атом азота.
В другом аспекте изобретение имеет отношение к фармацевтической композиции, содержащей соединение формулы (VI), предпочтительно (VIa), и фармацевтически приемлемый носитель.
В другом аспекте изобретение имеет отношение к соединению формулы (VI) как лекарственному средству, в частности это касается его применения для производства медикамента для лечения патологий, при которых необходим антагонист рецептора OХ1, например, в случае лечения ожирения, нарушений сна, компульсивных расстройств (навязчивых состояний), лекарственной зависимости (наркомании), шизофрении.
Осуществление изобретения
Таким образом, изобретение имеет отношение к спиро-аминосоединению формулы (VI):
где
m является 1 или 2 или 3,
n представляет собой 1 или 2,
R выбирают из 5- или 6-членного ароматического кольца и 5- или 6-членного гетероароматического кольца, содержащего от 1 до 3 гетероатомов, выбранных из S, О и N, причем такое кольцо является замещенным одним или двумя заместителями, выбранными из группы, состоящей из (С1-С3)алкила, галогена, (С3-С5)циклоалкилоксигруппы, (С1-С3)алкилкарбонила, фенила, необязательно замещенного одним или более атомами галогена, 5- или 6-членного гетероцикла, содержащего, по меньшей мере, один атом азота;
Р представляет собой заместитель Q или COQ, где Q представляет собой группу, выбранную из фенила, пиридила, пиримидила, хинолила, изохинолила, хиноксалила, бензофуранила, имидазотриазолила, такой Q необязательно замещен одним или двумя заместителями, выбранными из (С1-С3)алкила, галогена, трифторметила, карбамидной группы, метилкарбамидной группы, карбоксигруппы, метилкарбоксигруппы;
или его фармацевтически приемлемой соли.
В первом варианте осуществления в спиро-аминосоединении формулы (VI) Р представляет собой Q. Это соединение имеет формулу (VIa):
В этом варианте осуществления предпочтительно n представляет собой 2, а m является 1.
Предпочтительно первый вариант осуществления изобретения относится к соединению с пиперидиновым циклом, в котором кольцо из трех спироуглеродных атомов находится в гамма-положении к атому азота. Предпочтительно R представляет собой фенил или гетероциклическое кольцо.
Более предпочтительно, когда R представляет собой гетероциклическое кольцо, оно является тиазольным кольцом, даже более предпочтительно тиазольным кольцом, замещенным, по меньшей мере, одним заместителем, выбранным из группы, состоящей из метила, фенила, фенила, замещенного одним или более галогенами.
Более предпочтительно, когда R представляет собой фенил, этот фенил может замещаться группой, выбранной из циклопропил(С1-С3)алкилоксигруппы, триазолила, пиримидила.
Предпочтительно Q представляет собой пиридильное кольцо, даже более предпочтительно пиридил, замещенный одним или более заместителями, выбранными из группы, состоящей из трифторметила, карбоксигруппы, метилкарбоксигруппы, метила и галогена.
Предпочтительные соединения изобретения выбирают из группы, состоящей из:
метил 5-хлор-2-(((6-(5-(4-фторфенил)-2-метилтиазол-4-карбонил)-6-азаспиро[2.5]октан-5-ил)метил)амино)бензоата
(2-метил-5-фенилтиазол-4-ил)(5-(((5-(трифторметил)пиридин-2-ил)амино)метил)-6-азаспиро[2.5]октан-6-ил)метанона
(2-метил-5-фенилтиазол-4-ил)(5-(((6-метилпиридин-2-ил)амино)метил)-6-азаспиро[2.5]октан-6-ил)метанона
(2-метил-5-фенилтиазол-4-ил)(7-(((6-метилпиридин-2-ил)амино)метил)-8-азаспиро[4.5]декан-8-ил)метанона
(5-(((5-хлорпиридин-2-ил)амино)метил)-6-азаспиро[2.5]октан-6-ил)(2-(циклопропилметокси)фенил)метанона
(5-(((5-хлорпиридин-2-ил)амино)метил)-6-азаспиро[2.5]октан-6-ил)(2-(пиримидин-2-ил)фенил)метанона
(5-(((5-хлорпиридин-2-ил)амино)метил)-6-азаспиро[2.5]октан-6-ил)(2-метил-5-фенилтиазол-4-ил)метанона
(5-(((5-хлорпиридин-2-ил)амино)метил)-6-азаспиро[2.5]октан-6-ил)(5-(4-фторфенил)-2-метилтиазол-4-ил)метанона
(5-(((5-хлорпиридин-2-ил)амино)метил)-6-азаспиро[2.5]октан-6-ил)(5-метил-2-(2Н-1,2,3-триазол-2-ил)фенил)метанона
(5-(((5-хлорпиридин-2-ил)амино)метил)-6-азаспиро[2.5]октан-6-ил)(5-метил-2-(пиримидин-2-ил)фенил)метанона
(5-(((5-фторпиридин-2-ил)амино)метил)-6-азаспиро[2.5]октан-6-ил)(2-метил-5-фенилтиазол-4-ил)метанона
(7-(((5-хлорпиридин-2-ил)амино)метил)-8-азаспиро[4.5]декан-8-ил)(2-метил-5-фенилтиазол-4-ил)метанона
(R)-(2-метил-5-фенилтиазол-4-ил)(5-(((6-метилпиридин-2-ил)амино)метил)-6-азаспиро[2.5]октан-6-ил)метанона
(R)-(5-(((5-хлорпиридин-2-ил)амино)метил)-6-азаспиро[2.5]октан-6-ил)(2-метил-5-фенилтиазол-4-ил)метанона
(R)-(5-(((5-хлорпиридин-2-ил)амино)метил)-6-азаспиро[2.5]октан-6-ил)(5-фтор-2-(пиримидин-2-ил)фенил)метанона
(R)-(5-метил-2-(пиразин-2-ил)фенил)(5-(((6-(трифторметил)пиридин-2-ил)амино)метил)-6-азаспиро[2.5]октан-6-ил)метанона
(S)-(2,5-дихлорфенил)(5-(((4,б-диметилпиримидин-2-ил)амино)метил)-6-азаспиро[2.5]октан-6-ил)метанона
(S)-(2-(2Н-1,2,3-триазол-2-ил)фенил)(5-(((5-хлорпиридин-2-ил)амино)метил)-6-азаспиро[2.5]октан-6-ил)метанона
(S)-(2-метил-5-фенилтиазол-4-ил)(5-(((4-метилпиримидин-2-ил)амино)метил)-6-азаспиро[2.5]октан-6-ил)метанона
(S)-(2-метил-5-фенилтиазол-4-ил)(5-(((5-(трифторметил)пиридин-2-ил)амино)метил)-6-азаспиро[2.5]октан-6-ил)метанона
(S)-(2-метил-5-фенилтиазол-4-ил)(5-(((5-метилпиримидин-2-ил)амино)метил)-6-азаспиро[2.5]октан-6-ил)метанона
(S)-(2-метил-5-фенилтиазол-4-ил)(5-(((6-(трифторметил)пиридин-2-ил)амино)метил)-6-азаспиро[2.5]октан-6-ил)метанона
(S)-(2-метил-5-фенилтиазол-4-ил)(5-(((6-метилпиридин-2-ил)амино)метил)-6-азаспиро[2.5]октан-6-ил)метанона
(S)-(5-(((4,6-дифторпиримидин-2-ил)амино)метил)-6-азаспиро[2.5]октан-6-ил)(2-метил-5-фенилтиазол-4-ил)метанона
(S)-(5-(((4,6-диметилпиримидин-2-ил)амино)метил)-6-азаспиро[2.5]октан-6-ил)(2-метил-5-фенилтиазол-4-ил)метанона
(S)-(5-(((5-хлорпиридин-2-ил)амино)метил)-6-азаспиро[2.5]октан-6-ил)(2-(пиразин-2-ил)фенил)метанона
(S)-(5-(((5-хлорпиридин-2-ил)амино)метил)-6-азаспиро [2.5]октан-6-ил)(2-(пиримидин-2-ил)фенил)метанона
(S)-(5-(((5-хлорпиридин-2-ил)амино)метил)-6-азаспиро[2.5]октан-6-ил)(2-фтор-6-(2Н-1,2,3-триазол-2-ил)фенил)метанона
(S)-(5-(((5-хлорпиридин-2-ил)амино)метил)-6-азаспиро[2.5]октан-6-ил)(2-фтор-6-(пиридин-2-ил)фенил)метанона
(S)-(5-(((5-хлорпиридин-2-ил)амино)метил)-6-азаспиро[2.5]октан-6-ил)(2-фтор-6-(пиримидин-2-ил)фенил)метанона
(S)-(5-(((5-хлорпиридин-2-ил)амино)метил)-6-азаспиро[2.5]октан-6-ил)(2-метил-5-фенилтиазол-4-ил)метанона
(S)-(5-(((5-хлорпиридин-2-ил)амино)метил)-6-азаспиро[2.5]октан-6-ил)(5-фтор-2-(2Н-1,2,3-триазол-2-ил)фенил)метанона
(S)-(5-(((5-хлорпиридин-2-ил)амино)метил)-6-азаспиро[2.5]октан-6-ил)(5-фтор-2-(пиразин-2-ил)фенил)метанона
(S)-(5-(((5-хлорпиридин-2-ил)амино)метил)-6-азаспиро[2.5]октан-6-ил)(5-фтор-2-(пиридин-2-ил)фенил)метанона
(S)-(5-(((5-хлорпиридин-2-ил)амино)метил)-6-азаспиро[2.5]октан-6-ил)(5-фтор-2-(пиримидин-2-ил)фенил)метанона
(S)-(5-(((5-хлорпиридин-2-ил)амино)метил)-6-азаспиро[2.5]октан-6-ил)(5-метил-2-(пиридин-2-ил)фенил)метанона
(S)-(5-(((5-хлорпиридин-2-ил)амино)метил)-6-азаспиро[2.5]октан-6-ил)(5-метил-2-(пиримидин-2-ил)фенил)метанона
(S)-(5-(((5-фторпиридин-2-ил)амино)метил)-6-азаспиро[2.5]октан-6-ил)(2-метил-5-фенилтиазол-4-ил)метанона
(S)-(5-(((6-хлорпиридин-2-ил)амино)метил)-6-азаспиро[2.5]октан-6-ил)(2-метил-5-фенилтиазол-4-ил)метанона
(S)-(5-(((6-хлорпиридин-2-ил)амино)метил)-6-азаспиро[2.5]октан-6-ил)(5-метил-2-(2Н-1,2,3-триазол-2-ил)фенил)метанона
(S)-(5-(((6-хлорпиридин-2-ил)амино)метил)-6-азаспиро[2.5]октан-6-ил)(5-метил-2-(пиразин-2-ил)фенил)метанона
(S)-(5-(((6-хлорпиридин-2-ил)амино)метил)-6-азаспиро[2.5]октан-6-ил)(5-метил-2-(пиримидин-2-ил)фенил)метанона
(S)-(5-(((6-фторпиридин-2-ил)амино)метил)-6-азаспиро[2.5]октан-6-ил)(2-метил-5-фенилтиазол-4-ил)метанона
(S)-(5-метил-2-(2Н-1,2,3-триазол-2-ил)фенил)(5-(((5-(трифторметил)пиридин-2-ил)амино)метил)-6-азаспиро[2.5]октан-6-ил)метанона
(S)-(5-метил-2-(2Н-1,2,3-триазол-2-ил)фенил)(5-(((6-(трифторметил)пиридин-2-ил)амино)метил)-6-азаспиро[2.5]октан-6-ил)метанона
(S)-(5-метил-2-(пиразин-2-ил)фенил)(5-(((6-(трифторметил)пиридин-2-ил)амино)метил)-6-азаспиро[2.5]октан-6-ил)метанона
(S)-(5-метил-2-(пиримидин-2-ил)фенил)(5-(((5-(трифторметил)пиридин-2-ил)амино)метил)-6-азаспиро[2.5]октан-6-ил)метанона
(S)-(5-метил-2-(пиримидин-2-ил)фенил)(5-(((6-(трифторметил)пиридин-2-ил)амино)метил)-6-азаспиро[2.5]октан-6-ил)метанона
(S)-[1,1'-бифенил]-2-ил(5-(((4,б-диметилпиримидин-2-ил)амино)метил)-6-азаспиро[2.5]октан-6-ил)метанона
(7-(((5-хлорпиридин-2-ил)амино)метил)-8-азаспиро[4.5]декан-8-ил)(2-метил-5-фенилтиазол-4-ил)метанона
(2-метил-5-фенилтиазол-4-ил)(7-(((6-метилпиридин-2-ил)амино)метил)-8-азаспиро[4.5]декан-8-ил)метанона
(S)-(6-(((5-хлорпиридин-2-ил)амино)метил)-5-азаспиро[2.4]гептан-5-ил)(5-метил-2-(2Н-1,2,3-триазол-2-ил)фенил)метанона
(S)-(5-метил-2-(2Н-1,2,3-триазол-2-ил)фенил)(6-(((6-метилпиридин-2-ил)амино)метил)-5-азаспиро[2.4]гептан-5-ил)метанона
(S)-(6-(((5-хлорпиридин-2-ил)амино)метил)-5-азаспиро[2.4]гептан-5-ил)(5-метил-2-(пиримидин-2-ил)фенил)метанона
В первом варианте осуществления изобретения, когда m=2, n предпочтительно равно 2.
В этом варианте осуществления:
- Q предпочтительно выбирают из пиридила, пиридила, замещенного одним или более заместителями, выбранными из (С1-С3)алкила, трифторметила, галогена; и
- R выбирают из фенила и 5-членного гетероароматического кольца, содержащего два гетероатома, выбранных из S, О и N, причем такое кольцо является замещенным одним заместителем, выбранным из (С1-С3)алкила, пиримидила, тиазолила, фенила, необязательно замещенного одним или более атомами галогена.
Предпочтительными соединениями в тех случаях, когда m=2, являются:
(2-метил-5-фенилтиазол-4-ил)(6-((6-метилпиридин-2-иламино)метил)-7-азаспиро[3.5]нонан-7-ил)метанон
(5-(4-фторфенил)-2-метилтиазол-4-ил)(6-((6-метилпиридин-2-иламино)метил)-7-азаспиро[3.5]нонан-7-ил)метанон
(6-((5-хлорпиридин-2-иламино)метил)-7-азаспиро[3.5]нонан-7-ил)(2-метил-5-фенилтиазол-4-ил)метанон
(6-((5-хлорпиридин-2-иламино)метил)-7-азаспиро[3.5]нонан-7-ил)(5-(4-фторфенил)-2-метилтиазол-4-ил)метанон
(5-метил-2-(2Н-1,2,3-триазол-2-ил)фенил)(6-((6-метилпиридин-2-иламино)метил)-7-азаспиро[3.5]нонан-7-ил)метанон
(5-метил-2-(пиримидин-2-ил)фенил)(6-((6-метилпиридин-2-иламино)метил)-7-азаспиро[3.5]нонан-7-ил)метанон
(6-((5-хлорпиридин-2-иламино)метил)-7-азаспиро[3.5]нонан-7-ил)(5-метил-2-(2Н-1,2,3-триазол-2-ил)фенил)метанон
(6-((5-хлорпиридин-2-иламино)метил)-7-азаспиро[3.5]нонан-7-ил)(5-метил-2-(пиримидин-2-ил)фенил)метанон
(2-метил-5-фенилтиазол-4-ил)(6-((5-(трифторметил)пиридин-2-иламино)метил)-7-азаспиро[3.5]нонан-7-ил)метанон
(5-(4-фторфенил)-2-метилтиазол-4-ил)(6-((5-(трифторметил)пиридин-2-иламино)метил)-7-азаспиро[3.5]нонан-7-ил)метанон
(5-метил-2-(2Н-1,2,3-триазол-2-ил)фенил)(6-((5-(трифторметил)пиридин-2-иламино)метил)-7-азаспиро[3.5]нонан-7-ил)метанон
(5-метил-2-(пиримидин-2-ил)фенил)(б-((5-(трифторметил)пиридин-2-иламино)метил)-7-азаспиро[3.5]нонан-7-ил)метанон.
Когда m=3, n предпочтительно равно 2.
В этом варианте осуществления:
- Q предпочтительно выбирают из пиридила, пиридила, замещенного трифторметилом; пиридила, замещенного (С1-С3)алкилом;
- R предпочтительно выбирают из фенила и 5-членного гетероароматического кольца, содержащего два гетероатома, выбранных из S, О и N, причем такой R является замещенным одним или двумя заместителями, выбранными из (С1-С3)алкила, галогена, пиримидила, тиазолила, фенила, необязательно замещенного одним или двумя атомами галогена.
Более предпочтительно, Q представляет собой пиридил, замещенный трифторметилом или пиридил, замещенный (С1-С3)алкилом, а R представляет собой 5-членное гетероароматическое кольцо, содержащее два гетероатома, выбранных из S, О и N, еще более предпочтительно тиазолил, причем такой R является замещенным одним или двумя заместителями, выбранными из (С1-С3)алкила и галогена.
Предпочтительными соединениями в тех случаях, когда n=3, являются:
(2-метил-5-р-толилтиазол-4-ил)(7-((5-(трифторметил)пиридин-2-иламино)метил)-8-азаспиро[4.5]декан-8-ил)метанон
(5-(4-фторфенил)-2-метилтиазол-4-ил)(7-((5-(трифторметил)пиридин-2-иламино)метил)-8-азаспиро[4.5]декан-8-ил)метанон
(±)(2-метил-5-фенилтиазол-4-ил)(7-(((6-метилпиридин-2-ил)амино)метил)-8-азаспиро[4.5]декан-8-ил)метанон
(±)(7-(((5-хлорпиридин-2-ил)амино)метил)-8-азаспиро[4.5]декан-8-ил)(2-метил-5-фенилтиазол-4-ил)метанон
(5-метил-2-(2Н-1,2,3-триазол-2-ил)фенил)(7-((5-(трифторметил)пиридин-2-иламино)метил)-8-азаспиро[4.5]декан-8-ил)метанон
(5-метил-2-(пиримидин-2-ил)фенил)(7-((5-(трифторметил)пиридин-2-иламино)метил)-8-азаспиро[4.5]декан-8-ил)метанон.
Когда n=1, m предпочтительно равно 1.
В этом варианте осуществления:
- Q предпочтительно выбирают из пиридила, пиридила, замещенного одним или более галогенами; пиридила, замещенного (С1-С3)алкилом;
- R предпочтительно выбирают из фенила и 5-членного гетероароматического кольца, содержащего два или три гетероатома, выбранных из S, О и N, причем такой R является замещенным одним или двумя заместителями, выбранными из (С1-С3)алкила, галогена, пиримидила, тиазолила, фенила, необязательно замещенного одним или более атомами галогена, 5- или 6-членного гетероцикла, содержащего, по меньшей мере, один атом азота.
- Более предпочтительно, Q представляет собой пиридил, замещенный одним или более галогенами; пиридил, замещенный (С1-С3)алкилом, а R представляет собой фенил, замещенный одним или двумя заместителями, выбранными из (С1-С3)алкила и 5- или 6-членного гетероцикла, содержащего, по меньшей мере, один атом азота.
Предпочтительными соединениями в тех случаях, когда m=1, являются:
(6-((5-хлорпиридин-2-иламино)метил)-5-азаспиро[2.4]гептан-5-ил)(5-метил-2-(2Н-1,2,3-триазол-2-ил)фенил)метанон
(6-((5-хлорпиридин-2-иламино)метил)-5-азаспиро[2.4]гептан-5-ил)(5-метил-2-(пиримидин-2-ил)фенил)метанон;
S)-(6-(((5-хлорпиридин-2-ил)амино)метил)-5-азаспиро[2.4]гептан-5-ил)(5-метил-2-(2Н-1,2,3 -триазол-2-ил)фенил)метанон
8)-(5-метил-2-(2Н-1,2,3-триазол-2-ил)фенил)(6-(((6-метилпиридин-2-ил)амино)метил)-5-азаспиро[2.4]гептан-5-ил)метанон
8)-(б-(((5-хлорпиридин-2-ил)амино)метил)-5-азаспиро[2.4]гептан-5-ил)(5-метил-2-(пиримидин-2-ил)фенил)метанон
Во втором варианте осуществления в спиро-аминосоединении формулы (VI) Р представляет собой COQ. Это соединение имеет формулу (VIb):
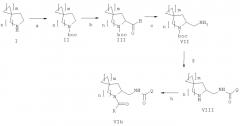
Изобретение также имеет отношение к способу получения соединения формулы (Via), включающему следующие стадии, представленные в схеме ниже:
a) защита соединения формулы (I) защитной группой BOC с получением соединения формулы (II);
b) взаимодействие соединения формулы (II) с сильными основаниями и диметилформамидом, что дает соединение формулы (III);
c) добавление амина формулы Q-NH2, где Q выбирают из группы, состоящей из фенила, пиридила, пиримидила, хинолила, изохинолила, хиноксалила, бензофуранила, имидазотриазолила, причем такой Q необязательно замещен одним или более заместителями, выбранными из группы, состоящей из (С1-С3)алкила, галогена, трифторметила, карбамидной группы, метилкарбамидной группы, карбоксигруппы, метилкарбоксигруппы, в присутствии восстановителя для получения соединения формулы (IV);
d) отщепление BOC-группы от соединения формулы (IV) для получения соединения формулы (V);
e) взаимодействие соединения формулы (V) с RCOOH в присутствии агентов сочетания или с соответствующими хлорангидридами RCOCl в присутствии основания, где R выбирают между 5- или 6-членным ароматическим кольцом и 5- или 6-членным гетероароматическим кольцом, содержащим от 1 до 3 гетероатомов, выбранных из S, О и N, причем такое кольцо является замещенным одним или двумя заместителями, выбранными из группы, состоящей из (С1-С3)алкила, галогена, (С3-С5)циклоалкилоксигруппы, (С1-С3)алкилкарбонила, фенила, необязательно замещенного одним или более атомами галогена, 5- или 6-членного гетероцикла, содержащего, по меньшей мере, один атом азота.
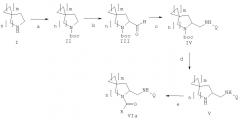
Кроме того, изобретение имеет отношение к способу получения соединения формулы (VIb), включающему следующие стадии, представленные в схеме ниже:
a) защита соединения формулы (I) защитной группой ВОС для получения соединения формулы (II);
b) взаимодействие соединения формулы (II) с сильными основаниями и диметилформамидом, что дает соединение формулы (III);
f) проведение восстановительного аминирования соединения формулы (III) для получения амина формулы (VII);
g) взаимодействие соединения формулы (VII) с QCOOH в присутствии агентов сочетания или с соответствующими хлорангидридами RCOCl в присутствии основания для получения амида формулы (VIII), где Q выбирают из группы, состоящей из фенила, пиридила, пиримидила, хинолила, изохинолила, хиноксалила, бензофуранила, имидазотриазолила, причем такой Q необязательно замещен одним или более заместителями, выбранными из группы, состоящей из (С1-С3)алкила, галогена, трифторметила, карбамидной группы, метилкарбамидной группы, карбоксигруппы, метилкарбоксигруппы;
h) отщепление ВОС-группы от соединения формулы (VIII) и взаимодействие с RCOOH в присутствии агентов сочетания или с соответствующими хлорангидридами RCOCl в присутствии основания, чтобы получить соединение формулы VIb, где R выбирают между 5- или 6-членным ароматическим кольцом и 5- или 6-членным гетероароматическим кольцом, содержащим от 1 до 3 гетероатомов, выбранных из S, О и N, причем такое кольцо является замещенным одним или двумя заместителями, выбранными из группы, состоящей из (С1-С3)алкила, галогена, (С3-С5)циклоалкилоксигруппы, (С1-С3)алкилкарбонила, фенила, необязательно замещенного одним или более атомами галогена, 5- или 6-членного гетероцикла, содержащего, по меньшей мере, один атом азота.
Соединения формулы (I) стадии а) являются или коммерчески доступными и/или описаны в литературе. На стадии b) в числе сильных оснований может использоваться втор-бутиллитий (втор-BuLi).
В наиболее предпочтительном варианте осуществления изобретение имеет отношение к пиперидиновым соединениям, содержащим спирокольцо из трех атомов углерода.
Кроме того, дополнительной целью изобретения является получение соединений формулы VIa, где m=1 и n=2, включающее следующие стадии:
а) взаимодействие соединения формулы (I) с трет-бутил дикарбонатом в органическом растворителе с получением соединения формулы (II);
b) взаимодействие соединений формулы (II) с сильным основанием и диметилформамидом с получением соединения формулы (III)
или взаимодействие соединений формулы (II) с основанием и N,N,N'N'-тетраметил этилендиамином при -60°C в органическом растворителе и затем с диметилформамидом при -78°C;
с) взаимодействие соединений формулы (III) с соединениями формулы Q-NH2 при использовании восстановителя в органическом растворителе в течение примерно 18 часов при комнатной температуре с получением соединений формулы (IV), где Q выбирают из группы, состоящей из фенила, пиридила, пиримидила, хинолила, изохинолила, хиноксалила, бензофуранила, имидазотриазолила, причем такой Q необязательно замещен одним или более заместителями, выбранными из группы, состоящей из (С1-С3)алкила, галогена, трифторметила, карбамидной группы, метилкарбамидной группы, карбоксигруппы, метилкарбоксигруппы;
d) взаимодействие соединений формулы (IV) с трифторуксусной кислотой в подходящем органическом растворителе в течение примерно 4 часов с получением соединений формулы (V);
е) взаимодействие соединений формулы (V) с соединениями формулы RCOOH с использованием подходящего конденсирующего агента и основания в органическом растворителе в течение примерно 18 часов с получением соединений формулы (Via), где R выбирают из 5- или 6-членного ароматического кольца и 5- или 6-членного гетероароматического кольца, содержащего от 1 до 3 гетероатомов, выбранных из S, О и N, причем такое кольцо является замещенным одним или более заместителями, выбранными из группы, состоящей из (С1-С3)алкила, галогена, (С3-С5)циклоалкилоксигруппы, (С1-С3)алкилкарбонила, фенила, необязательно замещенного одним или более атомами галогена, 5- или 6-членного гетероцикла, содержащего, по меньшей мере, один атом азота.
Способ получения соединений формулы VIa, где m=1 и n=2, предусматривает предпочтительное применение дихлорметана в качестве органического растворителя на стадии d) и NаВН(ОАс)3 в дихлорэтане на стадии с).
Предпочтительным агентом сочетания на стадии е) является O-(бензотриазол-1-ил) N,N,N',N'-тетраметилуронийгексафторфосфат, диизопропилэтиламин в качестве основания, диметилформамид/дихлорметан в качестве растворителей.
Согласно изобретению соединения получают, используя простой способ, удобный для увеличения в масштабе и не имеющий слишком длинных и дорогостоящих стадий получения, дающий высокий выход стабильного соединения фармацевтического качества.
Соединения изобретения как таковые или их фармацевтически приемлемую соль можно использовать в медицине, в частности в качестве антагонистов орексинового рецептора 1.
Их можно использовать в комбинации с фармацевтически приемлемым носителем и необязательно с подходящими эксципиентами для получения фармацевтических композиций. Термин "фармацевтически приемлемый носитель" означает растворители, носители, разбавители и т.п., которые используются при введении соединений изобретения.
Такие фармацевтические композиции могут быть введены парентеральным, пероральным, защечным, подъязычным, ректальным, местным или чрескожным путем.
Композиции данного изобретения, пригодные для перорального введения, можно удобно разделить на отдельные единицы дозирования, такие как таблетки, капсулы, облатки, порошки или пилюли, или использовать как жидкие суспензии.
Кроме того, таблетки могут содержать подходящие и обычно используемые в фармацевтической области эксципиенты, например предварительно желатинизированный крахмал, микрокристаллическую целлюлозу, натрия гликолят крахмала, тальк, лактозу, стеарат магния, сахарозу, стеариновую кислоту, маннитол.
Композиции для удобного парентерального введения включают стерильные препараты.
Композиции для удобного местного введения могут быть разработаны в виде кремов, паст, масел, мазей, эмульсий, пен, гелей, капель, растворов для опрыскивания и трансдермальных (чрескожных) пластырей.
Соединения изобретения могут использоваться в производстве медикамента для лечения патологий, при которых необходимо применение антагониста рецептора OX1, например, для лечения ожирения и нарушений сна, компульсивных нарушений, лекарственной и алкогольной зависимости, шизофрении.
Далее изобретение будет подробно описано с помощью следующих примеров, имеющих отношение к получению некоторых изобретательских соединений и оценке их активности в отношении рецептора OX1 и рецептора OX2.
В нижеприведенных методах после исходных материалов, как правило, дается ссылка на описание. Исходный материал необязательно должен быть приготовлен по упомянутому описанию. Стереохимию примеров определяли, исходя из предположения, что абсолютная конфигурация центров сохраняется.
Использованные в следующих примерах реагенты были коммерчески доступны от разных поставщиков (например, Sigma-Aldrich, Acros или Apollo scientific) и использовались без дополнительной очистки. Были использованы растворители в сухом виде. Реакции в безводном окружении проводили под избыточным давлением сухого N2.
Микроволновые реакции проводили на приборе Biotage Initiator 2.5.
Спектры протонного ядерного магнитного резонанса (1Н ЯМР) регистрировали с помощью прибора Bruker Avance 400 МГц. Химические сдвиги даются в м.д. (5) с использованием полосы остаточного растворителя в качестве внутреннего стандарта. Для параметров расщепления использовали следующие сокращения: s, синглет; d, дублет; t, триплет; q, квартет; m, мультиплет; b, широкий сигнал. Когда регистрировали более чем один конформер, то обычно приводили химические сдвиги наиболее распространенного конформера.
Масс-спектры (MS) регистрировали с помощью классического спектрометра Ion Trap Thermo LCQ, применяя положительный ES(+) и отрицательный ES(-) режим ионизации.
ВЭЖХ спектры получали с помощью прибора Waters Alliance 2965 и детектора UV-Vis Waters 2996. Использовали следующий метод хроматографии (с использованием Phenomenex Luna C18, 150*4.6, 5 мкм): 35 мин элюирование при 30°C, подвижная фаза состояла из разных смесей ацетонитрил/метанол/KH2PO4 (20 мМ pH 2,5), скорость потока 0,6 мл/мин.
ВЭЖХ-спектры для определения хиральной чистоты получали с помощью прибора Agilent 1200 и УФ-детектора DAD G1315D. Применяли следующий метод хроматографии (с использованием колонок Phenomenex LUX 5u cellulose-1, 250*4,6 мм): 30 мин элюирование при 30°C, подвижная фаза 90% н-гексан 10% этанол +0,1% DEA, скорость потока 0,5 мл/мин.
UPLC-спектры (спектры сверхпроизводительной жидкостной хроматографии) получали на приборе Waters Acquity UPLC-SQD, используя колонку Acquity UPLC-BEH C18 (1,7 мкМ; 50х2,1 мм).
Очистку методом препаративной хиральной ВЭЖХ проводили с помощью препаративного жидкостного хроматографа Shimadzu LC-8A и УФ-детектора SPD-20A. Использовали следующие методы хроматографии (с использованием Phenomenex LUX 5u cellulose-1, AXIA 250*21,20 мм):
А: подвижная фаза 90% н-гексан 10% этанол +0,1% DEA, скорость потока 10 мл/мин.
В: подвижная фаза 60% н-гексан 40% этанол+0,1% DEA, скорость потока 10 мл/мин.
С: подвижная фаза 93% н-гексан 7% изопропанол+0,1% DEA, скорость потока 10 мл/мин.
D: подвижная фаза 95% н-гексан 5% изопропанол+0,1% DEA, скорость потока 10 мл/мин.
Е: подвижная фаза 80% н-гексан 20% этанол+0,1% DEA, скорость потока 10 мл/мин.
Флэш-хроматографию с силикагелем проводили на силикагеле 230-400 меш (поставляемом компанией Merck AG Darmstadt, Германия); в ряде способов применяли автоматические флэш-хроматографические системы Biotage (системы Spl и Isolera), используя силикагелевые картриджи Biotage.
Тонкослойную хроматографию проводили с использованием пластин Kieselgel 60F-254 (Merck TLC), проявляли УФ светом, водным раствором перманганата, парами йода.
Пример 1. Получение промежуточного соединения 1: 6-азаспиро [2.5]октан гидробромида 5
Бензил 6-азаспиро [2-5]октан-6-карбоксилат (9 г; 36 ммоль), получение которого уже было описано, например, в WO 2008084300, растворили в 35% HB2 в AcOH (10 мл) при 0°C и перемешивали в течение 3 часов. Раствор обработали гексаном (200 мл). После декантирования растворителя добавили 80 мл Et2O. Полученное твердое вещество отфильтровали, промыли эфиром и гексаном (50 мл), затем высушили под вакуумом с получением 6,3 г промежуточного соединения 1 (светло-кремовое твердое вещество).
MS (ESI) m/z: 112 [M+H]+
1H-ЯМР (DMSO-d6) δ ppm 8.35 (m, 2H) 3.07 (m, 4H) 1.50-1.54 (m, 4H) 0.38 (s, 4H).
Пример 2.