Композиции, способы получения и применение каркаса на основе домена фибронектина типа iii
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к получению белковых каркасов, связывающихся с IgG, и может быть использовано в диагностике или лечении. Получают белковый каркас на основе консенсусной последовательности десятого повтора фибронектина типа III (FN3) человека, содержащий последовательность аминокислот SEQ ID NO: 16. На основе полученного белкового каркаса создают библиотеку белковых каркасов путем внесения разнообразия в копии указанного полипептида посредством мутирования по меньшей мере одной петлевой области остатков 22-28 и 75-81 SEQ ID NO: 16. Изобретение позволяет получить белковый каркас с высокой термостабильностью и сниженным риском аутоиммунного ответа при введении в организм. 2 н.п. ф-лы, 8 ил., 3 табл., 3 пр.
Реферат
ОБЛАСТЬ ПРИМЕНЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к белковым каркасам с новыми свойствами, включая возможность связываться с клеточными мишенями. Более конкретно, настоящее изобретение относится к белковому каркасу, основанному на консенсусной последовательности повтора фибронектина типа III (FN3).
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Наиболее часто в ситуациях, когда терапевтический белок должен иметь высокую аффинность и специфичность к молекуле-мишени, используют моноклональные антитела. Однако для биофармацевтической промышленности большой интерес также представляет изготовление не являющихся антителами белков, которые способны связываться с такими мишенями. Такие альтернативные белковые каркасы могут иметь преимущества перед традиционными антителами по причине малого размера, отсутствия дисульфидных связей, высокой стабильности и возможности экспрессироваться в прокариотических клетках-хозяевах. Для их очистки активно используют современные методы; они легко соединяются с лекарственными препаратами/токсинами, эффективно проникают в ткани и могут прекрасно использоваться в качестве многоспецифических связующих веществ .
Одним из таких альтернативных белковых каркасов является укладка цепи иммуноглобулинов (Ig). Эта укладка цепи встречается в переменных участках антител, а также в тысячах белков, не являющихся антителами. Исследования показывают, что один из таких белков Ig, десятый повтор фибронектина типа III (FN3) из человеческого фибронектина, может допускать ряд мутаций в поверхностных петлях, сохраняя при этом общую структуру укладки цепи Ig. Так, в последовательности этих петель были встроены библиотеки аминокислотных вариантов, после чего осуществлялся отбор веществ, связывающихся с рядом разнообразных мишеней . Как было обнаружено, такие созданные домены FN3 связываются с мишенями с высокой аффинностью, одновременно сохраняя свои важные биофизические свойства .
К числу желательных физических свойств, которые должны иметь потенциальные альтернативные молекулы каркаса, относятся высокая термостабильность и обратимость термального свертывания и развертывания. В целях повышения очевидной термостабильности белков и ферментов использовали несколько способов, в том числе рациональный дизайн, основанный на сравнении с термостабильными последовательностями с высокой степенью сходства, конструирование стабилизирующих дисульфидных мостиков, создание мутаций для повышения склонности к образованию α-спирали, создание солевых мостиков, изменение поверхностного заряда белка, направленная эволюция и изменение состава консенсусных последовательностей . Высокая термическая стабильность относится к числу желательных свойств таких каркасов, поскольку благодаря ей можно увеличивать выход получаемого рекомбинантного белка, улучшать растворимость очищенной молекулы, повышать активность внутриклеточных каркасов, снижать иммуногенность и сводить к минимуму потребность в «холодовой цепи» при производстве.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение представляет белковый каркас на основе белка с повтором фибронектина типа III (FN3), кодирующие или комплементарные нуклеиновые кислоты, векторы, клетки-хозяева, композиции, комбинации, препараты, устройства и способы их получения и применения. В предпочтительном варианте осуществления белковый каркас содержит консенсусную последовательность множественных доменов FN3 человеческого фибронектина. В другом предпочтительном варианте осуществления белковый каркас в соответствии с настоящим изобретением является консенсусной последовательностью из 7 доменов FN3. Белковые каркасы в соответствии с настоящим изобретением могут быть предназначены для связывания различных молекул, например, клеточного белка-мишени.
Белковые каркасы в соответствии с настоящим изобретением могут включать дополнительные молекулы или части, например, участок Fc антитела, альбумин-связывающий домен либо другую часть, влияющую на период полувыведения. В других вариантах осуществления белковые каркасы в соответствии с настоящим изобретением могут связываться с молекулой нуклеиновой кислоты, которая может кодировать белковый каркас.
Настоящее изобретение также относится по меньшей мере к одному способу экспрессии по меньшей мере одного белкового каркаса на основе консенсусной последовательности множественных доменов FN3 в клетке-хозяине, включающему культивирование клетки-хозяина как описано в настоящем документе в условиях, которые позволяют экспрессировать по меньшей мере один белковый каркас в количествах, допускающих детекцию и/или восстановление.
Настоящее изобретение также относится по меньшей мере к одной композиции, содержащей (a) белковый каркас на основе консенсусной последовательности нескольких доменов FN3 и/или кодирующей нуклеиновой кислоты, как описано в настоящем документе; и (b) подходящий и/или фармацевтически приемлемый носитель либо растворитель.
Кроме того, настоящее изобретение дополнительно включает способ создания библиотек белковых каркасов на основе повтора фибронектина типа III (FN3), предпочтительно, консенсусной последовательности множественных доменов FN3 и, более предпочтительно, консенсусной последовательности множественных доменов FN3 человеческого фибронектина. Библиотека формируется путем создания последовательных генераций каркасов за счет изменения (мутации) аминокислот или количества аминокислот в молекулах в отдельных позициях в частях каркаса, например, участках петель. Библиотеки могут создаваться посредством внесения изменений в аминокислотный состав единичной петли либо одновременного изменения множественных петель. Изменяемые петли могут быть соответствующим образом удлинены или сокращены. Возможна генерация подобных библиотек таким образом, чтобы они содержали все возможные аминокислоты в каждой позиции или особое подмножество аминокислот. Компоненты библиотек могут использоваться для скрининга при помощи дисплей-методов, таких как дисплей in vitro (ДНК, РНК, рибосомный дисплей) и фаговый дисплей.
Белковые каркасы в соответствии с настоящим изобретением имеют улучшенные биофизические свойства, например, стабильность в условиях восстановления и растворимость при высоких концентрациях; они могут быть экспрессированы и фолдированы в прокариотических системах, например, E. coli, в эукариотических системах, например, дрожжах, и в системах транскрипции/трансляции in vitro, например, лизате ретикулоцитов кролика.
Дополнительно настоящее изобретение предоставляет способ генерации молекулы каркаса, способной связываться со специфической мишенью, включающий пэннинг библиотеки каркаса в соответствии с настоящим изобретением относительно мишени и обнаружение связывающих веществ. Помимо этого, изобретение включает способы скрининга, которые могут быть использованы для генерации или аффинного созревания белковых каркасов с требуемой активностью, например, способных связываться с белками-мишенями с определенной аффинностью. Аффинное созревание может достигаться многократными процедурами мутагенеза и селекции с помощью таких систем, как фаговый дисплей или дисплей in vitro. Мутагенез в ходе этого процесса может являться результатом сайт-направленного мутагенеза к специфическим остаткам каркаса, случайным мутагенезом из-за ошибок в ПЦР либо перестановки в ДНК и/или комбинации этих способов. Настоящее изобретение дополнительно относится к любым изобретениям, описанным в настоящем документе.
ОПИСАНИЕ ФИГУР
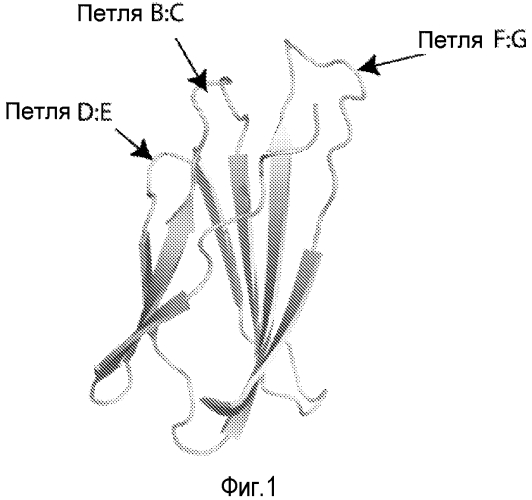
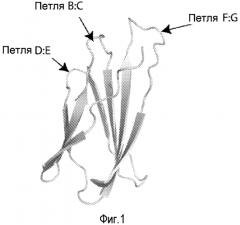
Фиг. 1. Структура домена FN3. Кристаллическая структура 10-го домена FN3 человеческого фибронектина (PDB 1TTF) . Помечены петли B:C, D:E и F:G, подвергшиеся диверсификации.
Фиг. 2A-N. Профили плавления очищенных доменов FN3 (за исключением 7-го домена) человеческого фибронектина, определенные посредством дифференциальной сканирующей калориметрии в фосфатном буфере при pH 7,4.
Фиг. 3. Множественный сравнительный анализ линейных последовательностей 15 доменов FN3 человеческого фибронектина. Анализ линейных последовательностей осуществляли с использованием программного обеспечения VectorNTI.
Фиг. 4. Множественный сравнительный анализ линейных последовательностей доменов FN3 1, 5, 8, 10, 12, 14, и 15 человеческого фибронектина. Анализ линейных последовательностей осуществляли с использованием программного обеспечения VectorNTI.
Фиг. 5A и B. Экспрессия и очистка фибкона. A) Анализ, при помощи электрофореза в 4-12% полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE), целостного клеточного лизата, растворимой фракции, «проскока» Ni-NTA, элюента и фракций, элюированных с хроматографической колонки Ni-NTA. B) Очистка фибкона в фосфатном буферном растворе (ФБР) при помощи Superdex 75. Стрелками обозначен элюируемый объем и масса стандартов молекулярного веса.
Фиг. 6. Дифференциальная сканирующая калориметрия фибкона в фосфатном буфере при pH 7,4.
Фиг. 7. Развертывание полипептидной цепи фибкона под воздействием Gu-HCl контролируют посредством внутренней флуоресценции триптофана. Возбуждение было отмечено при длине волны 280 нм, а эмиссия - при 365 нм.
Фиг. 8 Аминокислотная последовательность фибкона, показывающая расположение петель A-B, B-C, C-D, D-E, E-F, F-G.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение представляет собой выделенный, рекомбинантный и/или синтетический белковый каркас на основе повтора фибронектина типа III (FN3) человеческого фибронектина, включая, помимо прочего, каркас животного происхождения, а также композиции и молекулы кодирующих нуклеиновых кислот, включающие по меньшей мере один полинуклеотид, кодирующий белковый каркас, основанный на структуре десятого домена FN3. Настоящее изобретение дополнительно относится, помимо прочего, к способам изготовления и использования таких нуклеиновых кислот и белковых каркасов, в том числе к диагностическим и терапевтическим композициям, способам и устройствам.
Белковые каркасы в соответствии с настоящим изобретением имеют преимущества в сравнении с общепринятыми терапевтическими веществами, такие как возможность местного или перорального применения либо воздействия после преодолевания гемато-энцефалического барьера, способность экспрессироваться в клетках E. coli, позволяющая значительно повышать уровень экспрессии в сравнении с экспрессией в клетках млекопитающих, способность подвергаться генно-инженерному конструированию с созданием биспецифичных молекул, связывающихся с множественными мишенями либо множественными эпитопами одной и той же мишени, способность соединения с лекарственными препаратами, полимерами и зондами, способность использования в форме концентрированных лекарственных препаратов, а также способность таких молекул эффективно проникать в пораженные ткани и опухоли.
Кроме того, белковые каркасы обладают многими свойствами антител с точки зрения укладки, которая имитирует вариабельный участок антитела. Такая ориентация позволяет создавать поверхностные петли FN3 по аналогии с гипервариабельными участками (CDR) антител. Предполагается, что они смогут связываться с клеточными мишенями и петли можно будет изменять, например, подвергать аффинному созреванию, для улучшения некоторых свойств связывания и т.п.
Три из шести петель белкового каркаса в соответствии с настоящим изобретением топологически соответствуют гипервариабельным участкам (CDR 1-3) антитела, т.е. антигенсвязывающим участкам, а оставшиеся три петли являются поверхностными по аналогии с участками CDR антител. Эти петли охватывают промежутки между аминокислотными остатками 13-16, 22-28, 38-43, 51-54, 60-64 и 75-81 последовательности SEQ ID NO:16, как показано ниже в таблице 3 и фиг. 8. Предпочтительно, чтобы области петель в промежутках между аминокислотными остатками 22-28, 51-54 и 75-81 были изменены в целях усиления специфичности и аффинности связывания. Эти области петель модифицируются случайным образом в целях создания библиотеки, компоненты которых могут подвергаться селекции на основании наибольшей аффинности в отношении определенной белковой мишени. Один или более участков петель могут взаимодействовать с белком-мишенью по аналогии с тем, как участок CDR антитела взаимодействует с белком.
Каркасы в соответствии с настоящим изобретением могут включать другие субъединицы, например, посредством ковалентного взаимодействия. Константный участок антитела, либо его часть, может быть присоединен к каркасу, придавая ему антителоподобные свойства, например, функции, опосредуемые комплементом (ADCC), период полужизни и т.д. Например, может осуществляться и/или контролироваться эффекторная функция, например, посредством модификации связывания C1q и/или FcγR и, таким образом, изменения комплементзависимой цитотоксичности (CDC) и/или антителозависимой клеточно-опосредованной цитотоксичности (ADCC). «Эффекторные функции» являются ответственными за усиление либо снижение биологической активности (например, в организме пациента). К эффекторным функциям относятся, в частности, связывание C1q; комплементзависимая цитотоксичность (CDC); связывание рецептора Fc; антителозависимая клеточно-опосредованная цитотоксичность (ADCC); фагоцитоз; супрессирующий эффект на рецепторы клеточной поверхности (например, рецептор клеток B (BCR)) и т.д. Такие эффекторные функции могут потребовать связывания участка Fc со связывающим доменом (петлями белкового каркаса и т.д.) и могут быть оценены с помощью различных методов анализа (например, анализа связывания Fc, анализа ADCC, анализа CDC и т.д.).
Кроме того, для получения требуемых свойств к молекуле каркаса могут быть присоединены молекулы конъюгата токсина, альбумина или связывающего альбумин вещества, полиэтиленгликоля (PEG). Любые из этих соединений могут быть получены стандартными способами, например, путем экспрессии рекомбинантного белка из рекомбинантного гибридного гена, созданного из общедоступных последовательностей генов.
Каркасы в соответствии с настоящим изобретением могут быть моноспецифическими в мономерной форме и би- или мультиспецифическими (для разных белков-мишеней или антигенных детерминант одного белка-мишени) в многомерной форме. Присоединения могут быть ковалентными или нековалентными. Например, двумерный биспецифический каркас имеет одну субъединицу со специфичностью к первому белку-мишени или первой антигенной детерминанте и вторую субъединицу со специфичностью ко второму белку-мишени или второй антигенной детерминанте. Каркасные субъединицы могут соединяться друг с другом с формированием разнообразных конформаций, что способно увеличивать их валентность и, таким образом, авидность связывания антигенов.
В настоящем документе термин «антитело» означает любую белок- или пептид-содержащую молекулу, которая состоит по меньшей мере из части молекулы иммуноглобулина, в частности, по меньшей мере из одного гипервариабельного участка (CDR) тяжелой или легкой цепи либо его лиганд-связующей части, вариабельного участка тяжелой или легкой цепи, постоянного участка тяжелой или легкой цепи, каркасного участка или их части. В некоторых случаях такое антитело дополнительно воздействует на специфический лиганд, в частности, может модулировать, снижать, увеличивать, не допускать, предотвращать, уменьшать, смягчать, блокировать, ингибировать, уничтожать и/или нарушать по меньшей мере одну активность или связь либо активность или связь рецептора in vitro, in situ и/или in vivo.
Дополнительно термин «антитело» означает антитела, продукты расщепления, указанные части и их варианты, в частности, миметики антител или составные части антител, имитирующие структуру и/или функцию антитела или его указанного фрагмента либо части, в том числе одноцепочечные антитела, однодоменные антитела и их фрагменты. Функциональные фрагменты включают антигенсвязывающие фрагменты, которые связываются с конкретной мишенью. Например, в настоящее изобретение включены фрагменты антител, способные связываться с определенной мишенью, или их части, в частности, фрагменты Fab (например, в результате расщепления папаином), Fab' (например, в результате расщепления пепсином и частичного восстановления) и F(ab')2 (например, в результате расщепления пепсином), facb (например, в результате расщепления плазмином), pFc' (например, в результате расщепления пепсином или плазмином), Fd (например, в результате расщепления пепсином, частичного восстановления и реагрегации), Fv или scFv (например, с помощью методов молекулярной биологии) (см., например, Colligan, Immunology, supra).
Такие фрагменты могут быть получены путем ферментативного расщепления, методами синтеза или рекомбинации, известными из уровня техники и/или описанными в настоящем документе. Антитела также могут быть получены в различных процессированных формах с использованием генов антител, в которых один или более стоп-кодонов добавлены выше естественного сайта терминации. Например, возможно создание комбинационного гена, кодирующего часть тяжелой цепи F(ab')2, содержащего последовательности ДНК, кодирующие домен CH1 и/или шарнирный участок тяжелой цепи. Различные части антител могут быть соединены химически традиционными способами или получены в виде единого белка методами генной инженерии.
Белковый каркас в соответствии с настоящим изобретением может быть использован для измерения или вызывания в клетке, ткани, органе или животном (включая млекопитающих и человека), диагностирования, контролирования, модулирования, лечения, смягчения, предотвращения или снижения симптомов по меньшей мере одного заболевания или состояния, выбранного из группы, включающей, помимо прочего, иммунное нарушение или заболевание, сердечно-сосудистое нарушение или заболевание, инфекцию, злокачественное заболевание и/или неврологическое нарушение или заболевание, а также другие известные или отмеченные связанные состояния.
Такой способ может включать введение эффективного количества композиции или фармацевтической композиции, содержащей по меньшей мере один белковый каркас, в клетку, ткань, орган, организм животного или пациента, которым требуется такого рода модулирование, лечение, смягчение, предотвращение или сокращение симптомов, эффектов либо механизмов. Эффективное количество может составлять от приблизительно 0,001 до 500 мг/кг для однократного (например, болюс), многократного или непрерывно применения, либо достигать сывороточной концентрации 0,01-5000 мкг/мл при однократном, многократном или непрерывном применении, либо может находиться в любом эффективном диапазоне или иметь эффективное значение в таком диапазоне, установленном или определенном известными способами, как описано в настоящем документе или известно специалистам.
Белковый каркас в соответствии с настоящим изобретением. Формирование и генерация
По меньшей мере один белковый каркас в соответствии с настоящим изобретением может быть необязательно получен с помощью линии клеток, смешанной линии клеток, иммортализованной клетки или клональной популяции иммортализованных клеток, хорошо известных в данном уровне техники. См., например, Ausubel, et al., ed., Current Protocols in Molecular Biology, John Wiley & Sons, Inc., NY, NY (1987-2001); Sambrook, et al., Molecular Cloning: A Laboratory Manual, 2nd Edition, Cold Spring Harbor, NY (1989); Harlow and Lane, Antibodies, a Laboratory Manual, Cold Spring Harbor, NY (1989); Colligan, et al., eds., Current Protocols in Immunology, John Wiley & Sons, Inc., NY (1994-2001); Colligan et al., Current Protocols in Protein Science, John Wiley & Sons, NY, NY, (1997-2001).
Аминокислоты белкового каркаса могут быть изменены, добавлены и/или удалены для снижения иммуногенности или сокращения, улучшения либо изменения связывания, аффинности, скорости ассоциации, скорости диссоциации, авидности, специфичности, периода полувыведения, стабильности, растворимости или другого соответствующего свойства, известного из уровня техники.
В некоторых случаях белковые каркасы могут быть созданы с сохранением высокой аффинности к антигену и других благоприятных биологических свойств. Для достижения этой цели белковые каркасы могут быть необязательно получены путем анализа родительских последовательностей и различных концептуальных искусственных продуктов с помощью трехмерных моделей родительских и искусственных последовательностей. Трехмерные модели широко используются и известны специалистам в данной области техники. Существуют компьютерные программы, иллюстрирующие и показывающие вероятные трехмерные конформационные структуры отобранных последовательностей-кандидатов, а также способные измерять потенциальную иммуногеничность (например, программа Immunofilter разработки Xencor, Inc., Монровия, Калифорния). Изучение таких иллюстраций позволяет проанализировать предполагаемую роль остатков в функционировании последовательности-кандидата, например, остатков, влияющих на способность белкового каркаса-кандидата связывать его антиген. Таким образом, возможны селекция и комбинирование остатков из родительской и референсной последовательностей с целью получения требуемого свойства, например, аффинности к антигенам-мишеням. Помимо вышеуказанных процедур или в дополнение к ним могут быть использованы другие подходящие методы инженерии.
Скрининг
Скрининг белковых каркасов на предмет специфического связывания схожих белков или фрагментов без труда осуществляется с помощью библиотек дисплеев нуклеотидов (дисплея ДНК или РНК) или пептидов, например, дисплея in vitro. Этот способ предполагает скрининг больших количеств пептидов на предмет отдельных пептидов, имеющих требуемую функцию или структуру. Последовательности нуклеотидов или пептидов в дисплее могут содержать от 3 до 5000 и более нуклеотидов или аминокислот в длину, часто от 5 до 100 аминокислот в длину и периодически от приблизительно 8 до 25 аминокислот в длину. Помимо методов прямого химического синтеза, из уровня техники известны несколько методов рекомбинантных ДНК для генерации библиотек пептидов. Один из таких методов предусматривает дисплей последовательности пептидов на поверхности бактериофага или клетки. Каждый бактериофаг или каждая клетка содержит последовательность нуклеотидов, кодирующую отдельно взятую видимую последовательность пептидов. Такие методы описаны в патентных публикациях PCT № 91/17271, 91/18980, 91/19818 и 93/08278.
Другие системы генерации библиотек пептидов применяют как методы химического синтеза in vitro, так и рекомбинантные методы. См. патентные публикации PCT № 92/05258, 92/14843 и 96/19256. См. также патенты США № 5658754 и 5643768. В продаже доступны библиотеки пептидных дисплеев, векторы и комплекты для скрининга таких производителей, как Invitrogen (Карлсбад, Калифорния) и Cambridge Antibody Technologies (Кембриджшир, Великобритания). См., например, патенты США № 4704692, 4939666, 4946778, 5260203, 5455030, 5518889, 5534621, 5656730, 5763733, 5767260, 5856456, полученные Enzon; 5223409, 5403484, 5571698, 5837500, полученные Dyax, 5427908, 5580717, полученные Affymax; 5885793, полученные Cambridge Antibody Technologies; 5750373, полученные Genentech, 5618920, 5595898, 5576195, 5698435, 5693493, 5698417, полученные Xoma, Colligan, supra; Ausubel, supra; или Sambrook, supra.
Белковые каркасы в соответствии с настоящим изобретением могут связывать белки человека или других млекопитающих с разной степенью аффинности (KD). В предпочтительном варианте осуществления по меньшей мере один белковый каркас в соответствии с настоящим изобретением может необязательно связываться с белком-мишенью с высокой аффинностью, например, с KD, равным или составляющим менее чем приблизительно 10-7 M, в частности, 0,1-9,9 (либо любой диапазон или значение из него) × 10-8, 10-9, 10-10, 10-11, 10-12, 10-13, 10-14, 10-15 либо любой диапазон или значение из него, что может быть определено методом поверхностного плазмонного резонанса или методом Kinexa, используемыми специалистами в данной области техники.
Аффинность или авидность белкового каркаса по отношению к антигену могут быть определены экспериментально соответствующим способом. (См., например, Berzofsky, et al., «Antibody-Antigen Interactions,» In Fundamental Immunology, Paul, W. E., Ed., Raven Press: New York, NY (1984); Kuby, Janis Immunology, W. H. Freeman and Company: New York, NY (1992); а также способы, описанные в настоящем документе). Измеренная аффинность отдельно взятого комплекса «белковый каркас - антиген» может меняться в зависимости от условий измерения (концентрации соли, pH и т.д.). Следовательно, измерения аффинности и других параметров связывания антигена (KD, Kon, Koff и т.д.) предпочтительно производить с использованием стандартизированных растворов белкового каркаса и антигена и стандартизированного буфера, описанного, например, в настоящем документе.
Возможно проведение анализа конкурентного связывания белкового каркаса в соответствии с настоящим изобретением для определения, какие белки, антитела и другие антагонисты конкурируют за связывание белка-мишени с белковым каркасом в соответствии с настоящим изобретением и/или совместно используют участок антигенной детерминанты. Эти анализы, хорошо известные средним специалистам в данной области техники, предназначены для оценки конкуренции между антагонистами или лигандами за ограниченное количество сайтов связывания у белка. Белок и/или антитела нейтрализуют или переводят в нерастворимую форму до или после конкурентного анализа, и пробу, связавшуюся с белком-мишенью, отделяют от несвязавшейся пробы, например, путем переливания (если белок/антитело предварительно перевели в нерастворимую форму) или центрифугирования (если белок/антитело осадили после реакции конкурентного анализа). Кроме того, конкурентное связывание можно определить по тому, изменена ли функция в результате связывания или несвязывания белкового каркаса с белком-мишенью, например, молекула белкового каркаса может ингибировать или стимулировать ферментативную активность, к примеру, метки. Возможно использование ИФА и других функциональных анализов, хорошо известных из уровня техники.
Молекулы нуклеиновых кислот
Молекулы нуклеиновых кислот в соответствии с настоящим изобретением, кодирующие белковый каркас, могут иметь форму РНК, например, мРНК, гяРНК, тРНК или любую другую форму, либо форму ДНК, в частности, кДНК и геномной ДНК, полученной путем клонирования, синтеза или любой комбинации этих способов. ДНК может быть трехцепочечной, двухцепочечной и одноцепочечной либо комбинированной. Любая часть по меньшей мере одной цепи ДНК или РНК может быть кодирующей цепью, также называемой смысловой цепью, или некодирующей цепью, также называемой антисмысловой цепью.
Выделенные молекулы нуклеиновых кислот в соответствии с настоящим изобретением могут включать молекулы нуклеиновых кислот, содержащие открытую рамку считывания (ORF), в некоторых случаях с одним или несколькими интронами, в частности, по меньшей мере одну указанную часть по меньшей мере одного белкового каркаса; молекулы нуклеиновых кислот, содержащие кодирующую последовательность для белкового каркаса или участок петли, который связывается с белком-мишенью; и молекулы нуклеиновых кислот, содержащие последовательность нуклеотидов, существенно отличающуюся от вышеописанных, но из-за дегенерации генетического кода по-прежнему кодирующую белковый каркас, как описано в настоящем документе и/или известно из уровня техники. Очевидно, что генетический код хорошо известен из уровня техники. Следовательно, специалист в данной области техники без труда может получить такие дегенерировавшие варианты нуклеиновой кислоты, которые кодируют специфические белковые каркасы в соответствии с настоящим изобретением. См., например, Ausubel, et al., supra. Такие варианты нуклеиновой кислоты относятся к настоящему изобретению.
Как указано в настоящем документе, молекулы нуклеиновых кислот в соответствии с настоящим изобретением, которые составляют нуклеиновую кислоту, кодирующую белковый каркас, могут включать, помимо прочего, молекулы, кодирующие последовательность аминокислот одного фрагмента белкового каркаса; кодирующие последовательность всего белкового каркаса или его части; кодирующие последовательность белкового каркаса, фрагмента или части, а также дополнительные последовательности, например, кодирующие последовательность по меньшей мере одного сигнального пептида или слитого пептида с вышеуказанными дополнительными кодирующими последовательностями или без них, например, по меньшей мере один интрон, совместно с дополнительными некодирующими последовательностями, в частности, некодирующими 5'- и 3'-концевыми последовательностями, например, транскрибированными, не подвергшимися трансляции последовательностями, которые играют роль в транскрипции, обработке мРНК, включая сигналы сплайсинга и полиаденилирования (например, связывание рибосом и стабильность мРНК); дополнительная кодирующая последовательность, которая кодирует дополнительные аминокислоты, например, обеспечивающие дополнительные функции. Так, последовательность, кодирующая белковый каркас, может быть соединена с маркерной последовательностью, такой как последовательность, кодирующая пептид, облегчающий очистку рекомбинантного белкового каркаса, включающего фрагмент или часть белкового каркаса.
Селективная гибридизация полинуклеотидов в описанный в настоящем документе полинуклеотид
Настоящее изобретение включает выделенные нуклеиновые кислоты, которые в условиях селективной гибридизации образуют описанный в настоящем документе полинуклеотид. Таким образом, полинуклеотиды в соответствии с таким вариантом осуществления могут быть использованы для выделения, детекции и/или подсчета нуклеиновых кислот, составляющих такие полинуклеотиды. Например, полинуклеотиды в соответствии с настоящим изобретением могут быть использованы для идентификации, выделения или амплификации частичных либо полноразмерных клонов в подготовленной библиотеке. В некоторых вариантах осуществления полинуклеотиды являются последовательностями геномной ДНК или кДНК, выделенными или иным образом комплементарными относительно кДНК из библиотеки нуклеиновых кислот человека или млекопитающего.
Библиотека кДНК предпочтительно содержит по меньшей мере 80% полноразмерных последовательностей, более предпочтительно по меньшей мере 85% или 90% полноразмерных последовательностей и, наиболее предпочтительно, по меньшей мере 95% полноразмерных последовательностей. Библиотеки кДНК могут быть нормализованы с целью увеличения количества редких последовательностей. Для последовательностей, мало идентичных комплементарным последовательностям, обычно, но не исключительно, гибридизацию осуществляют в условиях низкой или умеренной жесткости. Для последовательностей с большей идентичностью необязательно применяют условия средней и высокой жесткости. Условия низкой жесткости допускают селективную гибридизацию последовательностей с уровнем идентичности приблизительно 70% и могут быть использованы для идентификации ортологических или паралогических последовательностей.
В некоторых случаях полинуклеотиды в соответствии с настоящим изобретением кодируют по меньшей мере часть белкового каркаса, кодируемого описанными в настоящем документе полинуклеотидами. Полинуклеотиды в соответствии с настоящим изобретением включают последовательности нуклеиновых кислот, которые могут использоваться для селективной гибридизации с полинуклеотидом, кодирующим белковый каркас в соответствии с настоящим изобретением. См., например, Ausubel, supra; Colligan, supra, каждый источник полностью включен в текст настоящего документа путем ссылки.
Конструирование нуклеиновых кислот
Выделенные нуклеиновые кислоты в соответствии с настоящим изобретением могут быть получены с помощью
(a) рекомбинантных способов, (b) методов синтеза, (c) методов очистки и/или
(d) их комбинаций, хорошо известных из уровня техники.
Нуклеиновые кислоты могут быть легко дополнены последовательностями, помимо полинуклеотида в соответствии с настоящим изобретением. Например, в нуклеиновую кислоту можно вставить сайт множественного клонирования, содержащий один или более сайтов рестрикции эндонуклеазы, чтобы способствовать выделению полинуклеотида. Кроме того, могут быть вставлены транслируемые последовательности, чтобы способствовать выделению транслированного полинуклеотида в соответствии с настоящим изобретением. К примеру, удобным способом очистки белков в соответствии с настоящим изобретением является гексагистидин-маркирующая последовательность. Нуклеиновая кислота в соответствии с настоящим изобретением, за исключением кодирующей последовательности, может необязательно являться вектором, адаптером или линкером для клонирования и/или экспрессии полинуклеотида в соответствии с настоящим изобретением.
В подобные клонирующие и/или экспрессирующие последовательности могут быть добавлены дополнительные последовательности, чтобы оптимизировать их функционирование при клонировании и/или экспрессии, способствовать выделению полинуклеотида или улучшить проникновение полинуклеотида в клетку. Использование клонирующих векторов, экспрессирующих векторов, адаптеров и линкеров хорошо известно из уровня техники (см., например, Ausubel, supra; или Sambrook, supra.).
Рекомбинантные способы конструирования нуклеиновых кислот
Выделенные композиции нуклеиновых кислот в соответствии с настоящим изобретением, например, РНК, кДНК, геномная ДНК или их комбинация, могут быть получены из биологических источников с помощью любого количества способов клонирования, известных специалистам в данной области техники. В некоторых вариантах осуществления пробы олигонуклеотидов, в результате селективной гибридизации в жестких условиях образующие полинуклеотиды в соответствии с настоящим изобретением, используют для идентификации требуемой последовательности в библиотеке кДНК или геномной ДНК. Способы выделения РНК и синтеза кДНК и геномных библиотек хорошо известны специалистам (например, Ausubel, supra; или Sambrook, supra).
Методы скрининга и выделения нуклеиновых кислот
Библиотека кДНК или геномной ДНК может быть подвергнута скринингу с помощью пробы, основанной на последовательности полинуклеотида в соответствии с настоящим изобретением, например, описанного в настоящем документе. Пробы могут быть использованы для гибридизации с последовательностями геномной ДНК или кДНК для выделения гомологичных генов в одинаковых либо разных организмах. Специалистам в данной области техники будет ясно, что при анализе можно варьировать жесткость условий гибридизации, при этом жесткие условия могут иметь как гибридизационная, так и промывочная среда. Чем жестче условия гибридизации, тем выше должна быть комплементарность между пробой и мишенью для образования дуплекса. Жесткость условий можно контролировать одним или более из следующих параметров: температурой, ионной силой, pH и присутствием частично денатурирующего растворителя, например, формамида. К примеру, жесткость условий гибридизации удобно регулировать путем изменения полярности реагирующего раствора, например, через подбор концентрации формамида в диапазоне от 0% до 50%. Степень комплементарности (идентичности последовательностей), необходимая для детекции связывания, зависит от жесткости условий гибридизационной и/или промывочной среды. Оптимальной является степень комплементарности, равная 100%, 70-100% либо находящаяся в любом диапазоне или имеющая любое значение из него. Однако следует понимать, что незначительные изменения последовательности в пробах и праймерах могут быть компенсированы за счет снижения жесткости гибридизационной и/или промывочной среды.
Методы амплификации РНК или ДНК хорошо известны из уровня техники и могут быть использованы в соответствии с настоящим изобретением без лишних экспериментов и на основании представленных в настоящем документе инструкций и рекомендаций.
К известным методам амплификации РНК или ДНК относятся, в частности, полимеразная цепная реакция (ПЦР) и соответствующие процессы амплификации (см., например, патенты США №№ 4683195, 4683202, 4800159, 4965188 авторства Mullis, et al.; 4795699 и 4921794 авторства Tabor, et al; 5142033 авторства Innis; 5122464 авторства Wilson, et al.; 5091310 авторства Innis; 5066584 авторства Gyllensten, et al; 4889818 авторства Gelfand, et al; 4994370 авторства Sil