Способ получения 2-аминометилстиролов, содержащих гетероциклический фрагмент
Иллюстрации
Показать всеИзобретение относится к области органической химии, в частности к новому способу получения 2-аминометилстиролов. Для получения 2-(N,N-диалкиламинометил)стиролов, содержащих гетероциклический фрагмент общей формулы
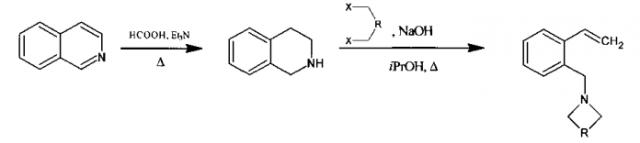
где R=CH2OCH2, R=o-C6H4, R=(CH2)3 или R=(CH2)2, изохинолин восстанавливают до 1,2,3,4-тетрагидроизохинолина в присутствии муравьиной кислоты, триэтиламина и (Ph3P)3RuCl2. Полученный 1,2,3,4-тетрагидроизохинолин в растворе изопропанола под действием соответствующего дигалогенида и щелочи переводят в целевой продукт. Изобретение обеспечивает смягчение режимов технологического процесса получения 2-аминометилстиролов, содержащих гетероциклический фрагмент, не требующих сложного оборудования, инертной атмосферы, дорогих и токсичных реагентов, с выходом 80-86% на исходный изохинолин. 2 з.п. ф-лы, 4 пр.
Реферат
Изобретение относится к области органической химии, в частности к новому способу получения 2-аминометилстиролов.
2-Аминометилстиролы применяются для получения катализаторов на основе карбеновых комплексов рутения для полимеризации цикло- и бициклоолефинов с раскрытием цикла по реакции метатезиса (RU 2374269 С2, 20.07.2009, RU 2393171 C1, 27.08.2010, RU 2462308 C1, 27.09.2012, RU 2436801 C1, 20.12.2011).
Известен способ получения 2-аминометилстиролов кросс-сочетанием производных 2-галогензамещенных бензиламинов и 2,4,6-тривинилциклотрибороксана или винил трибутилстаннатов, катализируемым соединениями палладия (WO 2011/079799 A1, 07.07.2011 и US 2007/0027071 A1, 01.02.2007).
К недостаткам способа можно отнести сложность аппаратурного оформления синтеза, а также высокую стоимость реагентов.
Известен способ получения 2-аминометилстиролов из о-винилбензилхлорида (А. Padwa, W. Dent. On the use of N-[(trimethylsilyl)methyl]amino ethers as capped azomethine ylide equivalents. J. Org. Chem., 1987, 52, 235-244).
Недостатком метода является высокая стоимость исходного о-винилбензилхлорида.
Расщепление четвертичных солей 1,2,3,4-тетрагидроизохинолинов по Гофману является эффективным методом синтеза 2-(N,N-диалкиламинометил)стиролов.
Известен способ получения 2-аминометилстиролов из солей диалкилтетрагидроизохинолинов с использованием оксида серебра (S. Kafka, P. Trska, J. Kytner, P. Taufmann, M. Ferles. Hydroboration of unsaturated amines. Part XIX. Hydroboration of N,N-dimethyl(2-vinylbenzyl)amine. Collection of Czechoslovak Chemical Communications, 1987, 52(8), 2047-2056, A. Rheiner, A. Brossi. Syntheses in the isoquinoline series. Hofmann degradation of 1-phenyl-substituted 1,2,3,4-tetrahydroisoquinolines. Helvetica Chimica Acta, 1962, 45, 2590-600).
К недостатком метода можно отнести необходимость использовать дорогостоящие и токсичные соли серебра.
Известен способ получения 2-(N,N-диметиламинометил)стирола из диметилтетрагидроизохинолиний иодида нагреванием в DMSO в присутствии KCN (G.A. Molander, S.К. Pack. Determining the scope of the lanthanide mediated, sequential hydroamination/C-C cyclization reaction: formation of tricyclic and tetracyclic aromatic nitrogen heterocycles, Tetrahedron, 2003, 59, 10581-10591).
Недостатком этого метода является использование высокотоксичного цианида калия.
Известен способ однореакторного получения [N-метил-N-(2-метоксиметил)]-2-винилбензиламина кипячением бензольного раствора N-(2-гидроксиэтил)-1,2,3,4-тетрагидроизохинолина, метилиодида и AliquatR 336 с гидроксидом калия (Silyl modification of biologically active compounds. 10. Lipid type organosilicon derivatives of 8-hydroxyquinoline and N-(2-hydroxyethyl)-1,2,3,4-tetrahydro(sila, iso)quinolones. Chemistry of Heterocyclic Compounds, 2005, 41 (5), 613-624).
К недостаткам данного метода можно отнести низкий (32%) выход целевого соединения.
Известен способ однореакторного получения 2-винил-N,N-диметилбензиламина из метилиодида N-метил-4-(триметилсилил)-1,2,3,4-тетрагидроизохинолина при комнатной температуре в ацетонитриле в присутствии ТБАФ и метилакрилата (Y. Ito, M. Nakatsuka, T. Saegusa. Syntheses of Polycyclic Ring Systems Based on the New Generation of o-Quinodimethanes, J. Am. Chem. Soc., 1982, 104, 7609-7622).
Недостатком этого метода является труднодоступность исходного тетрагидроизохинолина и высокая стоимость и токсичность реагентов.
Известен способ расщепления метилсульфата производного 1,2,3,4-тетрагидроизохинолина, в котором его переводят в гидроксипроизводное на ионообменной смоле IRA-401, которое затем претерпевает расщепление по Гофману (Т. Suzuki, M. Takarnoto, T. Okarnoto, H. Takayarna. Acid-catalyzed double-cyclization reactions of Ν,Ν-dibenzylamino-acetaldehyde dialkyl acetals and related compounds: general synthesis of 7,12-dihydro-5H-6,12-methanodibenz[c,f]azocines and related compounds. Chemical & Pharmaceutical Bulletin, 1986, 34 (5), 1888-1900).
Недостатком этого способа можно назвать невысокий выход конечного стирола.
Наиболее близким к данному изобретению является способ получения 2-аминометилстиролов из 2-(2-бромоэтил)бензилбромида, его реакцией с вторичными аминами в диоксане под действием микроволнового облучения, с последующим кипячением в системе трет-бутаиол/трет-бутилат калия (Н.М. Щеглова, И.Д. Колесник, Р.В. Аширов, Общий способ получения орто-винилзамещенных аминов, эфиров и сульфидов. Журнал органической химии, 2013, 49 (9), 1344-1349).
К недостаткам данного метода можно отнести относительно низкие выходы 42-65%, необходимость применения микроволнового облучения и ограниченность рядом вторичных аминов.
Техническим результатом способа является повышение общего выхода и чистоты 2-аминометилстиролов, содержащих гетероциклический фрагмент, позволяющего получать широкий ряд аминометилстиролов.
Преимущества от реализации заявленного изобретения заключается в повышении выхода 2-аминометилстиролов, содержащих гетероциклический фрагмент, при упрощении технологического процесса, проводимого в мягких условиях, не требующих сложного оборудования, инертной атмосферы, дорогих и токсичных реагентов, с выходом 80-86% на исходный изохинолин.
Технический результат достигается тем, что синтез проводят в соответствии с уравнениями реакций:
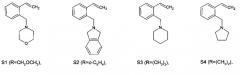
В результате получены 2-аминометилстиролы, содержащие гетероциклический фрагмент общей формулы
где R=CH2OCH2, R.=o-C6H4, R=(CH2)3 или R=(CH2)2, предусматривая проведение реакции восстановления изохинолина до 1,2,3,4-тетрагидроизохинолина в присутствии муравьиной кислоты, триэтиламина и (Ph3P)3RuCl2, который затем растворяют в изопропаноле, добавляют в раствор дигалогенид и щелочь, полученную реакционную смесь нагревают до температуры кипения изопропанола и выдерживают при данной температуре в течение 2-4 часов, после чего смесь упаривают, добавляют метилтретбутиловый эфир и перемешивают, полученную смесь фильтруют через порошок оксида алюминия до получения целевого продукта.
При этом дигалогенид выбирают из 2,2′-дихлороэтилового эфира, α,α-дихлоро-o-ксилола, 1,4-дибромбутана или 1,5-дибромпентана, а щелочь выбирают из гидроксида натрия или гидроксида калия.
Ниже приведены примеры способа получения 2-аминометилстиролов, содержащих гетероциклический фрагмент общей формулы:
,
представленных следующими формулами:
Пример 1
Получение 4-(2-винилбензил)морфолина S1.
В колбу объемом 500 мл, снабженную обратным холодильником, помещают 26 г (0,155 моль) изохинолина в виде гидрохлорида и через воронку прибавляют 35 мл (45 г, 0,93 моль) муравьиной кислоты, 25,3 мл (17,5 г, 0,23 моль) триэтиламина и 1,5 г (1,56 ммоль) (Ph3P)3RuCl2. Далее перемешивают при температуре 100°C до момента прекращения выделения газа (примерно 4 ч). Затем реакционную массу охлаждают до комнатной температуры и в колбу через воронку при охлаждении и перемешивании прибавляют 100 мл изопропанола и 43,4 г (1,08 моль) NaOH, перемешивают в течение 2 ч при кипячении, затем охлаждают до комнатной температуры. Реакционную колбу переносят на ротор и упаривают растворитель досуха, к остатку прибавляют 100 мл воды и 100 мл метилтретбутилового эфира (МТБЭ), перемешивают в течение 30 мин и переносят в делительную воронку. Разделяют слои, водный еще раз экстрагируют 100 мл МТБЭ. Объединенные органические слои промывают 50 мл воды, сушат над сульфатом натрия, растворитель упаривают на роторе, остаток перегоняют под вакуумом. Получают 14,5 г (70%) 1,2,3,4-тетрагидроизохинолина. 5,0 г (0,038 моль) 1,2,3,4-Тетрагидроизохинолина помещают в 50 мл круглодонную колбу, снабженную обратным холодильником, к нему прибавляют 100 мл изопропанола, 4,9 мл (6,0 г, 0,042 моль) 2,2′-дихлороэтилового эфира и 3,4 г (0,084 моль) гидрооксида натрия. Реакционную смесь нагревают при перемешивании в масляной бане, выдерживают при температуре кипения растворителя - изопрпопанола в течение 2 ч. Затем реакционную смесь упаривают, к остатку прибавляют 50 мл МТБЭ и перемешивают в течение 30 мин, пропускают через слой Al2O3, промывают на фильтре 50 мл МТБЭ, фильтраты упаривают, получают 6,1 г (80% на исходный изохинолин) 4-(2-этенилбензил)морфолина S1.
1H NMR (400 MHz, chloroform-d), δ, ppm: 2,56-2,62 (4H, м, CH2NCH2), 3,58 (2H, с, ArCH2N), 3,75-3,79 (4Н, м, CH2OCH2), 5,33 (1H, дд, J=11.1, 1.6 Гц, CH=CH2), 5,61 (1H, д, J=17,5, 1,6 Гц, CH=CH2), 7,22-7,41 (4Н, м, CH=CH2+HAr), 7,54 (1Н, д, J=6,8 Гц, HAr). GC/MS, M+: 203.
Пример 2
Осуществляют аналогично Примеру 1, но вместо 2,2′-дихлороэтилового эфира используют α,α-дихлоро-o-ксилол. Реакционную смесь 1,2,3,4-Тетрагидроизохинолина, α,α-дихлоро-o-ксилола и гидрооксида натрия в изопропаноле выдерживают при температуре кипения растворителя 3 часа. Получают 2-(2-винилбензил)изоиндолин S2 с выходом 82%.
1Н NMR (400 MHz, chloroform-d), δ, ppm: 3,97 (4H, с, CH2NCH2), 3,99 (2Н, с, CH2N), 5,34 (1H, д, J=10,9 Гц, CH=CH2), 5,68 (1H, д, J=17,5 Гц, CH=CH2), 7,21 (4H, с, HAr), 7,28-7,32 (3H, м, CH=CH2+HAr), 7,43 (1H, д, J=6,8 Гц, HAr), 7,53 (1H, д, J=6,8 Гц, HAr). GC/MS, М+: 235.
Пример 3
Осуществляют аналогично Примеру 1, но вместо 2,2′-дихлороэтилового эфира используют 1,5-дибромбутан, а вместо гидроксида натрия используют гидроксид калия. Реакционную смесь 1,2,3,4-Тетрагидроизохинолина, 1,5-дибромбутана и гидрооксида калия в изопропаноле выдерживают при температуре кипения растворителя 4 часа, получают 1-(2-винилбензил)пиперидин S3 с выходом 86%.
lH NMR (400 MHz, chloroform-d), δ, ppm: 1,40-1,47 (2H, м, CH2CH2CH2), 1,53-1,59 (4H, м, CH2CH2CH2), 2,29-2,46 (4H, м, CH2NCH2), 3,49 (2Н, с, ArCH2N), 5,30 (1H, дд, J=11,0, 1.4 Гц, CH=CH2), 5,66 (1H, д, J=17,5 Гц, CH=CH2), 7,22-7,33 (4Н, м, CH=CH2+HAr), 7,54 (1H, д, J=6,8 Гц, HAr). GC/MS, М+: 201.
Пример 4
Осуществляют аналогично Примеру 1, но вместо 2,2′-дихлороэтилового эфира используют 1,4-дибромбутан, а вместо гидроксида натрия используют гидроксид калия. Реакционную смесь 1,2,3,4-Тетрагидроизохинолина, 1,4-дибромбутана и гидрооксида калия в изопропаноле выдерживают при температуре кипения растворителя 3,5 часа, получают 1-(2-винилбензил)пирролидин S4 с выходом 83%.
1H NMR (400 MHz, chloroform-d), δ, ppm: 1,76-1,91 (4H, м, CH2CH2CH2CH2), 2,46-2,64 (4H, м, CH2NCH2), 3,68 (2H, с, ArCH2N), 5,31 (1H, дд, J=11.1, 1.6 Гц, CH=CH2), 5,66 (1H, д, J=17,5, 1,6 Гц, CH=CH2), 7,19-7,37 (4H, м, CH=CH2+HAr), 7,54 (1H, д, J=6,8 Гц, HAr). GC/MS, M+: 187.
Использование в предлагаемом способе доступных реагентов и условий (изохинолин как исходный реагент, муравьиная кислота - для восстановления изохинолиниевых солей, система гидроксид натрия/дигалогенид - для получения и расщепления четвертичных солей аминов) упрощает процесс и повышает его технологичность, позволяет получать различные аминометилстиролы, содержащие гетероциклический фрагмент с высокими выходами и чистотой.
1. Способ получения 2-аминометилстиролов, содержащих гетероциклический фрагмент общей формулы ,где R=CH2OCH2, R=o-C6H4, R=(CH2)3 или R=(CH2)2, заключающийся в том, что проводят реакцию восстановления изохинолина до 1,2,3,4-тетрагидроизохинолина в присутствии муравьиной кислоты, триэтиламина и (Ph3P)3RuCl2, который затем растворяют в изопропаноле, добавляют в раствор дигалогенид и щелочь, полученную реакционную смесь нагревают до температуры кипения изопропанола и выдерживают при данной температуре в течение 2-4 часов, после чего смесь упаривают, добавляют метилтретбутиловый эфир и перемешивают, полученную смесь фильтруют через порошок оксида алюминия до получения целевого продукта.
2. Способ по п. 1, отличающийся тем, что в качестве дигалогенида используют 2,2′-дихлороэтиловый эфир, α,α-дихлоро-o-ксилол, 1,4-дибромбутан или 1,5-дибромпентан.
3. Способ по п. 1, отличающийся тем, что щелочь выбирают из гидроксида натрия или гидроксида калия.