Новые бициклические диоксаны, их получение и применение в качестве ароматических соединений
Иллюстрации
Показать всеИзобретение относитcя к новым соединениям формулы (I), где: R3 и R4 независимо представляют собой атом водорода, C1-C6 алкильную группу или C2-C6 алкенильную группу, R5 представляет собой C1-C6 алкильную группу, а именно метил, этил, изобутил, трет-бутил, н.-пентил, C2-C6 алкенильную группу или (CH2)0-2-арильную группу, R6 представляет собой C1-C6 алкильную группу, C2-C6 алкенильную группу, (CH2)0-2-арильную группу или C5-C6 циклоалкильную или циклоалкенильную группу, и R7 представляет собой атом водорода, C1-C6 алкильную группу или C2-C6 алкенильную группу; или R3, R4 и R5 являются такими, как определено выше, и R6 и R7 вместе с атомом углерода, к которому они присоединены, образуют C5-C6 циклоалкильную или циклоалкенильную группу, а также к ароматической композиции на основе соединений формулы I, где R3, R4, R6 и R7 имеют вышеуказанные значения, и R5 представляет собой C1-C6 алкильную группу. 2 н. и 9 з.п. ф-лы, 6 табл., 48 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение относится к области ароматических веществ. Более конкретно, изобретение относится к бициклическим диоксанам, способам их получения и их применению в области парфюмерии.
УРОВЕНЬ ТЕХНИКИ
Ацетали составляют важный класс соединений в области химии ароматических соединений, применяемых, главным образом, в основных средах. Наиболее важные ацетали являются циклическими и известны благодаря своим фруктовым, цветочным или амбровым ароматам (Kraft, P., Bajgrowicz, J. A., Angew. Chem. Int. Ed. 2000, 39, 2980-3010).
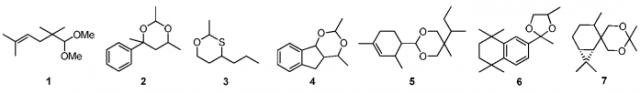
Среди фруктовых нот примеры коммерчески доступных ацеталей включают Methyl Pamplemousse® (1), Floropal® (2) и Oxane® (3). Эти соединения широко применяются в области парфюмерии. Среди цветочных нот довольно важны розовые ноты. Одним примером циклического диоксана, имеющего цветочную ноту, является Magnolan®. Его интересно используют для внесения свежести, в особенности в ландышевые аккорды. Примеры циклических диоксанов, имеющих амбровые ноты, включают окоумал (6), каранал (5) и спирамбрен (7). Окоумал обладает сильным амбровым ароматом, который очень хорошо смешивается с древесными аккордами. Каранал и спирамбрен также обладают сильным запахом.
ПРОБЛЕМЫ, ПОДЛЕЖАЩИЕ РЕШЕНИЮ
Потребность в новых соединениях является очень важной для развития парфюмерной промышленности, которая в последнее время должна соответствовать более строгим международным нормативным требованиям в отношении использования определенных материалов, а также экологическим и потребительским требованиям по улучшению качества. Кроме того, в области парфюмерии все чаще и чаще наблюдается явление, которое представляет собой аллергии на ароматические соединения. Одним способом минимизации риска аллергий является регулярная замена ароматических соединений в парфюмерных продуктах. Таким образом, существует постоянная потребность в ароматических соединениях, которые можно использовать для замены имеющихся веществ благодаря их подобным ароматам.
Следовательно, целью изобретения является предоставление новых ароматических соединений, а также способов селективного производства таких соединений.
Соответственно, заявитель фокусируется на синтезе новых бициклических ацеталей, более конкретно, бициклических 1,3-диоксанов. Удивительно и неожиданно то, что новые 1,3-диоксановые производные не дают ожидаемых амбровых нот, а главным образом, неожиданные зеленые ноты.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к применению в качестве ароматических агентов соединений формулы
В этой формуле:
- R3 и R4 независимо представляют собой атом водорода, C1-C6 алкильную группу или C2-C6 алкенильную группу,
- R5 представляет собой C1-C6 алкильную группу, C2-C6 алкенильную группу или (CH2)0-2-арильную группу,
- R6 представляет собой C1-C6 алкильную группу, C2-C6 алкенильную группу, (CH2)0-2-арильную группу или C5-C6 циклоалкильную или циклоалкенильную группу, и
- R7 представляет собой атом водорода, C1-C6 алкильную группу или C2-C6 алкенильную группу; или
- R3, R4 и R5 являются такими, как определено выше, и
- R6 и R7 вместе с атомом углерода, к которому они присоединены, образуют C5-C6 циклоалкильную или циклоалкенильную группу.
Среди соединений, определяемых формулой (I) и используемых по изобретению в качестве ароматических агентов, по сведению заявителей, некоторые являются новыми. В этом контексте изобретение также касается соединений формулы (I), которые определены выше, при условии что указанное соединение не является следующим:
- 2,2-диметил-4-этилгексагидробензо[1,3]диоксин,
- 2,2-диметил-4-н-пентилгексагидробензо[1,3]диоксин,
- 2,2-диметил-4-фенилгексагидробензо[1,3]диоксин,
- 2,4-диметилгексагидробензо[1,3]диоксин,
- 2,4-дифенилгексагидробензо[1,3]диоксин,
- 4-этил-2-метилгексагидробензо[1,3]диоксин,
- 4-метил-2-фенилгексагидробензо[1,3]диоксин,
- 2,2,4-триметилгексагидробензо[1,3]диоксин.
Настоящее изобретение относится к соединениям формулы (I), которые описаны выше, а также к любому из их разнообразных стереоизомеров.
Изобретение также касается способа получения соединений формулы (I), которые определены выше.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Как указано выше, изобретение касается соединений формулы
,
которые определены ранее, и применения соединений этого типа в качестве ароматических агентов.
Предпочтительно, если R3 и R4 независимо выбраны из группы, включающей атом водорода, метил, этил, изопропил, изобутил и трет-бутил, более предпочтительно из группы, включающей атом водорода, метил и трет-бутил.
R5 предпочтительно выбран из группы, включающей метил, этил, изопропил, изобутил, трет-бутил, н-пентил, 1-пропен-1-ил, аллил, винил и фенил, более предпочтительно из группы, включающей метил, этил, изобутил и фенил.
R6 предпочтительно выбран из группы, включающей метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, н-пентил, 1-пропен-1-ил, фенил, бензил и 2,4-диметилциклогексен-3-ил, более предпочтительно из группы, включающей метил, этил, изопропил, н-пентил, 1-пропен-1-ил, фенил, бензил и 2,4-диметилциклогексен-3-ил. Тогда R7 предпочтительно выбран из группы, включающей атом водорода, метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, н-пентил и 1-пропен-1-ил, более предпочтительно из группы, включающей атом водорода, метил и н-бутил.
Альтернативно, R6 и R7 вместе с атомом углерода, к которому они присоединены, образуют циклопентильную или циклогексильную группу, предпочтительно циклопентильную группу.
Согласно первому предпочтительному варианту R3 и R4 представляют собой атомы водорода. В этом первом варианте предпочтительно:
- R5 выбран из группы, включающей метил, этил, изобутил и фенил, и более предпочтительно метил,
- R6 выбран из группы, включающей метил, этил, изопропил, фенил, бензил и 2,4-диметилциклогексен-3-ил, и более предпочтительно этил или бензил,
- R7 выбран из группы, включающей атом водорода, метил и н-бутил, и более предпочтительно атом водорода.
Согласно второму предпочтительному варианту R3 и R7 представляют собой атомы водорода и R4 представляет собой трет-бутил. В этом втором варианте предпочтительно:
- R5 представляет собой метил, этил или фенил, и
- R6 представляет собой метил или изопропил.
В третьем предпочтительном варианте R3 и R4 представляют собой метил и R7 представляет собой атом водорода. В этом третьем варианте предпочтительно:
- R5 представляет собой метил или этил, и
- R6 выбран из группы, включающей метил, изопропил и 1-пропен-1-ил.
Особенно предпочтительными соединениями формулы (I) являются соединения из представленной в настоящем описании далее таблицы:
| R 3 | R 4 | R 5 | R 6 | R 7 | Обонятельный профиль | |
| Iaa | H | H | Me | Me | H | - зеленый, земляной, жареный орех, кофе |
| Iab | H | H | Me | н-C5H11 | H | - зеленый, маслянистый |
| Iac | H | H | Me | H | - зеленый, зрелые фрукты | |
| Iad | H | H | Me | Ph | H | - зеленый |
| Iae | H | H | Me | Bz | H | - цветочный (мимоза, гвоздика), пряный (эвгенол), мед |
| Iaf | H | H | Me | Et | H | - сильный, пряный (карри, эвгенол), лесной орех, пажитник, кофейные зерна, сельдерей, бархатцы, бессмертник, фруктовый (груша, яблоко, морковь) |
| Iah | H | H | Me | Me | Me | - зеленый, мятный, свежесть |
| Iai | H | H | Me | Me | н-Bu | - камфорный, фармацевтический, каучук |
| Iaj | H | H | Me | -(CH2)4- | - арахис, животный, чистый | |
| Iak | H | H | Me | H | - зеленый, цветочный, слегка животный | |
| Ial | H | H | Me | -[CH=CH-(CH2)3]- | - травяной, земляной, пряный | |
| Ibg | H | H | Et | i-Pr | H | - травяной, ромашка |
| Ica | H | H | Ph | Me | H | - пряный, экзотические фрукты |
| Ida | H | H | i-Bu | Me | H | - кожистый, крезол |
| I'aa | H | t-Bu | Me | Me | H | - серный, маслянистый |
| I'bg | H | t-Bu | Et | i-Pr | H | - травяной, ромашка, древесный |
| I'ca | H | t-Bu | Ph | Me | H | - зеленый, химический |
| I"aa | Me | Me | Me | Me | H | - ароматический, древесный, сильный |
| I"ac | Me | Me | Me | H | - травяной, мятный, фруктовый | |
| I"bg | Me | Me | Et | i-Pr | H | - травяной |
Соединения формулы (I), которые определены выше, демонстрируют интересные обонятельные свойства. Очень неожиданно и удивительно, что они не показывают типичные цветочные, амбровые или фруктовые ноты, ожидаемые специалистами, а скорее зеленые и/или пряные ноты.
Таким образом, другой аспект изобретения касается применения соединений формулы (I), которые описаны выше, в качестве ароматических агентов. Это изобретение также касается ароматической композиции, содержащей, по меньшей мере, одно соединение формулы (I) по изобретению.
Настоящее изобретение включает любую ароматическую композицию, содержащую в качестве ароматизатора или агента для придания запаха, по меньшей мере, соединение формулы (I). Соединения по изобретению можно использовать сами по себе или в комбинации с другими обычно используемыми парфюмерными ингредиентами, растворителями, добавками или фиксаторами, которые специалист в данной области способен выбрать в зависимости от желаемого эффекта и природы ароматизируемого продукта.
В первом варианте осуществления изобретение касается применения соединения формулы (I) по изобретению или композиции, содержащей, по меньшей мере, одно такое соединение, в области парфюмерии с целью получения ароматизированных основ и концентратов, ароматических веществ, духов и аналогичных продуктов (например, композиций локального применения, косметических композиций, таких как, например, кремы для лица и тела, очищающие средства, средства для ухода за лицом, порошки на базе талька, масла для волос, шампуни, лосьоны для волос, масла и соли для ванн, гели для душа и ванн, мыла, антиперспиранты и дезодоранты для тела, кремы и лосьоны для применения до, во время и после бритья, кремы, зубные пасты, полоскания для рта, помады, чистящие средства, такие как, например, смягчители, детергенты, дезодоранты воздуха и чистящие средства по уходу за домом). Таким образом, изобретение также касается ароматической композиции, включающей, по меньшей мере, одно соединение формулы (I).
Во втором варианте осуществления изобретение касается применения соединений или композиции, которые описаны выше, в качестве агентов маскировки запахов и любой фармацевтической или косметической композиции, содержащей, по меньшей мере, одно соединение формулы (I) или один или более изомеров соединения формулы (I). Таким образом, данное изобретение также касается любой композиции, содержащей, по меньшей мере, одно соединение формулы (I), которое описано в настоящем описании, в комбинации с любым подходящим наполнителем, главным образом, фармацевтическим или косметическим наполнителем.
В другом аспекте изобретение также касается способа ароматизации композиции посредством добавления к указанной композиции обонятельно-эффективного количества соединения формулы (I) по изобретению. Подходящие композиции включают ароматизированные основы и концентраты, ароматические вещества, духи и аналогичные продукты; композиции локального применения; косметические композиции, такие как, например, кремы для лица и тела, очищающие средства, средства для ухода за лицом, порошки на базе талька, масла для волос, шампуни, лосьоны для волос, масла и соли для ванн, гели для душа и ванн, мыла, антиперспиранты и дезодоранты для тела, кремы и лосьоны для применения до, во время и после бритья, кремы, зубные пасты, полоскания для рта, помады; чистящие средства, такие как, например, смягчители, детергенты, дезодоранты воздуха и чистящие средства по уходу за домом.
Еще в одном аспекте изобретение также касается способа маскировки запахов, включающего добавление к композиции обонятельно-эффективного количества, по меньшей мере, соединения формулы (I) по изобретению. Подходящие композиции включают, в частности, фармацевтические и косметические композиции. Подходящие косметические композиции включают кремы для лица и тела, очищающие средства, средства для ухода за лицом, порошки на базе талька, масла для волос, шампуни, лосьоны для волос, масла и соли для ванн, гели для душа и ванн, мыла, антиперспиранты и дезодоранты для тела, кремы и лосьоны для применения до, во время и после бритья, кремы, зубные пасты, полоскания для рта и помады.
Соединения по изобретению можно использовать при концентрациях в диапазоне от 0,001% до 99% масс., предпочтительно от 0,1% до 50% масс., более предпочтительно от 0,1% до 30% масс. Специалисту в данной области известно, что эти значения зависят от природы композиции/препарата, подлежащего ароматизации, требуемой интенсивности аромата и природы других ингредиентов, присутствующих в указанной композиции или препарате.
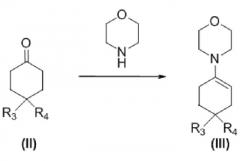
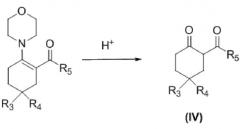
Изобретение также касается способа получения соединения, соответствующего формуле (I), которое определено выше, способа, включающего следующие стадии:
a) взаимодействие соединения формулы (II) с морфолином с получением енамина формулы (III)
,
где R3 и R4 такие, как определено выше,
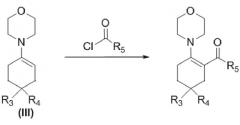
b) ацилирование енамина формулы (III) посредством R5-COCl, где R5 такой, как определено выше, с получением соответствующего ацилированного енамина
,
c) гидролиз ацилированного енамина, полученного на предыдущей стадии, в присутствии кислоты, такой как, например, соляная кислота, с получением дикетона формулы (IV)
,
d) восстановление дикетона (IV) с получением соответствующего диола (V)
и
e) взаимодействие диола (V) с R6-CO-R7, где R6 и R7 такие, как определено выше, с получением соединения формулы (I)
.
Стадию a) способа по изобретению проводят в органическом растворителе, который можно выбрать из группы, включающей толуол, ксилол, триметилбензол, циклогексан и метилциклогексан. Согласно предпочтительному варианту, органический растворитель представляет собой циклогексан или толуол.
Взаимодействие стадии a) предпочтительно проводят при температуре кипения с обратным холодильником.
Стадию b) проводят в органическом растворителе, который может быть выбран из группы, включающей толуол, ксилол, триметилбензол, циклогексан и метилциклогексан, в присутствии амина, предпочтительно триэтиламина. Согласно предпочтительному варианту органический растворитель представляет собой толуол.
Стадию c) предпочтительно проводят в том же растворителе, что и стадию b). Предпочтительно проводить непосредственное взаимодействие дикетона с кислотой без предварительной очистки.
Восстановление дикетона до диола на стадии d) проводят согласно обычным способам восстановления, хорошо известным специалисту в данной области, например, используя NaBH4, Dibal-H (динатрийбутилалюминийгидрид), LiAlH4 или H2. Особенно хорошие результаты получают с NaBH4.
ОПРЕДЕЛЕНИЯ
Термины "аромат" и "ароматизатор" используют попеременно в отношении соединения или смеси соединений, которая предназначена для приятного стимулирования обоняния.
Выражение "обонятельно-эффективное количество" обозначает уровень или количество ароматического соединения, присутствующего в материале, при котором включенное соединение демонстрирует сенсорный эффект.
Термин "маскировка" означает ослабление или устранение неприятного ощущения, генерируемого молекулами одного или нескольких видов, входящих в состав продукта.
Термин "изомер" обозначает молекулы, имеющие одну и ту же химическую формулу, что подразумевает одинаковое количество и типы атомов, но в которых атомы по-разному организованы. Термин "изомер" включает структурные изомеры, геометрические изомеры, оптические изомеры и стереоизомеры. Термин, в частности, включает цис/транс-изомеры, причем цис-изомеры представляют собой вещества, в которых бициклическое связывание осуществляется цис-способом, т.е. заместители, образующие ацетальный цикл, находятся с одной стороны циклогексильного цикла в (I). Транс-конфигурация представляет собой конфигурацию, в которой заместители, образующие ацетальный цикл, находятся с двух разных сторон циклогексильного цикла в (I) - бициклическое связывание осуществляется транс-способом.
Термин "C1-C6 алкил" или "C1-C6 алкильная группа" обозначает любую линейную или разветвленную насыщенную углеводородную цепь, имеющую 1, 2, 3, 4, 5 или 6 атомов углерода, такую как, например, метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил и н-пентил.
Термин "C2-C6 алкенил" или "C2-C6 алкенильная группа" обозначает любую линейную или разветвленную моно- или полиненасыщенную углеводородную цепь, имеющую 2, 3, 4, 5 или 6 атомов углерода, такую как, например, этенил, проп-1-енил, аллил, бут-1-енил, бут-2-енил или пентенил.
Термин "C5-C6 циклоалкил" или "C5-C6 циклоалкильная группа" обозначает любую циклическую насыщенную углеводородную цепь, имеющую 5 или 6 атомов углерода (а именно, циклопентил или циклогексил), замещенную (или нет) одной или несколькими алкильными и/или алкенильными группами, которые описаны выше, предпочтительно метилом и этилом.
Термин "C5-C6 циклоалкенил" или "C5-C6 циклоалкенильная группа" обозначает любую циклическую моно- или полиненасыщенную углеводородную цепь, имеющую предпочтительно 5, 6 или 7 атомов углерода, такую как, например, циклопентенил, циклогексенил и циклогептенил, замещенную (или нет) одной или несколькими алкильными и/или алкенильными группами, которые описаны выше, предпочтительно метилом и этилом.
Термин "арил" относится к полиненасыщенной, ароматической гидрокарбильной группе, имеющей один цикл (т.е. фенил) или несколько ароматических циклов, конденсированных вместе (например, нафтил) или связанных ковалентно, обычно содержащей от 5 до 12 атомов; предпочтительно от 6 до 10, где, по меньшей мере, один цикл является ароматическим. Предпочтительной арильной группой является фенил. Таким образом, термин "(CH2)0-2-арил" включает любую арильную группу, которая определена выше, а также любую -CH2-арильную группу и любую -(CH2)2-арильную группу, где арильный фрагмент такой, как определено выше. Предпочтительной -CH2-арильной группой является бензильная группа, и предпочтительной -(CH2)2-арильной группой является -(CH2)2-фенил.
Изобретение будет лучше понятно со ссылкой на следующие примеры. Эти примеры, как предполагается, являются типичными специфическими вариантами изобретения и не предназначены для ограничения области изобретения.
ПРИМЕРЫ
Пример 1: получение 4-циклогекс-1-енилморфолина (III)
Циклогексанон (98,14 г, 1,00 моль) добавляют по капле к 12 M раствору морфолина (118,48 г, 1,36 моль) в циклогексане (120 мл) при 65-70°C. Затем реакционную смесь нагревают при кипячении с обратным холодильником и по завершении взаимодействия проводят ГХ. Образовавшуюся воду удаляют, используя аппарат Дина-Старка.
После охлаждения удаляют растворитель в вакууме и сырой 4-циклогекс-1-енилморфолин (оранжевая жидкость, количественный выход) используют непосредственно на следующей стадии.
Пример 2: получение 4-(4-трет-бутилциклогекс-1-енил)морфолина (III')
Соединение III' (белое твердое вещество) получают количественно согласно примеру 1, из 4-трет-бутилциклогексанона (77,12 г, 0,50 моль), морфолина (54,01 г, 0,62 моль) и циклогексана (60 мл).
Пример 3: получение 4-(4,4-диметилциклогекс-1-енил)морфолина (III")
Соединение III" (коричневая жидкость) получают количественно согласно примеру 1, из 4,4-диметилциклогексанона (350,03 г, 2,76 моль), морфолина (327,01 г, 3,75 моль) и циклогексана (330 мл).
Пример 4: получение 2-ацетилциклогексанона (IVa)
К 0,65 M раствору 4-циклогекс-1-енилморфолина (82,64 г, 0,50 моль, 1 экв.), получаемого в примере 1, в толуоле (770 мл) добавляют триэтиламин (71,33 г, 0,70 моль, 1,41 экв.). Затем добавляют по капле ацетилхлорид (55,34 г, 0,70 моль, 1,41 экв.) и реакционную смесь перемешивают далее при 35°C в течение 20 часов и затем при комнатной температуре в течение ночи.
По завершении взаимодействия (с последующей ГХ) добавляют 20% водный раствор HCl (250 мл) и смесь перемешивают при кипячении с обратным холодильником в течение 1 часа.
После охлаждения органическую фазу дважды промывают водой, один раз насыщенным водным раствором NaHCO3 и насыщенным раствором соли. Затем органическую фазу сушат над сульфатом магния и выпаривают растворители. Далее очищают сырое масло дистиллированием, получая соединение IVa в виде бесцветного масла (49,95 г, 0,36 моль, 72% выход).
Т.к.: 48°C/0,6 Торр.
Пример 5: получение 2-пропионилциклогексанона (IVb)
Соединение IVb получают с 49% выходом в виде бесцветного масла согласно примеру 4, из 4-циклогекс-1-енилморфолина (82,64 г, 0,50 моль, получаемого в примере 1), триэтиламина (71,33 г, 1,41 моль), пропионилхлорида (64,76 г, 1,41 моль), толуола (770 мл) и 20% водного HCl (250 мл).
Т.к.: 98°C/5,4 Торр.
Пример 6: получение 2-бензоилциклогексанона (IVc)
Соединение IVc получают с 50% выходом в виде желтого порошка согласно примеру 4, из 4-циклогекс-1-енилморфолина (40,96 г, 0,25 моль, получаемого в примере 1), триэтиламина (35,35 г, 0,35 моль), бензоилхлорида (49,19 г, 0,35 моль), толуола (380 мл) и 20% водного HCl (125 мл).
Т.к.: 110°C/0,3 Торр.
Пример 7: получение 2-(3-метилбутаноил)циклогексанона (IVd)
Соединение IVd получают с 90% выходом в виде светло-желтой жидкости согласно примеру 4, из 4-циклогекс-1-енилморфолина (82,64 г, 0,5 моль, получаемого в примере 1), триэтиламина (71,34 г, 0,71 моль), изовалерилхлорида (85,01 г, 0,71 моль), толуола (760 мл) и 20% водного HCl (166 мл).
Т.к.: 76°C/0,68 Торр.
Пример 8: получение 2-ацетил-4-трет-бутилциклогексанона (IV'a)
Соединение IV'a получают с 53% выходом в виде желтого масла согласно примеру 4, из морфолиноенамина III' (36,89 г, 0,17 моль, получаемого в примере 2), триэтиламина (24,25 г, 0,24 моль), ацетилхлорида (18,84 г, 0,24 моль), толуола (260 мл) и 20% водного HCl (85 мл).
Т.к.: 74°C/0,5 Торр.
Пример 9: получение 4-трет-бутил-2-пропионилциклогексанона (IV'b)
Соединение IV'b получают с 58% выходом в виде желтого масла согласно примеру 4, из морфолиноенамина III' (36,89 г, 0,17 моль, получаемого в примере 2), триэтиламина (24,25 г, 0,24 моль), пропионилхлорида (22,2 г, 0,24 моль), толуола (260 мл) и 20% водного HCl (85 мл).
Т.к.: 98°C/0,7 Торр.
Пример 10: получение 2-бензоил-4-трет-бутилциклогексанона (IV'c)
Соединение IV'c получают с 35% выходом в виде желтого порошка согласно примеру 4 из морфолиноенамина III' (36,89 г, 0,17 моль, получаемого в примере 2), триэтиламина (24,25 г, 0,24 моль), бензоилхлорида (33,73 г, 0,24 моль), толуола (260 мл) и 20% водного HCl (85 мл).
Т.к.: 110°C/0,2 Торр.
Пример 11: получение 2-((Е)-бут-2-еноил)-4-трет-бутилциклогексанона (IV'e)
Соединение IV'e получают в виде белых кристаллов согласно примеру 4 из морфолиноенамина III' (55,33 г, 0,25 моль, получаемого в примере 2), триэтиламина (35,66 г, 0,35 моль), кротонилхлорида (36,85 г, 0,35 моль), толуола (380 мл) и 20% водного HCl (125 мл).
Т.к.: 115°C/0,76 Торр.
Т.пл.: 73,6°C.
Пример 12: получение 2-ацетил-4,4-диметилциклогексанона (IV"a)
Соединение IV"a получают с 33% выходом в виде светло-желтого масла согласно примеру 4 из морфолиноенамина III" (266,36 г, 1,36 моль, получаемого в примере 3), триэтиламина (194,04 г, 1,91 моль), ацетилхлорида (149,93 г, 1,91 моль), толуола (2,09 л) и 20% водного HCl (685 мл).
Т.к.: 98°C/6,1 Торр.
Пример 13: получение 4,4-диметил-2-пропионилциклогексанона (IV"b)
Соединение IV"b получают с 26% выходом в виде оранжевого масла согласно примеру 4 из морфолиноенамина III" (131,88 г, 0,67 моль, получаемого в примере 3), триэтиламина (95,59 г, 0,94 моль), пропионилхлорида (86,96 г, 0,94 моль), толуола (1,03 л) и 20% водного HCl (340 мл).
Т.к.: 64°C/1,1 Торр.
Пример 14: получение 2-(1-гидроксиэтил)циклогексанола (Va)
Дикетон IVa (49,95 г, 0,36 моль, 1 экв., получаемый в примере 4) добавляют по капле к молярной суспензии NaBH4 (13,47 г, 0,36 моль, 1 экв.) в EtOH (360 мл) при 10-15°C. По завершении взаимодействия (с последующей ТСХ) добавляют к реакционной смеси ацетон (65 мл). Затем выпаривают половину растворителей и смесь разбавляют водой и MTBE. Добавляют 10% водный HCl и водную фазу трижды экстрагируют MTBE. Затем объединенные органические фазы промывают насыщенным водным раствором NaHCO3 и насыщенным раствором соли. После сушки над сульфатом магния органическую фазу фильтруют и выпаривают растворители, получая сырой диол Va в виде светло-желтого масла с количественным выходом. Соединение Va используют на следующей стадии без дополнительной очистки.
Пример 15: получение 2-(1-гидроксипропил)циклогексанола (Vb)
Соединение Vb получают с 93% выходом в виде желтого масла согласно примеру 4 из дикетона IVb (37,73 г, 0,24 моль, получаемого в примере 5), NaBH4 (9,14 г, 0,24 моль), этанола (240 мл) и ацетона (40 мл).
Пример 16: получение 2-(гидроксифенилметил)циклогексанола (Vc)
Соединение Vc получают с количественным выходом в виде светло-желтого масла согласно примеру 14 из дикетона IVc (25,03 г, 0,12 моль, получаемого в примере 6), NaBH4 (4,67 г, 0,12 моль), этанола (120 мл) и ацетона (20 мл).
Пример 17: получение 2-(1-гидрокси-3-метилбутил)циклогексанола (Vd)
Соединение Vd получают с количественным выходом в виде бесцветного масла согласно примеру 14 из дикетона IVd (46,02 г, 0,25 моль, получаемого в примере 7), NaBH4 (9,45 г, 0,25 моль), этанола (240 мл) и ацетона (45 мл).
Пример 18: получение 4-трет-бутил-2-(1-гидроксиэтил)циклогексанола (V'a)
Соединение V'a получают с количественным выходом в виде желтого масла согласно примеру 14 из дикетона IV'a (15,5 г, 0,08 моль, получаемого в примере 8), NaBH4 (3,02 г, 0,08 моль), этанола (80 мл) и ацетона (15 мл).
Пример 19: получение 4-трет-бутил-2-(гидроксипропилметил)циклогексанола (V'b)
Соединение V'b получают с количественным выходом в виде желтого масла согласно примеру 14 из дикетона IV'b (16,7 г, 0,08 моль, получаемого в примере 9), NaBH4 (3,02 г, 0,08 моль), этанола (80 мл) и ацетона (15 мл).
Пример 20: получение 4-трет-бутил-2-(гидроксифенилметил)циклогексанола (V'c)
Соединение V'c получают с 78% выходом в виде белого порошка согласно примеру 14 из дикетона IV'c (14,56 г, 0,06 моль, получаемого в примере 10), NaBH4 (2,27 г, 0,06 моль), этанола (60 мл) и ацетона (10 мл).
Пример 21: получение 2-(1-гидроксиэтил)-4,4-диметилциклогексанола (V"a)
Соединение V"a получают с количественным выходом в виде светло-желтого масла согласно примеру 14 из дикетона IV"a (72,17 г, 0,43 моль, получаемого в примере 12), NaBH4 (16,25 г, 0,43 моль), этанола (430 мл) и ацетона (85 мл).
Пример 22: получение 2-(1-гидроксипропил)-4,4-диметилциклогексанола (V"b)
Соединение V"b получают с количественным выходом в виде светло-желтого масла согласно примеру 14 из дикетона IV"b (29,99 г, 0,16 моль, получаемого в примере 13), NaBH4 (6,05 г, 0,16 моль), этанола (160 мл) и ацетона (30 мл).
Пример 23: получение 2,4-диметилгексагидробензо[1,3]диоксина (Iaa)
Ацетальдегид (28,81 г, 0,40 моль) добавляют по капле к 2,3 M раствору диола Va (28,63 г, 0,20 моль, получаемого в примере 14) в кипящем с обратным холодильником циклогексане (85 мл). Взаимодействие катализируют посредством PTSA. Реакционную смесь кипятят с обратным холодильником в течение дополнительных 2 часов и образовавшуюся воду удаляют при помощи аппарата Дина-Старка.
По завершении взаимодействия (с последующей ГХ) реакционную смесь охлаждают и выливают в полунасыщенный водный раствор NaHCO3. Водную фазу дважды экстрагируют MTBE и объединенные органические слои промывают насыщенным водным раствором NaHCO3 и насыщенным раствором соли, а затем сушат над сульфатом магния. Растворители выпаривают и сырой продукт очищают дистиллированием, получая соединение Iaa в виде бесцветного масла с 25% выходом. Оно состоит из смеси 5 изомеров при 2 основных изомерах (83%): цис- и транс-изомеры с соотношением 70:30.
Т.к.: 65°C/6,5 Торр.
Обонятельный профиль: ароматы зеленый, земляной, жареный орех, кофе.
Основной цис-изомер:
1H-ЯМР (200 МГц, CDCl3): δ (м.д.) 0,70-1,80 (м, 8H), 1,12 (д, 3H, J=6,5 Гц), 1,32 (д, 3H, J=5,1 Гц), 1,88 (м, 1H), 3,76 (м, 2H), 4,72 (кв., 1H, J=5,1 Гц).
13C-ЯМР (50 МГц, CDCl3): δ (м.д.) 17,8, 19,4, 20,5, 21,2, 25,2, 31,7, 39,1, 75,3, 75,5, 98,7.
МС [e/m (%)]: 169 (M+, 5), 155 (10), 127 (3), 109 (39), 98 (9), 93 (11), 89 (29), 82 (100), 67 (75), 55 (16), 43 (18), 41 (15).
Основной транс-изомер:
1H-ЯМР (200 МГц, CDCl3, выборочные данные): δ (м.д.) 1,17 (д, 3H, J=6,3 Гц), 1,32 (д, 3H, J=5,1 Гц), 3,21 (дт, 1H, J=4,0 Гц, J=10,2 Гц), 3,38 (д.кв., 1H, J=6,3 Гц, J=9,5 Гц), 4,78 (кв., 1H, J=5,1 Гц).
13C-ЯМР (50 МГц, CDCl3): δ (м.д.) 18,5, 21,2, 24,6, 25,3, 25,8, 31,6, 47,2, 76,9, 80,5, 98,4.
МС [e/m (%)]: 169 (M+, 16), 155 (92), 127 (7), 109 (74), 98 (12), 93 (15), 89 (17), 82 (100), 67 (96), 55 (26), 43 (27), 41 (21).
Меньшие по количеству цис-изомеры:
1H-ЯМР (200 МГц, CDCl3, выборочные данные): δ (м.д.) 5,00 (кв., 1H, J=5,0 Гц).
13C-ЯМР (50 МГц, CDCl3, выборочные данные): δ (м.д.) 91,4.
МС [e/m (%)]: те же значения, что и для основного цис-изомера.
Пример 24: получение 4-метил-2-пентилгексагидробензо[1,3]диоксина (Iab)
Соединение Iab получают в виде бесцветного масла с 20% выходом согласно примеру 23 из диола Va (28,63 г, 0,2 моль, получаемого в примере 14), гексанала (24,03 г, 0,24 моль) и циклогексана (85 мл). Масло состоит из смеси 3 изомеров при 2 основных изомерах (98%) с соотношением 50:50.
Т.к.: 80°C/0,6 Торр.
Обонятельный профиль: зеленый, маслянистый.
Первый изомер:
1H-ЯМР (200 МГц, CDCl3): δ (м.д.) 0,87 (т, 3H, J=6,6 Гц), 1,05-1,20 (м, 3H), 1,06-1,81 (м, 16H), 1,91 (м, 1H), 3,75 (м, 2H), 4,56 (т, 1H, J=4,8 Гц).
13C-ЯМР (50 МГц, CDCl3): δ (м.д.) 14,1, 17,8, 19,4, 20,5, 22,6, 23,6, 25,2, 31,7, 31,8, 35,1, 39,3, 75,2, 75,5, 101,9.
МС [e/m (%)]: 225 (M+, 8), 155 (64), 145 (8), 127 (4), 109 (100), 83 (20), 82 (59), 67 (46), 55 (20), 43 (13), 41 (15).
Второй изомер:
1H-ЯМР (200 МГц, CDCl3, выборочные данные): δ (м.д.) 3,20 (дт, 1H, J=4,0 Гц, J=10,3 Гц), 3,37 (дкв, 1H, J=6,2 Гц, J=9,5 Гц), 4,60 (т, 1H, J=5,2 Гц).
13C-ЯМР (50 МГц, CDCl3): δ (м.д.) 14,0, 18,6, 22,5, 24,0, 24,6, 25,4, 25,9, 31,7, 31,8, 35,1, 39,3, 77,0, 80,6, 101,8.
МС [e/m (%)]: 225 (M+, 13), 155 (100), 145 (3), 127 (5), 109 (64), 83 (15), 82 (36), 67 (35), 55 (18), 43 (11), 41 (13).
Пример 25: получение 4-метил-2-пропенилгексагидробензо[1,3]диоксина (Iac)
Соединение Iac получают в виде бесцветного масла с 20% выходом согласно примеру 23 из диола Va (25,96 г, 0,18 моль, получаемого в примере 14), кротональдегида (15,14 г, 0,21 моль) и циклогексана (75 мл). Масло состоит из смеси 5 изомеров при 2 основных изомерах (85%): цис- и транс-изомеры с соотношением 62:38.
Т.к.: 62°C/0,6 Торр.
Обонятельный профиль: зеленый, зрелые фрукты.
Основной цис-изомер:
1H-ЯМР (200 МГц, CDCl3): δ (м.д.) 0,75-1,85 (м, 8H), 1,16 (д, 3H, J=6,5 Гц), 1,73 (д, 3H, J=6,4 Гц), 1,95 (м, 1H), 3,85 (м, 2H), 4,98 (д, 1H, J=6,0 Гц), 5,61 (м, 1H), 5,90 (дкв, 1H, J=0,5 Гц, J=6,4 Гц).
13C-ЯМР (50 МГц, CDCl3): δ (м.д.) 17,4, 17,5, 19,0, 20,1, 24,8, 31,4, 38,9, 75,1, 75,3, 101,0, 128,4, 130,5.
МС [e/m (%)]: 195 (М+, 6), 181 (10), 155 (1), 127 (3), 109 (68), 82 (14), 71 (100), 69 (18), 67 (44), 55 (17), 41 (19).
Основной транс-изомер:
1H-ЯМР (200 МГц, CDCl3, выборочные данные): δ (м.д.) 1,22 (д, 3H, J=6,2 Гц,), 1,74 (д, 3H, J=6,5 Гц), 3,29 (м, 1H), 3,48 (дкв, 1H, J=6,2 Гц, J=9,5 Гц), 5,06 (д, 1H, J=5,7 Гц), 5,97 (дкв, 1H, J=0,5 Гц, J=6,5 Гц).
13C-ЯМР (50 МГц, CDCl3): δ (м.д.) 17,3, 18,3, 24,3, 25,0, 25,6, 31,3, 47,0, 80,2, 80,3, 101,4, 128,1, 130,4.
МС [e/m (%)]: 195 (М+, 13), 181 (59), 155 (4), 127 (2), 109 (50), 82 (18), 71 (100), 69 (25), 67 (48), 55 (25), 41 (23).
Пример 26: получение 4-метил-2-фенилгексагидробензо[1,3]диоксина (Iad)
Соединение Iad получают в виде светло-желтого масла с 44% выходом согласно примеру 23 из диола Va (14,98 г, 0,1 моль, получаемого в примере 14), бензальдегида (21,22 г, 0,2 моль) и циклогексана (50 мл). Масло состоит из смеси 5 изомеров при 2 основных изомерах (84%): цис- и транс-изомеры с соотношением 60:40.
Т.к.: 102°C/0,5 Торр.
Обонятельный профиль: зеленый.
Основной цис-изомер:
1H-ЯМР (200 МГц, CDCl3): δ (м.д.) 0,82-1,43 (м, 2H), 1,23 (д, 3H, J=6,5 Гц), 1,44-1,95 (м, 6H), 2,03 (м, 1H), 4,02 (м, 2H), 5,57 (с, 1H), 7,37 (м, 3H), 7,55 (м, 2H).
13C-ЯМР (50 МГц, CDCl3): δ (м.д.) 17,9, 20,5, 24,6, 25,2, 31,7, 39,2, 75,9, 76,2, 101,7, 126,4, 128,2, 128,7, 139,2.
МС [e/m (%)]: 231 (М+, 80), 155 (2), 109 (43), 107 (100), 105 (36), 81 (20), 79 (23), 77 (23), 67 (32), 51 (5), 39 (6).
Основной транс-изомер:
1H-ЯМР (200 МГц, CDCl3, выборочные данные): δ (м.д.) 1,30 (д, 3H, J=6,2 Гц), 3,48 (м, 1H), 3,65 (дкв, 1H, J=6,2 Гц, J=9,5 Гц), 5,65 (с, 1H).
13C-ЯМР (50 МГц, CDCl3): δ (м.д.) 18,6, 19,5, 25,4, 25,9, 31,7, 47,4, 77,6, 81,1, 101,0, 126,2, 128,2, 128,6, 138,8.
МС [e/m (%)]: 231 (М+, 100), 155 (8), 109 (21), 107 (75), 105 (44), 81 (14), 79 (21), 77 (21), 67 (36), 51 (5), 39 (6).
Меньшие по количеству изомеры:
1H-ЯМР (200 МГц, CDCl3, выборочные данные): δ (м.д.) 5,89 (с, 1H).
13C-ЯМР (50 МГц, CDCl3, выборочные данные): δ (м.д.) 32,1.
1H-ЯМР (200 МГц, CDCl3, выборочные данные): δ (м.д.) 5,84 (с, 1H).
13C-ЯМР (50 МГц, CDCl3, выборочные данные): δ (м.д.) 31,7.
1H-ЯМР (200 МГц, CDCl3, выборочные данные): δ (м.д.) 5,94 (с, 1H).
13C-ЯМР (50 МГц, CDCl3, выборочные данные): δ (м.д.) 31,4.
Пример 27: получение 2-бензил-4-метилгексагидробензо[1,3]диоксина (Iae)
Соединение Iae получают в виде бесцветного масла с 30% выходом согласно примеру 23 из диола Va (25,96 г, 0,18 моль, получаемого в примере 14), фенилацетальдегида (25,23 г, 0,21 моль) и циклогексана (75 мл). Масло состоит из смеси 4 изомеров при 2 основных изомерах (93%): цис/транс-изомеры с соотношением 75:25.
Т.к.: 90°C/0,2 Торр.
Обонятельный профиль: цветочный (мимоза, гвоздика), пряный (эвгенол), мед.
Основной цис-изомер:
1H-ЯМР (200 МГц, CDCl3): δ (м.д.) 1,10 (д, 3H, J=6,6 Гц), 1,20-1,83 (м, 8H), 1,88 (м, 1H), 2,91 (д, 2H, J=5,0 Гц), 3,69 (м, 2H), 4,70 (т, 1H, J=5,0 Гц), 7,23 (м, 5H).
13C-ЯМР (50 МГц, CDCl3): δ (м.д.) 17,8, 19,4, 20,5, 25,2, 31,7, 39,2, 41,7, 75,3, 75,5, 101,9, 126,1, 127,9, 129,9, 137,2.
МС [e/m (%)]: 245 (М+, 1), 155 (52), 121 (3), 109 (100), 91 (31), 67 (25), 55 (8), 43 (5), 41 (8).
Основной транс-изомер:
1H-ЯМР (200 МГц, CDCl3, выборочные данные): δ (м.д.) 1,16 (д, 3H, J=6,3 Гц), 2,91 (д, 2H, J=5,0 Гц), 3,16 (дт, 1H, J=4,0 Гц, J=10,3 Гц), 3,34 (дкв, 1H, J=6,3 Гц, J=9,5 Гц), 4,74 (т, 1H, J=5,0 Гц).
13C-ЯМР (50 МГц, CDCl3): δ (м.д.) 18,6, 24,5, 25,4, 25,9, 31,6, 41,8, 47,6, 77,1, 80,6, 102,0, 126,2, 128,0, 129,7, 137,1.
МС [e/m (%)]: 245 (М+, 4), 155 (83), 121 (2), 109 (100), 91 (33), 67 (28), 55 (12), 43 (9), 41 (11).
Пример 28: получение 2-этил-4-метилгексагидро-4H-бензо[d][1,3]диоксина (Iaf)
Соединение Iaf получают в виде бесцветного масла с 60% выходом согласно примеру 23 из диола Va (25,96 г, 0,18 моль, получаемого в примере 14), пропиональдегида (51 г, 0,88 моль) и циклогексана (450 мл). Масло состоит, главным образом, из смеси 5 изомеров при 3 основных изомерах (78%) с соотношением 47:31:22.
Т.к.: 80-83°C/5,7 Торр.
Обонятельный профиль: сильный, пряный (карри, эвгенол), лесной орех, пажитник, кофейные зерна, сельдерей, бархатцы, бессмертник, фруктовый (груша, яблоко, морковь).
Первый основной цис-изомер:
1H-ЯМР (200 МГц, CDCl3): δ (м.д.) 0,70-1,05 (м, 1H), 0,92 (т, J=7,5 Гц, 3H), 1,05-1,53 (м, 5H), 1,17 (д, J=6,2 Гц, 3H), 1,53-1,73 (м, 3H), 1,73-2,05 (м, 2H), 3,19 (дт, J=10,1, 4,00 Гц, 1H), 3,38 (тт, J=9,5, 5,3 Гц, 1H), 4,54 (т, J=5,2 Гц, 1H).
13C-ЯМР (50 МГц, CDCl3): δ (м.д.) 8,62, 18,56, 24,59, 25,38, 25,88, 28,13, 31,66, 47,54, 76,94, 80,49, 102,70.
МС [e/m (%)]: 184 (М+, 1), 183 (10), 155 (63), 109 (82), 93 (11), 83 (14), 82 (79), 81 (17), 79 (13), 67 (100), 59 (19), 57 (27), 55 (37), 54 (21), 53 (13), 43 (21), 41 (34), 39 (18).
Второй основной транс-изомер:
1H-ЯМР (200 МГц, CDCl3, выборочные данные): δ (м.д.) 0,93 (т, J=7,61 Гц, 3H), 1,12 (д, J=6,54 Гц, 3H), 3,67-3,85 (м, 2H), 4,51 (т, J=4,65 Гц, 1H).
13C-ЯМР (50 МГц, CDCl3): δ (м.д.) 8,19, 17,8, 19,39, 20,53, 26,63, 28,06, 31,76, 39,32, 75,17, 75,41, 102,50
МС [e/m (%)]: 184 (М+, <1), 183 (4), 155 (29), 109 (80), 103 (14), 93 (11), 83 (14), 82 (100), 81 (14), 79 (13), 67 (100), 59 (17), 57 (20), 55 (29), 54 (20), 43 (19), 41 (30), 39 (15).
Третий основной транс-изомер:
1H-ЯМР (200 МГц, CDCl3, выборочные данные): δ (м.д.) 0,90 (т, J=7,64 Гц, 3H), 1,23 (д, J=6,96 Гц, 3H), 3,45-3,57 (м, 1H), 4,0-4,15 (м, 1H), 4,78 (т, J=5,01 Гц, 1H).
13C-ЯМР (50 МГц, CDCl3): δ (м.д.) 8,45, 13,08, 25,23, 25,67, 28,23, 32,14, 43,89, 71,67, 74,18, 95,27.
МС [e/m (%)]: 184 (М+, 1), 183 (9), 155 (66), 127 (10), 109 (100), 93 (13), 83 (12), 82 (40), 81 (15), 79 (11),