Способ уменьшения мультилекарственной резистентности с использованием трипирофосфата инозита
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к онкологии, и может быть использовано для лечения рака. Для этого субъекту, который в этом нуждается, последовательно вводят терапевтически эффективное количество триспирофосфата инозита (ITPP) и терапевтически эффективное количество химиотерапевтического агента, выбранного из агента, нацеленного на микротрубочки (доцетаксел, паклитаксел), ДНК-интеркалирующего агента (цисплатин, доксорубицин) и нуклеозидного метаболического ингибитора (гемцитабин, капецитабин). Причем ITPP вводят перед введением химиотерапевтического агента. Изобретение позволяет снизить дозу противоракового химиотерапевтического средства при последовательном введении ITPP и химиотерапевтических агентов за счет синергетического действия этих лекарственных средств. 13 з.п. ф-лы, 1 табл., 13 ил., 16 пр.
Реферат
РОДСТВЕННАЯ ЗАЯВКА
По данной заявке испрашивается приоритет на основании предварительной заявки США № 61/223 583, поданной 7 июля 2009 г., содержание которой полностью включено в настоящий документ посредством ссылки.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Рак представляет собой одну из ведущих причин смерти в развитых странах и приводит к смерти более 500 000 человек в год только в Соединенных штатах. Более миллиону человек ставят диагноз рака в США ежегодно, и, по общей оценке, более чем у 1 из трех человек в течение их жизни разовьется та или иная форма рака. Солидные опухоли отвечают более чем за 85% смертности от рака.
Ангиогенез связан с рядом различных типов рака. Ангиогенез контролируется хорошо регулируемой системой ангиогенных стимуляторов и ингибиторов. Контроль ангиогенеза изменяется при некоторых болезненных состояниях, и, во многих случаях, патологическое повреждение, связанное с заболеваниями, связано с неконтролируемым ангиогенезом. Полагают, что и контролируемый, и неконтролируемый ангиогенез происходят сходным образом. Эндотелиальные клетки и перициты, окруженные базальной мембраной, формируют кровеносные капилляры. Ангиогенез начинается с эрозии базальной мембраны ферментами, которые высвобождаются эндотелиальными клетками и лейкоцитами. Эндотелиальные клетки, выстилающие просвет кровеносных сосудов, затем выпячиваются через базальную мембрану. Ангиогенные стимуляторы индуцируют миграцию эндотелиальных клеток через эрозированную базальную мембрану. Мигрирующие клетки образуют «побег» из родительского кровеносного сосуда, в котором эндотелиальные клетки претерпевают митоз и пролиферируют. Эндотелиальные побеги сливаются друг с другом с образованием капиллярных петель, формируя новый кровеносный сосуд.
Постоянный, нерегулируемый ангиогенез наблюдается при многих болезненных состояниях, метастазах опухолей и патологическом росте эндотелиальных клеток. Различные патологические болезненные состояния, при которых имеет место нерегулируемый ангиогенез, подразделяют на ангиогенез-зависимые и ангиогенез-ассоциированные заболевания.
Гипотеза о том, что опухолевый рост является ангиогенез-зависимым, впервые была предложена в 1971 г. В простейших терминах указанная гипотеза гласит: «После того как появилась опухолевая «прививка» каждому увеличению популяции опухолевых клеток должно предшествовать увеличение количества новых капилляров, конвергирующих на опухоли». Под опухолевой «прививкой» в настоящее время понимают преваскулярную фазу роста опухоли, при которой популяция опухолевых клеток, занимающая объем в несколько кубических миллиметров и не превышающая нескольких миллионов клеток, может выживать с использованием существующих микрососудов хозяина. Экспансия опухолевого объема за пределы указанной фазы требует развития новых капиллярных кровеносных сосудов. Например, легочные микрометастазы на ранней преваскулярной стадии у мышей не выявляются, только на гистологических срезах с использованием мощного микроскопа.
Ангиогенез связан с рядом различных типов рака, включая солидные опухоли и гематогенные опухоли. Солидные опухоли, с которым связан ангиогенез, включают, без ограничения, рабдомиосаркомы, ретинобластомы, саркому Эвинга, нейробластому и остеосаркому. Ангиогенез также связан с гематогенными опухолями, такими как лейкозы, любые из острых или хронических неопластических заболеваний костного мозга, при которых наблюдается неограниченная пролиферация белых кровяных клеток, обычно сопровождающиеся анемией, нарушением свертываемости крови и увеличением лимфатических узлов, печени и селезенки. Полагают, что ангиогенез играет роль в патологических состояниях костного мозга, которые вызывают лейкозы и множественные миеломные болезни.
Как упоминалось выше, ряд свидетельств указывает на то, что ангиогенез является существенным для роста и персистенции солидных опухолей и их метастазов. После стимуляции ангиогенеза в опухолях появляется повышающая регуляция продукции ряда ангиогенных факторов, включая факторы роста фибробластов (aFGF и bFGF) и сосудистый эндотелиальный фактор роста/фактор проницаемости сосудов (VEGF/VPF).
Роль VEGF в регуляции ангиогенеза была объектом интенсивного изучения. В то время как VEGF представляет критический, ограничивающий скорость этап физиологического ангиогенеза, он, как представляется, является также важным при патологическом ангиогенезе, таком как ангиогенез, связанный с опухолевым ростом. VEGF известен также как фактор проницаемости сосудов, на основании его способности индуцировать просачивание из сосудов. Несколько солидных опухолей производят достаточные количества VEGF, который стимулирует пролиферацию и миграцию эндотелиальных клеток, индуцируя, таким образом, неоваскуляризацию. Как было показано, экспрессия VEGF достоверно влияет на прогноз различных видов рака у людей. Напряжение кислорода в опухоли играет ключевую роль в регуляции экспрессии гена VEGF. Экспрессия мРНК VEGF индуцируется воздействием низкого напряжения кислорода в ряде патофизиологических обстоятельств.
Растущие опухоли характеризуются гипоксией, которая индуцирует экспрессию VEGF, а также может служить прогностическим фактором возникновения метастатической болезни. Известно также, что, в отличие от нормальных кровеносных сосудов, сосудистая сеть опухолей имеет патологическую организацию, структуру и функцию. Сосуды опухоли, как было также установлено, протекают, а кровоток является неоднородным и часто скомпрометированным.
Поскольку раковым клеткам для роста и метастазирования требуется доступ к кровеносным сосудам, полагают, что ингибирование ангиогенеза дает надежду на лечение раковых заболеваний и опухолей. Однако антиангиогенные стратегии были изучены к настоящему времени без обеспечения продолжительного терапевтического эффекта из-за получающихся в результате селекции резистентных к лекарственным средствам высокоагрессивных метастатических раковых клеток. Указанные антиангиогенные лекарственные средства, которые нарушают васкуляризацию опухоли, в некоторых случаях, как было установлено, усиливают метастатическую инвазию.
Таким образом, то, что действительно необходимо, это практически нетоксичная композиция и способ, которые могут регулировать сосудистую сеть опухоли. Также требуется улучшение терапии рака.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Данные, представленные в примерах, указывают, что нормализация кровеносных сосудов в комбинации с химиотерапией является потенциально благоприятным подходом к лечению рака. Трисфосфат инозита (ITPP), аллостерический эффектор гемоглобина, усиливает высвобождение кислорода, противодействует эффектам гипоксии и ингибирует ангиогенез in vitro. В экспериментах на мышах ITPP в красных кровяных клетках (ITPP-RBC) уменьшает легочные метастазы, индуцированные внутривенной инъекцией клеток мышиной меланомы. ITPP, связанный с химиотерапевтическим агентами цисплатином и паклитакселом, ингибировали рост первичной меланомы и легочных метастазов. В экспериментах на крысах с аденокарциномой поджелудочной железы ITPP, использовавшийся в комбинации с гемцитабином, вызывал достоверное повышение коэффициента выживаемости экспериментальных животных, демонстрируя сильный аддитивный эффект. ITPP также достоверно усиливает инфильтрацию опухолей макрофагами и клетками натуральными киллерами.
Настоящее изобретение относится к способу лечения рака, включающему введение субъекту, который в этом нуждается, терапевтически эффективного количества ITPP и введение субъекту терапевтически эффективного количества химиотерапевтического агента после частичной сосудистой нормализации опухоли.
В одном аспекте настоящее изобретение относится к фармацевтической композиции, содержащей триспирофосфат инозита (ITPP) и химиотерапевтический агент, такой как агент, выбранный из паклитаксела, цисплатина и гемцитабина.
В другом аспекте настоящее изобретение относится к схеме лечения рака у субъекта, включающей введение, одновременно или последовательно, терапевтически эффективного количества ITPP и химиотерапевтического агента, такого как агент, выбранный из паклитаксела, цисплатина и гемцитабина.
В еще одном аспекте настоящее изобретение относится к фармацевтической композиции, содержащей ITPP и субтерапевтическое количество химиотерапевтического агента.
В еще одном аспекте настоящее изобретение относится к схеме лечения рака у субъекта, включающей введение, одновременно или последовательно, терапевтически эффективного количества ITPP и субтерапевтического количества химиотерапевтического агента.
В еще одном аспекте настоящее изобретение относится к способу лечения рака, который является резистентным к одному или более химиотерапевтическим агентам, введением терапевтически эффективного количества ITPP. В некоторых вариантах осуществления настоящего изобретения рак является резистентным к паклитакселу и/или цисплатину.
Настоящее изобретение относится также к способу лечения гиперпролиферативного состояния, включающему введение субъекту, который в этом нуждается, терапевтически эффективного количества ITPP, в котором гиперпролиферативное состояние не является раком или характеризуется нежелательным ангиогенезом.
Настоящее изобретение относится также к способу усиления иммунного ответа у субъекта, включающему введение субъекту, который в этом нуждается, терапевтически эффективного количества ITPP, в котором субъект не страдает раком или другой опухолью.
Помимо этого, настоящее изобретение включает применение композиций, описанных в настоящем документе, в медицине и применение композиций, описанных в настоящем документе, для производства лекарственного средства для лечения состояния, описанного в настоящем документе.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
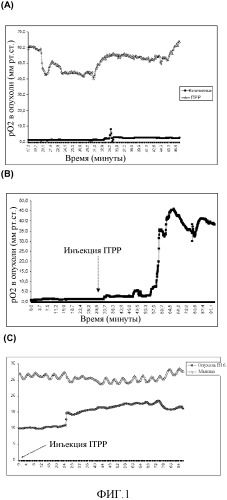
ФИГ. 1 показывает селективное повышение давление кислорода в развитой подкожной меланоме, индуцированное ITPP-красными кровяными клетками (RBC). (А) Сравнение между нелеченной опухолью, имплантированной 14 днями ранее, и такой же опухолью, леченной с использованием ITPP, на день 12 и 13. Обратите внимание на уровень рО2 через 24 часа после инъекции ITPP. (В) Измерение рО2 с промежутками времени в подкожно имплантированной опухоли до и после интраперитонеальной инъекции ITPP. Обратите внимание на повышение давления кислорода через 30 мин после воздействия. (С) ITPP не влияет на рО2 в мышце. Интраперитонеально инъецированный ITPP повышает рО2 в гипоксической подкожной опухоли (нижняя кривая), но не влияет на рО2 в здоровой мышце (верхняя кривая). Данные от одного репрезентативного эксперимента из десяти, проведенных с использованием десяти мышей на группу.
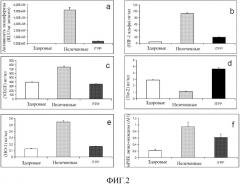
ФИГ. 2 показывает, что снабжение кислородом посредством ITPP-RBC ингибирует легочные метастазы и реверсирует индуцированный гипоксией генный каскад у экспериментальных животных с меланомой. Измерения белка и ферментативной активности в лизатах легких мышей с меланомой, не получавших лечения (серый цвет), и леченных ITPP-RBC (черный цвет), по сравнению со здоровыми контролями (белый цвет), на день 27 после инокуляции меланомы: (a) Количественное определение легочных метастазов с использованием исследования с люциферазой. (b) Экспрессия HIF-1α. (c) Экспрессия VEGF. (d) Экспрессия Tie-2 и (e) Экспрессия НО-1, оценка посредством ELISA на день 19 после инъекции клеток меланомы. (f) Содержание мРНК LOX, оценка. Данные представляют собой средние величины, рассчитанные по 8-10 отдельным мышам на группу, от одного репрезентативного эксперимента из 5.
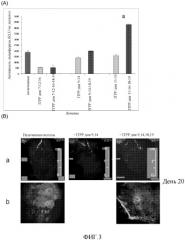
ФИГ. 3 показывает, что схема лечения ITPP может влиять на антиметастатическую активность, сосудистую нормализацию и уменьшение уровня клеток с мультилекарственной резистентностью у мышей с подкожной меланомой. (А) Эффект времени начала и продолжительности лечения ITPP до введения лекарственного средства на дни 20, 21. ITPP уменьшает метастазы, если его введение начинают на день 7, и является менее эффективным позднее, с увеличением метастазов при постоянном лечении. Анализ с люциферазой проводили на день 25. Данные представляют собой средние величины, рассчитанные по десяти отдельным мышам на группу, от одного репрезентативного эксперимента из 10. (В) Влияние лечения ITPP на нормализацию сосудов опухоли, по оценке на день 20, с использованием: (а) ядерного магнитного резонанса архитектуры сосудов в подкожных нелеченных опухолях по сравнению с леченными ITPP мышами. Обратите внимание на хорошо организованную сосудистую сеть (стрелки) после лечения ITPP (дни 9, 14, 18, 19) по сравнению с дезорганизованными прерывистыми сосудами (стрелки) в нелеченных опухолях; (b) иммунологического окрашивания перицитов вокруг нормализованных сосудов по сравнению с контролем с использованием анти-SMA антител.
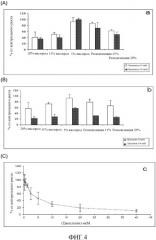
ФИГ. 4 показывает чувствительность к химиотерапевтическим агентам in vitro клеток мышиной меланомы после гипоксии и реоксигенации и эндотелия мышиного легкого. Чувствительность клеток меланомы к химиотерапевтическим лекарственным средствам: (А) паклитакселу; (В) цисплатину устранена гипоксией. Это стало обратимым после реоксигенации клеток. (С) Оценка чувствительности эндотелиальных клеток к цисплатину.
ФИГ. 5 показывает, что оксигенация и сосудистая нормализация опухоли улучшает химиотерапию меланомы. (А) Комбинация ITPP, паклитаксела и цисплатина уменьшает метастазы, согласно хронологии лечения. Ликвидация легочных метастазов была получена после реинъекции ITPP (дни после 18, 19) до реинъекции лекарственных средств (дни 20 и 21). (а) = нелеченные; (b) = ITPP дни 7, 12, 16; (с) = «b» + лекарственные средства дни 7, 12, 16; (d) = «с» + ITPP дни 18, 19 + лекарственные средства дни 20, 21; (е) = ITPP дни 9, 14; (f) = «е» + лекарственные средства дни 9, 14; (g) = «f» + ITPP дни 18, 19 + лекарственные средства дни 20, 21; (h) = ITPP 11, 16; (i) = «h» + лекарственные средства дни 11, 16; (j) = «i» + ITPP дни 18, 19 + лекарственные средства дни 20, 21. Активность люциферазы анализировали на день 25. Данные представляют собой средние величины, рассчитанные по десяти отдельным мышам на группу, от одного репрезентативного эксперимента из 10. (В) Равномерное комбинированное влияние ITPP-индуцированной нормализации на активность химиотерапевтических лекарственных средств. Две группы мышей лечили с использованием ITPP на дни 9, 14 или дни 9, 14, 18, 19. Две группы леченных ITPP мышей получали паклитаксел и цисплатин на дни 20, 21. Опухоли окрашивали на день 25. (а) Иммунологическое окрашивание сосудов с использованием CD31 (a1) в нелеченных опухолях по сравнению с ITPP-леченными и леченными лекарственными средствами мышами в а2 и а3 CD31 + окрашивание соответствует некротическим участкам. (b) Окрашивание гематоксилин-эозином опухолей у мышей, леченных как в (а). Обратите внимание на эффективную некротическую деструкцию опухоли после лечения (а3, b3). Данные являются репрезентативными для экспериментов, осуществленных с использованием 10 мышей на группу.
ФИГ. 6 показывает влияние лечения ITPP на выживаемость крыс с опухолью поджелудочной железы по сравнению с эффектом лечения только гемцитабином или плацебо. В группе, получавшей ITPP, крыс с опухолью поджелудочной железы лечили ITPP (1,5 мг/кг) еженедельно, в течение периода времени с дня 14 по день 49. В группе, получавшей гемцитабин, крыс с опухолью поджелудочной железы лечили гемцитабином (100 мг/кг) в дни 16, 18 и 20. Животные в контрольной группе не получали лечения.
ФИГ. 7 показывает влияние на выживаемость крыс с опухолью поджелудочной железы при использовании триспирофосфата гекса-натрий-миоинозита (OXY111A) в комбинации с гемцитабином, по сравнению с эффектом лечения только гемцитабином и плацебо. В группе комбинированного лечения крыс с опухолью поджелудочной железы лечили ITPP (1,5 мг/кг) в комбинации с гемцитабином (25 мг/кг или 50 мг/кг) еженедельно в течение периода времени с дня 14 по день 49. В группе лечения гемцитабином крыс с опухолью поджелудочной железы лечили гемцитабином (100 мг/кг) на дни 16, 18 и 20. Животные в контрольной группе не получали лечения.
ФИГ. 8 показывает влияние лечения ITPP на выживаемость бестимусных мышей с ксенотрансплантатами опухоли поджелудочной железы человека Panc-1, по сравнению с эффектом лечения только гемцитабином и плацебо. В группе лечения ITPP мышей с ксенотрансплантатом опухоли лечили ITPP (2 мг/кг) еженедельно в течение периода времени со дня 14 по день 49. В группе лечения гемцитабином мышей с ксенотрансплантатами опухоли поджелудочной железы лечили гемцитабином (100 мг/кг) на дни 16, 18 и 20. Животные в контрольной группе не получали лечения.
ФИГ. 9 показывает влияние на выживаемость бестимусных мышей с ксенотрансплантатами опухоли поджелудочной железы человека Panc-1 при использовании ITPP в комбинации с гемцитабином, по сравнению с эффектом лечения только гемцитабином и плацебо. В группе комбинированного лечения мышей с ксенотрансплантатами опухоли поджелудочной железы лечили ITPP (2 мг/кг) в комбинации с гемцитабином (25 мг/кг или 50 мг/кг) еженедельно в течение периода времени со дня 14 по день 49. В группе лечения гемцитабином мышей с ксенотрансплантатами опухоли поджелудочной железы лечили гемцитабином (100 мг/кг) на дни 16, 18 и 20. Животные в контрольной группе не получали лечения.
ФИГ. 10 показывает влияние лечения ITPP на экспрессию HIF-1α, VEGF, каспазы-3 и β-актина у крыс с опухолью поджелудочной железы, по сравнению с эффектом лечения только гемцитабином и плацебо.
ФИГ. 11 показывает влияние лечения ITPP на инфильтрацию CD68 (тип М2) макрофагами опухоли В16. OXY111A инъецировали интраперитонеально на дни 7, 8, 14, 15, 21, 22, 29 и 30. Анализ опухоли В16 осуществляли на день 31. (а) нелеченная опухоль В16; (b) и (с) окрашивание с использованием CD68 леченной ITPP опухоли показало инфильтрацию макрофагами CD68 (тип М2) опухоли В16.
ФИГ. 12 показывает влияние лечения ITPP на инфильтрацию клетками натуральными киллерами (NK) CD49b и на присутствие эндотелиальных клеток (ЕС) CD31 в опухоли В16. С (а) по (b) нелеченная опухоль В16; с (d) по (f) опухоль В16, леченная ITPP. Зеленые стрелки показывают инфильтрирующие клетки NK; красные стрелки показывают стенки сосудов.
ФИГ. 13 показывает влияние лечения ITPP на инвазию клетками NK меланомы опухолей В16. Клетки опухоли В16 метили с использованием B16F10 DAPI; клетки NK метили с использованием анти-CD49bFITCl; а эндотелиальные клетки сосудов метили с использованием анти-CD31TRITC. (а) нелеченная опухоль В16; (b) и (с) опухоль В16, леченная ITPP.
ПОДРОБНОЕ ОПИСАНИЕ
(1) Композиции по настоящему изобретению
Композиции, которые являются подходящими для настоящего изобретения, содержат кислоты и соли триспирофосфата инозита (ITPP); ITPP в настоящем документе представляет собой анион. Термин «триспирофосфат инозита», альтернативно известный как гексафосфат триспирофосфата инозита, относится к гексафосфату инозита с тремя внутренними пирофосфатными кольцами. Эквивалентный вид ITPP в настоящем документе называется противоионом, и комбинация ITPP с противоионом в настоящем документе называется кислотой или солью. Изобретение не ограничивается спариваниями, которые являются чисто ионными; действительно, специалистам хорошо известно, что спаренные ионы часто демонстрируют некоторую степень характеристики ковалентной или координационной связи между двумя компонентами пары. Кислоты и соли ITPP в композициях по настоящему изобретению могут содержать единственный тип противоиона или могут содержать смешанные противоионы, и могут, необязательно, содержать смесь анионов, одним из которых является ITPP. Композиции могут, необязательно, включать краун-эфиры, криптанды и другие виды, способные к хелатообразованию или к иному комплексированию с противоионами. Также композиции могут, необязательно, содержать кислотные макроциклы или другие виды, которые способны комплексироваться с ITPP через водородные связи или другие молекулярные притяжения. Способы получения кислот и солей с ITPP описаны в патенте США № 7 084 115, выданном Nicolau et al., содержание которого полностью включено в настоящий документ посредством ссылки.
Противоионы, которые предполагается использовать в изобретении, включают, без ограничения, следующие: катионные водородные виды, включая протоны и соответствующие ионы дейтерия и трития; одновалентные неорганические катионы, включая литий, натрий, калий, рубидий, цезий и медь (I); двухвалентные неорганические катионы, включая бериллий, магний, кальций, стронций, барий, марганец (II), цинк (II), медь (II) и железо (II); поливалентные неорганические катионы, включая железо (III); четвертичные азотистые соединения, включая аммоний, циклогептил аммония, циклооктил аммония, N,N-диметилциклогексил аммония и другие органические аммонийные катионы; соединения сульфония, включая триэтилсульфоний и другие органические соединения сульфония; органические катионы, включая пиридиний, пиперидиний, пиперазиний, хинуклидиний, пирролий, трипиперазиний и другие органические катионы; полимерные катионы, включая олигомеры, полимеры, пептиды, белки, положительно заряженные иономеры и другие макромолекулярные представители, которые имеют группы сульфония, четвертичные азотистые группы и/или заряженные органометаллические группы в боковых группах, концах цепи и/или каркасе полимера. Примером соли ITPP является монокальциевая тетранатриевая соль ITPP или смесь натрий-ITPP и кальций-ITPP, которая содержит 15-25 моль % кальция и 75-85 моль % натрия.
Предпочтительным изомером для ITPP, использующегося в настоящем изобретении, является миоинозит, который представляет собой цис-1,2,3,5-транс-4,6-циклогексангексил; однако изобретение этим не ограничивается. Так, изобретение предполагает использовать любой изомер инозита в ITPP, включая соответствующие трипирофосфаты природных сцилло-, хиро-, муко- и неоинозитных изомеров, а также трипирофосфаты натуральных алло-, эпи- и цис-инозитных изомеров.
Предполагается, что ITPP может образовываться in vivo из пролекарства, например, ферментативным расщеплением сложного эфира или перемещением удаляемой группы, такой как толилсульфонильная группа.
ITPP демонстрирует антиангиогенные и противоопухолевые свойства и является пригодным для контроля явлений, состояний или веществ, связанных с ангиогенезом или пролиферацией. Используемый в настоящем документе термин «контроль явлений, состояний или веществ, связанных с ангиогенезом или пролиферацией» относится к любому качественному или количественному изменению любого типа фактора, состояния, активности, индикатора, химического агента или комбинации химических агентов, мРНК, рецептора, маркера, медиатора, белка, транскрипционной активности и т.п., которое может или предполагается, что может быть связано с ангиогенезом или пролиферацией, и которое является результатом введения композиции по настоящему изобретению.
ITPP также повышает рО2 в микроокружении опухоли, ингибирует метастазы и неопластический неоангиогенез. Гипоксические опухолевые клетки, которые часто являются более инвазивными и устойчивыми к апоптозу, имеют тенденцию к резистентности к обычной химиотерапии. Так, в некоторых вариантах осуществления настоящего изобретения эффективность лечения химиотерапевтическим агентом повышается при комбинированном лечении с использованием ITPP. Далее, в некоторых аспектах, лечение ITPP индуцирует микрососудистую «нормализацию» опухоли.
ITPP, помимо этого, уменьшает количество помп, обеспечивающих отток лекарственных средств в опухолях, и, таким образом, в некоторых вариантах осуществления настоящего изобретения, лечит рак, резистентный к одному или более химиотерапевтическим агентам, и/или повышает эффективность химиотерапевтических агентов в отношении опухолевых клеток.
Настоящее изобретение относится к новым фармацевтическим композициям, содержащим ITPP и химиотерапевтический агент. Химиотерапевтический агент, подходящий для настоящего изобретения, включает: аминоглутетимид, амсакрин, анастрозол, аспарагиназу, БЦЖ, бикалутамид, блеомицин, бузерелин, бусульфан, камптотецин, капецитабин, карбоплатин, кармустин, хлорамбуцил, цисплатин, кладрибин, клодронат, колхицин, циклофосфамид, ципротерон, цитарабин, дакарбазин, дактиномицин, даунорубицин, диэнестрол, диэтилстилбестрол, доцетаксел, доксорубицин, эпирубицин, эстрадиол, эстрамустин, этопозид, экземестан, филграстим, флударабин, флудрокортизон, фторурацил, флуоксиместерон, флутамид, гемцитабин, генистеин, гозерелин, гидроксимочевину, идарубицин, ифосфамид, иматиниб, интерферон, иринотекан, иронотекан, летрозол, лейковорин, лейпролид, левамизол, ломустин, мехлорэтамин, медроксипрогестерон, мегестрол, мелфалан, меркаптопурин, месну, метотрексат, митомицин, митотан, митоксантрон, нилутамид, нокодазол, октреотид, оксалиплатин, паклитаксел, памидронат, пентостатин, пликамицин, порфимер, прокарбазин, ралтитрексед, ритуксимаб, стрептозоцин, сурамин, тамоскифен, темозоломид, тенипозид, тестостерон, тиогуанин, тиотепа, титаноцена дихлорид, топотекан, трастузумаб, третиноин, винбластин, винкристин, виндезин и винорелбин.
В одном варианте осуществления настоящего изобретения химиотерапевтический агент представляет собой агент, нацеленный на микротрубочки, такой как паклитаксел. В другом варианте осуществления настоящего изобретения химиотерапевтический агент представляет собой ДНК-интеркалирующий агент, такой как агенты на основе платины (например, цисплатин), или доксорубицин. В еще одном варианте осуществления настоящего изобретения химиотерапевтический агент представляет собой нуклеозидный метаболический ингибитор, такой как гемцитабин или капецитабин.
В некоторых вариантах осуществления настоящего изобретения химиотерапевтический агент композиции может содержаться в субтерапевтической дозе или количестве. Термин «субтерапевтическая доза или количество» означает, что доза или количество фармакологически активного вещества ниже дозы или количества указанного вещества, требующихся для введения в виде чистого вещества для достижения терапевтического эффекта. Субтерапевтическая доза указанного вещества будет варьироваться в зависимости от субъекта и болезненного состояния, подвергающихся лечению, массы тела и возраста субъекта, тяжести болезненного состояния, способа введения и т.п., что легко может определить специалист. В одном варианте осуществления настоящего изобретения субтерапевтическая доза или количество химиотерапевтического агента составляет менее 90% рекомендованной полной дозы химиотерапевтического агента, описанной в одобренной администрацией по пищевым продуктам и лекарственным средствам США информации по данному химиотерапевтическому агенту. В других вариантах осуществления настоящего изобретения субтерапевтическая доза или количество химиотерапевтического агента составляет менее 80%, 70%, 60%, 50%, 40%, 30%, 20% и даже 10% рекомендованной полной дозы, например, от 20% до 90%, от 30% до 80%, от 40% до 70%, или другие пределы в рамках величин, представленных в настоящем документе.
Настоящее изобретение относится также к набору для лечения рака, включающему ITPP и химиотерапевтический агент. Набор может быть снабжен инструкциями по использованию ITPP и химиотерапевтического агента, в соответствии со схемой лечения или способом по настоящему изобретению, как обсуждается ниже. Химиотерапевтический агент, подходящий для набора, может включать агенты, упомянутые выше. Субтерапевтическую дозу или количество химиотерапевтического агента можно использовать в наборе по настоящему изобретению. Также настоящим изобретением предусматриваются имплантаты или другие устройства, содержащие соединения или лекарственные средства ITPP или его пролекарства, в которых лекарственное средство или пролекарство помещено в биоразлагаемый или бионеразлагаемый полимер для замедленного высвобождения. Бионеразлагаемые полимеры высвобождают лекарственное средство контролируемым образом, посредством физических или механических процессов, без разложения самого полимера. Биоразлагаемые полимеры изготавливают таким образом, чтобы они постепенно гидролизовались или солюбилизировались посредством естественных процессов в организме, что позволяет получать постепенное высвобождение смешанного с ними лекарственного средства или пролекарства. Лекарственное средство или пролекарство может быть химически связано с полимером или может быть инкорпорировано в полимер смешиванием. Как биоразлагаемые, так и бионеразлагаемые полимеры, а также способы инкорпорирования лекарственных средств в полимеры для контролируемого высвобождения хорошо известны специалистам. Пример указанных полимеров можно найти во многих источниках, таких как статья Brem et al., J. Neuroserg. 74: стр. 441-446 (1991), которая целиком включена в настоящий документ посредством ссылки. Указанные имплантаты или устройства можно имплантировать поблизости от того места, в которое желательно осуществить доставку, например, в область опухоли.
Фармацевтические композиции по настоящему изобретению также могут содержать, или вводиться совместно (одновременно или последовательно), один или более фармакологических агентов, имеющих ценность для лечения одного или более болезненных состояний, упомянутых выше в настоящем документе.
Композиции обычно можно изготавливать и вводить с использованием стандартных методик, как, например, в Remington's Pharmaceutical Sciences, 17-е издание. Например, композиции, описанные в настоящем документе, можно изготавливать обычными способами, с использованием одного или более физиологически или фармацевтически приемлемых носителей или эксципиентов. Композиции по настоящему изобретению и их фармацевтически приемлемые соли, и сольваты могут изготавливаться, например, для введения путем инъекции (например, подкожной, внутримышечной, интраперитонеальной), ингаляции или инсуффляции (через рот или нос) или для перорального, трансбуккального, сублингвального, чрескожного, назального, парентерального или ректального введения. В одном варианте осуществления настоящего изобретения композицию можно вводить локально, в участок, где находятся клетки-мишени, т.е. в конкретную ткань, орган или жидкость (например, кровь, спинномозговую жидкость и т.п.). Следует понимать, что, помимо ингредиентов, упомянутых выше, композиции по настоящему изобретению могут включать другие агенты, обычные для изготовления композиции того типа, который рассматривается, например, композиции, подходящие для перорального введения, могут включать корригенты или другие агенты, которые делают композицию более привлекательной и легко проглатываемой.
Композиции по настоящему изобретению, подходящие для перорального введения, могут быть представлены как дискретные единицы, такие как капсулы, крахмальные капсулы или таблетки, содержащие заранее определенное количество активного ингредиента; как порошок или гранулы; как раствор или суспензия в водной жидкости или неводной жидкости; или как жидкая эмульсия типа «масло в воде» или эмульсия типа «вода в масле» и т.п. Таблетки можно изготавливать прессованием или формовкой, необязательно, с одним или более дополнительных ингредиентов. Таблетки могут, необязательно, иметь покрытие или насечки и могут изготавливаться таким образом, чтобы обеспечивать медленное или контролируемое высвобождение содержащегося в них активного ингредиента.
Композиции, подходящие для местного введения в рот, включают леденцы, содержащие ингредиенты в корригирующей основе, обычно в сахарозе или аравийской камеди или трагаканте; пастилки, содержащие активные ингредиенты в инертной основе, такой как желатин или глицерин, или в сахарозе и аравийской камеди; и ополаскиватели для полости рта, содержащие ингредиент, предназначенный для введения, в подходящем жидком носителе.
Композиции, подходящие для местного введения на кожу, могут быть представлены в виде мазей, кремов, гелей и паст, содержащих ингредиент, предназначенный для введения, в фармацевтически приемлемом носителе. Другая система для местной доставки представляет собой чрескожный пластырь, содержащий ингредиент, предназначенный для введения.
Композиции для ректального введения могут быть представлены в виде суппозитория на подходящей основе, включающей, например, масло какао и/или салицилат.
Композиции, подходящие для назального введения, в которых носитель представляет собой твердое вещество, включают крупный порошок, имеющий размер частиц, например, в пределах от 20 до 500 микрон, который вводят, втягивая носом, как нюхательный табак; т.е. посредством быстрого вдоха через носовой проход из контейнера с порошком, который держат вплотную к носу. Подходящие композиции, в которых носитель представляет собой жидкость, для введения в виде, например, назального спрея или назальных капель, включают водные или масляные растворы активного ингредиента.
Композиции, подходящие для вагинального введения, могут быть представлены в виде пессариев, тампонов, кремов, гелей, паст, пен или спреев, содержащих, помимо активного ингредиента, такие ингредиенты как носители, известные специалистам как подходящие для указанных целей.
Композиции, подходящие для ингаляции, могут быть представлены в виде аэрозолей, пылевидных порошков, порошков или спреев, содержащих, помимо активного ингредиента, такие ингредиенты как носители, известные специалистам как подходящие для указанных целей.
Композиции, подходящие для парентерального введения, включают водные и неводные стерильные растворы для инъекций, которые могут содержать антиоксиданты, буферы, бактериостатики и растворенные вещества, которые делают композицию изотоничной по отношению к крови предполагаемого реципиента; и водные и неводные стерильные суспензии, которые могут содержать суспендирующие агенты и загустители. Композиции могут быть представлены в виде контейнеров, содержащих одну дозу или множество доз, например, герметичных ампул и флаконов, и могут храниться в высушенном замораживанием (лиофилизированном) виде, требующем только добавления стерильного жидкого носителя, например, воды для инъекций, непосредственно перед использованием. Растворы и суспензии, получаемые непосредственно перед введением, могут изготавливаться из стерильных порошков, гранул и таблеток, описанных ранее.
Композиции, рассматриваемые как часть настоящего изобретения, включают композиции из наночастиц, изготовленные способами, описанными в публикации США № 2004/003367, которая полностью включена в настоящий документ посредством ссылки. В некоторых вариантах осуществления частицы соединений по настоящему изобретению имеют эффективный средний размер частиц менее приблизительно 2 микрон, менее приблизительно 1500 нм, менее приблизительно 1000 нм, менее приблизительно 500 нм, менее приблизительно 250 нм, менее приблизительно 100 нм или менее приблизительно 50 нм, по результатам измерения методами рассеяния света, микроскопии или других подходящих способов, хорошо известных специалистам.
(2) Схема и способ лечения по настоящему изобретению
ITPP индуцирует внутриопухолевую сосудистую нормализацию. ITPP-индуцированная сосудистая нормализация противодействует гипоксии опухоли, ключевой причине резистентности опухолевых клеток к облучению и цитотоксическим лекарственным средствам и метастазирования опухоли.
В одном аспекте настоящее изобретение относится к схеме или способу лечения рака или опухолей у субъекта, которые включают введение, одновременно или последовательно, терапевтически эффективного количества ITPP и химиотерапевтического агента. Фраза «терапевтически эффективное количество» означает такое количество указанного вещества, композиции, набор или схему лечения в целом, которые оказывают некоторый желательный локальный или системный эффект, обычно при разумном соотношении польза/риск, в контексте схемы или способа лечения. Терапевтически эффективное количество указанного вещества будет варьироваться в зависимости от субъекта и болезненного состояния, подвергающихся лечению, массы тела и возраста субъекта, тяжести болезненного состояния, способа введения и т.п., что легко может определить специалист. Например, определенные композиции, описанные в настоящем документе, можно вводить в количестве, достаточном для того, чтобы получить жел