Применение одного или комбинации фитоканнабиноидов для лечения эпилепсии
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к неврологии, и может быть использовано для лечения парциальных припадков эпилепсии. Для этого пациенту назначают каннабидиол (CBD) в виде выделенного соединения или растительного экстракта в количестве, которое обеспечивает суточную дозу по меньшей мере 400 мг. Растительный экстракт содержит менее 5% по массе тетрагидроканнабинола (ТНС) в качестве процента от любых каннабиноидов, присутствующих в составе смеси. Также заявлено применение CBD в комбинации с тетрагидроканнабиварином (THCV), где THCV присутствует в количестве, которое обеспечивает суточную дозу по меньшей мере 1,5 мг. Изобретение позволяет использовать фитоканннабиноиды в эффективной дозе для лечения определенных форм приступов, ассоциированных с эпилепсией. 10 з.п. ф-лы, 3 табл., 20 ил., 6 пр.
Реферат
Настоящее изобретение относится к применению одного или комбинации фитоканнабиноидов для лечения эпилепсии и, более конкретно, к применению тетрагидроканнабиварина (THCV) для лечения генерализованного приступа и/или каннабидиола (CBD) при генерализованном приступе и/или частичных приступах, (в противоположность приступам при локализации очага в височной доле).
УРОВЕНЬ ТЕХНИКИ
Эпилепсия представляет собой хроническое неврологическое расстройство, представляющее широкий спектр заболеваний, которыми страдают приблизительно 50 миллионов человек по всему миру (Sander, 2003).
Достижения в отношении понимания собственной "эндоканнабиноидной" системы человека привели к предположению, что некоторые лекарственные средства на основе конопли могут обладать потенциалом для лечения этого нарушения, связанного с гипервозбудимостью центральной нервной системы (Mackie, 2006, Wingerchuk, 2004, Alger, 2006).
Конопле приписывают как проконвульсивные (Brust et al., 1992), так и противоконвульсивные эффекты. Таким образом, еще предстоит установить, являются ли каннабиноиды еще не установленным терапевтическим противосудорожным препаратом или, напротив, потенциальным фактором риска для потребителей конопли в восстановительных и медицинских целях (Ferdinand et al., 2005).
В 1975 Consroe et al. описали случай молодого мужчины, у которого стандартное лечение (фенобарбитал и фенитоин) не обеспечивало контроль над приступами. Когда он начал курить коноплю вместе со стандартным лечением, у него не было приступов. Однако когда он употреблял коноплю отдельно, приступы возобновлялись. Они заключили, что "марихуана может обладать противосудорожным эффектом при эпилепсии у человека".
Исследование Ng (1990) вовлекало более крупную выборку из 308 пациентов с эпилепсией, которые были госпитализированы после их первого приступа. Их сравнивали с контрольной выборкой из 294 пациентов, которые не имели приступов, и было открыто, что употребление конопли, как оказалось, снижает вероятность приступа. Однако это исследование было подвергнуто критике в отчете Institute of Medicine (1999), где утверждается, исследование было "слабым", поскольку "оно не включало определение состояния здоровья до госпитализации и различия в их состоянии здоровья могли повлиять на употребление ими лекарственных средств".
В WO 02/064109 указываются антиэпилептические эффекты каннабиноида каннабидиола (CBD).
В WO 2006/054057 указывается на потенциальное применение THCV для лечения эпилепсии среди ряда заболеваний.
В WO 2009/007697 описаны составы, содержащие THCV и CBD.
В трех контролируемых испытаниях был исследован противоэпилептический потенциал каннабидиола. В каждом из них каннабидиол давали в пероральной форме людям, страдающим генерализованными тонико-клоническими или фокальными приступами.
Cunha et al. (1980) описали исследование на 16 пациентах с тонико-клоническими приступами, у которых традиционная терапия не имела успеха. Им проводили регулярную терапию и терапию 200-300 мг либо каннабидиола, либо плацебо. Среди пациентов, которые получали CBD, у 3 было показано полное улучшение, у 2 - частичное, у 2 - небольшое, а у 1 не было изменений. Единственным нежелательным эффектом было мягкое седативное действие. Среди пациентов, которым вводили плацебо, у 1 произошло улучшение, и у 7 не было изменений.
Ames (1986) описал менее успешное исследование, в котором 12 пациентам с эпилепсией давали 200-300 мг каннабидиола в сутки в дополнение к стандартным противоэпилептическим лекарственным средствам. Не было выявлено существенного улучшения в частоте приступов.
Trembly et al. (1990) описывают открытое испытание с одним пациентом, которому вводили 900-1200 мг каннабидиола в сутки в течение 10 месяцев. Это испытание продемонстрировало, что частота приступов у пациента существенно снизилась.
Возможно существенно, что в течение почти 20 лет после этих испытаний не было дальнейшего развития. Это можно связать с рядом факторов, включая общее предубеждение против лекарственных средств на основе конопли. Также возможно, что уровни доз, используемые в этих испытаниях, не были оптимальными, но заявитель определил, что каннабиноиды могут давать колоколообразные кривые доза-эффект.
В дополнение к описаниям, указывающим на то, что CBD может быть полезным, существует отчет (Davis & Ramsey) о тетрагидроканибиноле (THC), вводимом 5 детям, находящимся в стационарах, которые не отвечали на стандартное лечение (фенобарбитал и фенитоин). Один из них полностью освободился от приступов, один практически полностью освободился от приступов, а у других трех не возникло ухудшения.
Однако существует более сорока узнаваемых типов эпилептического синдрома, частично вследствие того, что подверженность приступам варьирует от пациента к пациенту (McCormick and Contreras, 2001, Lutz, 2004) и задачей является нахождение лекарственных средств, эффективных против этих различных типов.
Нейрональная активность является необходимым условием для надлежащего функционирования головного мозга. Однако нарушение равновесия возбуждение-ингибирование в нейрональной активности может индуцировать эпилептические приступы. Эти эпилептические приступы можно подразделить на две основных категории: частичные и генерализованные приступы. Частичные приступы возникают в конкретных областях головного мозга и остаются локализованными - наиболее часто в височных долях (включающих гиппокап), в то время как генерализованные приступы возникают во всем переднем мозге в качестве вторичной генерализации частичного приступа (McCormick and Contreras, 2001, Lutz, 2004). Эта концепция классификации на частичные и генерализованные приступы не становилась общей практикой до тех пор, пока International League Against Epilepsy в 1969 не опубликовала схему классификации эпилептических приступов (Merlis, 1970, Gastaut, 1970, Dreifuss et al., 1981).
International League Against Epilepsy далее подразделила частичные приступы, разделяя их на простые и комплексные, в зависимости от присутствия или нарушения сознания (Dreifuss et al., 1981).
Также лига подразделила генерализованные приступы на многочисленные клинические типы приступов, некоторые примеры которых описаны ниже.
Часто возникают малые эпилептические припадки, включающие внезапное начало и прерывание текущей активности. Кроме того, замедляется или затрудняется речь в случае приступов, длящихся только несколько секунд (Dreifuss et al., 1981).
Тонико-клонические приступы, часто известные как "большой эпилептический припадок", являются наиболее часто встречающимися из генерализованных приступов (Dreifuss et al., 1981). Этот тип генерализованных приступов имеет две стадии: тоническое сокращение мышц, которое затем приводит к клонической стадии конвульсивных движений. Пациент остается без сознания на протяжении приступа и в течение различных периодов времени после этого.
Атонические приступы, известные как "приступы падения", являются результатом внезапной утраты тонуса мышц конкретной мышцы, группы мышц или всех мышц в организме (Dreifuss et al., 1981).
Начало эпилептических приступов может быть угрожающим жизни, при этом больные также испытывают длительные последствия для здоровья (Lutz, 2004). Эти последствия могут иметь множество форм:
- проблемы с психическим здоровьем (например, препятствование нормальному развитию глутаматергических синапсов в детском возрасте);
- когнитивные нарушения (например, уменьшение способности нейрональных цепей в гиппокампе к обучению и сохранению воспоминаний);
- морфологические изменения (например, селективная утрата нейронов в областях CA1 и CA3 гиппокампа у пациентов с эпилепсией срединной височной доли в результате эксайтотоксичности) (Swann, 2004, Avoli et al., 2005).
Следует отметить, что эпилепсия также существенно влияет на образ жизни больного, потенциально живущего в страхе последующего повреждения (например травмы головы), вследствие тонико-клонических приступов или неспособности выполнять повседневные задачи или неспособности водить автомобиль, если только он не находится в длительном свободном от приступов периоде (Fisher et al., 2000).
Три твердо установившихся и широко используемых модели in vivo для острого приступа, который имитирует нейрональную активность и последующие физические симптомы, которые проявляются у людей с эпилепсией при приступе, представляют собой:
- индуцируемую пентилентетразолом модель генерализованных приступов (Obay et al., 2007, Rauca et al., 2004);
- индуцируемую пилокарпином модель приступов с очагом в височной доле (т.е. гиппокампе) (Pereira et al., 2007); и
- индуцируемую пенициллином модель частичных приступов (Bostanci and Bagirici, 2006).
Это обеспечивает ряд моделей приступов и эпилепсии, важных для терапевтического исследования у человека.
Задачей настоящего изобретения является идентификация фитоканнабиноидов или комбинаций фитоканнабиноидов, которые применимы для лечения определенных форм приступов, ассоциированных с эпилепсией.
Другой задачей настоящего изобретения является определение диапазонов доз которые, вероятно, окажутся эффективными, и идентификация комбинаций каннабиноидов (которые могут присутствовать в различных хемотипах или сортах конопли), которые, вероятно, окажутся более полезными, вследствие возможных отличий в их механизмах действия.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Согласно первому аспекту настоящего изобретения предоставляются один или несколько фитоканнабиноидов, выбранных из группы, состоящей из тетрагидроканнабиварина (THCV) и каннабидиола (CBD), для применения для лечения генерализованных приступов и/или частичных приступов.
Предпочтительно лекарственное средство предназначено для лечения клонических и/или тонических приступов.
Предпочтительная суточная доза THCV составляет по меньшей мере 1,5 мг, более предпочтительно по меньшей мере от 5 мг до 10 мг и до 15 мг или более.
Предпочтительно THCV применяют в комбинации по меньшей мере со вторым терапевтически эффективным каннабиноидом, предпочтительно CBD.
CBD предпочтительно присутствует в количестве, которое обеспечивает суточную дозу по меньшей мере 400 мг, более предпочтительно по меньшей мере 600 мг и вплоть до 800 мг или более, но предпочтительно менее 1200 мг.
Каннабиноиды могут присутствовать в качестве чистых или выделенных каннабиноидов или в форме растительных экстрактов. Когда используют растительный экстракт, предпочтительно, чтобы содержание THC составляло менее 5% по массе от всех каннабиноидов, более предпочтительно менее от 4% до 3%, 2% и 1%. THC можно селективно извлекать из экстрактов с использованием таких способов, как хроматография.
Также изобретение распространяется на применение фитоканнабиноида для изготовления лекарственного средства для лечения конкретной формы эпилепсии.
Согласно второму аспекту настоящего изобретения предоставляется композиция для применения для лечения генерализованных приступов и/или частичных приступов, содержащая THCV и/или CBD.
Композиция предпочтительно имеет форму растительного экстракта, содержащего один или несколько фитоканнабиноидов и один или несколько эксципиентов.
Согласно третьему аспекту настоящего изобретения предоставляется THCV и/или CBD для применения для изготовления лекарственного средства для лечения генерализованных приступов и/или частичных приступов.
Согласно четвертому аспекту настоящего изобретения предоставляется способ лечения генерализованных приступов и/или частичных приступов, включающий введение пациенту лекарственного средства, содержащего эффективное количество THCV и/или CBD.
Комбинированное применение основано на, несомненно, различных механизмах действия, учитывая различные результаты, наблюдаемые в различных моделях на животных и в различных дозах.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Варианты осуществления изобретения далее описаны в настоящем документе с помощью прилагаемых фигур.
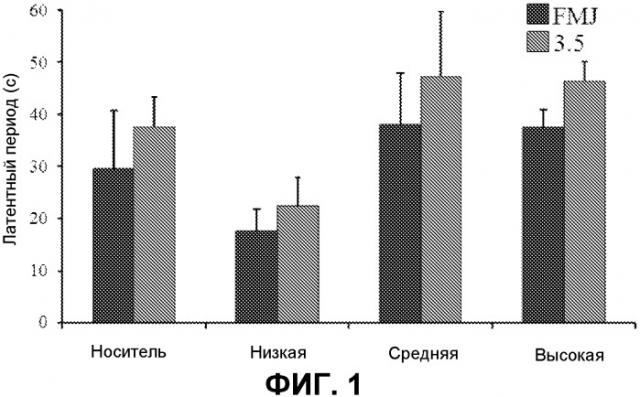
На фиг.1 представлен латентный период до начальной и поздней тяжести приступов. Представлена средняя латентность до первого судорожного мышечного движения (FMJ) и показателя 3,5±S.E.M. (стандартная ошибка среднего) для носителя или низких, средних или высоких доз THCV BDS и 70 мг/кг PTZ. n=8-10.
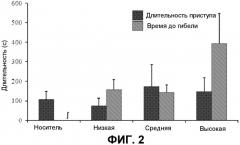
На фиг.2 представлена длительность приступа и время до смерти. Представлены средняя длительность приступов у животных, которые выжили, и время от первого признака приступа до смерти у тех животных, которые погибли, ±S.E.M. для носителя или для низких, средних или высоких доз THCV BDS и 70 мг/кг PTZ. n=3-10 в зависимости от доли животных, которые погибли в пределах экспериментальных групп. ∫ = в группе, получавших носитель, не было смертей и, таким образом, величина здесь не представлена.
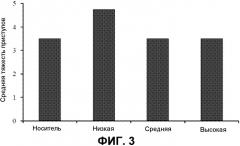
На фиг.3 представлены средние показатели тяжести. Средние показатели тяжести для групп животных, которым вводили носитель или низкие, средние или высокие дозы THCV BDS перед 70 мг/кг PTZ. n=10 для всех групп.
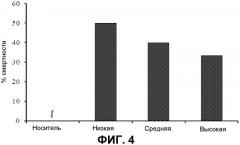
На фиг.4 представлены показатели смертности. Показатели смертности выражены в качестве процентов для животных, которым вводили носитель или низкие, средние или высокие дозы THCV BDS и 70 мг/кг PTZ. n=10 для всех групп. ∫ = в группе, получавших носитель, не было смертей, таким образом, величина не представлена.
На фиг.5 представлен латентный период для начальной и поздней тяжести приступов. Представлена средняя латентность до первого судорожного мышечного движения (FMJ) и показателя 3,5±S.E.M. для носителя или низких, средних или высоких доз THCV BDS и 80 мг/кг PTZ. n=7-10.
На фиг.6 представлена длительность приступа и время до смерти. Представлены средняя длительность приступов у животных, которые выжили, и время от первого признака приступа до смерти у тех животных, которые погибли, ±S.E.M. для носителя или для низких, средних или высоких доз THCV BDS и 80 мг/кг PTZ. n=3-7 в зависимости от доли животных, которые погибли в экспериментальных группах.
На фиг.7 представлены средние показатели тяжести. Средние показатели тяжести для групп животных, которым вводили носитель или низкие, средние или высокие дозы THCV BDS перед 80 мг/кг PTZ. n=10 для всех групп.
На фиг.8 представлены показатели смертности. Показатели смертности выражены в качестве процентов для животных, которым вводили носитель или низкие, средние или высокие дозы THCV BDS и 80 мг/кг PTZ. n=10 для всех групп.
На фиг.9A-D представлено индуцированное PTZ развитие приступа и его длительность в случае чистого THCV. На A, B и C представлена средняя латентность (c) от первой инъекции 80 мг/кг PTZ до: первого признака приступа (A); развития миоклонических приступов (B) и полных тонико-клонических приступов (C) для групп, в которых вводили носитель и THCV. n=5-16, в зависимости от встречаемости каждого показателя в конкретной группе). (D) представлена средняя длительность приступов (c) у животных, которые выжили после приступа. Все величины ±S.E.M., *указывают на значимое отличие от группы носителя (P<0,05; U-критерий Манна-Уитни).
На фиг.10A-B представлен эффект CBD на индуцируемые PTZ приступы A: % смертности, перенесенной в результате внутрибрюшинной инъекции 80 мг/кг PTZ у животных, которым вводили носитель и CBD (1, 10, 100 мг/кг CBD) (n=15 для всех групп). B: % животных, которым вводили носитель и CBD (1, 10, 100 мг/кг CBD), которые перенесли тонико-клонические приступы в результате внутрибрюшинной инъекции 80 мг/кг PTZ. * указывает на значимый результат (p<0,01).
На фиг.11 представлено отсутствие эффекта THCV на процентную смертность. Значимость оценивали с использованием биномиального критерия по сравнению с контролем, и значимость принимали при P<0,05. Не было выявлено значимого отличия относительно контроля в какой-либо дозе.
На фиг.12 представлено отсутствие эффекта THCV на среднее значение максимальной тяжести приступа. Значимость оценивали 1-сторонним ANOVA с помощью апостериорного критерия Тьюки; P>0,5 для всех сравнений против контроля.
На фиг.13A-D представлен процент животных в каждой группе, которые достигли конкретных состояний приступов после введения THCV. Значимые отличия против контроля оценивали с использованием биномиального критерия. P<0,05.
На фиг.14 представлен эффект CBD на процентную смертность. Значимость оценивали с помощью биномиального критерия; * указывает на значимое повышение смертности (P<0,05). Следует отметить, что этот эффект появлялся только при 10 мг/кг и утрачивался при 100 мг/кг, что указывает на двухфазный эффект.
На фиг.15 представлено среднее значение максимальной тяжести приступа. Значимость оценивали с помощью 1-стороннего ANOVA с апостериорным критерием Тьюки; P>0,5 для всех сравнений относительно контроля.
На фиг.16A-D представлен процент животных в каждой группе, которые достигли конкретных состояний приступов. Значимые отличия относительно контроля оценивали с использованием биномиального критерия. P<0,05(*); P<0,001(***).
На фиг.17 представлены эффекты CBD на среднюю частоту тонико-клонических приступов. Значимость оценивали с использованием одностороннего ANOVA с апостериорным критерием Тьюки. P<0,05(*); P<0,01(**).
На фиг.18 описана процентная продолжительность времени, проведенного в тонико-клоническом состоянии, по сравнению с общей длительностью периода приступа. Значимость оценивали с использованием одностороннего ANOVA с апостериорным критерием Тьюки. P<0,05(*).
На фиг.19A-B описаны эффекты CBD на тонико-клонические приступы без постурального контроля. A: % животных, которые перенесли тонико-клонические приступы без постурального контроля. B: частота, с которой у животных возникали тонико-клонические приступы без постурального контроля за период регистрации, составляющий два часа (или до гибели). A: биномиальный статистический критерий; B: односторонний ANOVA с последующим критерием Тьюки. **, *** и # указывают на p<0,01, 0,001 и 0,1 соответственно.
На фиг.20A-C описан эффект CBD на тяжесть индуцируемого пенициллином приступа и смертность. A: Средняя тяжесть приступов (серая линия), также показаны 25-й и 75-й процентили (черные горизонтальные линии) и максимальные и минимальные величины (верхние и нижние планки погрешностей, соответственно). B: Процент животных, которые оставались без приступов за все время. C: Процентная смертность. A: односторонний ANOVA с последующим критерием Тьюки. B и C: биномиальный статистический критерий; *, *** и # указывают на p<0,05, 0,001 и 0,1.
ПОДРОБНОЕ ОПИСАНИЕ
Модель PTZ - Примеры 1-3
Общая методика для модели PTZ
Животные
Для оценки эффектов каннабиноидов: THCV (BDS и чистые) и CBD в модели генерализованных приступов с PTZ, использовали самцов крыс Wistar (P24-29; 75-110 г). Перед экспериментированием животных приучали к тестовой окружающей среде, клеткам, протоколу инъекций и содержанию. Животных содержали в комнате при 21°С с 12-часовым циклом свет:темнота (включение света в 09:00) при 50% влажности, со свободным доступом к пище и воде.
Экспериментальная модель
Пять 6-л емкостей Perspex с крышками помещали на один стол с разделителями между ними. На разделители устанавливали передающие телевизионные камеры с замкнутой цепью (CCTV) для наблюдения за поведением. Камеры Sony Topica CCD (Bluecherry, США) были связаны через кабели BNC с малошумным PC через цифровые записывающие платы Brooktree (Bluecherry, США). Для мониторинга крыс, начала и завершения записи и управления видеофайлами использовали программное обеспечение Zoneminder (http://www.zoneminder.com). Для кодирования видеофайлов в пригодный формат для дальнейшего анализа в автономном режиме, с использованием The Observer (Noldus Technologies), применяли собственные скрипты для Linux.
Доза
Для определения наилучшей дозы для индукции приступов использовали ряд доз PTZ (50-100 мг/кг массы тела) (см. ниже). В результате для скрининга каннабиноидов использовали дозы 70 и 80 мг/кг, инъецируемые внутрибрюшинно (IP; исходный раствор 50 мг/мл в 0,9% солевом растворе).
Экспериментальные протоколы
В день тестирования животным проводили внутрибрюшинную инъекцию либо каннабиноидов (нижняя, средняя или высокая доза), либо соответствующего объема носителя для каннабиноидов (1:1:18 этанол:кремофор: 0,9% мас./об. раствор NaCl), который служил в качестве отрицательного контроля. Затем животных наблюдали в течение 30 мин, после чего им проводили внутрибрюшинную инъекцию 70 или 80 мг/кг PTZ. Параллельно исследовали отрицательные контроли в виде носителей у животных, которым вводили каннабиноиды. После введения дозы PTZ, животных наблюдали и записывали на видео для определения тяжести приступа и латентного периода до нескольких типов поведения при приступах (см. анализ in vivo ниже). Киносъемку животных проводили в течение получаса после последнего признака приступа, а затем возвращали в их клетки.
Анализ in vivo
Животных наблюдали в ходе экспериментальных процедур, однако весь анализ проводили в автономном режиме на записанных видеофайлах с использованием программы для анализа поведения The Observer (Noldus, Нидерланды). Для определения уровней приступа, перенесенного животными, использовали оценочную систему тяжести приступов (Pohl & Mares, 1987). Все признаки приступа детально исследовали для всех животных.
| Таблица 1 | ||
| Тяжесть приступов согласно шкале, адаптированная из Pohl & Mares, 1987 | ||
| Показатель приступа | Проявление поведения | Выпрямительный рефлекс |
| 0 | Без изменений в поведении | Сохранен |
| 0,5 | Аномальное поведение (принюхивание, чрезмерное умывание, ориентирование) | Сохранен |
| 1 | Изолированные судорожные мышечные движения | Сохранен |
| 2 | Атипический клонический приступ | Сохранен |
| 3 | Полностью развернутая двухсторонняя клоническая судорога передних конечностей | Сохранен |
| 3,5 | Клоническая судорога передних конечностей с тоническим компонентом и скручиванием тела | Сохранен |
| 4 | Тонико-клонический приступ с подавленной тонической фазой | Утрачен |
| 5 | Полностью развернутый тонико-клонический приступ | Утрачен |
| 6 | Гибель |
Латентность от инъекции PTZ до конкретных признаков развития приступа:
Регистрировали латентный период (в с) от инъекции PTZ до первого судорожного мышечного движения (FMJ; показатель 1) и до достижения животным "клонической судороги передних конечностей с тоническим компонентом и скручиванием тела" (показатель 3,5). FMJ является показателем начала связанной с приступом активности, в то время как у >90% животных развились показатели 3,5, и, таким образом, он является хорошим маркером развития более тяжелых приступов. Данные представлены в качестве среднего значения ± S.E.M. в пределах экспериментальной группы.
Максимальная тяжесть приступа:
Она приводится в качестве средней величины для каждой экспериментальной группы на основе оценочной шкалы ниже.
% смертности:
Процент животных в экспериментальной группе, которые погибли в результате индуцированных PTZ приступов. Следует отметить, что большинство животных, у которых развились тонико-клонические приступы (показатели 4 и 5) в исследовании THCV (BDS) в результате погибли, и что показатель 6 (гибель) автоматически означает, что животное также перенесло тонико-клонический приступ.
Длительность приступа:
Время (в секундах) от первого признака приступа (как правило, FMJ) до либо, последнего признака приступа, либо, в случае гибели животного, времени до гибели - раздельное для животных, которые выжили, и которые не выжили. Оно приводится в качестве среднего значения ± S.E.M. для каждой экспериментальной группы.
Статистика:
Отличия в латентном периоде и продолжительностях оценивали односторонним дисперсионным анализом (ANOVA) с апостериорным критерием Тьюки. Значимым считали P≤0,05.
Пример 1 - THCV (BDS)
THCV BDS содержал цельный экстракт хемовара, в котором THCV был преобладающим каннабиноидом. (т.е. он был основным каннабиноидом, присутствующим в экстракте, 80% по массе от общего содержания каннабиноидов). THC был вторым из наиболее распространенных каннабиноидов и он присутствовал в существенных количествах (т.е. он составлял более 10% по массе от общего содержания каннабиноидов, присутствуя в количестве приблизительно 16%), и был идентифицирован ряд второстепенных каннабиноидов, каждый из которых составлял менее 2% по массе от общего содержания каннабиноидов при измерении анализом ВЭЖХ. Соотношение THCV и THC в этом экстракте составляет приблизительно 5:1.
В действительности содержание THCV составляло 67,5% по массе экстракта и содержание THC составляло 13,6% по массе экстракта, причем другие идентифицированные каннабиноиды в целом составляли приблизительно 3% по массе экстракта, а остальные 16% составляли неканнабиноиды.
Предварительное исследование с PTZ
Исследовали приступы, индуцированные рядом концентраций PTZ (50-100 мг/кг; диапазон, представленный в литературе) у крыс для определения оптимальной дозы перед исследованием эффекта каннабиноидов. Дозы PTZ:
- 50 мг/кг и 60 мг/кг индуцировали очень небольшую подобную приступу активность (n=4);
- 70 мг/кг, как правило, индуцировали клонические приступы (показатель 3,5; 8 из 13 животных);
- 80 мг/кг регулярно индуцировали тонико-клонические приступы (показатели 4 и 5; 6 из 10 животных).
Кроме того, было открыто, что повторяющееся дозирование PTZ приводило к увеличенной чувствительности с течением времени; таким образом, на животных, которым уже вводили дозу PTZ, эксперименты не проводили.
Эффект THCV BDS на индуцированные PTZ приступы сначала оценивали в отношении дозы PTZ 70 мг/кг. Как описано ниже, это приводило к тому, что контрольная группа носителя, как правило, не испытывала тяжелые показатели приступов. Таким образом, THCV BDS также подвергали скринингу в отношении дозы 80 мг/кг PTZ. Было установлено, что увеличенная тяжесть приступа, которую испытывали контрольные животные, которым вводили носитель после введения 80 мг/кг PTZ, была более подходящим тестом для потенциальной противосудорожной активности.
Эффект THCV BDS на умеренно тяжелые (70 мг/кг) индуцированные PTZ приступы
Три дозы THCV BDS оценивали в отношении концентрации PTZ, известной тем, что она индуцирует умеренные приступы у крыс (70 мг/кг; см. предварительное исследование, выше). Использованные низкая, средняя и высокая дозы THCV BDS составляли 0,37, 3,70 и 37,04 мг/кг и они давали истинные дозы THCV 0,25, 2,5 и 25 мг/кг, соответственно. Эти дозы сопоставлялись по содержанию THCV с дозами, используемыми для скрининга чистого THCV против индуцированных PTZ приступов.
THCV BDS не имел каких-либо значимых эффектов на латентный период до первого судорожного мышечного движения или на латентный период до достижения показателя тяжести 3,5 по шкале тяжести приступов (фиг.1). Следует отметить, что хотя величины для обеих из этих переменных были более высокими у животных, которым вводили носитель и высокую дозу THCV BDS по сравнению с контролем, значимость не достигалась P>0,05). Аналогично, не наблюдали существенного влияния на длительность приступа (фиг.2).
Эффекты THCV BDS на тяжесть приступов (фиг.3) и смертность (фиг.4) у животных, которым вводили дозы 70 мг/кг PTZ, не согласуются с простым паттерном. Ни одно животное, которому инъецировали носитель отдельно, не превышало средний показатель тяжести 3,5 для этой группы, и ни одно животное не погибло (n=10).
Напротив, 70 мг/кг PTZ индуцировали тяжелые тонико-клонические приступы и гибель у 50% животных, которым инъецировали низкую дозу THCV BDS, демонстрируя средний показатель тяжести 4,75. Это увеличение тяжести не было значимым. Однако животные, которым инъецировали носитель и высокие дозы THCV BDS, проявляли более низкий средний показатель тяжести и более низкие уровни смертности, чем животные, которым вводили низкие дозы (фиг.3 и 4). Показатели смертности для средней и высокой дозы был выше, чем для группы носителя, но не значимо (P>0,05; фиг.4). Однако средние показатели тяжести были одинаковыми между средней и высокой дозами (фиг.3). Этот паттерн результатов показал, что требовался другой набор экспериментов, в котором THCV BDS подвергали скринингу против дозы PTZ, которая индуцировала бы тяжелые приступы у контрольных (которым вводили носитель) животных.
Эффект THCV BDS на тяжелые (80 мг/кг) индуцированные PTZ приступы
Оценивали эффекты тех же трех доз THCV BDS на приступы, индуцированные 80 мг/кг PTZ. Следует отметить, что 80 мг/кг индуцировали значимо более тяжелые приступы, чем 70 мг/кг в контрольных группах носителя (P=0,009), со средними показателями тяжести приступов 6 и 3,5, соответственно. THCV BDS не оказывал значимого эффекта на латентный период до FMJ или показателя тяжести 3,5 (фиг.5). Аналогично, не наблюдали эффекта на длительность приступов (фиг.6).
Низкая доза THCV BDS снижала как тяжесть приступов (фиг.7), так и смертность (фиг.8) у животных, которым вводили дозы 80 мг/кг PTZ. Животные, которым вводили низкую дозу THCV BDS, имели более низкий средний показатель тяжести (3,5 по сравнению с 6), чем контроли, которым вводили носитель. Однако это отличие не было значимым (P>0,5). Группа низкой дозы THCV BDS также имела показатель смертности, в два раза меньший, чем в контрольной группе носителя (30% против 60%).
Группы, в которых вводили средние и высокие дозы THCV BDS, имели более низкий показатель тяжести приступов 4,75 (P>0,5 против контроля), и более низкий уровень смертности, составляющий 50%, по сравнению с 6 и 60%, соответственно.
Обобщение и заключение для исследований in vivo
Скрининг THCV BDS в модели PTZ, по-видимому, не выявил каких-либо значимых противо- или проконвульсивных эффектов ни на умеренные, ни на тяжелые, индуцированные PTZ приступы. Однако наблюдали тенденцию в сторону более низкой тяжести и смертности у животных, которым вводили низкую дозу THCV BDS перед индукцией тяжелых (80 мг/кг PTZ) приступов, по сравнению с контролями в виде носителей.
Возможно, что этот эффект маскируется при более высоких дозах THCV BDS более высокими уровнями других каннабиноидных компонентов (таких как THC), присутствующих в не-THCV-содержимом THCV BDS. Более высокие дозы THCV BDS содержат возрастающие дозы не-THCV-содержимого, такого как THC, что может препятствовать каким-либо положительным эффектам THCV.
Пример 2 - THCV (чистый)
Эффект чистого THCV против индуцированных PTZ приступов
Низкую (0,025 мг/кг), среднюю (0,25 мг/кг) и высокую (2,5 мг/кг) дозы чистого THCV оценивали в отношении их эффектов на индуцируемые PTZ приступы. В этом отношении следует отметить, что, по сравнению с примером 1 (THCV BDS), использовали отличающиеся дозы чистого THCV по сравнению с THCV BDS. См. таблицу 2 ниже.
| Таблица 2 | |||
| Сравнение доз THCV BDS и чистого THCV, использованных в модели PTZ | |||
| Тестируемый CB | "Низкая" доза (мг/кг) | "Средняя" доза (мг/кг) | "Высокая" доза (мг/кг) |
| THCV BDS | 0,25 | 2,5 | 25 |
| Чистый THCV | 0,025 | 0,25 | 2,5 |
Величины приведены для эффективного содержания THCV в дозах (таким образом, истинные дозы THCV BDS приблизительно в 1,5 раза выше).
80 мг/кг PTZ успешно индуцировали приступы различной тяжести у животных из всех 4 экспериментальных групп (n=16 на группу). Индуцированные PTZ приступы приводили к гибели 44% животных, которым вводили носитель отдельно. Все группы, которым вводили низкую, среднюю и высокую дозу THCV, проявляли более низкие показатели смертности, составляющие 41%, 33% и 38% соответственно; однако эти величины не отличались значимо от группы носителя (p>0,05, биномиальный критерий).
Средние величины для латентного периода до первого признака приступа и до показателей [3] и [5] по использованной оценочной шкале для приступов, а также длительности приступа для выживших животных, описаны на фиг.9A-D.
Можно видеть, что у животных, которым вводили THCV, приступы начинались позже, как показано по увеличенному латентному периоду до первого проявления подобного приступу поведения (фиг.9A), по сравнению контролями, которым вводили носитель.
Задержка возникновения была значимой при наиболее высокой дозе THCV (p=0,02). Сходный паттерн наблюдали для латентных периодов до показателей [3] и [5] (фиг.9B и 9C), причем все дозы THCV проявляли увеличенные латентные периоды, достигая значимого уровня при наиболее высокой дозе THCV (p=0,017 и 0,013 для [3] и [5] соответственно).
Также было выявлено, что длительность индуцированных PTZ приступов у животных, которые пережили экспериментальный период, была значимо более короткой после введения средней дозы THCV по сравнению с контролями в виде носителя (фиг.9D; p=0,03).
В таблице 3 представлены величины для средней тяжести приступа в каждой экспериментальной группе.
| Таблица 3 | ||||
| Тяжесть и встречаемость приступов | ||||
| Носитель | 0,025 мг/кг THCV | 0,25 мг/кг THCV | 2,5 мг/кг THCV | |
| Средняя тяжесть | 4,25 | 3,5 | 3,5 | 3,5 |
| % без приступа | 12,5 | 5,9 | 33,3* | 18,8 |
Приведены средняя величина максимальной тяжести и % животных, которые не имели каких-либо признаков приступа для каждой экспериментальной группы (n=16 для каждой величины). *указывает на значимое отличие от группы носителя (биномиальный критерий значимости, P<0,05).
Контрольные животные, которым вводили носитель, проявляли среднюю тяжесть приступа 4,25, в то время как все группы, в которых вводили THCV, имели средний показатель тяжести 3,5. Это снижение не было статистически отличающимся.
12,5% контрольных животных, которым вводили носитель, не проявляли признаков приступа, указывая на то, что у этих животных не развивались приступы после введения PTZ. Значимо более высокое количество животных (33,3%) не проявляли признаков приступа в группе, в которой вводили 0,25 мг/кг (таблица 3; p=0,031). Эти данные указывают на то, что средняя доза 0,25 мг/кг THCV защищала против развития приступов.
Обобщение и заключение исследований in vivo
Эффекты высокой дозы THCV на величины латентности указывают на то, что THCV может замедлять как возникновение, так и развитие приступа, в то время как значимые эффекты средней дозы на встречаемость приступа при средних (0,25 мг/кг) дозах THCV указывают на значительное противосудорожное действие при индуцированных PTZ приступах.
Пример 3 - CBD (чистый)
В дополнение к THCV, CBD также подвергали скринингу в модели PTZ. Результаты отчетливо указывают на то, что CBD (на уровнях 100 мг/кг) в этой модели является противосудорожным средством, поскольку он значимо снижал уровень смертности и встречаемость наиболее тяжелых приступов по сравнению с контрольными животными, которым вводили носитель.
Эффект чистого CBD против индуцированных PTZ приступов
Чистый CBD инъецировали внутрибрюшинно (IP) в стандартном носителе (1:1:18 этанол:кремофор:0,9% мас./об. NaCl) в дозах 1, 10 и 100 мг/кг, наряду с животными, которым вводили только носитель в соответствующем объеме (n=15 для каждой группы). Через 60 минут вводили PTZ (80 мг/кг, IP).
46,7% контрольных животных, которым вводили носитель отдельно, погибли в течение 30 минут после ведения PTZ (фиг.10). Напротив, погибли только 6,7% (только 1 из 15) животных, которым вводили 100 мг/кг CBD, что является существенным снижением, которое оказалось значимым (p<0,001).
Кроме того, только 6,7% животных, которым вводили 100 мг/кг CBD, перенесли наиболее тяжелые приступы (показатель 5) по сравнению с 53,3% животных, которым вводили контроль в виде носителя, что является снижением, которое также было значимым (p<0,001; фиг.10 in vivo).
В противоположность чистому THCV, не наблюдали значимого увеличения латентного периода при развитии приступа. Однако выраженное и значимое снижение указывает на убедительный противосудорожный эффект в отношении индуцированных PTZ приступов.
Скрининг и анализ чистого CBD в модели с PTZ при высокой дозе (100 мг/кг) CBD на уровни смертности и встречаемость более тяжелых приступов указывают на то, что CBD может снижать тяжесть индуцированных PTZ приступов.
Модель с пилокарпином - Примеры 4 и 5
Пример 4 - чистый THCV
Эффект чистого THCV против индуцированных пилокарпином приступов
Чистый THCV инъецировали внутрибрюшинно (IP) в стандартном носителе (1:1:18 этанол:кремофор:0,9% масс/об. NaCl) в дозах 0,025, 0,25 и 2,5 мг/кг, наряду с животными, которым вводили носитель отдельно в соответствующем объеме (n>14 для каждой группы). Через 15 минут вводили метилскополамин (1 мг/кг; для снижения периферических мускариновых эффектов пилокарпина), а затем через 45 минут вводили пилокарпин (380 мг/кг, IP).
Результаты
Не наблюдали значимого эффекта в какой-либо дозе THCV на латентный период до начала приступа (P>0,5 для всех доз против контроля; 1-сторонний ANOVA с апостериорным критерием Тьюки). Для любой дозы THCV не на