Способ получения наноразмерной системы доставки трифосфата азидотимидина в клетки млекопитающих
Иллюстрации
Показать всеИзобретение относится к области химии, биологии и молекулярной медицины. Способ относится к получению наноразмерной системы доставки трифосфата азидотимидина в клетки млекопитающих и включает модификацию носителя, в качестве которого используют коммерческие аминосодержащие наночастицы диоксида кремния размером до 20 нм, путем суспендирования последних в ДМСО, содержащем 5% триэтиламин, до конечной концентрации 50-100 мг/мл с последующей обработкой полученной суспензии равным объемом 5% N-гидроксисукцинимидного эфира 5-(пропинилокси)-5-оксопентановой кислоты или 10% пентафторфенилового эфира 6-пропинилоксигексановой кислоты в ДМСО и последующую иммобилизацию трифосфата азидотимидина на полученных алкино-модифицированных наночастицах. Изобретение обеспечивает сокращение длительности способа и повышение функциональных возможностей целевого продукта. 2 з.п. ф-лы, 2 ил., 2 табл., 6 пр.
Реферат
Изобретение относится к области химии, биологии и молекулярной медицины и может быть использовано для получения наноразмерной системы доставки трифосфата азидотимидина в эукариотические клетки с целью создания эффективного противовирусного препарата.
Наночастицы вносят существенный вклад в развитие методов доставки лекарственных препаратов. В качестве наночастиц используются золотые наночастицы (Young K.L., et al., Nano Lett. 2012, v. 12, p. 3867-3871), полимеры (полимерные наночастицы, мицеллы, дендримеры) и органометаллические соединения (наночастицы, нанотрубки) (Cho К., et al., Clin. Cancer Res. 2008, v. 14, p. 1310-1316).
Известно использование наночастиц диоксида кремния (SiO2) для увеличения эффективности действия терапевтических агентов в раковых клетках, решения проблем растворимости и стабильности некоторых лекарств, а также адресной доставки лекарств и их последующего контролируемого высвобождения (Slowing I.I, et al., Adv. Drag Deliv. Rev. 2008, v. 60, p. 1278-1288; Manzano M., et al., Expert Opin. Drag Deliv. 2009, v. 6, p. 1383-1400; Vivero-Escoto J.L., et al., Small 2010, v. 6, p. 1952-1967).
В качестве противовирусных, противораковых и в меньшей степени противогрибковых препаратов достаточно широко используются аналоги нуклеозидов (N). Активной формой, воздействующей на вирус, являются не сами по себе аналоги нуклеозидов, а их фосфорилированные формы - 5′-трифосфаты (pppN), которые являются основными субстратами для ДНК и РНК полимераз (Galmarini С.М., et al., Lancet. Oncol. 2002, v. 3(7), p. 415-424).
Известен аналог нуклеозида - азидотимидин (AZT), который, попадая в клетку, подвергается фосфорилированию клеточными ферментами с образованием трифосфата AZT (pppAZT), избирательно подавляющего репликацию вирусной ДНК, конкурируя с трифосфатом тимидина (природного нуклеозида) за встраивание в растущие цепи вирусной РНК-зависимой ДНК-полимеразы (обратная транскриптаза) и подавляя тем самым репликацию вирусной ДНК (Lavie A. et al. Nat Med. 1997 v. 3(8), p. 922-941; Olivero O.A. Environ Mol Mutagen. 2007 v. 48(3-4), p. 215-223). Как и во всех случаях использования аналогов нуклеозидов, pppAZT проникает в клетки с низкой эффективностью, поэтому используют нефосфорилированный азидотимидин, что влечет необходимость использования больших доз препарата.
Решением проблемы токсичности может быть использование в качестве антивирусных препаратов не аналогов нуклеозидов (N), а уже готовых фосфорилированных форм - трифосфатов. Создание эффективного способа доставки трифосфатов нуклеозидов (pppN) является, таким образом, актуальной задачей, решение которой позволит использовать эти соединения в качестве лекарственных препаратов.
Известен способ получения наноразмерной системы доставки pppN в клетки путем их инкапсулирования в эритроциты (Magnani Μ., et al., J. Leukoc. Biol. 1997, v. 62, p. 133-137). Использование такой системы доставки pppN ограничено из-за трудности хранения, возможности загрязнения и недостаточной разработанности процедуры приготовления.
Известен способ получения наноразмерной системы доставки pppN в клетки в виде комплекса pppN с катионными наногелями, представляющими собой сополимер полиэтиленимина и полиэтиленгликоля (Vinogradov S.V., Expert Opin. Drug. Deliv. 2007, v. 4(1), p. 5-17; Vinogradov S.V., Curr. Pharm. Des. 2006, v. 12, p. 36). Предварительно полученный наногель диспергируют в воде при рН 10 для депротонирования аминогрупп, затем титруют его полученным раствором нуклеозидтрифосфата до рН 7.5, концентрируют в вакууме, пропускают через колонку NAP-20 и лиофилизуют.
Недостатками известного способа являются длительность и низкое качество целевого продукта, вследствие недостаточно прочной связи pppN с носителем.
Во всех упомянутых выше способах молекулы pppN связаны с носителями нековалентно, в частности за счет ионообменных взаимодействий. Это является причиной относительно быстрой кинетики высвобождения pppN из наноконструкции, его деградации и выведения из организма и, как следствие, больших потерь лекарства. Этот недостаток может быть преодолен путем создания такой системы доставки, в которой pppN ковалентно, т.е. достаточно прочно, связан с носителем.
Наиболее близким к заявляемому способу - прототипом - является способ получения системы доставки pppN в клетки млекопитающих (патент RU 2527681 C1, опубл. 10.09.2014), включающий модификацию носителя, в качестве которого используют коммерческие аминосодержащие наночастицы диоксида кремния (SiO2~NH2) размером до 24 нм, путем обработки последних N-гидроксисукцинимидным эфиром алифатической азидокислоты, далее получение модифицированного нуклеозидтрифосфата (pppN) путем обработки последнего смесью трифенилфосфин/дитиодипиридин с последующим инкубированием образующегося активного производного pppN с 3-пропинилоксипропиламином и последующую иммобилизацию модифицированного pppN на полученных азидо-модифицированных наночастицах в течение 2-4 ч. Полученный нанокомпозит SiO2~pppN выделяют центрифугированием. Емкость полученных наночастиц SiO2~pppN по нуклеозиду составляет 0.2-0.3 мкмоль/мг.
Недостатками известного способа являются длительность и ограниченные функциональные возможности целевого продукта, поскольку в качестве трифосфата нуклеозида используют трифосфат цитидина или уридина (природных нуклеозидов), не обладающие противовирусными свойствами.
Задачей изобретения является создание более простого способа получения наноразмерной системы доставки трифосфата нуклеозида в клетки.
Техническим результатом является упрощение и сокращение длительности способа, а также расширение функциональных возможностей целевого продукта.
Поставленная задача достигается заявляемым способом, заключающимся в следующем.
Предварительно получают алкино-модифицированные наночастицы диоксида кремния (≡L~SiO2). Для этого исходные аминосодержащие наночастицы (SiO2~NH2) размером до 20 нм добавляют в диметилсульфоксид (ДМСО), содержащий 5% триэтиламина (ТЭА), до конечной концентрации 50-100 мг/мл и суспендируют с помощью ультразвука. Затем к полученной суспензии добавляют равный объем 5% N-гидроксисукцинимидного эфира 5-(пропинилокси)-5-оксопентановой кислоты или 10% пентафторфенилового эфира 6-пропинилоксигексановой кислоты в ДМСО. Реакционную смесь перемешивают в течение 40-60 минут при комнатной температуре. Полученные алкино-модифицированные наночастицы (≡L~SiO2) отделяют центрифугированием, промывают ацетоном и серным эфиром и высушивают на воздухе. Замена аминогрупп на линкер с алкиногруппами происходит с выходом 85%. Процедура получения ≡L~SiO2 занимает около 2-х часов.
Далее проводят ковалентное присоединение трифосфата азидотимидина (pppAZT), полученного известным способом (Abramova T.V., et al., Tetrahedron Letters, 2004, v. 45, p.4361-1364), к алкино-модифицированным наночастицам. Для этого к ≡L~SiO2, суспендированным в воде с помощью ультразвука до конечной концентрации 30-70 мг/мл, добавляют 3-5-кратный объем 10 мМ водного раствора pppAZT и 1-1.5-кратный объем 1 М буферного раствора ацетата триэтиламмония, рН 7.0, содержащего 50 мМ сульфата меди(II) и 0.1 Μ аскорбата натрия. Реакционную смесь дегазируют 2 мин аргоном и перемешивают при комнатной температуре в течение 4 ч. Полученный целевой нанокомпозит (pppAZT*~L~SiO2) отделяют центрифугированием, затем высушивают и получают 10-20 мг целевого нанокомпозита (85-90% выход). В целом процесс получения наноразмерной системы доставки (нанокомпозита pppAZT*~L~SiO2) занимает не более 1 суток. Емкость полученных наночастиц pppAZT*~L~SiO2 по нуклеозиду составляет 0.3-0.39 мкмоль/мг.
Заявляемый способ позволяет сократить число стадий приготовления нанокомпозита и общую длительность приготовления целевого продукта с 3-х до 1 суток. При этом обеспечивается практически такая же высокая прочность связывания pppAZT с частицами, большая емкость нанокомпозита и способность проникать в клетки и быть субстратом для ДНК-полимеразы, как и в известном способе (прототипе).
Определяющими отличиями предлагаемого способа от прототипа, являются:
1. В качестве объекта для присоединения к системе доставки используют трифосфат азидотимидина (pppAZT), обладающий противовирусными свойствами, что позволяет расширить функциональные возможности целевого продукта, а также сократить длительность процесса получения целевого продукта, поскольку не требуется дополнительная модифицкация трифосфата нуклеозида. В прототипе в качестве трифосфата нуклезида использовали трифосфаты цитидина или уридина (природных нуклеозидов), не обладающие ингибирующими противовирусными (или противоопухолевыми) свойствами.
2. Суспензию, содержащую ДМСО, 5% ТЭА и коммерческие SiO2~NH2 в концентрации 50-100 мг/мл, обрабатывают равным объемом 5% N-оксисукцинимидным эфиром 5-(пропинилокси)-5-оксопентановой кислоты или 10% пентафторфениловым эфиром 6-пропинилоксигексановой кислоты, что позволяет получить алкино-модифицированные наночастицы (≡L~SiO2) для последующего присоединения трифосфата азидотимидина (pppAZT). При этом первый линкер несет в своей структуре сложноэфирную группировку, которая в дальнейшем под действием клеточных ферментов внутри клетки может разрушаться, приводя к высвобождению из нанокомпозита трифосфата производного азидотимидина. В прототипе использовались азидо-модифицированные наночастицы и линкеры, не содержащие эфирные группы.
3. Полученные алкино-модифицированные наночастицы суспендируют в воде с помощью ультразвука до конечной концентрации 30-70 мг/мл, к полученной суспензии добавляют 3-5-кратный объем 10 мМ водного раствора pppAZT и 1-1.5-кратный объем 1М буферного раствора ацетата триэтиламмония, рН 7.0, содержащего 50 мМ сульфата меди(II) и 0.1 Μ аскорбата натрия, что обеспечивает получение стабильной и эффективной системы доставки трифосфата азидотимидина в клетки млекопитающих.
Изобретение иллюстрируется следующими примерами конкретного выполнения.
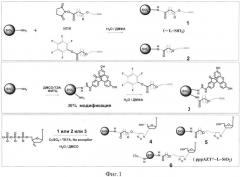
Пример 1. Получение нанокомпозита pppAZT*~L~SiO2 (1) (Фиг. 1, соединение 4)
Вначале получают алкино-модифицированные наночастицы (≡L-SiCO2). Для этого исходные NH2~SiO2-наночастицы (SkySpring Nanomaterials, Inc., USA) размером до 20 нм (10 мг, 5 мкмоль NH2-групп) суспендируют с помощью ультразвука в 0.1 мл ДМСО, содержащего 5% ТЭА, добавляют 0.1 мл 5% раствора N-оксисукцинимидного эфира 5-(пропинилокси)-5-оксопентановой кислоты (ООО «Нанотех-С», Новосибирск, Россия), предварительно растворенные в ДМСО. После перемешивания в течение 40 мин при комнатной температуре реакционную смесь центрифугируют (7000 об/мин, 5 мин), супернатант удаляют, а частицы промывают ацетоном (2×1 мл), эфиром (1×1 мл) и сушат на воздухе 30 мин. Получают 10 мг модифицированных наночастиц ≡L~SiO2 (SiO2-NH-CO-(CH2)3-CO-O-CH2-C≡CH, Фиг. 1, соединение 1) с выходом 86%. Замена аминогрупп на линкер с алкиногруппами происходит с выходом 85% (количество непрореагировавших аминогрупп определяют титрованием пикриновой кислотой и составляет не более 15%).
Затем полученные модифицированные наночастицы ≡L~SiO2 (10 мг, 4.3 мкмоль алкиногрупп), суспендируют в 0.3 мл воды с помощью ультразвука, добавляют 1 мл 10 мМ водного раствора pppAZT (~5 мг), 50 мМ раствор сульфата меди(II) в воде (0.1 мл), 1М ТЭААс буфер (рН 7, 0.1 мл) и 0.1 Μ свежеприготовленный раствор аскорбата натрия в воде (0.1 мл). Реакционную смесь дегазируют 2 мин аргоном и перемешивают при комнатной температуре в течение 4 ч. Полученный целевой нанокомпозит (pppAZT*~L~SiO2) (Фиг. 1, соединение 4) отделяют центрифугированием и промывают последовательно физиологическим раствором NaCl (1.5 мл), 10% ЭДТА, водой (2×1,5 мл), ацетоном (1.5 мл) и серным эфиром (1.5 мл). Частицы высушивают на воздухе и получают 10.37 мг целевого нанокомпозита (90% выход). Емкость нанокомпозита по нуклеозидтрифосфату, определенная по количеству присоединенного pppAZT*, составляет 0.39 мкмоль/мг.
Пример 2. Получение нанокомпозита pppAZT*~L~SiO2 (Фиг. 1, соединение 5)
Способ осуществляли аналогично примеру 1, за исключением того, что в реакции используют 20 мг SiO2~NH2-наночастиц, суспендированных в 0.4 мл ДМСО, содержащего 5% ТЭА, и пентафторфениловый эфир 6-пропинилоксигексановой кислоты (0.4 мл 10% раствора в ДМСО) (С6Н5-O-СО-(СН2)5-O-СН2-С≡СН (ООО «Нанотех-С», Новосибирск, Россия)), а перемешивание осуществляют в течение 60 мин. Получают 20 мг (92%) модифицированных наночастиц ≡L~SiO2 (SiO2~NH-CO-(CH2)3-CO-O-CH2-С≡СН, Фиг. 1, соединение 2). Замена аминогрупп на линкер с алкиногруппами происходит с выходом 85%.
Полученные наночастицы (20 мг, 8.4 мкмоль алкиногрупп) суспендируют в 0.3 мл воды, а все остальные реагенты используют в 1.5 раза большем количестве, чем указано в примере 1. Получают 19.5 мг целевого нанокомпозита (85% выход) (pppAZT*~L~SiO2) (Фиг. 1, соединение 5). Емкость нанокомпозита по нуклеозидтрифосфату, определенная по количеству присоединенного pppAZT*, составляет 0.3 мкмоль/мг.
Пример 3. Получение флуоресцеин-содержащего нанокомпозита pppAZT*~L~SiO2-Flu (Фиг. 1, соединение 6)
Вначале получают алкино-модифицированные наночастицы ≡L~SiO2(Flu), несущие остаток флуоресцеина (Фиг. 1, соединение 3). Для этого исходные NH2~SiO2-наночастицы (10 мг, 5 мкмоль NH2-групп) суспендируют с помощью ультразвука в 0.2 Μ растворе NaHCO3 (0.1 мл), добавляют раствор флуоресцеинизотиоцианата (1 мг, 2.6 мкмоль, 0.5 экв) в ДМСО (20 мкл). После перемешивания в течение 1 ч при комнатной температуре реакционную смесь центрифугируют (7000 об/мин, 5 мин), супернатант удаляют, а частицы промывают 0.1 Μ раствором NaCl (1 мл), водой (2×1 мл), ацетоном (2×1 мл), эфиром (1 мл) и сушат на воздухе 30 мин.
Полученные наночастицы (SiO2(Flu)~NH2 (10 мг) суспендируют в 0.2 мл ДМСО, содержащего 5% ТЭА, и далее проводят реакцию с пентафторфениловым эфиром 6-пропинилоксигексановой кислоты (0.2 мл 10% раствора в ДМСО). Получают 10 мг модифицированных наночастиц (SiO2(Flu)-NH~NH-CO-(CH2)5-O-CH2-C≡CH (80%) (=L~SiO2(Flu), Фиг. 1, соединение 3). Замена аминогрупп на остаток Flu и затем на линкер с алкиногруппами происходит на 10% и 75%, соответственно.
На следующей стадии получают флуоресцеин-содержащий нанокомпозит pppAZT*~L~SiO2-Flu (Фиг. 1, соединение 6) аналогично примеру 1, за исключением того, что вместо алкино-модифицированных частиц ≡L~SiO2 без остатка флуоресцеина используют флуоресцеин-содержащие наночастицы ≡L~SiO2(Flu) (10 мг). Получают 9.7 мг целевого нанокомпозита pppAZT*~L~SiO2-Flu (90% выход). Емкость нанокомпозита по нуклеозидтрифосфату, определенная по количеству присоединенного pppAZT*, составляет 70 наномоль/мг. Флуоресцентная метка необходима для дальнейшего исследования способности нанокомпозита проникать в клетки.
Пример 4. Оценка способности нанокомпозитов pppAZT*~L~SiO2-Flu проникать в клетки
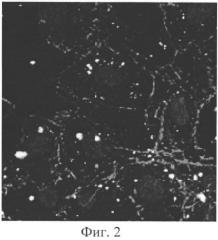
В эксперименте используют клетки Vero, Hoechst 33343, Cell Mask Plasma Membrane Stain, клеточную среду IMDM, эмбриональную телячью сыворотку (ЭТС), антибиотики, фосфатный буфер (PBS), рН 7.4. Для экспериментов клетки рассеивают в необходимой концентрации на 8-луночные камеры (Chamber Slide, Nunc. Inc.) и культивируют в среде IMDM, содержащей 10% ЭТС и антибиотики (пенициллин и стрептомицин, по 100 ед./мл) до достижения 70% монослоя, после этого заменяют культуральную среду на среду (200 мкл) без сыворотки и антибиотика. К клеткам добавляют суспензию, содержащую исследуемый образец pppAZT*~L~SiO2-Flu, полученный, как описано в примере 3, разбавленный буфером до концентрации 0.1 мг/мл (конечная концентрация в клеточной среде - ~0.01 мг/мл). После 24 ч инкубации клетки отмывают PBS, фиксируют 3.7% формалином (10 мин) и окрашивают Hoechst 33343 и Cell Mask Plasma Membrane Stain в течение 10 мин. Полученный образец анализируют с помощью конфокального лазерного сканирующего микроскопа LSM 510 UV Meta Microscope (Carl Zeiss, Inc., Германия) (Центр коллективного пользования ИЦИГ СО РАН).
На Фиг. 2 представлено изображение клеток после инкубации с исследуемым образцом pppAZT*~L~SiO2-Flu. В черно-белом изображении нанокомпозиты внутри клеток проявляются в виде белых точек.
Пример 5. Оценка цитотоксичности наночастиц и нанокомпозитов
Для оценки токсичности и противовирусной эффективности препаратов используют перевиваемую культуру клеток Vero, полученных из коллекции культур клеток ФБУН ГНЦ ВБ «Вектор». Суспензию клеток с концентрацией 1×105 кл./мл питательной среды DMEM (ООО «БиолоТ» г. Санкт-Петербург) вносят в объеме 100 мкл/лунку 96-луночного планшета. Планшеты с клетками помещают в термостат на 2-3 сут до образования монослоя при температуре 37°С, 5% CO2 и 100% влажности.
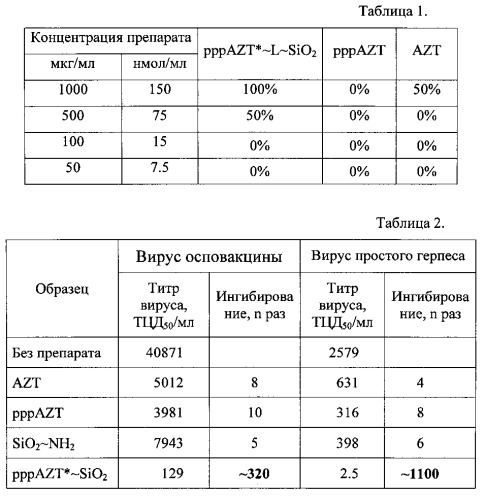
При определении токсических доз препараты pppAZT*~L~SiO2, AZT и pppAZT разводят средой DMEM до концентраций 150, 75, 30, 15 и 7,5 нмоль/мл (в случае препартов с наночастицами это соответствует концентрациям 1000, 500, 200, 100 и 50 мкг/мл по наночастицам при емкости нанокомпозитов по нуклеозиду по AZT 150 нмоль/мг). Образцы разведений препаратов вносят в лунки, содержащие монослой клеток Vero, по 100 мкл/лунку, и планшеты оставляют при температуре 37°С, 5% CO2 и 100% влажности. Через 4 сут с помощью инвертированного микроскопа оценивают деструктивные изменения в монослое клеток Vero, инкубированных с разными концентрациями препаратов. В качестве контроля используют монослой культуры клеток Vero без препарата. Результаты приведены в Табл. 1
Концентрация нанокомпозита pppAZT*~L~SiO2, приводящая к гибели 50% клеток (ТС50), оценена как 500 мкг/мл (75 нмоль/мл для нуклеозида в составе нанокомпозита), в то время как ТС50 для AZT оценена как 150 нмоль/мг, а трифосфат AZT не вызывал гибель клеток во всей области исследуемых концентраций.
Пример 6. Исследование противовирусных свойств исследуемых образцов
В работе использовали ортопоксвирусы: вирус осповакцины (штамм Л-ИВП) и вирус простого герпеса 2-го типа (штамм MS), полученные из коллекции ФБУН ГНЦ ВБ «Вектор».
При исследовании противовирусной активности препаратов использовали нетоксические концентрации, в несколько раз меньшие по сравнению с величиной ТС50 (100 мкг/мл по частицам или 15 нмоль/мл по нуклеозиду).
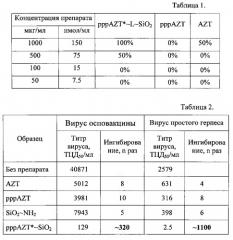
В среде DMEM готовили 8 разведений вируссодержащей культуральной жидкости (ВКЖ) с десятикратным шагом. На монослой клеток Vero вносили разведения препарата в объеме 100 мкл/лунку и разведения ВКЖ (с 1-го по 8-е) в объеме 100 мкл/лунку. Клетки инкубировали 4 сут при температуре 37°С в атмосфере 5% CO2. Затем в каждой лунке с помощью инвертированного микроскопа регистрировали цитопатическое действие в монослое клеток. Определяли титры вирусов в клетках в величинах log ТЦД50/мл в опыте и контроле (т.е. с препаратом и без препарата). Для того чтобы определить, во сколько раз исследуемые препараты подавляют репродукцию вирусов, величины log ТЦД50/мл переводили в ТЦД50/мл (Табл. 2) и полученные значения ТЦД50/мл сравнивали с соответствующим значением для титра вируса в клетках, не обработанных препаратами:
Контрольные образцы AZT и pppAZT, не связанные с наночастицами, а также исходные наночастицы SiO2~NH2 показали очень низкую противовирусную активность (подавление репродукции вирусов происходило не более чем на один порядок). В то же время полученный препарат pppAZT*~L~SiO2 оказался эффективным и ингибировал вирус осповакцины и простого герпеса в ~300 и ~1000 раз соответственно.
Использование предлагаемого способа позволит существенно сократить его длительность и обеспечить получение стабильной и эффективной системы доставки трифосфата азидотимидина в клетки млекопитающих.
1. Способ получения наноразмерной системы доставки трифосфата азидотимидина в клетки млекопитающих, включающий получение модифицированных наночастиц диоксида кремния с последующим присоединением к полученным модифицированным наночастицам трифосфата нуклеозида, отделением целевого продукта центрифугированием и высушиванием, отличающийся тем, что исходные аминосодержащие наночастицы добавляют в диметилсульфоксид, содержащий 5% триэтиламина, до конечной концентрации 50-100 мг/мл и суспендируют, затем к полученной суспензии добавляют равный объем 5% N-оксисукцинимидного эфира 5-(пропинилокси)-5-оксопентановой кислоты или 10% пентафторфенилового эфира 6-пропинилоксигексановой кислоты в ДМСО, далее полученные алкино-модифицированные наночастицы суспендируют в воде до конечной концентрации 30-70 мг/мл, к полученной суспензии добавляют 3-5-кратный объем 10 мМ водного раствора трифосфата азидотимидина и 1-1.5-кратный объем 1М буферного раствора ацетата триэтиламмония, pH 7.0, содержащего 50 мМ сульфата меди(II) и 0.1 M аскорбата натрия, с последующим отделением и высушиванием целевого продукта.
2. Способ по п. 1, отличающийся тем, что суспендирование наночастиц в реакционной смеси осуществляют при помощи ультразвука.
3. Способ по п. 1, отличающийся тем, что все реакции с участием наночастиц диоксида кремния проводят при перемешивании при комнатной температуре, а промежуточные и целевые продукты выделяют центрифугированием.