Кинетический способ определения антиоксидантной активности биоматериала
Иллюстрации
Показать всеИзобретение относится к медицине, биологии, фармации и пищевой технологии применительно к исследованию гомолитических свойств липидов и их участия в свободнорадикальных реакциях окисления, а также - к осуществлению подбора антиоксидантов. Способ осуществляют путем экстрагирования из навески биоматериала жирорастворимого антиоксиданта в виде гептанового экстракта и водорастворимого антиоксиданта в виде изопропилового экстракта, насыщения пробы модельного субстрата каждого антиоксиданта кислородом с перемешиванием при температуре 60,0±0,2°C и определения объема поглощенного кислорода во времени волюмометрическим методом в термостатированной установке типа Варбурга с построением графика в координатах ΔV/t, последующим определением из кинетических кривых величины периода индукции (τi) и расчетом суммарной антиоксидантной активности компонентов биоматериала в составе модельного субстрата с учетом контрольных проб, не содержащих гептанового и изопропилового экстракта, причем модельный субстрат жирорастворимого антиоксиданта включает в себя: биоматериал, метиловый или этиловый эфир высших ненасыщенных жирных кислот, раствор азо-бис-изобутиронитрила (АИБН) в хлорбензоле в концентрации в пробе (2-60)×10-3 M, полученный образец доводят хлорбензолом до 2 мл, модельный субстрат водорастворимого антиоксиданта включает в себя: биоматериал, метиловый или этиловый эфир ненасыщенных жирных кислот, водный раствор хлорида меди (II) в концентрации в пробе (1-3)×10-3 М, водный раствор цетилтриметиламмония бромида (ЦТМАБ) в концентрации в пробе (1-5)×10-3 М, полученный образец доводят водой до 4 мл, а определение суммарной антиоксидантной активности жирорастворимых и водорастворимых компонентов биоматериала осуществляют из заданной расчетной зависимости. Достигаются повышение точности и ускорение определения. 1 табл., 4 пр.
Реферат
Изобретение относится к медицине, биологии, фармации и пищевой технологии, а именно к тем их разделам, где исследуются гомолитические свойства липидов и их участие в свободнорадикальных реакциях окисления, осуществляется подбор антиоксидантов.
В настоящее время развитие многих патологий связывают с активацией перекисного окисления липидов биомембран /Бурлакова Е.Б., Алесенко А.В., Молочкина A.M. Биоантиоксиданты в лучевом поражении и злокачественном росте. - М.: Наука, 1975. - 214 с.; Коган А.Х., Сыркин А.Л., Дриницина С.В. Кислородные свободнорадикальные процессы в патогенезе ишемической болезни сердца и перспективы применения антиоксиданта Q10 (убихинона) для их коррекции // Кардиология. - 1997. - №12. - С.62-70; Козлов Ю.П. Свободные радикалы и их роль в нормальных и патологических процессах. - М.: Изд-во МГУ, 1973. - 174 с./. При этом в организме нарушается баланс процессов образования и распада пероксидов, свойственный нормальным тканям. Увеличение концентрации пероксидов меняет физические и биологические свойства мембран. Поэтому терапию многих патологий связывают с применением антиоксидантов. Актуальной остается проблема предварительного тестирования их антиоксидантной активности, контролирование и диагностика антиоксидантной активности липидов биомембран в норме и при патологии.
В последние годы ведется целенаправленный поиск эффективных ингибиторов окисления среди объектов растительного и биологического материала: морепродукты, лекарственные растения, сапропели. Исследования подобного рода позволили открыть новые классы антиоксидантов, отыскать альтернативные природные источники ингибиторов окисления. При этом необходимо проводить тестирование суммарной антиоксидантной активности растительного и животного биоматериала.
Разработан экспресс-способ тестирования антиоксидантной активности соединений в водно-липидной среде в условиях эмульсий, приближенных к биологическим средам, позволяющий тестировать водорастворимые антиоксиданты /Ушкалова В.Н., Перевозкина М.Г., Барышников Э.В. Разработка способа тестирования средств антиоксидантотерапии // В сб.: Свободно-радикальное окисление липидов в эксперименте и клинике. - Тюмень, Из-во Тюм. ГУ, 1997. - С.77-82/.
В качестве прототипа был выбран кинетический способ определения антиоксидантной активности липидов /А.с. 1051428 (СССР), МКИ3 G01N 33/48. Способ определения антиокислительной активности липидов. Ушкалова В.Н., Кадочникова Г.Д., Соловьев В.Е., заявка №3357314/28-13, 16.10.1981, опубл. 30.10.1983. Бюл. №40, с.154/. Сущность способа состоит в том, что в качестве субстрата окисления используют метилолеат (0,5-2,5 мл) в присутствии азо-бис-изобутиронитрила (АИБН) в количестве 0,5-4 мг/мл в растворе хлорбензола и добавки липидов (1-3 мл), пробу насыщают кислородом при температуре 60,0±0,2°C, волюмометрическим методом определяют τi2 время поглощения 25 мм3 кислорода на 1 мл пробы. В аналогичных условиях определяют τi1 время поглощения 25 мм3 кислорода на 1 мл контрольной пробы без добавок липидов. Рассчитывают антиоксидантную активность липидов по формуле:
A O A = τ i 2 − τ i 1 τ i 1 × K ,
где τi1 - время поглощения кислорода на 1 мл субстрата при окислении контрольной пробы, мин;
τi2 - время поглощения кислорода на 1 мл субстрата при окислении пробы, мин;
K = 1 2 , P - навеска липидов, мг.
Недостатком способа (прототипа) является исключение определения антиоксидантной активности суммы водорастворимых ингибиторов окисления в гомогенатах растительного и животного биоматериала, использование большого количества липидов и эфиров высших ненасыщенных жирных кислот, что делает сложным применение способа к дорогостоящим биологическим объектам, а также трудоемкость и длительность анализа.
Задачей, решаемой заявляемым изобретением, является увеличение эффективности способа и сокращение времени тестирования пробы биоматериала.
Технический результат - простой способ, не требующий больших материальных затрат, основанный на определении суммарной антиоксидантной активности жирорастворимых и водорастворимых компонентов биоматериала, ведущий к увеличению точности результатов и сокращению времени тестирования пробы биоматериала.
Указанный технический результат достигается тем, что наряду с определением антиоксидантной активности жирорастворимых компонентов биоматериала в составе модельного субстрата, включающего в себя: биоматериал, эфиры высших ненасыщенных жирных кислот (этилолеата, метилолеата, метиллинолеата и др.) в присутствии азо-бис-изобутиронитрила (АИБН) в концентрации в пробе (2-60)×10-3 М в хлорбензоле, особенностью является то, что параллельно проводят определение антиоксидантной активности водорастворимых компонентов биоматериала в составе модельного субстрата, включающего в себя: биоматериал, эфиры высших ненасыщенных жирных кислот (этилолеата, метилолеата, метиллинолеата и др.), водный раствор хлорида меди (II) в концентрации в пробе (1-3)×10-3 М, водный раствор цетилтриметиламмония бромида (ЦТМАБ) в концентрации в пробе (1-5)×10-3 М, поглощение кислорода оценивают волюмометрическим методом в термостатированной установке типа Варбурга при температуре t=(60±0,2)°C при перемешивании на магнитной мешалке. Измеряют объем (мм3) поглощенного кислорода во времени, строят график в координатах ∆V/t. Графическим методом из кинетических кривых определяют величину периода индукции (τi) и рассчитывают суммарную антиоксидантную активность жирорастворимых и водорастворимых компонентов биоматериала с учетом контрольных проб.
Сущность предлагаемого способа состоит в том, что гомогенат биоматериала 0,001-0,05 г экстрагируют 10-100-кратным избытком смеси (1:1 по объему) н-гептан:изопропиловый спирт в течение 5 минут, центрифугируют 2-3 минуты при 1500-3000 об/мин, разделяют на 2 фазы.
Гептановый экстракт (жирорастворимые антиоксиданты) сушат 20 мин безводным сульфатом натрия, 0,5-1 мл гептанового экстракта помещают в манометрическую ячейку, добавляют 0,5-1 мл эфира высшей ненасыщенной жирной кислоты (этилолеата, метилолеата, метиллинолеата и др.) и раствор азо-бис-изобутиронитрила (АИБН) в концентрации в пробе (2-60)×10-3 М в хлорбензоле, доводят хлорбензолом до общего объема пробы 2 мл. Поглощение кислорода оценивают волюмометрическим методом в термостатированной установке типа Варбурга при температуре t=(60±0,2)°C при перемешивании на магнитной мешалке. Измеряют объем (мм3) поглощенного кислорода во времени, строят график в координатах ∆V/t. Графическим методом из кинетических кривых определяют величину периода индукции (τi). В аналогичных условиях определяют поглощение кислорода в контрольной пробе (без добавок гептанового экстракта).
0,5-1 мл изопропилового экстракта помещают в манометрическую ячейку, добавляют 0,5-1 мл эфира высшей ненасыщенной жирной кислоты (этилолеата, метилолеата, метиллинолеата и др.), добавляют водный раствор хлорида меди (II) в концентрации в пробе (1-3)×10-3 М, водный раствор цетилтриметиламмония бромида (ЦТМАБ) в концентрации в пробе (1-5)×10-3 М, доводят водой до общего объема пробы 4 мл. Поглощение кислорода оценивают волюмометрическим методом в термостатированной установке типа Варбурга при температуре t=(60±0,2)°C при перемешивании на магнитной мешалке. Измеряют объем (мм3) поглощенного кислорода во времени, строят график в координатах ∆V/t. Графическим методом из кинетических кривых определяют величину периода индукции (τi). В аналогичных условиях определяют поглощение кислорода в контрольной пробе (без добавок изопропилового экстракта). Разработанный экспресс-способ тестирования антиоксидантной активности водорастворимых соединений в водно-эмульсионной среде позволяет сократить время тестирования биоматериала в 2-3 раза по сравнению с прототипом.
Полученные в процессе окисления липидных субстратов экспериментальные кинетические кривые описываются функциональными зависимостями методом наименьших квадратов.
Определение суммарной антиоксидантной активности жирорастворимых и водорастворимых компонентов биоматериала осуществляется по формуле:
∑ A O A = τ i 1 × ( τ i 2 − τ i 3 ) + τ i 3 × ( τ i 4 − τ i 1 ) τ i 3 × τ i 1 × K ,
где ΣАОА - суммарная антиоксидантная активность;
τi1 - период индукции без изопропиловой пробы (контроль), мин;
τi2 - период индукции гептановой пробы (жирорастворимые антиоксиданты), мин.;
τi3 - период индукции без гептановой пробы (контроль), мин;
τi4 - период индукции изопропиловой пробы (водорастворимые антиоксиданты), мин;
K = 1 P , Р - навеска биоматериала, мг.
При навеске менее 5 мг биоматериала на 1 мл метилолеата поправочным коэффициентом К можно пренебречь.
Сущность изобретения иллюстрируется следующими примерами.
Пример 1.
Берут 0,005 г (точная навеска) лярда пеляди, экстрагируют 5 мл смеси (1:1 по объему) н-гептан:изопропиловый спирт в течение 5 минут, центрифугируют 2-3 минуты при 1500-3000 об/мин, разделяют на 2 фазы.
Гептановый экстракт сушат 20 мин. 0,5 г безводного сульфата натрия, 0,5 мл гептанового экстракта помещают в манометрическую ячейку, добавляют 0,5 мл метилолеата, добавляют раствор азо-бис-изобутиронитрила (АИБН) в концентрации в пробе 3×10-3 М в хлорбензоле, доводят хлорбензолом до общего объема пробы 2 мл. Поглощение кислорода оценивают волюмометрическим методом в термостатированной установке типа Варбурга при температуре t=(60±0,2)°C при перемешивании на магнитной мешалке. Измеряют объем (мм3) поглощенного кислорода во времени, строят график в координатах ∆V/t. Графическим методом из кинетических кривых определяют величину периода индукции (τi). В аналогичных условиях определяют поглощение кислорода в контрольной пробе (без добавок гептанового экстракта).
1 мл изопропилового экстракта помещают в манометрическую ячейку, добавляют 1 мл метилолеата, добавляют водный раствор хлорида меди (II) в концентрации в пробе 3×10-3 М, водный раствор цетилтриметиламмония бромида (ЦТМАБ) в концентрации в пробе 1×10-3 М доводят водой до общего объема пробы 4 мл. Поглощение кислорода оценивают волюмометрическим методом в термостатированной установке типа Варбурга при температуре t=(60±0,2)°C при перемешивании на магнитной мешалке. Измеряют объем (мм3) поглощенного кислорода во времени, строят график в координатах ∆V/t. Графическим методом из кинетических кривых определяют величину периода индукции (τi). В аналогичных условиях определяют поглощение кислорода в контрольной пробе (без добавок изопропилового экстракта).
Определение суммарной антиоксидантной активности жирорастворимых и водорастворимых компонентов биоматериала осуществляется по формуле:
∑ A O A = 5 × ( 50 − 15 ) + 15 × ( 25 − 5 ) 15 × 5 × 1 = 6,3
Пример 2.
Берут 0,005 г (точная навеска) липидов эритроцитов крови, экстрагируют 5 мл смеси (1:1 по объему) н-гептан:изопропиловый спирт в течение 5 минут, центрифугируют 2-3 минуты при 1500-3000 об/мин, разделяют на 2 фазы.
Гептановый экстракт сушат 20 мин. 0,5 г безводного сульфата натрия, 0,5 мл гептанового экстракта помещают в манометрическую ячейку, добавляют 0,5 мл метилолеата, добавляют раствор азо-бис-изобутиронитрил (АИБН) в концентрации в пробе 3×10-3 М в хлорбензоле, доводят хлорбензолом до общего объема пробы 2 мл. Поглощение кислорода оценивают волюмометрическим методом в термостатированной установке типа Варбурга при температуре t=(60±0,2)°C при перемешивании на магнитной мешалке. Измеряют объем (мм3) поглощенного кислорода во времени, строят график в координатах ∆V/t. Графическим методом из кинетических кривых определяют величину периода индукции (τi). В аналогичных условиях определяют поглощение кислорода в контрольной пробе (без добавок гептанового экстракта).
1 мл изопропилового экстракта помещают в манометрическую ячейку, добавляют 1 мл метилолеата, добавляют водный раствор хлорида меди (II) в концентрации в пробе 3×10-3 М, водный раствор цетилтриметиламмония бромида (ЦТМАБ) в концентрации в пробе 1×10-3 М, доводят водой до общего объема пробы 4 мл. Поглощение кислорода оценивают волюмометрическим методом в термостатированной установке типа Варбурга при температуре t=(60±0,2)°C при перемешивании на магнитной мешалке. Измеряют объем (мм) поглощенного кислорода во времени, строят график в координатах ∆V/t. Графическим методом из кинетических кривых определяют величину периода индукции (τi). В аналогичных условиях определяют поглощение кислорода в контрольной пробе (без добавок изопропилового экстракта).
Определение суммарной антиоксидантной активности жирорастворимых и водорастворимых компонентов биоматериала осуществляется по формуле:
∑ A O A = 5 × ( 140 − 15 ) + 15 × ( 40 − 5 ) 15 × 5 × 1 = 15,3
Пример 3.
Берут 0,005 г (точная навеска) облепихового масла, экстрагируют 5 мл смеси (1:1 по объему) н-гептан:изопропиловый спирт в течение 5 минут, центрифугируют 2-3 минуты при 1500-3000 об/мин, разделяют на 2 фазы.
Гептановый экстракт сушат 20 мин. 0,5 г безводного сульфата натрия, 0,5 мл гептанового экстракта помещают в манометрическую ячейку, добавляют 0,5 мл метилолеата, добавляют раствор азо-бис-изобутиронитрил (АИБН) в концентрации в пробе 3×10-3 М в хлорбензоле, доводят хлорбензолом до общего объема пробы 2 мл. Поглощение кислорода оценивают волюмометрическим методом в термостатированной установке типа Варбурга при температуре t=(60±0,2)°C при перемешивании на магнитной мешалке. Измеряют объем (мм3) поглощенного кислорода во времени, строят график в координатах ∆V/t. Графическим методом из кинетических кривых определяют величину периода индукции (τi). В аналогичных условиях определяют поглощение кислорода в контрольной пробе (без добавок гептанового экстракта).
1 мл изопропилового экстракта помещают в манометрическую ячейку, добавляют 1 мл метилолеата, добавляют водный раствор хлорида меди (II) в концентрации в пробе 3×10-3 М, водный раствор цетилтриметиламмония бромида (ЦТМАБ) в концентрации в пробе 1×10-3 М, доводят водой до общего объема пробы 4 мл. Поглощение кислорода оценивают волюмометрическим методом в термостатированной установке типа Варбурга при температуре t=(60±0,2)°C при перемешивании на магнитной мешалке. Измеряют объем (мм3) поглощенного кислорода во времени, строят график в координатах ΔV/t. Графическим методом из кинетических кривых определяют величину периода индукции (τi). В аналогичных условиях определяют поглощение кислорода в контрольной пробе (без добавок изопропилового экстракта).
Определение суммарной антиоксидантной активности жирорастворимых и водорастворимых компонентов биоматериала осуществляется по формуле:
∑ A O A = 5 × ( 70 − 15 ) + 15 × ( 30 − 5 ) 15 × 5 × 1 = 8,7
Пример 4.
Капотен является производным пролина с отдаленной боковой тиольной группой. Препарат применяют при лечении легкой и умеренной гипертонии, а также при тяжелых формах сердечно-сосудистых заболеваний. Была изучена антиоксидантная активность капотена в процессе окисления метиллинолеата в условиях инициирования в среде хлорбензола и катализа в водно-липидной среде в сравнении с дибунолом и α-токоферолом. Была установлена высокая антиоксидантная активность капотена в водно-липидных катализируемых субстратах, превышающая ингибирующие свойства а-токоферола и уступающая активности дибунола. В безводной среде капотен проявлял низкие антиоксидантные свойства /Перевозкина М.Г., Тихонова В.В., Кадочникова Г.Д. и др. / Физико-химические закономерности окисления липидных субстратов под действием гипотензивных препаратов // Свободно-радикальное окисление липидов в эксперименте и клинике. - Тюмень, Из-во Тюм. ГУ, 1997. - С. 104-113/.
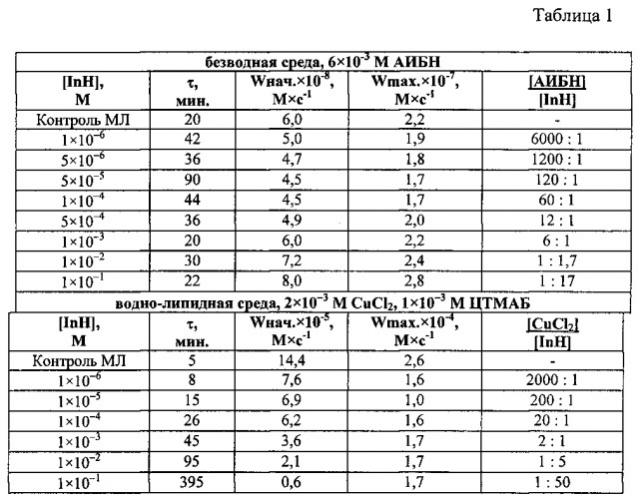
Кинетические параметры окисления метиллинолеата в растворе хлорбензола в присутствии 6×10-3 М АИБН и в водно-липидной среде в присутствии 2×10-3 М CuCl2 в зависимости от концентрации капотена, [InH] - ингибитор, t=600C (Таблица 1).
С учетом этих выводов проанализируем биоматериал больных, проходивших лечение капотеном, при этом важно учитывать жирорастворимые и водорастворимые фракции препарата.
Берут 1,0 г (точная навеска) цельной крови больных, принимавших препарат капотен в среднесуточной дозе 150 мг в течение двух недель, экстрагируют 5 мл смеси (1:1 по объему) н-гептан:изопропиловый спирт в течение 5 минут, центрифугируют 2-3 минуты при 1500-3000 об/мин, разделяют на 2 фазы.
Гептановый экстракт сушат 20 мин. 0,5 г безводного сульфата натрия, 0,5 мл гептанового экстракта помещают в манометрическую ячейку, добавляют 0,5 мл метилолеата, добавляют раствор азо-бис-изобутиронитрил (АИБН) в концентрации в пробе 3×10-3 М в хлорбензоле, доводят хлорбензолом до общего объема пробы 2 мл. Поглощение кислорода оценивают волюмометрическим методом в термостатированной установке типа Варбурга при температуре t=(60±0,2)°C при перемешивании на магнитной мешалке. Измеряют объем (мм) поглощенного кислорода во времени, строят график в координатах ∆V/t. Графическим методом из кинетических кривых определяют величину периода индукции (τi). В аналогичных условиях определяют поглощение кислорода в контрольной пробе (без добавок гептанового экстракта).
1 мл изопропилового экстракта помещают в манометрическую ячейку, добавляют 1 мл метилолеата, добавляют водный раствор хлорида меди (II) в концентрации в пробе 3×10-3 М, водный раствор цетилтриметиламмония бромида (ЦТМАБ) в концентрации в пробе 1×10-3 М, доводят водой до общего объема пробы 4 мл. Поглощение кислорода оценивают волюмометрическим методом в термостатированной установке типа Варбурга при температуре t=(60±0,2)°C при перемешивании на магнитной мешалке. Измеряют объем (мм) поглощенного кислорода во времени, строят график в координатах ∆V/t. Графическим методом из кинетических кривых определяют величину периода индукции (τi). В аналогичных условиях определяют поглощение кислорода в контрольной пробе (без добавок изопропилового экстракта).
Определение суммарной антиоксидантной активности жирорастворимых и водорастворимых компонентов биоматериала осуществляется по формуле:
Преимущества предлагаемого способа состоят в том, что он позволяет определять суммарную антиоксидантную активность водорастворимых и жирорастворимых компонентов биоматериала, увеличить точность расчетов, снизить расходование метилового или этилового эфира высших ненасыщенных жирных кислот, а также сократить время тестирования пробы биоматериала.
Кинетический способ определения антиоксидантной активности биоматериала путем экстрагирования из навески биоматериала жирорастворимого антиоксиданта в виде гептанового экстракта и водорастворимого антиоксиданта в виде изопропилового экстракта, насыщения пробы модельного субстрата каждого антиоксиданта кислородом с перемешиванием при температуре 60,0±0,2°C и определения объема поглощенного кислорода во времени волюмометрическим методом в термостатированной установке типа Варбурга с построением графика в координатах ΔV/t, последующим определением из кинетических кривых величины периода индукции (τi) и расчетом суммарной антиоксидантной активности компонентов биоматериала в составе модельного субстрата с учетом контрольных проб, не содержащих гептанового и изопропилового экстракта, причем модельный субстрат жирорастворимого антиоксиданта включает в себя биоматериал, метиловый или этиловый эфир высших ненасыщенных жирных кислот, раствор азо-бис-изобутиронитрила (АИБН) в хлорбензоле в концентрации в пробе (2-60)×10-3 M, полученный образец доводят хлорбензолом до 2 мл, модельный субстрат водорастворимого антиоксиданта включает в себя: биоматериал, метиловый или этиловый эфир ненасыщенных жирных кислот, водный раствор хлорида меди (II) в концентрации в пробе (1-3)×10-3 М, водный раствор цетилтриметиламмония бромида (ЦТМАБ) в концентрации в пробе (1-5)×10-3 М, полученный образец доводят водой до 4 мл, а определение суммарной антиоксидантной активности жирорастворимых и водорастворимых компонентов биоматериала осуществляют по формуле: где ΣAOA - суммарная антиоксидантная активность;τi1 - период индукции без изопропиловой пробы (контроль), мин;τi2 - период индукции гептановой пробы (жирорастворимые антиоксиданты), мин;τi3 - период индукции без гептановой пробы (контроль), мин;τi4 - период индукции изопропиловой пробы (водорастворимые антиоксиданты), мин; , Р - навеска биоматериала, мг.