Способ культивирования стволовых клеток, препятствующий их спонтанной дифференцировке (варианты)
Иллюстрации
Показать всеИзобретения относятся к области клеточной биологии, фармакологии и медицины. Описан способ культивирования стволовых клеток, исключающий их спонтанную дифференцировку. Способ включает приготовление раствора пектина с концентрацией до 5% и степенью этерификации не более 50%; нанесение его на основу, формирование пектинового матрикса ведут в присутствии раствора поперечно-сшивающего агента ионного типа. В качестве раствора поперечно-сшивающего агента ионного типа используют композицию, содержащую растворимую соль кальция, натрия хлорид, и буферную систему на основе нетоксичных для клеток компонентов. Введение после нанесения раствора пектина на основу дополнительных операций удаления избытка пектина, промывки основы и ее высушивания позволяет сформировать матрикс различной толщины от слоя гидрогеля до тонкой пленки. В способе в качестве подложки могут использоваться различные основы. В другом варианте выполнения способа берут раствор пектина с концентрацией до 5% и степенью этерификации не более 50%, приготовленный на изотоническом растворе. А внесение культуры клеток выполняют перед формированием матрикса с последующим перемешиванием, затем к полученной смеси добавляют поперечно-сшивающий агент ионного типа (ПСА), приготовленный на изотоническом растворе, и перемешивают. Этот вариант исполнения способа позволяет в большей степени приблизить процесс культивирования клеток к естественным условиям, при которых клетки находятся в трехмерном окружении молекул внеклеточного матрикса. Таким образом, заявляемые способы значительно расширяют варианты их применения в клеточных технологиях, поскольку позволяют получать покрытия различной толщины и структуры на поверхностях разного вида. 2 н. и 8 з.п. ф-лы, 7 ил., 10 пр.
Реферат
Изобретения относятся к области клеточной биологии, фармакологии и медицины, в частности к способам культивирования стволовых клеток, исключающим их спонтанную дифференцировку и позволяющим получать культуры, обогащенные мультипотентными клетками для последующего их применения в клеточной терапии широкого круга заболеваний, и может быть использовано как в научных исследованиях, так и в медицине.
Стволовые клетки используются в научно-исследовательских целях в качестве моделей и в практических целях в медицине для лечения заболеваний и травм, при которых организм не в состоянии самостоятельно восстановить утраченные ткани и органы. В обоих случаях, прежде чем применять культуру стволовых клеток, требуется нарастить определенную биомассу клеток, обладающих сходным фенотипом и мультипотентными свойствами. На данном этапе основным препятствующим фактором является спонтанная дифференцировка клеток, которые прикрепляются к подложке, распластываются и приобретают черты определенного типа клеток, теряя способность к дифференцировке в другие типы. Поиск веществ и условий культивирования стволовых клеток (способов), препятствующих их спонтанной дифференцировке, является актуальной задачей современной клеточной биологии и медицины.
Первым подходом для стимуляции стволовых клеток к размножению было культивирование на фидерном слое фибробластов (Thomson J.A., Itskovitz-Eldor J., Shapiro S.S., Waknitz M.A., Swiergiel J.J., Marshall V.S., Jones J.M. Embryonic stem cell lines derived from human blastocysts //Science. 1998. Vol.282 (5391). P. 1145-1147). Известный метод позволяет получать быстро пролиферирующие культуры стволовых клеток, в том числе эмбриональных стволовых клеток, исключая их спонтанную дифференцировку. Однако использование дополнительных клеточных линий создает определенные трудности. Системы сокультивирования увеличивают издержки производства и малопригодны для крупномасштабного культивирования. К тому же необходимы отделение и очистка стволовых клеток от клеток-фидеров.
Последующие исследования были направлены на разработку методов культивирования плюрипотентных стволовых клеток с сохранением их недифференцированного состояния и плюрипотентности без использования клеток-фидеров. Известен способ культивирования эмбриональных стволовых клеток на поверхности Матригеля или ламинина с добавлением среды, кондиционированной клетками МЭФ (мышиные эмбриональные фибробласты), что способствует длительному культивированию эмбриональных стволовых клеток человека с сохранением их недифференцированного состояние и плюрипотентности (Xu C., Inokuma M.S., Denham J., Golds K., Kundu P., Gold J.D., Carpenter M.K. Feeder-free growth of undifferentiated human embryonic stem cells //Nature. 2001. Vol.19. P/971-974; WO 01/51616, МПК C12N 15/09, C12 15/10, опубл. 19.07.2001). В данном способе культивирования не используются клетки-фидеры, поэтому не требуется отделение вспомогательной линии (МЭФ) на заключительном этапе. Однако использование продукта жизнедеятельности животных клеток для культивирования клеток человека нежелательно вследствие опасности загрязнения инфекционными агентами и антигенами. Матригель, используемый в данном способе в качестве подложки для культивирования, является матриксом, получаемым из опухолевых клеток (BD Matrigel™ Basement Membrane Matrix) и никогда не будет допущен к применению в области регенеративной медицины из-за его потенциальных канцерогенных свойств.
Известно несколько способов культивирования стволовых клеток, препятствующих их спонтанной дифференцировке, заключающихся в применении комбинации различных ростовых факторов, добавляемых в питательную среду. Одним из них является способ культивирования эмбриональных стволовых клеток в бессывороточной среде, содержащей фактор роста bFGF/FGF-2 или фактор стволовых клеток (далее называемый SCF) (WO 03/020920, МПК A61K 35/12, A61P 43/00, C12N 5/00, опубл. 13.03.2003). Недостатком данного метода является тот факт, что способ позволяет получать культуры, в которых максимум содержится 70% недифференцированных клеток.
Также сообщалось о способе поддержания недифференцированного состояния эмбриональных стволовых клеток человека добавлением bFGF/FGF-2 и антагониста костного морфогенетического белка Noggin (Xu R., Peck R.M., Li D.S., Feng X., Ludwig T., Thomson J.A. Basic FGF and suppression of BMP signaling sustain undifferentiated proliferation of human ES cells //Nature methods. 2005. Vol.2(3). P. 185-190).
Отдельно было показано, что простое добавление ингибитора гликогенсинтазы-киназы (GSK)-3 к культуральной среде может эффективно поддерживать недифференцированное состояние эмбриональных стволовых клеток мыши и человека без добавления факторов роста или подобных им и без использования клеток-фидеров (Sato N., Meijer L., Skaltsounis L., Greengard P., Brivanlou A.H. Maintenance of pluripotency in human and mouse embryonic stem cells through activation of Wnt signaling by a pharmacological GSK-3-specific inhibitor //Nature Med. 2004. Vol.10 (1). P. 55-63).
Известны также другие способы поддержания недифференцированного состояния стволовых клеток, в том числе гемопоэтических стволовых клеток, основанные на активации или ингибировании того или иного сигнального пути. Например, воздействие лиганда сигнального пути Notch (delta-like protein) в виде растворенного фактора либо иммобилизованного на подложке или стромальных клетках, ингибирует дифференцировку гемопоэтических и других типов стволовых клеток (EP1004669A1, МПК С07K 14/475, C12N 15/19, опубл. 31.05.2005; US6613565, МПК А61K 38/00, А61K 38/18, 02.09.2003). Однако в патенте EP1004669A1 указано, что таким образом ингибируется не только дифференцировка клеток, но и пролиферация, что нежелательно на этапах наращивания культуры.
Аналогом также может служить и инозитол-3-фосфатный путь, причем одни авторы описывают способ культивирования стволовых клеток, предполагающий ингибирование инозитол-3-фосфат киназы совместно с воздействием ростового фактора TGFβ (US20070281355, МПК C12N 5/0735, опубл. 06.12.2007), другие ограничиваются только ингибитором инозитол-3-фосфат киназы (US20050054103, МПК C12N 15/85, C12N 501/405, опубл. 10.03.2005). Еще одна группа исследователей предлагает применение ингибитора фосфотензина (PTEN) и вышеупомянутой гликогенсинтазы-киназы (GSK)-3 для поддержания недифференцированного состояния и пролиферации стволовых клеток (US20120309088, МПК C12N 5/071, C12N 5/0789, опубл. 06.12.2012). Есть данные о том, что фосфотензин (PTEN) является антионкогеном (Leslie N.R., K Downes C.P. PTEN function: how normal cells control it and tumour cells lose it //Biochem J. 2004. Vol.382. P. 1-11), следовательно, ингибирование этого фактора может повысить риск канцерогенеза.
Как видно из представленных данных, большинство способов ингибирования спонтанной дифференцировки и экспансии стволовых клеток основаны на модулировании сигнальными путями в клетке. Несмотря на позитивные результаты, полученные исследователями в экспериментах, такие подходы могут привести к неконтролируемым результатам на практике. Несмотря на активное изучение механизмов передачи сигналов в клетке и большой массив накопленных данных, внутриклеточный сигналинг, по-прежнему, остается не до конца изученным. Воздействие, на какой либо компонент сигнального пути приводит к запуску каскада реакций, которые впоследствии могут привести к нежелательным результатам.
Наиболее близким к заявляемому техническому решению по технической сущности и достигаемому результату является способ культивирования стволовых клеток, исключающий спонтанную дифференцировку нейральных стволовых клеток в культуре путем культивирования их на поверхности агарозного геля (Zheng X., Yang X., Liu W., Shen G., Pan D., Luo M. A novel method for culturing neural stem cells //In Vitro Cell.Dev.Biol.-Animal (2007) 43:155-158). Данный способ предполагает покрытие культуральной посуды гелем на основе агарозы, относящейся к классу полисахаридов.
Способ осуществлялся следующим образом: 1 грамм агарозы смешивали с 70 мл фосфатно-солевого буфера и автоклавировали, полученный раствор, охлажденный до 70°C, разливали в полистироловые культуральные флаконы (25 см2) так, чтобы покрыть дно флакона. После формирования геля добавляли 5 мл среды DMEM/F12 (1:1, Gibco, Grand Island, NY). Через 2 часа посуда была готова для культивирования.
Нейральные стволовые клетки, изолированные из гиппокампа новорожденных крыс, высевали во флаконы, покрытые агарозой, в количестве 5×106/мл. Культуральная среда включала следующие компоненты: среда DMEM/F12, добавка B27 (1:50, Gibco), человеческий рекомбинантный эпидермальный фактор роста ЭФР (20 нг/мл, Gibco), основной фактор роста фибробластов ФРФ (20 нг/мл, Gibco). Среду меняли каждые 2-3 дня. Пассаж осуществляли через неделю. Отделяли нейросферы, инкубировали в ФСБ, содержащем 0,05% трипсин и 0,012% ЭДТА в течение 30 мин. Затем пипетированием дезагрегировали нейросферы, центрифугировали клеточную суспензию и высевали клетки той же плотностью. Нейральные стволовые клетки, культивируемые на поверхности агарозного геля, сохраняли округлую морфологию, сохраняя при этом приемлемый уровень пролиферации, не отличимый от контрольной культуры. 99,36% клеток в культуре оставались нестин-позитивными в течение 3 месяцев культивирования, что свидетельствовало о сохранении их статуса нейральных стволовых клеток. Также клетки сохраняли свойство мультипотентности - при переводе культуры в условия, стимулирующие дифференцировку, нейральные стволовые клетки дифференцировались в нейроны и глиальные клетки.
К недостаткам способа, выбранного в качестве прототипа, следует отнести:
- ограниченное применение, предназначенное исключительно для создания толстых гидрогелевых покрытий на ровной поверхности;
- трудность получения тонких пленочных покрытий из-за высокой вязкости растворов агарозы и высокой температуры плавления гелей;
- ограниченное применение гидрогелей на основе агарозы в системах трехмерного культивирования стволовых клеток, поскольку при процессе извлечения биомассы наработанных клеток (харвестинг) требуется дополнительное введение ферментного препарата, что снижает жизнеспособность клеток;
- небольшой срок хранения основы для последующего культивирования клеток, т.к. высыхание и последующее быстрое набухание геля из агарозы приводит к его разрушению.
Задачей изобретения является создание нового физиологичного способа культивирования стволовых клеток, препятствующего их спонтанной дифференцировке, и значительно расширяющего варианты его применения в клеточных технологиях, которые позволяют получать покрытия различной толщины и структуры на поверхностях разного вида.
Поставленная задача решается тем, что в известном способе культивирования стволовых клеток, препятствующем их спонтанной дифференцировке, который включает приготовление раствора полисахарида, нанесение раствора полисахарида на основу, формирование на ней полисахаридного матрикса и высев культуры клеток, согласно изобретению, в качестве полисахарида берут раствор пектина с концентрацией до 5% и степенью этерификации не более 50%. Формирование полисахаридного матрикса ведут в присутствии раствора поперечно-сшивающего агента ионного типа.
Использование в качестве полисахарида для формирования матрикса высокогидрофильного природного полисахарида - пектина - позволило разработать новый способ культивирования стволовых клеток, препятствующий их спонтанной дифференцировке. Пектин является не только биосовместимым и нетоксичным для клеток и животных, но и позволяет получать матриксные покрытия различной толщины и на поверхностях разной геометрии и структуры.
В качестве полисахарида берут пектин со степенью этерификации до 50%, что означает, что не менее 50% всех карбоксильных групп галактуроновой кислоты, являющейся основным мономером молекулы пектина, находятся в свободном состоянии, т.е. не этерифицированы метиловым эфиром. Пектин со степенью этерификации до 50% получают методом щелочной деэтерификации из высокоэтерифицированного цитрусового, яблочного или иного вида пектина любым известным способом, в частности, согласно методике Ренарда (Renard C.M.G.C., Thibault J.F. Structure and properties of apple and sugar beet pectins extracted by chelating agents //Carbohydr. Res. -1993.- Vol.244.- P.99), Ильиной (Ильина И.А. Научные основы технологии модифицированных пектинов. Краснодар, 2001. 148-156 с), Донговски (Dongowski G, Lorenz A. Unsaturated oligogalacturonic acids are generated by in vitro treatment of pectin with human feacal flora. Carbohydr Res 1998; 314:237-244) или согласно методу, зарегистрированному в патенте RU №2262865 , МПК A23L1/0524, опубл. 27.10.2005.
Использование низкоэтерифицированного пектина (со степенью этерификации до 50%) позволяет проводить гелеобразование при нейтральном рН и физиологичной температуре, что очень важно при культувировании клеток живых организмов. В то время как высокоэтерифицированные пектины (со степенью этерификации более 50%) формируют гели в кислых условиях (рН ~ 3.6) и высокой концентрации сахарозы (более 55%), эти условия являются нефизиологическими условиями и неприемлемы при работе с клеточными культурами.
Повышение концентрации пектина выше 5% значительно затрудняет формирование матрикса, так как при растворении образуются слишком вязкие растворы.
Формирование полисахаридного матрикса в присутствии раствора поперечно-сшивающего агента ионного типа обеспечивает получение высокогидрофильного матрикса - гидрогеля, имитирующего естественный внеклеточный матрикс животных, который является оптимальным для культивирования клеток. Данный гидрогель формируется за счет поперечного сшивания молекул пектина двухвалентными катионами, которые связывают отрицательно заряженные карбоксильные группы низкоэтерифицированного пектина.
Для достижения заявленного технического результата в качестве поперечно-сшивающего агента ионного типа (ПСА) в предлагаемом способе целесообразно использовать композицию, содержащую растворимую соль кальция, хлорид натрия и буферную систему на основе нетоксичных для клеток компонентов.
Присутствующая в ПСА растворимая соль кальция является источником ионов кальция - двухвалентных катионов, обеспечивающих поперечное сшивание, в результате чего образуется гидрогель. Формирование геля возможно и в присутствие любых других двухвалентных катионов, например, магния, цинка, меди. Однако ионы кальция являются наиболее удобными в случае создания гелей для культивирования клеток, так как кальций не только нетоксичен для клеток, но и необходим для их нормального функционирования, к тому же он является важным компонентом внутриклеточного сигналинга.
В качестве растворимой соли кальция в раствор ПСА могут вводиться хлорид кальция, нитрат кальция и др.
Экспериментально установлено, что введение в раствор поперечно-сшивающего агента растворимой соли кальция в концентрации до 10 мМ, обеспечивает ассоциацию молекул пектина и формирование геля, поддерживает физиологическую концентрацию ионов кальция и не создает при этом условий гиперкальциемии в системе культивирования, что может быть губительно для клеток. Связывание ионов кальция молекулами низкоэтерифицированного пектина необходимо не только для формирования высокогидрофильного матрикса, но требуется еще для предотвращения возможной абсорбции кальция из питательной среды.
Введение в состав ПСА хлорида натрия в концентрации 150 мМ позволяет поддерживать изотоничность раствора ПСА.
А использование в составе ПСА буферной системы на основе нетоксичных для клеток компонентов обеспечивает физиологическую кислотность матрикса, поддерживая рН от 7.2 до 7.6.
В качестве буферной системы на основе нетоксичных для клеток компонентов могут быть использованы, в частности, 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота (HEPES), титрованная гидроксидом натрия; буфер на основе трис(гидроксиметил)аминометана, титрованного соляной кислотой.
Заявленный способ позволяет также в качестве ПСА использовать питательную среду для культивирования клеток, содержащую ионы кальция, с необходимыми ростовыми добавками, рекомендованными для работы с данной культурой. В качестве питательной среды для культивирования клеток могут использоваться, в частности, среда Игла в модификации Дульбекко (DMEM), комплексная среда DMEM/F12, специализированная среда Neurobasal, среда N2B27. А в качестве ростовых добавок могут быть применены фетальная бычья сыворотка, различные белковые ростовые факторы, такие как эпидермальный фактор роста (EGF), фактор роста фибробластов (FGF), фактор ингибирования лейкемии (LIF) и др.
Введение данных добавок обеспечивается использованием пектинов, способных формировать коллоидные растворы и гели при физиологической температуре, что является дополнительным преимуществом заявляемого способа по сравнению с прототипом, в котором используют агарозу. Для поддержания препаратов агарозы в состоянии водных коллоидных растворов, необходимых для смешивания с ростовыми добавками, нужна температура, как правило, превышающая 37°С, что может привести к денатурации ростовых добавок.
Заявляемый способ значительно расширяет варианты применения в клеточных технологиях, позволяет культивировать различные виды клеток, благодаря особенностям пектина, использовать различную основу для нанесения полисахарида, позволяет формировать матрикс в различной форме и различной толщины.
Удаление избытка раствора пектина после нанесения его на основу перед формированием матрикса позволяет получать гелевое покрытие, имеющее толщину в среднем 0,05 − 0,5 мм, что облегчает для экспериментатора наблюдение за живыми клетками в культуре.
Более тонкие пленки, менее 0,05 мм, матриксного покрытия могут быть получены введением дополнительного этапа промывки после нанесения и удаления избытка раствора пектина. Использование на практике таких пленок позволяет проводить анализ клеточных культур с помощью конфокального лазерного микроскопа, обычно имеющего ограничения по глубине проникновения луча.
Введение операции высушивания основы обеспечивает хранение основы в течение длительного времени, что позволяет вести промышленную наработку основ для дальнейшего использования. Срок хранения основ, приготовленных заявленным способом, составляет не менее одного года.
Проведение лиофильной сушки пектинового матрикса, сформированного в присутствии раствора ПСА, позволяет получить пористые губки. Пористые губки представляют собой трехмерно организованный матрикс, что значительно расширяет сферу его применения для культивирования клеток в разных системах.
Для культивирования стволовых клеток в качестве основы могут использоваться либо подложки стеклянные или полимерные, либо сосуды для культивирования клеток.
В качестве полимерной подложки можно использовать пластмассовые покровные стекла, пленки из эластичных полимеров, вставки с развитыми поверхностями для высокоэффективного промышленного или полупромышленного культивирования в биореакторах, полимерные сферы и волокна.
В качестве стеклянной подложки могут быть использованы стеклянные покровные и предметные стекла для микроскопии, стеклянные пластины различного формата, стеклянные сферы и волокна. Использование покровных стекол для культивирования клеток облегчает процесс проведения иммуноцитохимического анализа. Тонкое покрытие в виде пленки пектинового матрикса позволяет анализировать полученные препараты с применением конфокального микроскопа и получать микрофотографии высокого разрешения.
В качестве сосудов для культивирования клеток могут быть использованы многолуночные планшеты, чашки Петри, флаконы для культивирования клеток, биореакторы различных типов.
Возможность использования основ различных типов для формирования пектинового матрикса на их поверхности значительно расширяет возможности культивирования клеток в условиях, препятствующих их дифференцировки, и позволяет получать биомассу стволовых клеток в различных системах культивирования.
Поставленная задача решается также тем, что в известном способе культивирования стволовых клеток, препятствующем их спонтанной дифференцировке, включающем внесение раствора полисахарида в сосуд для культивирования клеток, формирование матрикса и внесение культуры клеток, согласно изобретению, в качестве полисахарида берут раствор пектина с концентрацией до 5% и степенью этерификации не более 50%, приготовленный на изотоническом растворе. Внесение культуры клеток выполняют перед формированием матрикса с последующим перемешиванием, к полученной смеси добавляют поперечно-сшивающий агент ионного типа (ПСА), приготовленный на изотоническом растворе, и перемешивают.
Внесение культивируемых клеток в раствор пектина перед формированием матрикса позволяет в большей степени приблизить процесс культивирования клеток к естественным условиям, при которых клетки находятся в трехмерном окружении молекул внеклеточного матрикса.
Приготовление пектина и ПСА на изотоническом растворе обеспечивает поддержание физиологической среды для культивируемых клеток.
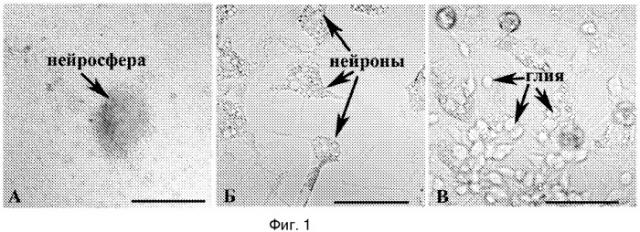
Для доказательства работоспособности заявленного способа используют культуру нейральных стволовых клеток, полученных из эмбрионального мозга крыс. Полученные культуры эмбриональных клеток вентрального среднего мозга, гиппокампа и обонятельных луковиц 15-дневных эмбрионов крыс активно пролиферируют в среде с добавлением 12% эмбриональной телячьей сыворотки и образуют многочисленные нейросферы, типичный вид которых представлен на фиг. 1А. Культуры проявляют хорошую жизнеспособность, которая в среднем составляет 84±9%. Клетки способны к дифференцировке в основные клеточные типы нервной ткани - нейроны и глиальные клетки - при снижении концентрации сыворотки до 2% (фиг. 1Б, В), что подтверждается микрофотографиями, полученными с помощью микроскопа Zeiss Axiovert 200M с применением метода дифференциального интерференционного контраста. Альтернативно применяют бессывороточное культивирование. Клетки культивируют в среде Neurobasal с добавкой B-27 без витамина А и ростовыми факторами: 10 нг/мл эпидермального фактора роста (EGF) 20 нг/мл основного фактора роста фибробластов (bFGF).
В другом случае используют культуру эмбриональных стволовых клеток мыши, культивируемых в бессывороточной среде N2B27 с добавлением 1000 ед./мл фактора ингибирования лейкемии (LIF) и 10 нг/мл костного морфогенетического белка 4 (BMP 4).
Жизнеспособность культивируемых клеток оценивают с помощью окраски трипановым синим и подсчета количества клеток в камере Горяева.
Дифференцировку оценивают по морфологии клеток. Дифференцированными считают распластанные клетки с округлым телом, формирующие отростки - клетки глиального направления дифференцировки, либо клетки отросчатой формы с гранулярной цитоплазмой - клетки нейронального направления дифференцировки. Клетки сферической формы, слабо адгезированные на субстрате, не формирующие отростков, считают недифференцированными. Дополнительно к оценке общих морфологических признаков применяют типирование клеток методами иммуноцитохимии с помощью специфических антител: недифференцированные нейральные клетки выявляют антителам против нестина, клетки нейронального направления маркируют антителами против β-III-тубулина, олигодендроциты выявляют с помощью антител против маркера O4, астроциты выявляют антителами против кислого фибриллярного белка. Подсчитывают количество недифференцированных клеток в процентах от общего количества клеток на субстрате.
Способ осуществляют следующим образом.
Пример 1.
Готовят 5% раствор пектина со степенью этерификации 27,4%. Для этого 5 г пектина вносят в 95 мл дистиллированной воды и растворяют при постоянном перемешивании при температуре 90°С до получения однородного раствора, охлаждают до комнатной температуры, доводят объем раствора до 100 мл. Полученный раствор центрифугируют в течение 20 мин при 3000g для удаления следовых количеств нерастворенных примесей. Раствор полисахарида стерилизуют автоклавированием в условиях 0,7 атм (115°С) в течение 30 мин. Готовят раствор поперечно-сшивающего агента (ПСА), содержащий: 12 мМ CaCl2, 300 мМ NaCl, 40 мМ HEPES-NaOH, рН 7,4.
Приготовленный раствор пектина охлаждают до комнатной температуры и дозатором наносят на основу, в качестве которой берут планшет для культивирования клеток.
В лунки 96-луночного планшета для культивирования клеток вносят 5% раствор пектина в количестве 50 мкл, затем добавляют раствор ПСА количестве 50 мкл и смешивают, в результате чего формируется матрикс в виде слоя гидрогеля толщиной 1-2 мм. Затем к сформированному матриксу добавляют питательную среду ДМЕМ (среда Игла в модификации Дульбекко) и инкубируют 2 ч. Среду меняют на среду с 2% эмбриональной сывороткой, создавая таким образом условия, стимулирующие дифференцировку клеток. На поверхность полученного матрикса наносят нейральные стволовые клетки плотностью 1,25×104/см2. Культивируют клетки в течение 14 суток, среду меняют раз в 3 суток. В качестве контроля анализируют нейральные стволовые клетки, культивируемые на поверхности лунок планшета для культивирования клеток, непокрытых матриксом.
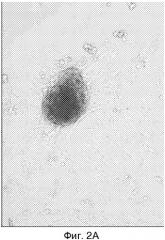
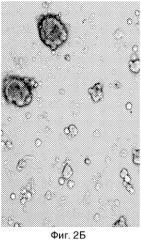
В полученной культуре жизнеспособность клеток составляет 77±6%. В контрольной культуре наблюдается адгезия нейросфер и дифференцировка клеток по периферии нейросфер, формирование отросчатых клеток (фиг. 2А). Как видно из фиг. 2Б, в культуре нейральных клеток на поверхности пектинового матрикса отростчатые клетки практически отсутствуют. Культуры представлены плотными нейросферами с редким высеванием клеток по периферии; формирование отростков и выраженных признаков дифференцировки не наблюдается при культивировании на поверхности пектина со степенью этерификации 27,4%. Количество недифференцированных клеток в культуре составляет 96-97%.
Таким образом, даже в условиях, стимулирующих дифференцировку, нейральные стволовые клетки сохраняют недифференцированное состояние при культивировании на поверхности матрикса, состоящего из пектина.
Пример 2.
Готовят 1% раствор пектина со степенью этерификации 1,2%. Для этого 1 г пектина вносят в 95 мл дистиллированной воды и растворяют при постоянном перемешивании при температуре 90°С до получения однородного раствора, охлаждают до комнатной температуры, доводят объем раствора до 100 мл. Полученный раствор центрифугируют в течение 20 мин при 3000g для удаления следовых количеств нерастворенных примесей. Раствор пектина стерилизуют автоклавированием в условиях 0,7 атм (115°С) в течение 30 мин. Готовят раствор поперечно-сшивающего агента (ПСА) следующего состава: 3 мМ CaCl2, 150 мМ NaCl, 20 мМ HEPES-NaOH, рН 7,4.
В качестве основы используют флакон для культивирования клеток из полистирольного пластика. Раствором пектина, имеющего комнатную температуру, заполняют флакон для культивирования клеток, инкубируют 2 часа. Затем полностью удаляют раствор пектина из флакона. Флакон заполняют раствором ПСА, инкубируют 2 часа при комнатной температуре, удаляют ПСА. Сформированный матрикс представляет собой пленку толщиной около 0,25±0,05 мм, покрывающую внутреннюю поверхность флакона для культивирования клеток. На подготовленный матрикс наносят питательную среду ДМЕМ и инкубируют 1 ч для уравновешивания состава матрикса основными компонентами среды. После инкубирования питательную среду меняют на среду ДМЕМ с 12% эмбриональной сывороткой, создавая условия, типичные для поддержания активно пролиферирующих культур столовых клеток. Затем производят посев клеток плотностью 1,25×104/см2. Культивируют клетки в течение 10 суток, при этом питательную среду меняют через каждые трое суток.
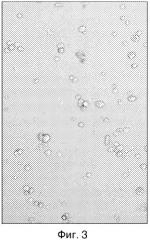
В качестве контроля анализируют нейральные стволовые клетки, культивируемые на поверхности лунок планшета для культивирования клеток, непокрытых матриксом. В контрольной культуре клетки формировали нейросферы с умеренно выраженной адгезией и дифференцировкой клеток.
Исследуемая культура на пектиновом матриксе представляла собой поля разрозненных слабо адгезированных клеток сферической формы. Такие клетки в отдельных случаях образовывали небольшие ассоциации из 5-15 клеток, что можно наблюдать на представленных микрофотографиях (фиг. 3). В исследуемых культурах на матриксе, состоящем из пектина со степенью этерификации 1,2%, отсутствовали признаки начала дифференцировки - плотная адгезия, образование отростков будущих нейронов или глиальных клеток на протяжении 10 суток эксперимента. Количество недифференцированных клеток в культуре составило 99%.
Таким образом, в условиях, обычно создаваемых для эффективного наращивания биомассы стволовых клеток, матрикс на основе пектина эффективно подавляет дифференцировку клеток, сохраняя мультипотентные культуры.
Пример 3.
Готовят 1% раствор пектина со степенью этерификации 50,0%. Для этого 1 г пектина вносят в 95 мл дистиллированной воды и растворяют при постоянном перемешивании при температуре 90°С до получения однородного раствора, охлаждают до комнатной температуры, доводят объем раствора до 100 мл. Полученный раствор центрифугируют в течение 20 мин при 3000g для удаления следовых количеств нерастворенных примесей. Раствор полисахарида стерилизуют автоклавированием в условиях 0,7 атм (115°С) в течение 30 мин.
Готовят раствор поперечно-сшивающего агента (ПСА) следующего состава: 10 мМ Ca(NO3)2, 150 мМ NaCl, 50 мМ трис-HCl, рН=7,2.
Раствор пектина, охлажденного до комнатной температуры, вносят в лунки 96-луночного планшета для культивирования клеток в количестве 100 мкл, инкубируют 2 часа. Затем дозатором полностью удаляют раствор пектина из лунок. Планшет оставляют открытым в асептических условиях ламинарного шкафа до полного высыхания раствора. Подготовленный таким образом планшет стерильно упаковывают, хранят при комнатной температуре в течение 12 месяцев в недоступном для света месте. Перед использованием подготовленного планшета для культивирования клеток в лунки планшета вносят ПСА в количестве 100 мкл, инкубируют 2 часа при комнатной температуре, удаляют ПСА. Сформированный пектиновый матрикс представляет собой пленку толщиной 0,09 мм. На подготовленный матрикс наносят 100 мкл питательной среды Neurobasal (Invitrogen) и инкубируют 1 ч. Среду меняют на среду Neurobasal с добавкой B-27 без витамина А и ростовыми факторами (10 нг/мл эпидермального фактора роста, 20 нг/мл основного фактора роста фибробластов) и помещают в лунки планшета нейральные стволовые клетки плотностью 1,25×104 /см2. Культивируют клетки в течение 10 суток, среду меняют раз в 3 суток.
Культуры нейральных стволовых клеток трех отделов эмбрионального мозга крыс проявляли сходные свойства при культивировании на поверхности пленки из пектина со степенью этерификации 50,0%. Отличительной чертой таких культур явилось формирование конгломератов, для которых была отмечена разобщенная структура со слабо выраженными контактами «клетка-клетка». Часть клеток таких ассоциаций россыпью располагалась по периферии более плотной части конгломератов, кроме того, значительная доля клеток в культурах была спорадически распределена между конгломератами (фиг. 4). Среди части свободно рассеянных элементов встречались веретеновидные и отростчатые клетки с первыми признаками дифференцировки, однако их доля не превышала 1-2% от общего числа клеток в культуре. 98-99% клеток в культуре сохраняло сферическую морфологию, т.е. культивированные клетки оставались недифференцированными. Количество живых клеток в культуре составило 81±7%.
Пример 4.
Готовят 0,5% раствор пектина со степенью этерификации 18,8%. Для этого 0,5 г пектина вносят в 95 мл дистиллированной воды и растворяют при постоянном перемешивании при температуре 90°С до получения однородного раствора, охлаждают до комнатной температуры, доводят объем раствора до 100 мл. Полученный раствор центрифугируют в течение 20 мин при 3000g для удаления следовых количеств нерастворенных примесей. Раствор полисахарида стерилизуют автоклавированием в условиях 0,7 атм (115°С) в течение 30 мин. Готовят раствор поперечно-сшивающего агента (ПСА) следующего состава: 3 мМ Ca(NO3)2, 150 мМ NaCl, 50 мМ трис-HCl, рН 7,4.
В качестве основы берут покровные стекла, которые тщательно моют, обрабатывают горячей (90°С) концентрированной соляной кислотой в течение 15 мин, промывают в проточной воде, дистиллированной воде, сушат, стерилизуют в сухожаровом шкафу при температуре 180°С и хранят в стерильных условиях. Стерильные оптические стекла инкубируют 1 час в растворе пектина, охлажденного до комнатной температуры, в закрытых чашках Петри. Проводят промывку стекол сменой 3-5 порций раствора Дульбекко. Стекла вынимают пинцетом, удаляют избыток раствора влаги прикосновением края стекла к стерильной фильтровальной бумаге. Высушивают стекла в течение 30 мин в горизонтальном положении на решетчатой платформе из тефлона. Подготовленные таким образом стеклянные подложки, покрытые раствором пектина, хранят в течение 12 месяцев.
Подготовленные стекла, покрытые пектинами, раскладывают в лунки культуральных планшетов и инкубируют в растворе ПСА в течение 2 часов при комнатной температуре. В результате на стеклянной подложке образуется пектиновый матрикс в виде тонкой пленки, толщиной около 0,02 мм. В лунки планшета вносят питательную среду ДМЕМ (среда Игла в модификации Дульбекко) и инкубируют 1 ч. Среду меняют на среду с 2% эмбриональной сывороткой и помещают в лунки планшета нейральные стволовые клетки эмбрионального мозга плотностью 1,25×104/см2. В качестве контроля используют полистирольный пластик дна планшета. Культивируют клетки в течение 14 суток, среду меняют раз в 3 суток. Живые клетки визуализируют при помощи красителя флуоресцеина диацетата, мертвые клетки окрашивают ядерным красителем пропидием иодидом. Препараты анализируют на конфокальном сканирующем микроскопе LSM 510 Meta (CarlZeiss) с применением лазеров, генерирующих излучение в области 488 нм (для флуоресфеина диацетата) и 546 нм (для пропидия иодида).
На фиг. 5 представлены комбинированные изображения живых (зеленые) и мертвых (красные) клеток. При культивировании нейральных стволовых клеток на поверхности стекол, покрытых пленкой из пектина, в культуре сохранялось до 99% недифференцированных клеток, которые представлены на фиг. 5А. Количество живых клеток в культурах составило 79±3%. В контрольной культуре на поверхности полистирольного пластика клетки в составе нейросфер дифференцировались и формировали отростки, что подтверждается микрофотографиями, представленными на фиг. 5Б.
Пример 5.
Готовят 0,05% раствор пектина со степенью этерификации 18,8%. Для этого 0,05 г пектина вносят в 95 мл дистиллированной воды и растворяют при постоянном перемешивании при температуре 90°С до получения однородного раствора, охлаждают до комнатной температуры, доводят объем раствора до 100 мл. Полученный раствор центрифугируют в течение 20 мин при 3000g для удаления следовых количеств нерастворенных примесей. Раствор полисахарида стерилизуют автоклавированием в условиях 0,7 атм (115°С) в течение 30 мин.
В качестве основы берут стерильные пластмассовые покровные стекла, которые стекла инкубируют 1 час в растворе пектинов в закрытых чашках Петри. Стекла вынимают пинцетом. Проводят промывку стекол раствором Дульбекко, удаляют избыток раствора влаги прикосновением края стекла к стерильной фильтровальной бумаге. Высушивают стекла в течение 40 мин в горизонтальном положении на игольчатой платформе и хранят в течение 6 месяцев при комнатной температуре в недоступном для света месте.
Подготовленные пластмассовые подложки раскладывают в лунки 24-луночного планшета. В лунки вносят 500 мкл ПСА, в качестве которого берут питательную среду N2B27, и инкубируют 1 ч. В результате получают пектиновый матрикс на полимерной подложке в виде тонкой пленки толщиной 0,01 мм. Затем среду меняют на среду N2B27 с добавлением 1000 ед./мл фактора ингибирования лейкемии (LIF) и 10 нг/мл костного морфогенетического белка 4 (BMP 4) и помещают в лунки планшета эмбриональные стволовые клетки мыши плотностью 1,25×104 /см2. В качестве контроля используют полистирольный пластик дна планшета. Культивируют клетки в течение 7 суток, среду меняют раз в 3 суток.
При культивировании эмбриональных клеток мыши на поверхности пленки из пектина со степенью этерификации 18,8% клетки не проявляли признаков дифференцировки - клетки имели сферическую морфологию и не формировали отростков. Клетки формировали крупные сфероидные ассоциации. Жизнеспособность культуры составила 80 ± 8%. В культуре не наблюдали клеток с признаками дифференцировки. Подавляющее число клеток находилось в составе сфероидных колоний, рассеянные о