Способ стимуляции восстановления иннервации поврежденной ткани
Иллюстрации
Показать всеИзобретение относится к области генной инженерии и генной терапии и может быть использовано для стимуляции роста и регенерации нервов и восстановления иннервации ишемизированных тканей. Изобретение представляет собой способ стимуляции восстановления иннервации поврежденной ткани у млекопитающих с использованием оптимизированного для экспрессии в клетках млекопитающих гена, кодирующиего активатор плазминогена урокиназного типа (урокиназу, uPA). Изобретение также касается плазмидной конструкции, содержащей указанный оптимизированный ген урокиназы и последовательность Козак. Изобретение позволяет ускорить восстановление структуры и проводимости периферических нервов после травм и ишемии путем трансфекции мышц, иннервируемых поврежденным нервом. 3 н. и 2 з.п. ф-лы, 7 ил., 1 табл., 4 пр.
Реферат
Область техники
Настоящее изобретение относится к области генной инженерии и генной терапии и может быть использовано в регенеративной медицине, в частности в травматологии, трансплантологии и нейробиологии для стимуляции роста и регенерации нервов и восстановления периферической иннервации тканей. Предлагается оптимизированный для экспрессии в клетках млекопитающих ген, кодирующий активатор плазминогена урокиназного типа (урокиназу, uPA), новая плазмидная конструкция, содержащая оптимизированный ген урокиназы и последовательность Козак, а также способ, позволяющий ускорить восстановление структуры и проводимости периферических нервов после травм и ишемии путем трансфекции мышц, иннервируемых поврежденным нервом, новой плазмидной конструкцией.
Уровень техники
Нарушения периферической иннервации, вызванные травмами, ишемией и нейродегенеративными заболеваниями являются важнейшей причиной временной и стойкой инвалидности населения России трудоспособного возраста [Одинак М.М., Живолупов С.А. Заболевания и травмы периферической нервной системы. Санкт-Петербург, СпецЛит., 2009].
Стимуляция роста и восстановления периферического нерва - результат сложнейшего процесса, включающего множество физиологических и биохимических реакций. Необходимым условием для нормального протекания процесса регенерации нервов являются поддержка выживания поврежденных нейронов, обеспечение проходимости эндоневральных каналов, стимуляция направленного роста новых нервных окончаний к клеткам-мишеням, а также восстановление синаптических контактов. В стимуляции направленного роста нервных окончаний и восстановлении иннервации ключевую роль играют протеолитические ферменты и, прежде всего, урокиназа. Этот фермент способствует росту и регенерации нервных волокон благодаря очищению соединительнотканного чехла нерва от фибрина и матриксных белков, ингибирующих рост нервных волокон. Также урокиназа способствует высвобождению из окружающего матрикса и последующей активации нейротрофных факторов роста. Таким образом, уже на основе теоретического анализа вопроса можно заключить, что на процесс регенерации нерва и восстановления периферической иннервации стимулирующее воздействие может оказать локальное повышение в участке повреждения продукции такого протеолитического фермента как урокиназа.
Одним из наиболее разработанных подходов к решению вопроса локального обеспечения органов и тканей необходимыми полипептидными продуктами (гормонами, ферментами и факторами роста) является применение векторных конструкций, которые кодируют нужные белки, в данном случае ключевые факторы, стимулирующие рост нервов и восстановление периферической иннервации.
В отношении урокиназы известно, что она необходима для восстановления поврежденного периферического нерва [Siconolfi LB, Seeds NW. Mice lacking tPA, uPA, or plasminogen genes showed delayed functional recovery after sciatic nerve crush. J Neurosci. 2001 Jun 15; 21 (12): 4348-55], а астроциты, трансфицированные плазмидой, кодирующей урокиназу, стимулируют рост аксонов in vitro [Muir Е, Du JS, Fok-Seang J, Smith-Thomas LC, Housden ES, Rogers J, Fawcett JW. Increased axon growth through astrocyte cell lines transfected with urokinase. Glia. 1998 Мау; 23 (1): 24-34]. Однако влияние плазмидных конструкций, экспрессирующих урокиназу, на регенерацию периферического нерва до настоящего времени не исследовалось.
Наиболее близкими аналогами предлагаемого способа являются способы регенерации периферического нерва после травмы, описанные в патенте РФ №2486918 (дата публикации: 10.07.2013), а также в статье Lopatina T, Kalinina N, Karagyaur M, Stambolsky D, Rubina K, Revischin A, Pavlova G, Parfyonova Y, Tkachuk V. Adipose-derived stem cells stimulate regeneration of peripheral nerves: BDNF secreted by these cells promotes nerve healing and axon growth de novo. PLoS One. 2011; 6(3): e17899.
В отношении способа, описанного в патенте РФ №2486918 необходимо отметить, что несмотря на то, что продемонстрировано положительное влияние разработанной невирусной конструкции на восстановление периферической иннервации, эффект выражен недостаточно.
В связи с этим, авторами настоящего изобретения была предпринята попытка усовершенствовать способ стимуляции восстановления периферической иннервации с помощью метода рекомбинантных ДНК в направлении повышения его эффективности и разработки эффективной плазмидной конструкции.
Раскрытие изобретения
При разработке настоящего изобретения во внимание были приняты следующие факты.
Первое. Для успешной регенерации периферического нерва необходимо обеспечить своевременное удаление фибринового сгустка и проходимость эндоневральных каналов. Кроме того, для поддержки выживания и стимуляции роста аксонов необходимо активизировать такие нейротрофические факторы как мозговой нейротрофический фактор (BDNF), глиальный фактор роста (GDNF) и фактор роста нервов (NGF), которые депонированы во внеклеточном матриксе. Данную функцию выполняет система активаторов плазминогена, в том числе урокиназа (uPA). Соответственно, можно заключить, что стимуляции роста нервных окончаний и восстановления нервов с высокой степенью вероятности можно достичь, обеспечив долговременную продукцию урокиназы в участке повреждения.
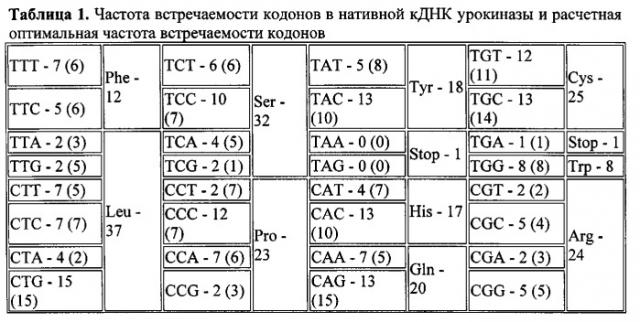
Второе. Признанным является тот факт, что долговременную продукцию факторов роста можно обеспечить путем введения в поврежденную ткань генно-инженерных конструкций, содержащих кДНК этих белков. Для нативной последовательности кДНК урокиназы характерно значительное содержание т.н. «редких триплетов», что может негативно влиять на эффективность ее экспрессии. Поэтому повышения эффективности экспрессии можно добиться путем анализа частоты встречаемости каждого триплета и замены тех триплетов, частота встречаемости которых в нативной кДНК различается с расчетным значением более чем на 2, сохранив при этом аминокислотную последовательность белка.
Добиться дальнейшего повышения эффективности продукции трансгена можно благодаря введению в его структуру консенсусной последовательности Козак [Kozak M (October 1987). "An analysis of 5′-noncoding sequences from 699 vertebrate messenger RNAs". Nucleic Acids Res. 15 (20): 8125-8148.].
Учитывая перечисленные факты, добиться повышения эффективности экспрессии урокиназы в участках повреждения можно путем оптимизации целевой кДНК и путем введения в экспрессионный вектор консенсусной последовательности Козак.
Третье. Для успешной стимуляции восстановления иннервации в ишемизированной ткани необходимо обеспечить высокий уровень продукции урокиназы. Соответственно, эффективным способом стимуляции восстановления иннервации в ишемизированных тканях с высокой вероятностью могло бы быть применение плазмидной конструкции, кодирующей урокиназу, обеспечивающей максимально возможную продукцию трансгена.
С учетом этого, решение поставленной задачи предполагало:
а) создание плазмидной конструкции, содержащей оптимизированную к ДНК uPA, в которую внесена консенсусная последовательность Козак;
б) оценку эффективности экспрессии созданной плазмидной конструкции in vitro; и
в) определение влияния плазмидной конструкции на эффективность восстановления периферического нерва после травмы, а также после ишемии.
При осуществлении изобретения впервые была оптимизирована для экспрессии в клетках млекопитающих последовательность кДНК урокиназы человека и сконструирована рекомбинантная плазмида (пример 1), характеризующаяся последовательностью нуклеотидов, приведенной в SEQ ID NO: 1. Предложенная плазмида содержит модифицированную (оптимизированную для экспрессии в клетках млекопитающих) последовательность кДНК урокиназы человека (называемую согласно настоящему изобретению «модифицированный ген урокиназы», нуклеотиды с 764 по 2063 в SEQ ID NO: 1, выделена серым затенением и полужирным шрифтом на Фигуре 7) и консенсусную последовательность Козак (нуклеотиды с 759 по 764 и 768 в SEQ ID NO: 1, выделена двойным подчеркиванием на Фигуре 7). Полная последовательность фрагмента ДНК, кодирующего оптимизированную для экспрессии в клетках млекопитающих урокиназу, содержащую последовательность Козак слитую с модифицированным геном урокиназы, приведена в SEQ ID NO: 2. Для специалиста очевидно, что для клонирования могут быть использованы различные плазмидные векторы, для которых характерна высококопийная репликация в E. coli и высокий уровень экспрессии клонируемого гена в клетках млекопитающих. Наилучшие результаты были получены авторами изобретения при использовании в качестве вектора плазмиды pVax1 (#V260-20, Invitrogen, http://tools.lifetechnologies.com/content/sfs/manuals/pvaxl_man.pdf).
В результате исследования экспрессии полученной плазмидной конструкции, было показано, что через 48 часов после трансфекции клеток наблюдается секреция соответствующего белка в среду культивирования. Трансформация НЕК293 плазмидой, содержащей оптимизированную кДНК урокиназы и консенсусную Козак-последовательность, привела почти к 5-кратному увеличению продукции белка в среду культивирования по сравнению с трансформацией НЕК293 плазмидой, содержащей кДНК нативной урокиназы (пример 2).
На модели травматического повреждения периферического нерва мыши было получено экспериментальное подтверждение того, что сконструированная плазмидная конструкция после введения в мышцу, иннервируемую поврежденным нервом, существенно ускоряет восстановление структуры и проводимости поврежденного нерва. Так, введение плазмиды, содержащей оптимизированную последовательность гена урокиназы слитую с последовательностью Козак, обеспечивает ускорение восстановления структуры и проводимости травмированного нерва, а, следовательно, и иннервации соответствующих скелетных мышц более чем в 1,3 раза (пример 3). Плазмида, кодирующая нативную урокиназу и не содержащая консенсусной Козак-последовательности, достоверного эффекта на восстановление структуры и функции травмированного нерва не оказала.
Впервые на модели ишемии нерва мыши была применена созданная плазмидная конструкция. Введение плазмидной конструкции, содержащей оптимизированную последовательность гена урокиназы слитую с последовательностью Козак, позволило предотвратить дегенерацию и стимулировать регенерацию нервных волокон в ишемизированном нерве. Так восстановление иннервации мышц (PFI) было примерно в 1,5 раза лучше, а восстановление проводимости ишемизированного нерва в 1,4 раз больше, чем у животных в группе контроля. В то же время, плазмида, кодирующая нативную урокиназу и не содержащая консенсусной Козак последовательности, достоверного эффекта на восстановление структуры и функции нерва после ишемического повреждения не оказала.
Таким образом, в результате создания настоящего изобретения были разработаны следующие технические решения:
- фрагмент ДНК, кодирующий оптимизированную для экспрессии в клетках млекопитающих урокиназу, содержащий последовательность Козак слитую с модифицированным геном урокиназы и характеризующийся последовательностью, приведенной в SEQ ID NO: 2;
- рекомбинантная плазмида, предназначенная для экспрессии гена урокиназы в клетках млекопитающих, содержащая плазмидный вектор pVax1 со встроенным фрагментом ДНК, кодирующим оптимизированную для экспрессии в клетках млекопитающих урокиназу, содержащим последовательность Козак слитую с модифицированным геном урокиназы, характеризующаяся нуклеотидной последовательностью, приведенной в SEQ ID NO: 1;
- способ стимулирования регенерации периферического нерва после травмы и ишемии, сущность которого состоит в том, что в мышцу, иннервируемую поврежденным нервом, вводят терапевтически эффективное количество упомянутой выше рекомбинантной плазмиды, содержащей плазмидный вектор pVax1 со встроенным фрагментом ДНК, кодирующим оптимизированную для экспрессии в клетках млекопитающих урокиназу, содержащим последовательность Козак слитую с модифицированным геном урокиназы, характеризующейся нуклеотидной последовательностью, приведенной в SEQ ID NO: 1.
При этом основным техническим результатом является разработка модифицированной последовательности гена урокиназы и плазмиды для эффективной экспрессии урокиназы в клетках млекопитающих, а также повышение эффективности способа стимулирования регенерации периферического нерва после травмы и ишемии. При использовании по существу одной и той же модели травматизации периферического нерва значения основных показателей иннервации ткани увеличились в сравнении с прототипом примерно в полтора раза. Дополнительными результатами данного способа следует считать возможность применения разработанной конструкции для стимуляции регенерации нерва после ишемического повреждения и отказ от применения небезопасных аденовирусных конструкций.
Краткое описание Фигур (чертежей)
Фиг. 1. Анализ эффективности продукции урокиназы, клетками траснфицированными плазмидными конструкциями. Данные представлены в виде среднее ± стандартное отклонение (*-p<0,01; n=3).
Фиг. 2. Восстановление функции мышц-разгибателей стопы после травмы нерва. По оси ординат - значение PFI, усл.ед.; по оси абсцисс - время после повреждения, дни. Данные представлены в виде среднее ± стандартное отклонение (*-p<0,05; n=84).
Фиг. 3. Восстановление количества аксонов в поврежденном нерве. А. - нерв мыши, которой вводили плазмиду, не содержащую трансген. Б. - нерв мыши, которой вводили плазмидную конструкцию pVax1-muPA-native. В. - нерв мыши, которой вводили плазмидную конструкцию pVax1-K-muPA-opt. Количество аксонов оценивали с помощью окрашивания кроличьими антителами к цитоскелету аксонов, белку NF200. Г. - результаты морфометрического анализа количества аксонов на срезе поврежденного нерва. По оси ординат - количество аксонов, шт.Данные представлены в виде медиана (25 процентилей; 75 процентилей) (*-p<0,05; n>10).
Фиг. 4. Восстановление проводимости травмированного нерва. А. - восстановление латентного периода СПДН, по оси ординат - длительность латентного периода, мс. Б. - восстановление амплитуды СПДН, по оси ординат - амплитуда СПДН, мВ. Данные представлены в виде медиана (25 процентилей; 75 процентилей) (*-p<0,05; n>5).
Фиг. 5. Восстановление функции мышц-разгибателей стопы после ишемического повреждения нерва. По оси ординат - значение PFI, усл.ед.; по оси абсцисс - время после повреждения, дни. Данные представлены в виде среднее ± стандартное отклонение (*-p<0,05; n=84).
Фиг. 6. Восстановление амплитуды СПДН после ишемического повреждения. По оси ординат - амплитуда СПДН, мВ. Данные представлены в виде медиана (25 процентилей; 75 процентилей) (*-p<0,05; n>5).
Фиг. 7. Нуклеотидная последовательность рекомбинантной плазмиды pVax1-K-uPA-opt (соответствует последовательности SEQ ID NO: 1). Серым затенением и полужирным шрифтом выделена оптимизированная (модифицированная) последовательность кДНК урокиназы человека, двойным подчеркиванием выделена консенсусная последовательность Козак, полужирным шрифтом и курсивом выделены сайты рестрикции EcoRI и EcoRV. Осуществление изобретения
При осуществлении изобретения, помимо методов, подробно раскрытых в нижеследующих примерах, были использованы стандартные технологии генной инженерии, культивирования клеток млекопитающих и описанные ранее методы анализа регенерации нерва после травмы.
Пример 1. Создание плазмидной конструкции, кодирующей урокиназу
Дизайн оптимизированной плазмидной конструкции, кодирующей кДНК урокиназы, производили следующим образом. Анализ нуклеотидной последовательности кДНК урокиназы человека (NM_002658, https://www.ncbi.nlm.nih.gov/nuccore/NM_002658) выявил значительное содержание т.н. «редких триплетов», что может негативно влиять на эффективность ее экспрессии (таблица 1). На основании этих данных с помощью программы Sequence Optimizer (http://easyprot.org/programs/sequence_optimization.htm) авторами изобретения была проведена оптимизация кДНК урокиназы, в результате которой соотношение кодонов в кДНК урокиназы было максимально приближено к расчетному оптимальному, т.е. кодон, который встречался чаще или реже, чем в рассчитанных значениях, заменяли на аналогичный с сохранением аминокислотной последовательности.
Для того чтобы повысить эффективность трансляции мРНК урокиназы, в кДНК встраивали консенсусную последовательность Козак [Kozak М (October 1987). "An analysis of 5′-noncoding sequences from 699 vertebrate messenger RNAs". Nucleic Acids Res. 15 (20): 8125-8148.]. А именно, внесли 2 триплета, до старт-кодона 5′-GCC АСС-3′ Для получения «сильной» последовательности Козак также необходимо было внести G непосредственно после старт-кодона. Для этого в последовательность был введен триплет GTG, кодирующий аминокислоту валин. Данный подход позволил достичь внедрения «сильной» последовательности Козак в кДНК урокиназы, избежав при этом сдвига рамки считывания. Полученная последовательность нуклеотидов, кодирующая урокиназу человека, представлена на SEQ ID NO: 2. Эту последовательность получали с помощью прямого химического синтеза фрагментов и последующей их сборки. Идентичность полученной последовательности ожидаемой определяли с помощью секвенирования.
Для клонирования оптимизированной кДНК в экспрессионный вектор к ее 5′- и 3′-концам добавляли последовательности, распознаваемые эндонуклеазами EcoRI и EcoRV (5′-GAATTC-3′ и 5′-САТАТС-3′ соответственно). В данном примере в качестве вектора использовали плазмиду pVax1 (#V260-20, Invitrogen), однако, для клонирования могли быть использованы и другие плазмидные векторы, для которых характерна высококопийная репликация в E. coli и высокий уровень экспрессии клонируемого гена в клетках млекопитающих.
Пример 2.
Анализ эффективности полученной плазмидной конструкции
Эффективность экспрессии разработанной плазмиды определяли по продукции целевого белка клетками линии НЕК293, трансфицированными данной плазмидой. Клетки НЕК293, высеянные в лунки 24-луночной плашки (50000 клеток на лунку) в среде DMEM, содержащей 2% эмбриональной телячьей сыворотки, трансфицировали плазмидами pVax1, pVax1-uPA-native (несущей ген урокиназы дикого типа, конструирование плазмиды описано в патенте РФ №2486918, пример 1) или pVax1-K-uPA-opt (несущей фрагмент ДНК, содержащий последовательность Козак слитую с модифицированным геном урокиназы - SEQ ID NO: 2, полная последовательность плазмиды приведена в SEQ ID NO: 1). Трансфекцию проводили с использованием по 1 мкг одной из плазмидных ДНК и по 1 мкл реагента Липофектамин 2000 (Invitrogen) в соответствии с протоколом производителя. Через 24 ч после трансфекции культуральную среду заменяли на свежую. Концентрацию урокиназы в среде анализировали через следующие 48 часов культивирования.
Концентрацию урокиназы в культуральной среде измеряли при помощи набора для иммуноферментного анализа (CSI19849A, Cell Sciences, США) в соответствии с протоколом производителя. Согласно этим измерениям, концентрация урокиназы в культуральной среде от НЕК293, трансформированных pVax1-uPA-native, составляла примерно 0,8 нг/мл. При использовании плазмиды с оптимизированной кДНК и последовательностью Козак, продукция целевого белка увеличивается примерно в 5 раз по сравнению с использованием плазмиды pVax1-uPA-native, что свидетельствует о высокой эффективности плазмиды pVax1-K-uPA-opt, содержащей оптимизированную последовательность кДНК и консенсусную последовательность Козак (фиг. 1).
Пример 3.
Влияние плазмиды pVax1-K-uPA-opt на восстановление периферического нерва после травмы
Для оценки эффективности влияния разработанной плазмиды на восстановление периферического нерва с использованием мышиной модели были дополнительно сконструированы плазмиды pVax1-muPA-native (несущая мышиный ген урокиназы дикого типа, в качестве которого в плазмиду встраивали кДНК, характеризующуюся последовательностью, доступной по ссылке http://www.ncbi.nlm.nih.gov/nuccore/NM_008873.3) и pVax1-K-muPA-opt (несущая фрагмент ДНК, содержащий последовательность Козак слитую с модифицированным геном урокиназы мыши).
Конструирование плазмиды pVax1-K-muPA-opt и оптимизацию кДНК урокиназы мыши, осуществляли по алгоритму, описанному в Примере 1. Полная нуклеотидная последовательность плазмиды pVaxl-K-muPA-opt приведена в SEQ ID NO: 3.
Анализ эффективности полученных плазмид pVax1-muPA-native и pVax1-K-muPA-opt осуществляли согласно методике, описанной в статье Makarevich P, Tsokolaeva Z, Shevelev A, Rybalkin I, Shevchenko E, Beloglazova I, Vlasik T, Tkachuk V, Parfyonova Y. Combined transfer of human VEGF165 and HGF genes renders potent angiogenic effect in ischemic skeletal muscle. PLoS One. 2012; 7 (6): e38776. doi: 10.1371/journal.pone.0038776, с модификациями.
При использовании плазмиды с оптимизированной кДНК и последовательностью Козак, продукция целевого белка увеличивается примерно в 4 раз по сравнению с использованием плазмиды pVax1-muPA-native, что как и в случае плазмиды pVax1-K-uPA-opt, свидетельствует о высокой эффективности плазмиды содержащей оптимизированную последовательность кДНК и консенсусную последовательность Козак.
Для исследования процесса регенерации периферического нерва после травмы использовали модель повреждения общего малоберцового нерва, описанную ранее [патент РФ №2486918, пример 4; Lopatina T, Kalinina N, Karagyaur M, Stambolsky D, Rubina K, Revischin A, Pavlova G, Parfyonova Y, Tkachuk V. Adipose-derived stem cells stimulate regeneration of peripheral nerves: BDNF secreted by these cells promotes nerve healing and axon growth de novo. PLoS One. 2011; 6 (3): e17899]. Сразу после повреждения нерва в переднюю большеберцовую мышцу вводили от 200 мкг плазмидной ДНК pVax1, pVax1-muPA-native или pVax1-K-muPA-opt. Данная терапевтически эффективная концентрация была подобрана по результатам предварительных экспериментов.
Восстановление иннервации мышц оценивали через 1, 2, 4 и 7 суток по восстановлению функции мышц-разгибателей пальцев стопы. Восстановление функции мышц-разгибателей стопы анализировали с помощью измерения функционального индекса малоберцового нерва (PFI) как описано ранее [Lopatina T, Kalinina N, Karagyaur M, Stambolsky D, Rubina K, Revischin A, Pavlova G, Parfyonova Y, Tkachuk V. Adipose-derived stem cells stimulate regeneration of peripheral nerves: BDNF secreted by these cells promotes nerve healing and axon growth de novo. PLoS One. 2011; 6 (3): e17899]. Было обнаружено, что уже через 2 суток у животных, которым была инъецирована pVax1-K-muPA-opt, значение PFI было примерно в 1,3 раза выше, чем у животных в группе контроля (фиг. 2). Плазмида pVax1-muPA-native не оказала достоверного эффекта на восстановление иннервации мышц-разгибателей пальцев стопы после травмы нерва.
Восстановление структурной целостности нерва оценивали с помощью иммуннофлуоресцентного окрашивания замороженных срезов поврежденных нервов через 4 суток после повреждения как описано ранее [патент РФ №2486918, пример 4; Lopatina T, Kalinina N, Karagyaur M, Stambolsky D, Rubina К, Revischin A, Pavlova G, Parfyonova Y, Tkachuk V. Adipose-derived stem cells stimulate regeneration of peripheral nerves: BDNF secreted by these cells promotes nerve healing and axon growth de novo. PLoS One. 2011; 6(3): е17899]. Уже через 4 дня после повреждения у животных, которым была инъецирована pVax1-K-muPA-opt наблюдали примерно в 1,3 раза больше аксонов, содержащих белок NF200, на 1 срез нерва по сравнению с нервами животных, которым вводили плазмиду pVax1, не содержащую трансгена (p<0,05; n=18). Плазмида pVax1-muPA-native достоверного эффекта на восстановление структуры травмированного нерва не оказала (фиг. 3).
Эти данные свидетельствуют о более быстром росте и лучшей выживаемости аксонов в поврежденных нервах животных, которым была инъецирована pVax1-K-muPA-opt.
Восстановление проводимости регенерировавших нервных волокон оценивали с помощью вызванных потенциалов действия, регистрируемых с поверхностной веточки общего малоберцового нерва, как описано ранее [патент РФ №2486918, пример 4; Lopatina T, Kalinina N, Karagyaur M, Stambolsky D, Rubina K, Revischin A, Pavlova G, Parfyonova Y, Tkachuk V. Adipose-derived stem cells stimulate regeneration of peripheral nerves: BDNF secreted by these cells promotes nerve healing and axon growth de novo. PLoS One. 2011; 6 (3): e17899]. Полученные данные анализировали следующим образом. Регистрируемый СПДН содержит два параметра, позволяющие судить о степени восстановления нерва: латентный период и амплитуду.
Латентный период - промежуток времени от момента стимуляции нерва до момента регистрации вызванного потенциала действия, измеряется в миллисекундах (мс). Исходя из определения понятно, что латентный период характеризует скорость проведения возбуждения по нерву, причем величина латентного периода обратно пропорциональна скорости проведения возбуждения по нерву. Таким образом, укорочение латентного периода свидетельствует о большей скорости проведения вызванных потенциалов, что в свою очередь говорит о степени миелинизации для миелинизированных нервных волокон или об увеличении толщины безмиелиновых нервных волокон.
Амплитуда характеризует количество нервных волокон, участвующих в проведении возбуждения; измеряется в милливольтах (мВ) Чем больше амплитуда - тем больше количество восстановившихся нервных волокон.
При помощи регистрации вызванных потенциалов действия нерва через 7 суток после повреждения нам удалось показать, что инъекция генетической конструкции pVax1-K-muPA-opt стимулирует восстановление нерва. Хотя инъекция данной плазмиды не вызывала достоверного уменьшения латентного периода, она привела к увеличению амплитуды СПДН примерно в 1,3 раза по сравнению с соответствующими значениями СПДН мышей, получивших плазмиду pVax1, не содержащую трансгена (фиг. 4). Плазмида pVax1-muPA-native достоверного эффекта на восстановление проводимости травмированного нерва не оказала.
Таким образом, инъекция плазмиды pVax1-K-muPA-opt приводила к более выраженному восстановлению проводимости нерва по сравнению с разработанной ранее плазмидой pVax1-muPA-native.
Пример 4.
Влияние плазмиды pVax1-K-muPA-opt на восстановление периферического нерва после ишемического повреждения
Впервые на модели ишемии нерва мыши была применена созданная плазмидная конструкция. Введение плазмидной конструкции pVax1-K-muPA-opt позволило замедлить развитие дегенеративных изменений в нерве после его ишемического повреждения. Для исследования процесса регенерации периферического нерва после ишемического повреждения использовали модель ишемического повреждения общего малоберцового нерва. В данной модели повреждения артерии, питающие седалищный и общий малоберцовый нервы, перевязывали стерильной нейлоновой нитью (8-0) и иссекали [Adams WE - The Blood Supply of Nerves. The effects of exclusion of its regional sources of supply on the sciatic nerve of the rabbit (1943) Journal of Anatomy, 77(3): 243-250; Kadiyala RK et al. - The blood supply of the common peroneal nerve in the popliteal fossa (2005) J. Bone Joint Surg Br, 87-B (3): 337-342]. Седалищный и общий малоберцовый нервы аккуратно с помощью стеклянного крючка отделяли от окружающих тканей, при этом тщательно избегали травмирования нерва.
Сразу после нанесения ишемического повреждения в переднюю большеберцовую мышцу вводили 200 мкг плазмидной ДНК pVax1, pVax1-muPA-native или pVax1-K-muPA-opt. Данная терапевтически эффективная концентрация была подобрана по результатам предварительных экспериментов.
Восстановление иннервации мышц оценивали через 1, 2 и 4 суток после ишемического повреждения по восстановлению функции мышц-разгибателей пальцев стопы. Восстановление функции мышц-разгибателей стопы анализировали с помощью измерения функционального индекса малоберцового нерва (PFI) как описано ранее [патент РФ №2486918;]. Было обнаружено, что уже через 2 суток у животных, которым была инъецирована pVax1-K-muPA-opt, значение PFI было примерно в 1,4 раза выше, чем в контроле, и в 1,3 раза выше, чем у животных, которым была инъецирована плазмида pVax1-muPA-native. А через 4 суток у животных, которым была инъецирована pVax1-K-muPA-opt, значение PFI было примерно в 1,5 раза выше, чем в контроле и у животных, которым была инъецирована плазмида pVax1-muPA-native (фиг. 5). Плазмида pVax1-muPA-native достоверного эффекта на восстановление иннервации мышц после ишемического повреждения нерва не оказала.
Восстановление проводимости ишемизированных нервных волокон оценивали с помощью вызванных потенциалов действия, регистрируемых с поверхностной веточки общего малоберцового нерва, как описано ранее [патент РФ №2486918, пример 4; Lopatina T, Kalinina N, Karagyaur M, Stambolsky D, Rubina K, Revischin A, Pavlova G, Parfyonova Y, Tkachuk V. Adipose-derived stem cells stimulate regeneration of peripheral nerves: BDNF secreted by these cells promotes nerve healing and axon growth de novo. PLoS One. 2011; 6 (3): e17899]. Полученные данные анализировали, как было описано выше (см. пример 3).
При помощи регистрации вызванных потенциалов действия нерва через 7 суток после повреждения нам удалось показать, что инъекция генетической конструкции pVax1-K-muPA-opt препятствует дегенерации нервных волокон после ишемического повреждения и стимулирует их восстановление. Введение плазмиды pVax1-K-muPA-opt способствовало увеличению амплитуды СПДН. Так, у животных, получивших pVax1-K-muPA-opt, амплитуда СПДН была примерно в 1,4 раза больше, чем у животных, которым вводили pVax1 (фиг. 6). Эти данные свидетельствуют о том, что инъекция pVax1-K-muPA-opt препятствует дегенерации и стимулирует восстановление проводимости нервных волокон после ишемического повреждения, поскольку большее количество нервных волокон, чем в группе контроля проводит вызванные потенциалы действия. В то же время, плазмида pVax1-muPA-native достоверного эффекта на восстановление проводимости нерва после его ишемического повреждения не оказала.
Заключение
В результате проведенных исследований, впервые было показано, что инъекция плазмидной конструкции, содержащей оптимизированную последовательность гена урокиназы слитую с последовательностью Козак, в мышцу, иннервируемую травмируемым нервом, с последующей электропорацией стимулирует регенерацию: примерно в 1,3 раза в сравнении с контролем ускоряется восстановление иннервации мышц-разгибателей пальцев стопы (см. кривые на фиг. 2), которое сопровождается увеличением числа аксонов в поврежденном нерве в 1,3 раза (см. столбцы на фиг. 3), а также возрастанием амплитуды СПДН в 1,3 раза (см. столбцы на фиг. 4).
Установлено, что введение плазмиды pVax1-K-muPA-opt после ишемического повреждения нерва сопровождается увеличением амплитуды СПДН примерно в 1,4 раза по сравнению с животными, которым вводили pVax1 и pVax1-muPA-native (см.столбцы на фиг. 6). Также инъекция pVax1-K-muPA-opt сопровождается лучшим восстановлением иннервации мышц: так, через 2 и 4 суток у животных, которым была инъецирована pVax1-K-muPA-opt, значение PFI было примерно в 1,3-1,5 раза выше, чем у животных в группе контроля (см. кривые на фиг. 5).
На основании полученных данных был сделан вывод о том, что стимуляция восстановления структуры и функции нерва после травмы и ишемии может быть достигнута путем введения плазмидной конструкции, содержащей оптимизированную нуклеотидную последовательность урокиназы и консенсусную последовательность Козак. Высокая продукция целевого белка, достигнутая в результате проведенной модификации, обеспечила возможность использования этой плазмиды для стимуляции восстановления нервов как после травмы, так и после ишемического повреждения.
1. Способ стимуляции восстановления иннервации поврежденной ткани у млекопитающих с помощью введения в область повреждения векторной конструкции, обеспечивающей высокий уровень экспрессии фактора, участвующего в процессе регенерации нерва, отличающийся тем, что в поврежденную мышцу вводят терапевтически эффективное количество рекомбинантной плазмиды, содержащей плазмидный вектор pVax1 со встроенным по сайтам рестрикции EcoRI и EcoRV фрагментом ДНК, кодирующим оптимизированную для экспрессии в клетках млекопитающих урокиназу, содержащим последовательность Козак, слитую с модифицированным геном урокиназы, характеризующуюся нуклеотидной последовательностью, приведенной в SEQ ID NO:1.
2. Способ по п. 1, в котором повреждение представляет собой травму периферического нерва.
3. Способ по п. 2, в котором повреждение представляет собой ишемическое повреждение периферического нерва.
4. Рекомбинантная плазмида, предназначенная для экспрессии гена урокиназы в клетках млекопитающих, содержащая плазмидный вектор pVax1 со встроенным по сайтам рестрикции EcoRI и EcoRV фрагментом ДНК, кодирующим оптимизированную для экспрессии в клетках млекопитающих урокиназу, содержащим последовательность Козак, слитую с модифицированным геном урокиназы, характеризующаяся нуклеотидной последовательностью, приведенной в SEQ ID NO: 1
5. Фрагмент ДНК, кодирующий оптимизированную для экспрессии в клетках млекопитающих урокиназу, содержащий последовательность Козак, слитую с модифицированным геном урокиназы, и характеризующийся нуклеотидной последовательностью, приведенной в SEQ ID NO: 2.