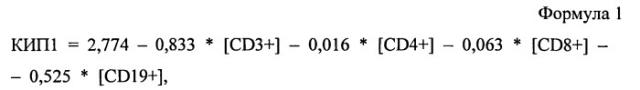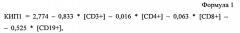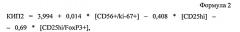Способ прогнозирования быстрого вирусологического ответа у больных хроническим гепатитом с
Иллюстрации
Показать всеИзобретение относится к области медицины, в частности гепатологии, и может быть использовано для прогнозирования быстрого вирусологического ответа на терапию пегилированным интерфероном α и рибавирином у больных хроническим гепатитом C. Для этого определяют аллельный вариант гена ИЛ-28В и проводят иммунологическое исследование. При наличии аллели rs12979860CC/rs8099917TT рассчитывают коэффициент иммунопрогнозирования 1 (КИП-1) по формуле: КИП-1=2,774-0,833*[CD3+]-0,016*[CD4+]-0,063*[CD8+]-0,525*[CD19+], где [CD3+] - абсолютное содержание CD3+ клеток в 1 л крови, [CD4+] - абсолютное содержание CD3+/CD4+ клеток в 1 л крови, [CD8+] - абсолютное содержание CD3+/CD8+ клеток в 1 л крови, [CD19+] - абсолютное содержание CD19+ клеток в 1 л крови. При величине КИП-1 ≤1,5 прогнозируют развитие быстрого вирусологического ответа на стандартную терапию, а >1,5 - его отсутствие. При наличии любого другого аллельного варианта рассчитывают КИП-2 по формуле: КИП2=3,994+0,014*[CD56+/ki-67+]-0,408*[CD25hi]-0,69*[CD25hi/FoxP3+], где [CD56+/ki-67+] - % CD16+/CD56+/ki-67+ клеток среди лимфоцитов крови, [CD25hi] - % CD3+/CD25high клеток среди лимфоцитов крови, [CD25hi/FoxP3+] - % CD3+/CD25high/FoxP3+ клеток среди лимфоцитов крови. При величине КИП-2 ≤3,0 прогнозируют развитие быстрого вирусологического ответа на стандартную терапию, а >3,0 - его отсутствие. Использование данного способа позволяет выявить по разным аллельным вариантам гена ИЛ-28В различные сдвиги иммунограмм и дает возможность прогнозировать наличие или отсутствие быстрого вирусологического ответа. 5 ил., 2 табл., 4 пр.
Реферат
Изобретение относится к области медицины, в частности гепатологии и инфекционным болезням, и может использоваться для прогнозирования быстрого вирусологического ответа на терапию пегилированным интерфероном α и рибавирином у больных хроническим гепатитом C. Для осуществления способа у больных хроническим гепатитом C определяется аллельный вариант гена ИЛ-28B, и в зависимости от аллели названного гена проводится иммунологическое тестирование и рассчитывается коэффициент иммунопрогнозирования (КИП) для благоприятной и неблагоприятной аллели. При сочетании аллельного варианта «CC-TT» (rs12979860CC/rs8099917TT) со значениями КИП благоприятной аллели (КИП-1)<1,5 прогнозируют развитие быстрого вирусологического ответа, при сочетании аллельного варианта CC-TT со значениями КИП-1>1,5 прогнозируют отсутствие быстрого вирусологического ответа, при сочетании аллельного варианта «не СС-ТТ» со значениями КИП такой неблагоприятной аллели (КИП-2)<2,0 прогнозируют развитие быстрого вирусологического ответа, при сочетании аллельного варианта «не CC-TT» со значениями КИП-2>2,0 прогнозируют отсутствие быстрого вирусологического ответа.
Повышение эффективности лечения хронического гепатита С (ХГС) является важной задачей медицины в связи широкой распространенностью этой инфекционной патологии и ее принадлежностью к социально значимым заболеваниям с высокой частотой неблагоприятных исходов (цирроза печени, гепатоклеточной карциномы) [1-3].
Известно, что наиболее информативным прогностическим критерием достижения устойчивого вирусологического ответа (УВО) на стандартную терапию, является наличие быстрого вирусологического ответа (БВО) - отсутствие РНК вируса гепатита C (ВГС) в крови через 4 недели лечения [4]. Причины, обусловливающие снижение уровня виремии быстрыми темпами или, наоборот, наличие так называемого «медленного вирусологического ответа», долгое время оставались неясными.
Определенный прорыв в понимании значения отдельных факторов, ответственных за эффективность лечения, возник в связи с открытием в последние годы феномена ассоциации ответа на лечение пегилированным ИФНα и рибавирином пациентов, инфицированных генотипом 1b вируса гепатита C (ВГС), а также спонтанной элиминации ВГС из организма с вариантом полиморфизма гена ИЛ-28B человека [5-8]. Было установлено, что аллельный вариант rs12979860 СС по сравнению с rs12979860 СТ и rs12979860 ТТ является наиболее благоприятным с точки зрения получения быстрого и устойчивого ответа на лечение (достижение УВО при этом варианте регистрировали у 80% пациентов), так же как генотип rs8099917 ТТ был сопряжен с чувствительностью к названным терапевтическим воздействиям в гораздо большей степени, чем варианты rs8099917TG и rs8099917GG [9].
По данным, полученным к настоящему времени, можно заключить, что индивидуальное предсказательное значение генотипа человека не достаточно высоко, поскольку УВО может достичь пациент как с благоприятным, так и неблагоприятным генотипом, и уже известен ряд факторов, которые могут модифицировать влияние генотипа человека на эффективность противовирусной терапии [10-11]. В частности, в литературе есть сведения о взаимосвязи качества вирусологического ответа на лечение пегилированным ИФНα и рибавирином с функциональным состоянием естественных киллерных клеток (ЕК) и уровнем специфического Т-клеточного ответа на антигены ВГС [12-14].
В связи с этим целью настоящего исследования было определение дополнительных иммунологических критериев у больных хроническим гепатитом C, которые могли бы повысить предсказательное значение аллельного варианта гена ИЛ-28B у данных больных по развитию или отсутствию у них быстрого вирусологического ответа на терапию препаратами пегилированного ИФНα и рибавирина.
В настоящее время в международной патентной базе содержится довольно много сведений о способах прогнозирования вирусологического ответа на терапию пегилированным интерфероном α и рибавирином. Среди них есть способы, основанные как на генетических исследованиях, так и на обнаружении отдельных белковых и пептидных маркеров предикции в биологических жидкостях организма.
Так, например, есть способ прогнозирования формирования вирусологического ответа на терапию у больных ХГС, основанный на соотношении двух сывороточных цитокинов - интерлейкина-18 и фактора некроза опухолей α [15].
Разработаны белковые чипы, а также чипы интерферон-стимулируемых генов (ISG) для прогнозирования результатов интерферонотерапии у больных ХГС [16, 17]. В качестве маркеров чувствительности к терапии пегилированным ИФНα и рибавирином предлагаются тесты по обнаружению в клетках печени определенных микроРНК [18], олигонуклеотидов и мРНК [19, 20].
Имеются в числе запатентованных способов и методы, основанные на предсказательном значении для эффективности противовирусной терапии обнаружения полиморфных генов ИЛ-28B [21, 22, 23].
Поскольку предлагаемый нами способ носит комплексный характер и сочетает, помимо генетических, еще и иммунологические методы детекции биомаркеров, а также элементы математического моделирования, прототипом данного исследования следует считать патент Великобритании 2004 г. «Bayesian model for the prognosis of hepatitis C virus infection» [24]. Оба патента объединяет интегральный подход к прогнозированию успешности вирусологического ответа на лечение пегилированным ИФНα и рибавирином, объединив результаты нескольких различных по характеру исследований. Общим является и использование математико-статистического аппарата для оценки исследований, хотя в случае зарубежного патента, в отличие от предлагаемого способа, изучаемые вероятности не были частотными.
Наряду с этим, у аналога с позиций поставленной задачи исследования имеются недостатки, важнейший из которых заключается в том, что рассматриваемая в зарубежном патенте модель определяет вероятность риска неблагоприятного течения инфекционного процесса без выявления конкретных показаний к терапии пегилированным ИФНα и рибавирином, в то время как предлагаемый способ решает эту задачу с довольно высокой диагностической точностью.
В связи с этим особенностью данного изобретения является то, что для достижения технического результата используется комбинация генетических и иммунологических тестов, на основе которых для относительно благоприятных и неблагоприятных для развития вирусологического ответа на противовирусную терапию аллелей разработаны способы расчета коэффициентов иммунопрогнозирования, позволяющие в определенных диапазонах значений этих коэффициентов с высокой диагностической точностью предсказывать развитие быстрого вирусологического ответа.
Под наблюдением находились 18 больных с верифицированным диагнозом хронического вирусного гепатита C, подписавших информированное согласие на исследование их образцов крови. Среди больных было 10 женщин и 8 мужчин со средним возрастом 36,1±10,3 (от 18 лет до 47 лет). У большинства больных (13 человек) фиброз печени находился на начальных стадиях формирования (F1 по шкале Metavir), у 3-х больных на стадии F2 и у 2-х больных на стадии F3. 13 больных были инфицированы генотипом 1b ВГС, 1 человек - генотипом 2a ВГС, 4 человека - генотипом 3a ВГС. Все больные получали терапию пегилированным ИФНα2b 1 раз в неделю подкожно и рибавирином 800-1200 мг в сутки в дозах, рассчитанных по массе тела.
Кровь всех пациентов была использована для выделения геномной ДНК, РНК ВГС и выполнения иммунологических исследований. Для регистрации быстрого вирусологического ответа вирусная нагрузка в образцах крови определялись дважды - до лечения и через 4 недели от начала лечения.
Взятие образцов крови проводилось в вакуумные пластиковые пробирки Vacuette объемом 2,0 мл с ЭДТА в конечной концентрации 2,0 мг/мл. Плазму крови получали центрифугированием образцов при 3000 об/мин в течение 20 мин при комнатной температуре (18-25°C).
Определение полиморфизма гена ИЛ-28B по rs12979860 (генотипы CC, CT или TT) и rs8099917 (генотипы TT, TG или GG) проводилось с помощью модифицированного метода «примыкающих проб», выявляющего однонуклеотидные замены в генах [25]. Выделение геномной ДНК осуществлялось при помощи роботизированного многофункционального диспенсора Biomeck Workstaion 2000 (Beckman Coulter, USA) в соответствии с инструкцией по применению прибора. В подготовленные заранее пробирки, содержащие смесь для амплификации IL28B rs12979860 C>Т или IL28B: rs8099917 T>G (20 мкл), 10 мкл ПЦР-буфера, 10 мкл Taq-AT-полимеразы, 20 мкл минерального масла, добавляли 5 мкл выделенного из крови образца ДНК. После центрифугирования в вортексе в течение 1-3 сек пробирки устанавливали в блок амплификатора детектирующего «IQ-5», BIO RAD (USA). Регистрация и учет результатов ПЦР проводились автоматически на основе программного обеспечения прибора.
Для выявления РНК вируса гепатита C, его генотипирования и количественной оценки использовался метод обратной транскрипции и полимеразной цепной реакции (RT-PCR) на оборудовании «IQ-5», BIO RAD (USA) с использованием набора реагентов «ОТ-ГЕПАТОГЕН-C ГЕНОТИП и «ОТ-ГЕПАТОГЕН-C КОЛИЧЕСТВЕННЫЙ» в соответствии с инструкциями по применению прибора и набора реагентов. Особенностью количественной оценки РНК ВГС являлось использование набора реагентов, включающего калибровочные образцы HCV-PHK в 2-х концентрациях: 1×106 копий/мл и 3×103 копий/мл. При этом результат определялся как положительный с указанием вирусной нагрузки в образце (копий/мл), если значение вирусной нагрузки находилось в пределах 7,5×102-1×108 копий/мл. Наличие быстрого вирусологического ответа констатировалось в тех случаях, если РНК ВГС была ниже уровня детекции анализатора через 4 недели лечения.
Иммунологическое исследование включало анализ количественного содержания в крови лимфоцитов различного популяционного/субпопуляционного состава, а также пролиферирующих лимфоцитов с использованием проточного цитофлуориметра BD FACSCanto II (Becton Dickinson, США). Для определения количественного содержания Т-лимфоцитов, их основных субпопуляций, В-лимфоцитов, а также естественных киллерных клеток среди лимфоцитов крови (CD45+ клеток) использовался стандартизированный комплект моноклональных антител (МКАТ) BD Multitest 6-Color TBNK Reagent (BD Biosciences, США), содержащий меченные PerCP-Cy5.5 anti-CD45 МКАТ, меченные FITC anti-CD3 МКАТ, меченные PE-Cy7 anti-CD4 МКАТ, меченные АРС-Cy7 anti-CD8 МКАТ, меченные АРС anti-CD19 МКАТ, меченные РЕ anti-CD16/anti-CD56 МКАТ. Для определения экспрессии поверхностного маркера активации CD25 использовали смесь МКАТ, содержащую anti-human-CD3 МКАТ, меченные PerCP (BD Biosciences, США), и anti-human-CD25 МКАТ, меченные АРС (BD Biosciences, США). Для числа CD3+ клеток определялась субпопуляция регуляторных Т-клеток по экспрессии внутриклеточного маркера PoxP3, регистрируемого с помощью anti-human-FoxP3 МКАТ, меченных PE (BD Biosciences, США), и пермабилизирующих компонентов фирмы Beckman Coulter (США). Для числа CD3+, CD3+/CD4+, CD3+/CD8+ и CD3-/CD56+ клеток определялась пролиферативная активность по наличию внутриклеточного маркера пролиферирующих клеток - Ki67 (Ki-67+), для чего использовались моноклональные антитела, меченные PE (BD Biosciences, США), и пермабилизирующие компоненты фирмы Beckman Coulter (США).
Статистическая обработка данных осуществлялась на основе пакета программ SPSS, версия 17. Использовались методы дискриптивной статистики, сопоставление показателей в группах исследования осуществлялось непараметрическим методом по критерию Манна-Уитни. Определение диагностического значения информативных показателей сопровождалось расчетом их 95% доверительных интервалов, построением ROC-кривой и определением величины AUROC.
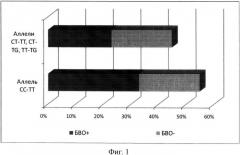
Результаты генотипирования больных представлены в таблице 1, из которой следует, что относительно часто встречающейся среди больных ХГС была комбинация аллельных вариантов СС гена rs 12979860 и TT гена rs 8099917 - 10 человек. Эта категория больных расценивалась с позиций относительно «благоприятного» прогноза по ответу на стандартную противовирусную терапию. К относительно «неблагоприятному» генотипу были отнесены несколько вариантов, в частности комбинации аллелей CT-TT (2 человека), CT-TG (5 человек) и TT-TG (1 человек), то есть все случаи, когда хотя бы одна аллель считалась неблагоприятной. В результате все обследованные были поделены на 2 группы: (1) пациенты с относительно благоприятным генотипом CC-TT - 10 человек, (2) пациенты с относительно неблагоприятными генотипами CT-TT, CT-TG, TT-TG - 8 человек.
Сочетание различных аллельных вариантов гена ИЛ-28B с развитием быстрого вирусологического ответа (БВО) у наблюдаемых больных представлено на фиг.1, из которого следует, что предсказательное значение поморфизмов гена ИЛ-28B не абсолютно, поскольку как у лиц с благоприятной аллелью возможно отсутствие БВО, так и у лиц с неблагоприятной аллелью возможно его наличие.
Анализ иммунного статуса проводился раздельно в группах пациентов с благоприятным и неблагоприятными генотипами с разграничением подгрупп по наличию и отсутствию быстрого вирусологического ответа. Результаты иммунологического исследования представлены в таблице 2.
Поскольку основной целью исследования служил прогноз развития БВО, то в этой ситуации при анализе каждого аллельного варианта необходимо было выделить в них дифференциальные иммунологические признаки, характеризующие наличие или отсутствие БВО. Обращает на себя внимание тот факт, что не удалось установить ни одного показателя, который позволял бы дифференцировать все 4 группы одновременно.
При наличии у пациентов «благоприятного» варианта гена ИЛ-28B (CC-TT) с разным результатом по БВО (+/-) основные отличия коснулись параметров базовой иммунограммы, то есть, в первую очередь, абсолютного содержания в крови CD3+, CD3+/CD4+, CD3+/CD8+, CD19+ лимфоцитов. В то же время в группах пациентов с «неблагоприятными» вариантами гена ИЛ-28B и разным результатом по достижимости БВО основные отличия относились к активационно-пролиферативному статусу лимфоцитов и затрагивали процентное содержание в крови CD3+/CD25high, CD3+/CD25high/FoxP3+, CD56+/CD16+/ki-67+ клеток.
Таким образом, разным группам аллельных вариантов гена ИЛ-28B («благоприятный» и «неблагоприятные» варианты) и наличию или отсутствию БВО соответствовали принципиально различные сдвиги иммунограмм. С использованием программы SPSS (17) были получены «коэффициенты иммунопрогнозирования» (КИП), которые были результатом решения 2-х уравнений линейной регрессии успеха/неуспеха достижения БВО при наличии разных аллельных вариантов ИЛ-28B (КИП1 - формула 1 и КИП2 - формула 2).
где [CD3+] - абсолютное содержание CD3+ клеток в 1 л крови, [CD4+] - абсолютное содержание CD3+/CD4+ клеток в 1 л крови, [CD8+] - абсолютное содержание CD3+/CD8+ клеток в 1 л крови, [CD19+] - абсолютное содержание CD19+ клеток в 1 л крови.
где [CD56+/ki-67+] - процент CD16+/CD56+/ki-67+ клеток среди лимфоцитов крови, [CD25hi] - процент CD3+/CD25high клеток среди лимфоцитов крови, [CD25hi/FoxP3+] - процент CD3+/CD25high/FoxP3+ клеток среди лимфоцитов крови.
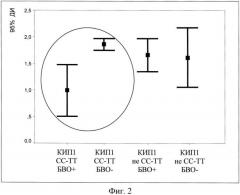
На фиг.2 и 4 представлены 95% доверительные интервалы коэффициентов иммунопрогнозирования успеха и неуспеха БВО, рассчитанные для всех групп пациентов с разными аллельными вариантами гена ИЛ-28B и разным успехом по БВО, а также ROC-кривые для дифференциации групп (фиг.3 и 5).
Как показывает фиг.2, группы пациентов с благоприятным аллельным вариантом и наличием БВО достоверно отличалась от группы пациентов с такой же благоприятной аллелью гена ИЛ-28B, но без БВО, по величине КИП1, в то время как неблагоприятные аллели такого различия не демонстрировали. При этом значения КИП1<1,5 с практически абсолютной информативностью свидетельствовали о вероятности получения БВО, а >1,5 - в пользу отсутствия БВО у пациентов с CC-TT вариантом генотипа по ИЛ-28B, что подтверждается величиной AUROC, равной 1, на фиг.3.
Как видно из фиг.4, в случае неблагоприятных аллельных вариантов гена ИЛ-28B «не CC-TT» (CT-TT, CT-TG, TT-TG) диагностически значимым показателем становится другой коэффициент - КИП2. Так, в случае неблагоприятного аллельного варианта гена ИЛ-28B значения этого коэффициента <3,0 свидетельствуют в пользу развития БВО, а >3,0 - о практически абсолютной вероятности его отсутствия, что подтверждается величиной AUROC, равной 1, представленной на фиг.5.
Таким образом, прогнозирование успеха терапии пегилированным ИФНα и рибавирином на основе варианта полиморфизма гена ИЛ-28B не является абсолютным и требует дополнительных критериев. Предлагаемый нами способ показывает, что эти критерии были получены на основе иммунологических показателей и они различны для благоприятных и неблагоприятных аллелей гена ИЛ-28B.
Способ иллюстрируется следующими чертежами.
Фиг.1. Частота встречаемости наличия и отсутствия быстрого вирусологического ответа на терапию пегилированным интерфероном α и рибавирином у больных хроническим гепатитом C с различными аллельными вариантами гена ИЛ-28B.
Фиг.2. 95% доверительные интервалы коэффициента иммунопрогнозирования 1 (КИП1) у больных хроническим гепатитом C с наличием и отсутствием быстрого вирусологического ответа на стандартную терапию при разных аллельных вариантах гена ИЛ-28B.
Фиг.3. ROC-кривая различий по величине КИП1 у больных хроническим гепатитом C с благоприятным аллельным вариантом (CC-TT) гена ИЛ-28B при наличии и отсутствии быстрого вирусологического ответа на стандартную терапию.
Фиг.4. 95% доверительные интервалы коэффициента иммунопрогнозирования 2 (КИП2) у больных хроническим гепатитом C с наличием и отсутствием быстрого вирусологического ответа на стандартную терапию при разных аллельных вариантах гена ИЛ-28B.
Фиг.5. ROC-кривая различий по величине КИП2 у больных хроническим гепатитом C с неблагоприятными аллельными вариантами (не CC-TT) гена ИЛ-28B при наличии и отсутствии быстрого вирусологического ответа на стандартную терапию.
Способ иллюстрируется следующими клиническими примерами.
Пример 1
Пациент Т., 46 лет, наблюдался в гепатологическом центре ИКБ №1. Антитела к вирусу впервые обнаружены в декабре 2011 г. при обследовании по поводу случая желтушной формы гепатита у коллеги по работе. В анамнезе у пациента не было хронических заболеваний и полостных оперативных вмешательств. В прошлом в течение порядка 10 лет злоупотреблял алкогольными напитками.
При дальнейшем обследовании выявлен 3a генотип вируса гепатита C. По данным пункционной биопсии печени (в марте 2012 г.) выявлен фиброз 1 (Metavir). Определялся генотип пациента по аллельному варианту полиморфизмов rs12979860 и rs8099917 гена интерлейкина 28B и был установлен генотип CC-TT («благоприятный» генотип для УВО).
Пациент Т. был мотивирован к проведению терапии ХГС и включен в настоящее исследование с проведением иммунологического обследования. В общем анализе крови не наблюдалось отклонений от общепопуляционных норм, в биохимическом анализе обращали на себя внимание небольшое повышение уровней АЛТ - 83 ЕД, ACT - 56 ЕД, общий билирубин - 12 ммоль/л, прямой - 0,8 ммоль/л, непрямой - 11,2 ммоль/л. РНК HCV до лечения - 4,8×105 МЕ/мл.
Показатели иммунограммы по абсолютному содержанию в крови лимфоцитов, необходимых для тестирования, до лечения: CD3+ - 1,93*109/л, CD3+/CD4+ - 0,94*109/л, CD3+/CD4+ - 0,97*109/л, CD19+ - 0,53*109/л.
Учитывая благоприятный аллельный вариант гена ИЛ-28B, была использована следующая формула для расчета коэффициента иммунопрогнозирования: КИП1=2,774-0,833*[CD3+]-0,016*[CD4+]-0,063*[CD8+]-0,525*[CD19+]. КИП1 у данного больного составлял 0,81 (меньше 1,5), что позволяло прогнозировать у него развитие быстрого вирусологического ответа.
Пациенту была назначена противовирусная терапия (Альгерон 1,5 мкг/кг/нед, Ребетол 1000 мг/сут). На фоне лечения на 4 неделе при вирусологическом обследовании в крови вирус не определялся, то есть был достигнут быстрый вирусологический ответ. Лечение продолжалось в течение 24 недель, и были достигнуты ранний вирусологический ответ, ответ в конце терапии и устойчивый вирусологический ответ.
Пример 2
Пациент З., 37 лет, наблюдался в гепатологическом центре ИКБ №1. Антитела к вирусу впервые обнаружены в 1998 г. при обследовании на донорство. В анамнезе у пациента не было хронических заболеваний. С 1990 по 1992 гг. перенес 6 операций на коленном суставе по поводу спортивной травмы.
При дальнейшем обследовании выявлен 3a генотип вируса гепатита C. По данным пункционной биопсии печени (в июне 2010 г.) выявлен фиброз 2 (Metavir). Определялся генотип пациента по аллельному варианту полиморфизмов rs12979860 и rs8099917 гена интерлейкина 28B и был установлен генотип CC-TT («благоприятный» генотип для УВО).
Пациент З. был мотивирован к проведению терапии ХГС и включен в настоящее исследование с углубленным иммунологическим обследованием. В общем анализе крови не наблюдалось отклонений от общепопуляционных норм, в биохимическом анализе обращали на себя внимание небольшое повышение уровней АЛТ - 114 ЕД, ACT - 67 ЕД, общий билирубин - 11,8 ммоль/л, прямой - 3,8 ммоль/л, непрямой - 8 ммоль/л. РНК HCV до лечения - 4,72×106 МЕ/мл. Показатели иммунограммы по абсолютному содержанию в крови лимфоцитов, необходимых для тестирования, до лечения: CD3+ - 1,03*109/л, CD3+/CD4+ - 0,69*109/л, CD3+/CD4+ - 0,31*109/л, CD19+ - 0,17*109/л.
Учитывая благоприятный аллельный вариант гена ИЛ-28B, была использована следующая формула для расчета коэффициента иммунопрогнозирования: КИП1=2,774-0,833*[CD3+]-0,016*[CD4+]-0,063*[CD8+]-0,525*[CD19+]. КИП1 у данного больного составлял 1,80 (больше 1,5), что позволяло прогнозировать у него, несмотря на благоприятный генотип, отсутствие быстрого вирусологического ответа.
Пациенту была назначена противовирусная терапия (Альгерон 2,0 мкг/кг/нед, Ребетол 1200 мг/сут). На фоне лечения на 4 неделе при вирусологическом обследовании в крови определялся вирус в количестве менее 15 МЕ/мл, то есть быстрый вирусологический ответ не был достигнут. Лечение продолжалось в течение 24 недель, в ходе терапии был достигнут ранний вирусологический ответ, но ответ в конце лечения и устойчивый вирусологический ответ достигнуты не были.
Пример 3
Пациентка Г., 32 года, наблюдалась в гепатологическом центре ИКБ №1. Антитела к вирусу впервые обнаружены в июне 2006 г. при обследовании по поводу сопутствующей гинекологической патологии. В анамнезе у пациентки аденомиоз, хронический сальпингооофорит, в 2007 г. - резекция левого яичника (киста), сальпингоовариолизис, в 2010 - сальпингит, удаление левой маточной трубы.
При дальнейшем обследовании выявлен 2a генотип вируса гепатита C. По данным фиброэластометрии определялся фиброз 0. Генотип по аллельному варианту полиморфизмов rs12979860 и rs8099917 гена интерлейкина 28B был CT-TT («неблагоприятный» генотип для УВО).
Пациентка Г. была мотивирована к проведению терапии ХГС и включена в настоящее исследование с углубленным иммунологическим обследованием. В общем анализе крови не наблюдалось отклонений от общепопуляционных норм, в биохимическом анализе обращали на себя внимание повышение уровней АЛТ - 154 ЕД, ACT - 67 ЕД, общий билирубин - 9,9 ммоль/л, прямой - 3,8 ммоль/л, непрямой - 6,1 ммоль/л. РНК HCV до лечения - 2,35×106 МЕ/мл.
При углубленном иммунологическом анализе было установлено: пролиферирующие ЕК не определялись (0), CD3+/CD25high клетки - 0,2%, CD3+/CD25high/FoxP3+ клетки - 38,5%. Учитывая неблагоприятный аллельный вариант гена ИЛ-28B, была использована следующая формула для расчета коэффициента иммунопрогнозирования: КИП2=3,994+0,014*[CD56+/ki-67+]-0,408*[CD25high]-0,69*[CD25high/FoxP3]. КИП2 у данной больной составлял -22,65 (меньше 3,0), что позволяло прогнозировать у нее наличие быстрого вирусологического ответа.
Пациентке была назначена противовирусная терапия (Альгерон 1,5 мкг/кг/нед, Ребетол 1000 мг/сут). На фоне лечения при вирусологическом обследовании на 4 неделе терапии вирус в крови не определялся, был достигнут быстрый вирусологический ответ. Лечение продолжалось в течение 24 недель, и были достигнуты ранний вирусологический ответ, ответ в конце терапии и устойчивый вирусологический ответ.
Пример 4
Пациент К., 43 года, наблюдался в гепатологическом центре ИКБ №1. Антитела к вирусу впервые обнаружены в ноябре 2010 г. при обследовании в стационаре по поводу токсико-аллергической реакции. В анамнезе у пациента не было хронических заболеваний и полостных оперативных вмешательств. В 1986 году проводилось переливание крови по поводу укуса гюрзы.
При дальнейшем обследовании выявлен 1b генотип вируса гепатита C. По данным пункционной биопсии печени (в марте 2011 г.) выявлен фиброз 3 (Metavir). Определялся также генотип пациента по аллельному варианту полиморфизмов rs12979860 и rs8099917 гена интерлейкина 28B и был установлен CT-TG («неблагоприятный» генотип для УВО).
Пациент К. был мотивирован к проведению терапии ХГС и включен в настоящее исследование с углубленным иммунологическим обследованием. В общем анализе крови не наблюдалось отклонений от общепопуляционных норм, в биохимическом анализе обращали на себя внимание повышение уровней АЛТ - 372 ЕД, ACT - 233 ЕД, общий билирубин - 24,4 ммоль/л, прямой - 7,1 ммоль/л, непрямой - 17,3 ммоль/л. PHK HCV до лечения - 4,07×105 МЕ/мл. Показатели стандартной иммунограммы до лечения соответствовали среднестатистическим показателям здоровых взрослых лиц.
При углубленном иммунологическом анализе было установлено: число пролиферирующих ЕК - 5,0%, CD3+/CD25high и CD3+/CD25high/FoxP3+ клетки не обнаружены. Учитывая неблагоприятный аллельный вариант гена ИЛ-28B, была использована следующая формула для расчета коэффициента иммунопрогнозирования: КИП2=3,994+0,014*[CD56+/ki-67+]-0,408*[CD25high]-0,69*[CD25high/FoxP3]. КИП2 у данного больного составлял 4,06 (больше 3,0), что позволяло прогнозировать у него отсутствие быстрого вирусологического ответа.
Пациенту была назначена противовирусная терапия (Пегинтрон 1,5 мкг/кг/нед, Ребетол 1200 мг/сут) на 48 недель. При вирусологическом обследовании на 4-й неделе терапии в крови определялся вирус в количестве 3,5×103 МЕ/мл, то есть быстрый вирусологический ответ не был достигнут. На фоне терапии у пациента отмечалось развитие панцитопении (анемии тяжелой степени, лейкопении и тромбоцитопении), что потребовало госпитализации в гематологическое отделение и исключения из исследования через 6 недель от начала противовирусной терапии.
| Таблица 1 | |||||
| Характеристика больных ХГС с учетом аллельных вариантов генов rs12979860 и rs8099917 ИЛ-28B | |||||
| № пациента | Пол | Возраст (годы) | Фиброз печени (шкала Metavir) | Аллель rs12979860 | Аллель rs8099917 |
| 11 | Ж | 32 | 1 | CC | TT |
| 12 | М | 30 | 1 | CT | TG |
| 14 | Ж | 45 | 2 | CC | TT |
| 15 | Ж | 37 | 2 | CC | TT |
| 26 | Ж | 26 | 1 | CT | TG |
| 36 | М | 37 | 1 | CC | TT |
| 37 | М | 32 | 3 | CC | TT |
| 39 | М | 36 | 1 | CC | TT |
| 40 | М | 40 | 2 | CT | TG |
| 41 | М | 43 | 1 | CT | TT |
| 42 | Ж | 31 | 1 | CT | TT |
| 45 | Ж | 32 | 1 | TT | TG |
| 49 | М | 30 | 1 | CC | TT |
| 50 | Ж | 47 | 3 | CT | TG |
| 56 | М | 46 | 1 | CC | TT |
| 57 | М | 18 | 1 | CC | TT |
| 58 | Ж | 18 | 1 | CC | TT |
| 59 | М | 37 | 1 | CT | TG |
| Таблица 2 | ||||||
| Сравнение групп ХГС с разными вариантами ИЛ-28B и наличием или отсутствием БВО | ||||||
| Показатель | ХГС CC-TT БВО+ (n=6) Медиана [min; max] | ХГС CC-TT БВО- (n=4) Медиана [min; max] | ХГС не CC-TT БВО+ (n=4) Медиана [min; max] | ХГС неCC-TT БВО- (n=4) Медиана [min; max] | p1 | p2 |
| CD3+ (%) | 66,2 [59,9; 81,6] | 68,6 [59,7; 77,5] | 77,0 [61,4; 85,5] | 71,1 [52,5; 88,2] | 0,643 | 0,773 |
| CD3+ (абс.) | 1870 [1453;2252] | 896,6 [762; 1031] | 1105 [971; 1545] | 1105 [802; 1687] | 0,044* | 0,773 |
| CD4+ (%) | 39,8 [29,4; 41,9] | 39,5 [27,1; 51,8] | 49,8 [38,3; 58,6] | 44,6 [28,0; 55,1] | 0,998 | 0,468 |
| CD4+ (абс.) | 1049 [799;1205] | 517,6 [346; 689] | 770,7 [610; 899] | 730,4 [428;965] | 0,044* | 0,773 |
| CD8+ (%) | 30,3 [13.8; 34,9] | 25,4 [23,1; 27,6] | 20,8 [17,7; 24,3] | 22,1 [16,6; 29,5] | 0,355 | 0,997 |
| CD8+ (абс.) | 786,7 [418; 967] | 329,9 [307; 352] | 296,5 [263; 469] | 298,3 [264; 670] | 0,044* | 0,564 |
| CD19+ (%) | 18,7 [15,9; 22,9] | 11,9 [9,70; 14,0] | 14,9 [6,20; 21,8] | 14,3 [7,60; 25,3] | 0,044* | 0,773 |
| CD19+ (абс.) | 547,7 [340; 693] | 153,9 [129; 179] | 244,8 [89,3; 347] | 291,8 [80,7; 386] | 0,044* | 0,773 |
| CD56+/CD16+ (%) | 12,0 [2,70; 18,4] | 20,9 [13,1; 28,6] | 12,6 [4,70; 19,7] | 12,4 [3,10; 37,4] | 0,355 | 0,998 |
| CD56+/CD16+ (a6c.) | 340,8 [74,5; 557] | 269,7 [174;365] | 172,6 [90,6; 314] | 261,6 [32,9; 571] | 0,996 | 0,386 |
| CD3+/CD25+ (%) | 29,0 [4,60; 33,8] | 12,2 [12,2; 12,2] | 9,70 [3,10; 21,4] | 22,2 [12,1; 46,0] | 0,348 | 0,157 |
| CD3+/FoxP3+ (%) | 0,50 [0,01; 7,30] | 1,50 [0,80; 2,20] | 1,20 [0.60; 1,70] | 2,05 [0,80; 4,10] | 0,348 | 0,480 |
| CD3+/CD25high (%) | 0,35 [0,01; 0,50] | 0,11 [0,01; 0,20] | 0,50 [0,20; 0,90] | 0,01 [0,01; 0,10] | 0,240 | 0,028* |
| CD3+/CD25high /FoxP3+ (%) | 0,01 [0,01; 25,0] | 0,01 [0,01; 0,01] | 38,5 [19.0; 42,9] | 0,01 [0,01; 0,01] | 0,480 | 0,019* |
| CD3+/ki67+ (%) | 0,90 [0,10; 1,70] | 7,50 [0,80; 14,2] | 0,55 [0,10; 1,50] | 0,95 [0,60; 1,40] | 0,355 | 0,561 |
| CD4+/ki67+ (%) | 0,30 [0,01; 0,60] | 4,70 [0,20; 9,20] | 0,60 [0,10; 1,10] | 0,45 [0,10; 5,20] | 0,481 | 0,885 |
| CD8+/ki67+ | 0,30 [0,10; 0,80] | 2,55 [0,10; 5,00] | 0,21 [0,01; 0,80] | 1,05 [0,40; 2,00] | 0,623 | 0,078 |
| CD56+/CD16+/ki67+ (%) | 0,50 [0,01; 2,60] | 0,11 [0,01; 0,20] | 0,25 [0,01; 0,60] | 2,20 [1,00; 5,00] | 0,340 | 0,021* |
| Примечание: p1 - вероятность различий между больными ХГС «благоприятным» вариантом ИЛ-28B с наличием и отсутствием БВО, p2 - вероятность различий между группами ХГС с «неблагоприятными» вариантами ИЛ-28B с наличием и отсутствием БВО, * - достоверность различий по критерию Манна-Уитни при p<0,05 |
Литература
1. Fung, J. Hepatitis B and C virus-related carcinogenesis / J. Fung, C.L. Lai, M.F. Yuen // Clin Microbiol Infect. - 2009. - Vol.15, N11. - P.964-970.
2. Pham, T.N. Occult persistence and lymphotropism of hepatitis C virus infection / T.N. Pham, T.I. Michalak // World J Gastroenterol. - 2008. - Vol.14, N18. - P.2789-2793.
3. Stauber, R.E., Lackner C (2007). Noninvasive diagnosis of hepatic fibrosis in chronic hepatitis C / R.E. Stauber, C. Lackner // World J Gastroenterol. - 2007. - Vol.13, N32. - P.4287-4294.
4. Craxi, A. (2011). EASL Clinical Practice Guidelines: management of hepatitis C virus infection / A. Craxi A // J Hepatol. - 2011. - Vol.55, N2. - P.245-264.
5. Ge, D. Genetic variation in IL28B predicts hepatitis C treatment-induced viral clearance / D. Ge, J. Fellay, A.J. Thompson et al. // Nature. - 2009. - Vol.461, N7262. - P.399-401.
6. Suppiah, V. IL28B is associated with response to chronic hepatitis C interferon-alpha and ribavirin therapy / V. Suppiah, M. Moldovan, G. Ahlenstiel et al. // Nat Genet. - 2009. - Vol.41, N10. - P.1100-1104.
7. Tanaka, Y. Genome-wide association of IL28B with response to pegylated interferon-alpha and ribavirin therapy for chronic hepatitis C / Y. Tanaka, N. Nishida, M. Sugiyama et al. // Nat Genet. - 2009. - Vol.41, N10. - P.1105-1109.
8. Thomas, D.L. Genetic variation in IL28B and spontaneous clearance of hepatitis C virus / D.L. Thomas, C.L. Thio, M.P. Martin et al. // Nature. - 2009. - Vol.461, N7263. - P.798-801.
9. Ridruejo, E. Genetic variation in interleukin-28B predicts SVR in hepatitis C genotype 1 Argentine patients treated with PEG IFN and ribavirin / E. Ridruejo, A. Solano, S. Marciano et al. // Ann Hepatol. - 2011. - Vol.10, N4. - P.452-457.
10. Darling, J.M. Quantitation of pretreatment serum interferon-γ-inducible protein-10 improves the predictive value of an IL28B gene polymorphism for hepatitis C treatment response / J.M. Darling, J. Aerssens, G. Fanning et al. // Hepatology. - 2011. - Vol.53, N1. - P.14-22.
11. Clark, P.J. IL28B Genomic-based treatment paradigms for patients with chronic hepatitis C infection: the future of personalized HCV therapies / P.J. Clark, A.J. Thompson, J.G. McHutchison // Am J Gastroenterol. - 2011. - Vol.106, N1. - P.38-45.
12. dos Santos, D.C. Activated lymphocytes and high liver expression of IFN-γ are associated with fulminant hepatic failure in patients / D.C. dos Santos, P.C. Neves, E.L. Azeredo et al. // Liver Int. - 2012. - Vol.32, N1. - P.147-157.
13. Tatsumi, Т. Hepatitis C virus-specific CD8+ Т cell frequencies are associated with the responses of pegylated interferon-α and ribavirin combination therapy in patients with chronic hepatitis C virus infection / T. Tatsumi, T. Takehara, T. Miyagi et al. // Hepatol Res. - 2011. - Vol.41, N1. - P.30-38.
14. Zhang, Y. Hepatitis C virus nonstructural protein specific Т cells are associated with virological responses to combination therapy in chronic HCV patients / Y. Zhang, Y. Liu, Y. Zhao et al. // Liver Int, - 2012. - Vol.32, N1. - P.102-109.
15. Флоряну, А.И. Способ прогнозирования формирования вирусологического ответа у больных хроническим гепатитом C / А.И. Флоряну, В.В. Макашова, М.А. Яковенко с соавт. // Патент РФ №2431834 (C1), опубл. 20.09.2012.
16. Xiaoben, P., Protein chip for chronic hepatitis C outcome prediction in chronic hepatitis C interferon treatment / P. Xiaoben, W. Lai // Patent CN 102486474 (A), publ. 2010-12-06.
17. Xiaoben, P. Gene chip for chronic hepatitis C outcome prediction in chronic hepatitis C interferon treatment / P. Xiaoben, W. Lai // Patent CN 102485907 (A), publ. 2012-06-06.
18. Murakami, Y. Method for predicting therapeutic effect on chronic hepatitis C / Y. Murakami // Patent US 2012238459 (A1), publ. 2012-09-20.
19. Oshima, H. Method for predicting therapeutic effect of chronic type C hepatitis / H. Oshima, T. Fukushima, Y. Murakami, H. Fujita // Patent JP 2011155866 (A), publ. 2011-08-18.
20. Younossi, Z.M. Prognostic chronic hepatitis C biomarkers / Z.M. Younossi // Patent TW 200907070 (A), publ. 2009-02-16.
21. Bochud, P.-Y. Methods for diagnosing or predicting hepatitis C outcome in HCV infected patients / P.-Y. Bochud, A. Rauch // Patent US 20110165124 A1, publ. 2011-07-07.
22. Univ, O. Test method and test kit for predicting therapeutic effect for chronic hepatitis C / O. Univ, G. Kawasaki // Patent JP 2012105634 (A), publ. 2012-06-07.
23. Univ, O. Examination method and marker for predicting therapeutic effect for chronic hepatitis C / O. Univ, G. Kawasaki // Patent JP 2013005801 (A), publ. 2013-01-10.
24. Wright, M. Bayesian model for the prognosis of hepatitis C virus infection / M. Wright, M. Thursz // Patent WO 2004086031 (A3), publ. 2004-10-07.
25. Trofimov, D.Y. The delta-TF method for real-time PCR data standardization / D.Y. Trofimov, D.V. Rebrikov, G.A. Samatov et al. // Dokl Biol Sci. - 2008. - Vol.419. - P.118-121.
Способ прогнозирования быстрого вирусологического ответа у больных хроническим гепатитом С на стандартную терапию пегилированным интерфероном α и рибавирином, включающий определение аллельного варианта гена ИЛ-28В и проведение иммунологического тестирования, отличающийся тем, что при наличии аллели rs12979860CC/rs8099917TT рассчитывают коэффициент иммунопрогнозирования 1 (КИП-1) по формуле: КИП-1=2,774-0,833*[CD3+]-0,016*[CD4+]-0,063*[CD8+]-0,525*[CD19+], где [CD3+] - абсолютное содержание CD3+ клеток в 1 л крови, [CD4+] - абсолютное содержание CD3+/CD4+ клеток в 1 л крови, [CD8+] - абсолютное содержание CD3+/CD8+ клеток в 1 л крови, [CD19+] - абсолютное содержание CD19+ клеток в 1 л крови, при величине которого ≤1,5 прогнозируют развитие быстрого вирусологического ответа на стандартную терапию, а >1,5 - его отсутствие; при наличии любого другого аллельного варианта рассчитывают КИП-2 по формуле: КИП2=3,994+0,014*[CD56+/ki-67+]-0,408*[CD25hi]-0,69*[CD25hi/FoxP3+], где [CD56+/ki-67+] - % CD16+/CD56+/ki-67+ клеток среди лимфоцитов крови, [CD25hi] - % CD3+/CD25high клеток среди лимфоцитов крови, [CD25hi/FoxP3+] - % CD3+/CD25high/FoxP3+ клеток среди лимфоцитов крови, при величине которого ≤3,0 прогнозируют развитие быстрого вирусологического ответа на стандартную терапию, а >3,0 - его отсутствие.